转导免疫细胞的方法与流程
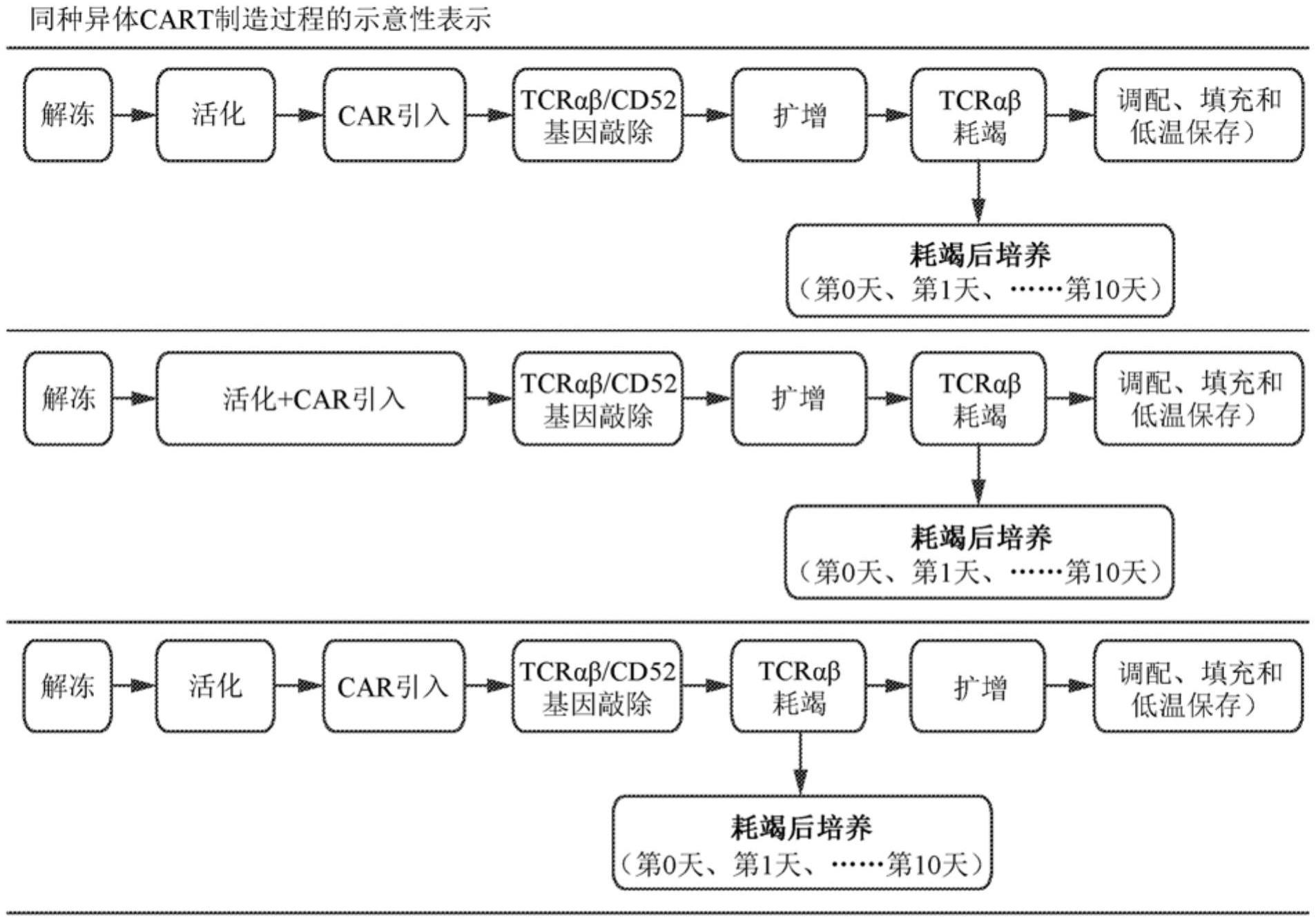
本公开涉及用逆转录病毒载体转导免疫细胞,例如t细胞以表达基因产物,例如嵌合抗原受体(car)基因产物的方法。
背景技术:
1、在过继性细胞疗法中,自体和同种异体免疫细胞可以经遗传修饰以表达使得细胞能够执行新治疗功能的合成蛋白质。免疫细胞可以经基因工程改造以表达嵌合抗原受体(“car”),即包含抗原识别部分和t细胞活化结构域的融合蛋白。含有car的经工程改造的免疫细胞,例如car-t细胞(“car-t”)具有抗原特异性和保持或增强的识别并杀伤靶细胞,例如癌细胞的能力。免疫细胞可通过转导进行工程改造,其中将编码car的核酸经由病毒载体引入免疫细胞中。先前的为了car t免疫疗法转导免疫细胞,特别是以制造规模转导同种异体免疫细胞的方法可能会效率低下,产生不一致的结果且通常使用提高加工成本和复杂性的试剂。
2、因此,仍需要一种产生car-t细胞的方法,其中免疫细胞转导效率稳定且一致,并且比当前方法更简单且更便宜。
技术实现思路
1、本文描述用病毒载体转导免疫细胞从而提供经遗传修饰的免疫细胞群体的改进方法,所述经遗传修饰的免疫细胞群体具有较高百分比的表达外源基因产物的细胞;包含较高百分比的外源基因产物阳性细胞的细胞群体;和采用由所公开的方法制备的细胞群体的治疗方法。另外,所描述的方法提供了表达外源基因产物的细胞的百分比在每次生产操作之间更一致的经遗传修饰的细胞群体,和/或更便宜和更简单的转导方法。举例来说,本文描述特别适于t细胞逆转录病毒载体转导的方法,所述方法可用于制造适用于采用嵌合抗原受体的同种异体细胞疗法(例如同种异体car-t细胞疗法)中的细胞。
2、在一个方面中,提供一种用逆转录病毒载体转导细胞群体的方法,其中所述载体包含对于所述细胞为外源性的核酸,所述方法包含:a)选择所述细胞群体,其中所选择的细胞群体包含t淋巴细胞、辅助t细胞、肿瘤细胞、记忆t细胞、细胞毒性t细胞、自然杀伤t细胞、外周血淋巴细胞、外周血单核细胞、树突状细胞或自然杀伤细胞,或其混合物;和b)在细胞培养基中,在7.0至7.9的起始ph范围内的起始ph下将所选择的细胞群体与所述逆转录病毒载体一起培养,并在转导培养步骤的至少第一个小时内将所述起始ph维持在所述起始ph范围内,以产生经转导细胞群体,所述经转导细胞群体包含表达由所述外源性核酸编码的基因产物的细胞。
3、在一个实施例中,将所述转导方法的起始ph维持在7.0至7.9的起始ph范围内,保持至少1、2、4、6、8、10、12、16、18、20、22或24小时。在一些实施例中,将所述起始ph维持在所述起始ph范围内,保持至少约1、约2、约4、约6、约8、约10、约12、约14、约16、约18、约20、约22、约24、约36、约48、约72或约96小时至不超过约168小时。
4、在一些实施例中,将所述起始ph维持在所述起始ph范围内,直至转导培养步骤结束。在一些实施例中,转导培养步骤进行至少1、2、4、6、8、12、14、16、18、20、22、24、36、48、72或96小时。在一些实施例中,ph被动地控制。在一些实施例中,ph用生物反应器主动地控制。
5、在一些实施例中,本公开的转导方法包含以约0.25、约0.5、约1、约5、约10、约15、约20、约25、约30、约35、约40、约45、约或约50至约55、约60、约65、约70、约75、约80、约85、约90、约95、约100、约125、约150、约175、约200、约225或约250的moi培养所选择的细胞群体。在一些实施例中,moi是转导程序中功能性病毒粒子与靶细胞的总数的比率。在一些实施例中,待添加至转导程序中的功能性病毒粒子的滴度通过qpcr测定。
6、在本公开的一些实施例中,所述外源性核酸编码嵌合抗原受体(car)。在一些实施例中,所述外源性核酸编码对单克隆抗体具有特异性的表位、自杀多肽、诱导性“开启(on)”或“加速剂(accelerator)”开关或控制开关,例如二聚化结构域。
7、在一些实施例中,所选择的细胞群体在容器中培养,其中所述容器是细胞培养板、细胞培养深孔板、细胞培养室(cell stack)、受控生物反应器、摇瓶或透气袋。在一些实施例中,转导培养步骤包含在约0.75升体积至约250升体积的细胞培养基中将所选择的细胞群体与所述逆转录病毒载体一起培养。在一些实施例中,转导培养步骤包含在约0.5升体积至约10升体积的细胞培养基中将所选择的细胞群体与所述逆转录病毒载体一起培养。
8、在一些实施例中,本公开的方法中使用的逆转录病毒载体是慢病毒载体。
9、在一些实施例中,在转导培养步骤起始之后3至18天,至少35%至95%、40%至95%、50%至95%、60%至95%、70%至95%的经转导细胞群体表达外源性核酸基因产物。在一些实施例中,在转导培养步骤起始之后7至18天,至少35%至95%、40%至95%、50%至95%、60%至95%、70%至95%的经转导细胞群体表达外源性核酸基因产物。
10、在一些实施例中,所述细胞培养基在转导培养步骤期间任选地包含共定位剂,例如在转导培养步骤期间包含纤维连接蛋白、纤维连接蛋白衍生物、聚凝胺或试剂。
11、在一些实施例中,所述细胞培养基在转导培养步骤期间不包含共定位剂,例如纤维连接蛋白或纤维连接蛋白衍生物,例如试剂。
12、在一些实施例中,所述细胞培养基在转导培养步骤期间不包含共定位剂。
13、在一些实施例中,在转导之前或期间没有向所述细胞培养基中添加聚阳离子,例如聚凝胺、硫酸鱼精蛋白或deae-葡聚糖。
14、在一些实施例中,所选择的细胞群体为同种异体细胞群体。在一些实施例中,所选择的细胞群体为自体细胞群体。
15、在一个方面中,提供一种转导第一和第二细胞群体的方法,其中所述第一和第二细胞群体通过本公开的相同方法转导且由此第一与第二经转导细胞群体中表达外源性核酸基因产物的经转导细胞群体的百分比不会相差超过2%至5%、5%至10%、10%至20%或20%至30%。
16、在一些实施例中,本公开的方法提供一种经转导细胞群体,其中经转导细胞群体的细胞包含与通过本公开的相同方法转导的细胞相比减少的载体拷贝数,其中所述相同方法的转导培养步骤的起始ph小于7.0。
17、在本公开的一个方面中,提供一种用逆转录病毒载体转导细胞毒性t细胞群体的方法,所述载体包含对于所述细胞毒性t细胞为外源性的核酸,所述方法包含在细胞培养基中,在7.0至7.9的起始ph范围内的起始ph下将所述细胞毒性t细胞群体与所述逆转录病毒载体一起培养,并在转导培养步骤的至少第一个小时内将所述起始ph维持在所述起始ph范围内,以产生经转导细胞毒性t细胞群体,所述经转导细胞毒性t细胞群体包含表达由所述外源性核酸编码的基因产物的细胞,且其中所述细胞培养基不包含共定位剂。
18、在本公开这个方面的一些实施例中,将所述起始ph维持在7.0至7.9的起始ph范围内,保持至少1、2、4、6、8、10、12、14、16、18、20、22或24小时。在一些实施例中,将细胞毒性t细胞培养基的起始ph维持在所述起始ph范围内,保持至少约1、约2、约4、约6、约8、约10、约12、约14、约16、约18、约20、约22、约24、约36、约48、约72或约96小时至不超过约168小时。
19、在这个方面的一些实施例中,将所述细胞毒性t细胞培养基的起始ph维持在所述起始ph范围内,直至转导培养步骤结束。在一些实施例中,转导培养步骤进行至少1、2、4、6、8、12、14、16、18、20、22、24、36、48、72或96小时。
20、在本公开这个方面的一些实施例中,ph被动地控制。在一些实施例中,ph主动地控制。
21、在一些实施例中,所述细胞毒性t细胞培养基在转导培养步骤期间不包含共定位剂,例如纤维连接蛋白或纤维连接蛋白衍生物,例如
22、在一些实施例中,在转导之前或期间没有向所述细胞毒性t细胞培养基中添加聚阳离子,例如聚凝胺、硫酸鱼精蛋白或deae-葡聚糖。
23、在本公开这个方面的一些实施例中,所述细胞毒性t细胞群体以约0.25、约0.5、约1、约5、约10、约15、约20、约25、约30、约35、约40、约45、约或约50至约55、约60、约65、约70、约75、约80、约85、约90、约95、约100、约125、约150、约175、约200、约225或约250的moi培养。在一些实施例中,moi是转导程序中功能性病毒粒子与细胞毒性t细胞的总数的比率。
24、在本公开这个方面的一些实施例中,所述外源性核酸编码嵌合抗原受体。在一些实施例中,所述外源性核酸编码对单克隆抗体具有特异性的表位、自杀多肽、诱导性“开启”或“加速剂”开关或控制开关,例如二聚化结构域。
25、在本公开这个方面的一些实施例中,所述细胞毒性t细胞群体在容器中培养,其中所述容器是细胞培养板、细胞培养深孔板、细胞培养室、受控生物反应器、摇瓶或透气袋。在一些实施例中,转导培养步骤包含在约0.75升体积至约250升体积的细胞培养基中将所述细胞毒性t细胞群体与所述逆转录病毒载体一起培养。
26、在一些实施例中,用于本公开的方法中的逆转录病毒载体是慢病毒载体。
27、在本公开这个方面的一些实施例中,在转导培养步骤起始之后3至18天,至少40%至95%、50%至95%、60%至95%、70%至95%的经转导细胞毒性t细胞群体表达外源性核酸基因产物。在一些实施例中,在转导培养步骤起始之后7至18天,至少40%至95%、50%至95%、60%至95%、70%至95%的经转导细胞毒性t细胞群体表达外源性核酸基因产物。
28、在一些实施例中,待转导的细胞毒性t细胞群体为同种异体细胞毒性t细胞群体。在一些实施例中,待转导的细胞毒性t细胞群体为自体细胞毒性t细胞群体。
29、在本公开的一个方面中,提供一种转导第一和第二细胞毒性t细胞群体的方法,其中所述第一和第二细胞毒性t细胞群体通过本公开的相同方法转导,由此第一与第二经转导细胞毒性t细胞群体中表达外源性核酸基因产物的经转导细胞毒性t细胞群体的百分比不会相差超过2%至5%、5%至10%、10%至20%或20%至30%
30、在本公开的一个方面中,提供一种用逆转录病毒载体转导外周血单核细胞群体的方法,所述载体包含对于所述外周血单核细胞为外源性的核酸,所述方法包含在细胞培养基中,在7.0至7.9的起始ph范围内的起始ph下将所述外周血单核细胞群体与所述逆转录病毒载体一起培养,并在转导培养步骤的至少第一个小时内将所述起始ph维持在所述起始ph范围内,以产生经转导外周血单核细胞群体,所述经转导外周血单核细胞群体包含表达由所述外源性核酸编码的基因产物的细胞,且其中所述细胞培养基不包含共定位剂。
31、在本公开这个方面的一些实施例中,将所述起始ph维持在7.0至7.9的起始ph范围内,保持至少1、2、4、6、8、10、12、14、16、18、20、22或24小时。在一些实施例中,将所述起始ph维持在所述起始ph范围内,保持至少约1、约2、约4、约6、约8、约10、约12、约14、约16、约18、约20、约22、约24、约36、约48、约72或约96小时至不超过约168小时。
32、在这个方面的一些实施例中,将所述起始ph维持在所述起始ph范围内,直至转导培养步骤结束。在一些实施例中,转导培养步骤进行至少1、2、4、6、8、12、14、16、18、20、22、24、36、48、72或96小时。
33、在本公开这个方面的一些实施例中,ph被动地控制。在一些实施例中,ph主动地控制。
34、在一些实施例中,所述外周血单核细胞培养基在转导培养步骤期间不包含共定位剂,例如纤维连接蛋白或纤维连接蛋白衍生物,例如
35、在一些实施例中,在转导之前或期间没有向所述外周血单核细胞培养基中添加聚阳离子,例如聚凝胺、硫酸鱼精蛋白或deae-葡聚糖。
36、在本公开这个方面的一些实施例中,所述外周血单核细胞群体以约0.25、约0.5、约1、约5、约10、约15、约20、约25、约30、约35、约40、约45、约或约50至约55、约60、约65、约70、约75、约80、约85、约90、约95、约100、约125、约150、约175、约200、约225或约250的moi培养。在一些实施例中,moi是转导程序中功能性病毒粒子与外周血单核细胞的总数的比率。
37、在本公开这个方面的一些实施例中,所述外源性核酸编码嵌合抗原受体。在一些实施例中,所述外源性核酸编码对单克隆抗体具有特异性的表位、自杀多肽、诱导性“开启”或“加速剂”开关或控制开关,例如二聚化结构域。
38、在本公开这个方面的一些实施例中,所述外周血单核细胞群体在容器中培养,其中所述容器是细胞培养板、细胞培养深孔板、细胞培养室、受控生物反应器、摇瓶或透气袋。在一些实施例中,转导培养步骤包含在约0.75升体积至约250升体积的细胞培养基中将所述外周血单核细胞群体与所述逆转录病毒载体一起培养。
39、在一些实施例中,用于本公开这个方面的方法中的逆转录病毒载体是慢病毒载体。
40、在本公开这个方面的一些实施例中,在转导培养步骤起始之后3至18天,至少40%至95%、50%至95%、60%至95%、70%至95%的经转导外周血单核细胞群体表达外源性核酸基因产物。在一些实施例中,在转导培养步骤起始之后7至18天,至少40%至95%、50%至95%、60%至95%、70%至95%的经转导外周血单核细胞群体表达外源性核酸基因产物。
41、在一些实施例中,待转导的外周血单核细胞群体为同种异体外周血单核细胞群体。在一些实施例中,待转导的外周血单核细胞群体为自体外周血单核细胞群体。
42、在本公开的一个方面中,提供一种转导第一和第二外周血单核细胞群体的方法,其中所述第一和第二外周血单核细胞群体通过本公开的相同方法转导,由此第一和第二经转导外周血单核细胞群体中表达外源性核酸基因产物的经转导外周血单核细胞群体的百分比不会相差超过2%至5%、5%至10%、10%至20%或20%至30%。
43、在本公开的一个方面中,提供一种用逆转录病毒载体转导衍生自诱导性多能干细胞的t细胞群体的方法,所述载体包含对于衍生t细胞为外源性的核酸,所述方法包含在细胞培养基中,在7.0至7.9的起始ph范围内的起始ph下将衍生t细胞群体与所述逆转录病毒载体一起培养,并在转导培养步骤的至少第一个小时内将所述起始ph维持在所述起始ph范围内,以产生经转导的衍生t细胞群体,所述经转导的衍生t细胞群体包含表达由所述外源性核酸编码的基因产物的细胞,且其中所述细胞培养基不包含共定位剂。
44、在本公开这个方面的一些实施例中,将所述起始ph维持在7.0至7.9的起始ph范围内,保持至少1、2、4、6、8、10、12、16、18、20、22或24小时。在一些实施例中,将衍生自诱导性多能干细胞的t细胞群体的培养基的起始ph维持在所述起始ph范围内,保持至少约1、约2、约4、约6、约8、约10、约12、约14、约16、约18、约20、约22、约24、约36、约48、约72或约96小时至不超过约168小时。
45、在这个方面的一些实施例中,将衍生t细胞培养基的起始ph维持在所述起始ph范围内,直至转导培养步骤结束。在一些实施例中,转导培养步骤进行至少1、2、4、6、8、12、14、16、18、20、22、24、36、48、72或96小时。
46、在本公开这个方面的一些实施例中,衍生t细胞培养基的ph被动地控制。在一些实施例中,ph主动地控制。
47、在本发明这个方面的一些实施例中,衍生t细胞培养基在转导培养步骤期间不包含共定位剂,例如纤维连接蛋白或纤维连接蛋白衍生物,例如
48、在一些实施例中,在转导之前或期间没有向衍生t细胞培养基中添加聚阳离子,例如聚凝胺、硫酸鱼精蛋白或deae-葡聚糖。
49、在本公开这个方面的一些实施例中,衍生t细胞群体以约0.25、约0.5、约1、约5、约10、约15、约20、约25、约30、约35、约40、约45、约或约50至约55、约60、约65、约70、约75、约80、约85、约90、约95、约100、约125、约150、约175、约200、约225或约250的moi培养。在一些实施例中,moi是转导程序中功能性病毒粒子与衍生自诱导性多能干细胞的t细胞的总数的比率。
50、在本公开这个方面的一些实施例中,所述外源性核酸编码嵌合抗原受体。在一些实施例中,所述外源性核酸编码对单克隆抗体具有特异性的表位、自杀多肽、诱导性“开启”或“加速剂”开关或控制开关,例如二聚化结构域。
51、在本公开这个方面的一些实施例中,衍生t细胞群体在容器中培养,其中所述容器是细胞培养板、细胞培养深孔板、细胞培养室、受控生物反应器、摇瓶或透气袋。在一些实施例中,转导培养步骤包含在约0.5升体积至约10升体积的细胞培养基中将衍生t细胞群体与所述逆转录病毒载体一起培养。
52、在一些实施例中,用于本公开的方法中的逆转录病毒载体是慢病毒载体。
53、在本公开这个方面的一些实施例中,在转导培养步骤起始之后3至18天,35%至约95%、约40%至约95%、约50%至约95%、约60%至约95%或约70%至约95%的经转导的衍生t细胞群体表达外源性核酸基因产物。在一些实施例中,在转导培养步骤起始之后7至18天,约35%至约95%、约40%至约95%、约50%至约95%、约60%至约95%或约70%至约95%的经转导的衍生t细胞群体表达外源性核酸基因产物。
54、在一些实施例中,待转导的衍生t细胞群体为同种异体衍生t细胞群体。在一些实施例中,待转导的衍生t细胞群体为自体衍生t细胞群体。
55、在本公开的一个方面中,提供一种转导第一和第二衍生t细胞群体的方法,其中所述第一和第二衍生t细胞群体通过本公开的相同方法转导,由此第一与第二经转导的衍生t细胞群体中表达外源性核酸基因产物的经转导的衍生t细胞群体的百分比不会超过2%至5%、5%至10%、10%至20%或20%至30%。
56、在本发明的一些实施例中,提供一种通过本公开的方法产生的经遗传修饰的细胞。在本发明的另一个实施例中,提供一种通过本公开的方法产生的经遗传修饰的细胞群体。在另一个实施例中,提供一种治疗组合物,其包含通过本发明的方法产生的细胞或细胞群体。在另一个实施例中,提供一种治疗方法,其包含向有需要的受试者施用治疗有效量的通过本发明的方法产生的细胞、细胞群体或治疗组合物。
- 还没有人留言评论。精彩留言会获得点赞!