用于生产遗传改造的细胞的方法与流程
本发明涉及细胞的遗传改造,特别是用于生产遗传改造的细胞的方法。
背景技术:
1、基因组改造工具特别地基于可编程核酸酶(pn),其包括大范围核酸酶3、锌指核酸酶(znf)转录激活因子样效应物核酸酶(talen)和最突出的成簇规律间隔短回文重复(crispr)/crispr-相关的(cas)核酸酶类别。
2、用pn诱导dna链断裂(单链断裂[ssb]和双链断裂[dsb])引发细胞dna修复应答,以逆转损伤。在大多数情况下,dsb通过dna的重新连接进行修复。这经常导致序列的改变和后续的非功能性基因产物。可替代地,来自分开的dna供体分子的模板化修复可以通过同源性指导的修复(hdr)发生。这些dna修复过程被基因组编辑利用,以引入所需的基因组改变。
3、基因组改造、个性化医疗和合成生物学的进步需要众多且复杂的遗传改造的细胞系。在过去的几十年里,这些细胞系已成为生物制药研究的关键,用于使得能够更好地理解基础生物学、模型疾病和开发新型的个性化治疗剂。因此,它们需要众多改造的细胞系来允许其研究并实现这些目标。
4、生成改造的细胞系的现有制造方法基于将dna、rna、蛋白质或这些大分子的组合递送至数百万个细胞的批量方法。取决于货物的性质,递送方法包括但不限于病毒载体、基于脂质的囊泡或物理方法例如电穿孔。取决于细胞类型、转染方法和/或递送的货物,转染率从0到99%不等。另外,所有这些方法都可能对细胞具有毒性作用,导致坏死或程序性细胞死亡。如果转染率足够高(>90%),则多克隆批量培养物可以用于特定应用。
5、然而,在基础生物学中以及对于翻译应用,需要单克隆细胞系。在这些大分子的成功递送后,需要繁琐的选择过程来鉴定且分离改变的细胞,以生成单克隆细胞系。这可以通过添加可选择标记物来实现,所述可选择标记物例如编码荧光蛋白或药物抗性的质粒,以通过facs或药物选择来纯化细胞。所选择的细胞形成克隆集落,并且收集各个集落的子样品以测试是否存在所需的修饰。正确修饰的细胞克隆经受几轮连续稀释,以确保真正的单克隆性。总体而言,这个过程是繁琐的、耗时的并且无法良好地按比例缩放。当在同一细胞中执行多重修饰时,按比例缩放问题甚至进一步恶化,因为生成时间随着每一种另外的修饰/编辑大致线性地按比例缩放。关于具有n种修饰的细胞系的生成时间是n乘以10周。此外,由于低转染效率,许多已知过程无法提供靶细胞中的所需改造组分,例如crispr组分的实际浓度的充分控制。
技术实现思路
1、本发明的一般目的是提高用于生产遗传改造的细胞的方法的技术水平,并且优选完全或部分地克服现有技术的缺点。在有利的实施方案中,提供了用于生产遗传改造的细胞的方法,其可以在比现有技术中已知的方法明显更少的时间内完成。在进一步有利的实施方案中,提供了用于生产遗传改造的细胞的方法,其允许更方便和/或更快速的生成单克隆细胞集群的方法。
2、在第一个方面,一般目的通过根据权利要求1的用于在体外生产遗传改造的细胞的方法来实现。该方法包括将基因组编辑组合物直接注射到细胞的核内,所述细胞优选贴壁细胞,即粘附到表面的细胞。基因组编辑组合物包含至少一种cas蛋白和针对待编辑的基因组定位的至少一种grna分子。grna通常由两个功能部分组成:负责结合cas蛋白的发夹结构以及与待靶向的dna互补的序列。用包括悬臂的微机电系统注射芯片执行注射,所述悬臂可以特别是afm悬臂,其中所述悬臂包括与悬臂的纳米注射器流体连通的微通道。直接注射包括通过将纳米注射器插入细胞的核内来提供微通道和细胞的核之间的流体连通,和通过纳米注射器经由微通道将基因组编辑组合物注射到细胞的核内。根据本发明的方法使得能够将基因组编辑组合物直接引入单细胞的核内,这尤其允许免除改造的cas蛋白,例如包含nls序列(核定位序列)的cas蛋白。与批量转染至数千个细胞形成对比,由于可以准确地控制化学计量,提供了更加可靠和可控的方法。另外,可以精确地确定注射到每个核内的基因组编辑组合物的体积。单细胞本身然后可以用作用于扩增的原始来源,以便提供单克隆细胞系,其随后固有地是单克隆的。因此,避免了繁琐的细胞选择和分析过程。由于细胞通过悬臂式纳米注射器的力反馈渗透,注射像这样是可准确地控制的,从而避免了细胞损伤和因此的细胞死亡,这最终增加了成功改造的细胞的量。一般而言,悬臂弯曲可以由激光束控制,如例如与配置用于接收从悬臂反射的激光束的光电二极管组合在afm中常见的。
3、此外,根据本发明的微机电系统注射芯片的使用允许在短时间内,即在1秒至60秒内执行注射步骤本身而不失去控制。
4、应理解,grna可以包含具有结合cas蛋白的支架以及与靶向dna区域互补的间隔物的单个rna。可替代地,grna可以包含与靶dna互补的crrna以及负责cas结合的tracrrna。应理解,crrna和tracrrna必须在与cas蛋白结合之前进行退火。
5、cas蛋白应理解为crispr相关蛋白。在与grna结合后,cas蛋白可以被导向限定的基因组定位。cas蛋白可以包括诱导ss(切口酶)和ds断裂的核酸酶以及无催化活性的核酸酶。cas蛋白可以被改造为含有碱基编辑器活性、转录激活或阻遏结构域和其它感兴趣的活性。应理解,该权利要求并不限于来自特定种类的特定cas蛋白(例如cas9),而是扩展到其它类型的cas蛋白(1类,i、iii、iv型,2类,ii、v、vi型)
6、应进一步理解,对于待靶向的每个dna序列,存在与结合cas蛋白的dna互补的个别grna对。因此,为了一次靶向几个基因组基因座,必须存在至少一种grna/cas复合物,其包括与靶位点互补的grna。
7、纳米注射器应理解为一种结构特征,其包括具有开口的尖端,其允许在1-60秒内注射在小于1nl,优选小于1pl的范围内的体积,以及对水溶液例如基因组编辑组合物1-5000毫巴的施加压力。在亚微米范围(纳米范围)内的开口,例如直径为10-1500nm,优选为10至999nm的开口,适合于满足这些条件。
8、在一些实施方案中,纳米注射器的开口具有小于10μm,优选小于5μm的尺寸,特别是直径。特别地,开口可以具有10nm至5μm,例如0.1μm至1.5μm的尺寸,特别是直径。
9、在一些实施方案中,纳米注射器可以具有金字塔结构,其中开口布置在金字塔结构的壳表面上。此类纳米注射器是有利的,因为金字塔结构的顶点充当尖锐的穿刺尖端,从而提供明确的细胞穿刺。
10、在一些实施方案中,纳米注射器可以包括配置为纳米注射器尖端的中空管状主体,优选地至少部分地具有圆柱形形状。
11、在一些实施方案中,悬臂和/或微通道,特别是微通道的壁涂布有防污剂,例如有机聚硅氧烷,特别是卤代有机聚硅氧烷。合适的防污剂可以是或
12、通常,基因组编辑组合物可以是水溶液。
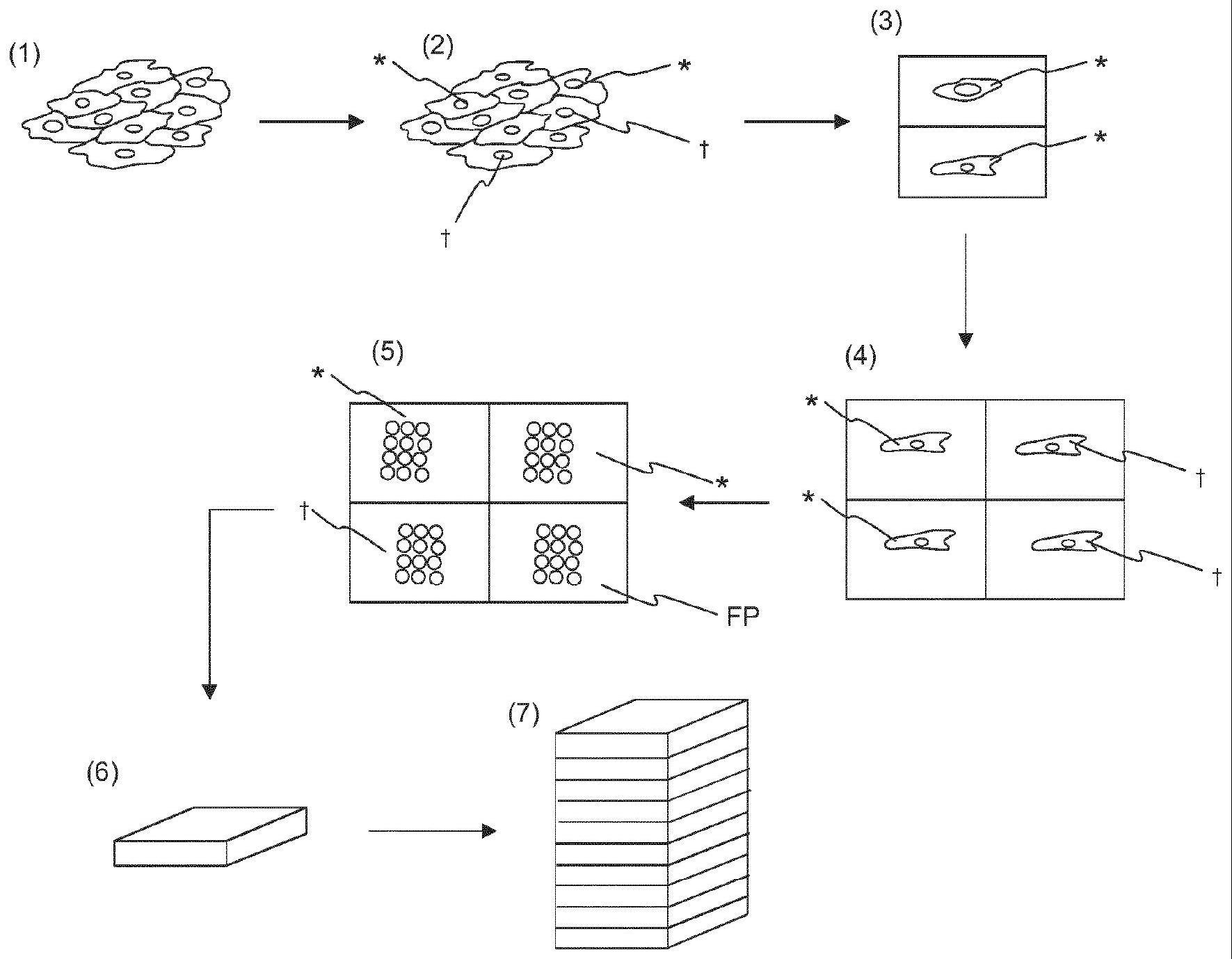
13、在一些实施方案中,该方法进一步包括扩增所产生的细胞以生成第一单克隆细胞培养物的步骤。扩增可以例如在单个孔中执行。应理解,细胞培养物包含多个细胞,即它可以被视为细胞系。根据本发明的方法允许准确地选择和注射相应的细胞。如果例如在注射后的细胞例如通过在适当条件下的细胞培养进行扩增,则所得到的细胞培养物像这样是单克隆的。因此,该方法允许在仅2至4周内的遗传修饰的细胞的简化生产。
14、在一些实施方案中,第一单克隆细胞培养物的细胞,即通过扩增所产生的细胞获得的细胞培养物,被分成至少两个,特别是两个或三个亚组,例如第一亚组、第二亚组和任选的第三亚组。特别地,可以在所产生的细胞的10-20次群体倍增后执行细胞培养物的分割。在某些实施方案中,第一单克隆细胞培养物的细胞被分成仅两个或仅三个亚组。
15、在一些实施方案中,第一亚组可以包含第一单克隆细胞培养物的5%至20%的细胞。在一些实施方案中,第二亚组可以包含第一单克隆细胞培养物的60%至90%的细胞。在一些实施方案中,第三亚组可以包含第一单克隆细胞培养物的5%至20%的细胞。
16、在一些实施方案中,通过测序分析第一亚组的细胞,且特别是其dna序列。特别地,可以例如通过细胞的化学和/或酶促处理首先释放细胞dna。在某些实施方案中,所释放的dna通过pcr进行扩增。特别地,定位于待编辑的基因组定位上游和下游的ssdna寡核苷酸可以用于pcr。然后通过测序分析所释放且扩增的dna。在一些实施方案中,通过桑格测序对释放的dna和扩增的dna分别进行测序。
17、在一些实施方案中,将获得的序列与预计的未修饰的序列进行比较,以鉴定编辑。编辑可以进一步通过合适的计算机实现的方法进行表征。
18、在一些实施方案中,第二亚组的细胞特别是在孔板的孔中进行进一步扩增,以生成第二单克隆细胞培养物。该步骤优选在分析第一亚组的细胞的同时执行。如技术人员理解的,扩增在合适的细胞培养基中执行。第二亚组的细胞的扩增可以执行2至12次群体倍增,分别持续2至4天。从分析第一亚组的细胞获得的测序结果可以用于鉴定第二亚组的细胞的基因型。在某些实施方案中,含有所需突变的细胞例如通过冷冻保存进行保存。冷冻保存培养基可以例如由含有1-30% dmso的常规生长培养基或专门的商业冷冻保存培养基(例如cryostore,sigma)组成。在一些实施方案中,一定量的未修饰的细胞,即不含所需突变的细胞,也被保存,特别是冷冻保存。这具有获得已经历与修饰细胞相同处理的一组对照细胞的优点,这有益于对照实验,并且因此减少对所获得的第二单克隆细胞培养物的实验中的数据解释的错误。
19、其中第一单克隆细胞培养物,即通过扩增所产生的细胞获得的细胞培养物的细胞,被分成两个亚组,即如上所述的第一亚组和第二亚组的实施方案显著增加了细胞系生成的效率,因为在进一步扩增且保存细胞的同时分析了第一亚组。从而确保了仅保存已经历所需遗传修饰的细胞。
20、在一些实施方案中,第三亚组的细胞特别是在孔板的孔中进行进一步扩增,以产生第三单克隆细胞培养物。应理解,第三亚组的细胞与第二亚组的细胞独立地且分开地进行扩增。如技术人员理解的,扩增在合适的细胞培养基中执行。第二亚组的细胞的扩增可以执行2至12次群体倍增,分别持续2至4天。冷冻保存培养基可以例如由含有1-30%dmso的常规生长培养基或专门的商业冷冻保存培养基(例如cryostore,sigma)组成。第三亚组的扩增细胞可以进行保存,特别是冷冻保存。第三亚组的扩增细胞充当第二亚组的扩增细胞的备用细胞。因此,避免了第二亚组的扩增细胞的意外丢失,并且可以容易地提供备用细胞。
21、分割第一单克隆细胞培养物的扩增细胞具有以下优点:与需要8至16周且另外麻烦得多的现有技术方法相比,生产单克隆遗传修饰细胞系所需的时间减少到仅2至6周左右。此外,群体倍增的次数,例如没有对照分析的倍增次数减少,这导致更可靠的方法,因为每次另外的倍增都增加遗传漂移的风险。
22、在一些实施方案中,在直接注射的步骤之前,提供了包含多个细胞,特别是1至1000个细胞的细胞制剂,并且执行基因组合物直接注射到一个或多个细胞内,例如执行基因组合物直接注射到细胞制剂的至多10%、20%、30%、40%、50%,例如60%,例如70%,例如80%,例如90%,例如95%,例如100%细胞内。在基因组编辑组合物的直接注射后,选择已注射了基因组编辑组合物的单细胞,并且将其从细胞制剂中分离,并且任选地随后个别地扩增,以生成第一单克隆细胞培养物。此类实施方案具有以下优点:由于相对快速的注射步骤,可以产生多重不同的单克隆细胞系。虽然注射通常是连续执行的,但在细胞分离后,特定的单细胞可以进行分离,并且任选地提供到单孔内,然后通过扩增而充当单克隆细胞培养物的起源。因此,在显著减少的过程时间内,可以生成不同的单克隆细胞系。应注意,此类过程中的时间限制步骤不是注射,而是扩增步骤,其可以对于多重不同的单克隆细胞系平行地执行。
23、在某些实施方案中,单细胞的选择和分离包括借助于微机电系统转运芯片来移动单细胞,所述微机电系统转运芯片包括悬臂,其具有开口和延伸穿过悬臂到开口的微通道,其中移动通过对微通道施加关于环境的负压使得单细胞粘附到悬臂,并且将悬臂连同粘附的细胞一起作为整体移动来执行。可以通过使单细胞与开口接触并施加负压来执行移动。通常,与微机电系统注射芯片的悬臂相比,微机电系统转运芯片的悬臂并不包括特别是在开口处的尖锐边缘或尖端。因此,微机电系统转运芯片的悬臂可以包括包含开口的平坦的细长元件或表面。在施加负压后,待分离的细胞可以部分地被吸入它在其上附着至悬臂的开口内。悬臂然后可以特别是相对于细胞培养物的剩余细胞移动,以便分离所选择的细胞。细胞可以例如被转运,优选自动地转运到分开的容器例如单个孔内。在后续步骤中,所选择且分离的细胞可以进行扩增,以产生单克隆细胞培养物。此类实施方案具有以下优点:微机电系统转运芯片可容易地与微机电系统注射芯片组合,即可以使用相同的自动元件和特征,并且可以以节省时间和温和的方式准确地执行细胞选择,使得能够避免细胞损伤。
24、在一些实施方案中,在从邻近细胞和培养容器移动之前通过局部化学处理和或酶促处理(例如通过胰蛋白酶、edta),可以首先使贴壁细胞脱离。这些溶液可以通过微机电系统转运芯片局部地递送。
25、在一些实施方案中,在基因组编辑组合物直接注射到细胞的核内之前,特别是在分开的孔中分离单细胞。因此,与其中提供多个细胞中的一个或多个并且对相应细胞制剂的给定细胞执行直接注射的实施方案形成对比,在直接注射之前首先将单细胞分离且分开。这是可能的,因为由于根据本发明的直接注射,遗传改造的成功率比批量转染方法高得多,因为基因组编辑组合物在高度可控的条件下直接引入细胞的核内。因此,单细胞可以用作起点,其可以进行改造,然后进行扩增以生成单克隆细胞系。分离可以例如使用如上文公开的微机电系统转运芯片来执行。在一些实施方案中,分离单细胞可以用细胞印刷装置进行,所述细胞印刷装置将单细胞沉积在分开的孔中,特别是分开的孔的中心。如容易理解的,分离单细胞一般而言可以重复多次,使得分离各自在分开的孔中的多重细胞。因此,具有12、24、48或96个孔的孔板的每个孔可以例如含有单一分离的细胞。
26、在一些实施方案中,分离的单细胞在生长培养基中维持一定的回收时间间隔,例如2至24小时。特别地,分离的单细胞可以维持在4℃至37℃的温度和/或0-95%的湿度和/或0.1体积%至10体积%的co2浓度下。在此期间,分离的单细胞可能在基因组编辑组合物直接注射到其核内之前进行回收。优选地,可以在注射前验证单克隆性。
27、微机电系统注射芯片和/或微机电系统转运芯片可以例如由si、sio2或si3n4制成。
28、在一些实施方案中,基因组编辑组合物进一步包含转染标记物和/或编码转染标记物的质粒或mrna。合适的转染标记物使得能够确定转染是否已成功,并且因此提供对于根据本发明的方法的直接控制机制。此外,还可以简化待分离细胞的选择。在某些实施方案中,转染标记物可以是荧光转染标记物或萤光素酶。合适的荧光转染标记物是gfp、rfp、yfp、bfp、罗丹明等等。在一些实施方案中,转染标记物可以以0.5ng/μl至250ng/μl,特别是0.5ng/μl至100ng/μl的浓度存在。
29、在一些实施方案中,通过分别地扫描基因组编辑组合物已注射到其核内的细胞和通过扩增源自该细胞的细胞来监测转染。在某些实施方案中,监测用显微镜,特别是成像系统,例如evosm 7000来进行。监测可以在预定的时间点或在固定时间间隔内进行。例如,监测可以在第1天、第2天、第4天和第10天时进行。
30、在一些实施方案中,基因组编辑组合物包含多个cas蛋白和多个grna分子。各个grna通过序列互补性靶向基因组定位。grna与一种cas蛋白复合,并且从而可以将cas蛋白引导至所述基因组定位。cas蛋白的核酸酶活性随后切割靶向基因组定位。取决于cas蛋白的性质,核酸酶可以诱导ss(单链)或ds(双链)dna断裂。
31、在一些实施方案中,cas蛋白可以携带突变,以致使其核酸酶结构域失活。在这种情况下,cas蛋白可以与其它蛋白质或蛋白质结构域融合,以增加特定活性。这可以是但不限于转录激活或阻遏结构域、碱基编辑功能、荧光结构域或其它酶促活性。
32、对于grna与cas蛋白的最佳结合,优选10:1至1:10,特别是1:1至1:10的化学计量。
33、通常,基因组编辑组合物一般而言含有与一种cas蛋白复合的至少一个个别的grna分子,从而靶向一个不同的基因组实体。在一些实施方案中,基因组编辑组合物可以包含1-500种个别grna/cas复合物。这些可以同时进行注射,以靶向1-500个不同的基因组基因座。此类实施方案允许在单个注射步骤后,在单细胞中的多重基因编辑事件。因此,多重基因编辑事件以节省时间的方式执行,因为与连续批量转染形成对比,所需的试剂可以在单个步骤中选择性地注射。
34、在一些实施方案中,基因组编辑组合物进一步包含缓冲组合物,其具有ph范围为6至9的一种或多种缓冲剂和/或无机盐混合物,特别是水溶液,例如nacl、kcl、mgcl2、cacl2及其混合物。配置盐混合物以匹配细胞的特定内部渗透压。合适的缓冲剂可以选自pbs、hepes、tris/hcl、tris/hcl/edta、tcep等等中的一种或多种。缓冲剂浓度可以为0.1mm至200mm。
35、在一些实施方案中,至少一种cas蛋白选自cas9、cas12和cas13和/或切口酶、其无催化活性的变体或缀合至酶促功能的无催化活性的变体,所述酶促功能例如碱基编辑器、荧光蛋白、核酸酶、转录激活物或阻遏物、表观遗传修饰剂。
36、在一些实施方案中,基因组编辑组合物进一步包含双链或单链dna。在某些实施方案中,双链或单链dna的长度为50bp至10kb。对于同源重组,双链或单链dna的浓度可以例如为0.1pmol/μl至100pmol/μl。
37、在一些实施方案中,基因组编辑组合物进一步包含示踪剂,其配置为追踪注射效率并且用于实现注射体积的计算。合适的示踪剂可以例如是特别是浓度为0.1mg/ml至10mg/ml的萤光黄的水溶液。在某些实施方案中,基因组编辑组合物包含用合适的注射效率标记,特别是荧光标记,例如atto550进行标记的标记的tracrrna。特别地,包含在grna中的未标记的tracrrna和标记的tracrrna之间的比率范围可以为1:10至10:1。
38、在一些实施方案中,基因组编辑组合物进一步包含以下中的一种或多种:纳米颗粒例如荧光、磁性或功能化纳米颗粒,病毒,细胞器例如线粒体、核糖体,激素,生长因子,抑制剂,蛋白质,肽,氨基酸,神经递质,脂质,脂质、蛋白质和/或糖的缀合物,rna,小分子和药物。
39、在一些实施方案中,在基因组编辑组合物的直接注射之前,纳米注射器以1μm/s至1mm/s的接近速度接近细胞,这避免了细胞损伤。在特定实施方案中,纳米注射器的接近在确保恒定接近速度的控制单元的控制下。
40、在一些实施方案中,通过纳米注射器施加以穿透细胞膜的力为1nn至5000nn,优选为700nn至1500nn。
41、为了避免在注射基因组编辑组合物后的细胞损伤,纳米注射器在一些实施方案中以1μm/s至1000μm/s的速度从细胞中缩回。
42、在一些实施方案中,用于将基因组编辑组合物注射到细胞的核内的注射时间为1秒至60秒。
43、在一些实施方案中,通过对悬臂的微通道施加相对于大气压为0毫巴至5000毫巴的压力,将基因组编辑组合物注射到细胞的核内。
44、在一些实施方案中,微机电系统注射芯片和/或微机电系统转运芯片可操作地连接到定位单元,其配置用于在3d空间中定位微机电系统注射芯片。定位单元可以是自动定位单元。它也可以在控制单元的控制下。定位单元可以至少由一组轴例如三个正交轴(x,y,z)实现,从而建立笛卡尔运动学机器人结构。x轴和y轴被称为横轴,并且在操作配置中,分别水平横穿重力方向,而z轴被称为垂直轴,并且与重力方向对齐。轴通常是机动化轴并且实现为例如如本领域一般已知的线性主轴或线性电机驱动。在一些实施方案中,横轴中的任一个(例如y轴)分开放置在基底支持物上,而另外两个轴(例如x轴和z轴)组合放置,其中一个轴承载另一个。在其它实施方案中,所有三个轴作为组合放置(例如,y轴承载x轴并且z轴由x轴承载)。
45、在一些实施方案中,将激光束引导到悬臂上,并且对光电二极管进行布置,使得它收集被悬臂反射的激光束。提供激光束的激光器和光电二极管均可以在控制单元的控制下。
46、在一些实施方案中,可以通过显微镜实现视觉控制,所述显微镜也可以由控制单元控制。显微镜可以配备有荧光或共焦成像手段。
47、在一些实施方案中,其中将1至1000fl体积的基因组编辑组合物直接注射到细胞的核内。
48、在一些实施方案中,至少一种grna分子包含与crrna退火的tracrrna。在此类实施方案中,tracrrna和crrna通常并非共价连接的。与sgrna相比,已知此类退火的grna在切割靶dna方面较不有效,所述sgrna由包含crrna和tracrrna的序列的单个rna分子组成。然而,由于根据本发明的方法具有高得多的基因组编辑效率和特异性(由于免除了传统的转染屏障,并且组分直接递送到核内的事实),因此由于使用退火grna的效率降低是可忽略不计的。然而,强大的优点在于,由于与sgrna相比,退火grna的效率降低,脱靶率显著降低,从而降低了脱靶效应的发生。
49、在一些实施方案中,至少一种grna分子是sgrna,其由单个rna分子组成或包含单个rna分子,所述单个rna分子包含crrna和tracrrna的序列。
50、根据另一个方面,一般目的通过由根据本文所述的任何实施方案的方法获得的遗传改造的细胞来实现。
- 还没有人留言评论。精彩留言会获得点赞!