用于血小板生成的3D多孔结构的用途的制作方法
本发明涉及体外血小板生成。具体地,本发明公开了一种从巨核细胞(mk)大规模生成血小板的方法和装置。
背景技术:
1、血小板是小的无核血细胞,其功能是阻止出血。由于某些疾病、治疗或重大出血后使得其血小板数较低(血小板减少症)的病人需要进行血小板输血–这是一种拯救生命的产品。目前,唯一的来源是血液捐献。尽管如此,由于血小板只有五天的保质期,医院库存需要持续更新,而在已开发国家经常出现短缺问题(大约20%)(疫情传播、恶劣天气、假期期间等),而在新兴国家有超过一半的需求无法得到满足。短缺议题可能导致错误配型的输血,可能造成输血效果不佳或不良事件,包括异体免疫反应。任何这类事件,对于需要血小板输血的脆弱患者群体在管理上是实质的难题,这与较长的住院时间、较高的住院成本和较低的存活率有关。体外生成血小板以用于治疗应用是一种吸引人的替代方案,但仍然是一项重大的技术挑战,尤其是关于在面向工业生产过程中的可扩展性。
2、血小板起源于成熟的巨核细胞。成熟的巨核细胞是在骨髓中发生的过程的结果,所述过程涉及多能造血干细胞向mk祖细胞的定型、这些祖细胞的增殖和分化、它们的多倍体化和它们的成熟。通过动态过程,成熟mk的细胞质形成长假足伸长(被称为前血小板)通过血管环境,以释放成盘形的血小板到窦状血管中。已经确立,血小板生成的“器官”不仅由骨髓构成,还包括肺部,其中mk可以流动依赖的方式直接在肺微循环中生成这些伸长物(等人;“肺是血小板生源的地点和造血祖细胞的储备库”;自然。2017年4月6日;544(7648):105–109)。已经进行许多设计专用于血小板生成的生物反应器的尝试。
3、基于骨髓环境模型的生物反应器通常有两个区域:一个是播种mk的地方,另一个是收集血小板的地方。从骨髓(mk区域)到血流(血小板区域)的动态途径被以不同方式模仿。
4、在2011年,balduini及其团队报告了一种3d系统,这是第一个以研究mk迁移、附着到窦状血管、前血小板形成和血小板释放为目标的骨髓环境空间重建(pallotta等人;“使用丝基血管针对巨核细胞和功能性血小板生成体外研究的三维系统”;组织工程:部分c方法。2011;17(12):1223-32)。丝微管(壁厚50μm±20μm以匹配前血小板长度,孔径2μm-8μm以允许前血小板)以从家蚕(bombyx mori)茧纯化出的生物源蛋白聚合体此丝质纤维蛋白制备,然后涂上sdf1-α(一种化学趋化因子)和被不同蛋白所稀释的基底胶(温韦伯氏因子(vwf)、纤维蛋白原(fbg)或i型胶原)。来自脐血(cb)造血干细胞(hscs)的3·105mk悬浮液被添加在胶原i凝胶准备物(模拟成骨区位)和被涂布的丝管外壁(模拟血管区位)之间的界面。在16小时的孵育后,7%±2%的植入mk通过微管壁延伸出前血小板(与vwf和fbg的组合),并且大约200万个血小板在32μl/ml的流速(剪切速率~40/s)下被收集在于微管中输注的溶液中。在2015年,通过将丝管(壁厚50μm±20μm和孔直径22μm±4μm)嵌入被以ecm蛋白功能化的丝海绵(连接的孔从100μm到500μm直径范围)中以完全重建人类骨髓区位环境的生理状态,3d系统被改善(di buduo等人;“可编程3d丝骨髓区位用于体外血小板生成和巨核细胞生成病理学模拟”;血液。2015;125(14):2254-2264)。总共2.5·105成熟的源自cb的mk被植入到功能化的丝海绵中。16小时后,所述系统允许mk向血管迁移,黏附到外壁,24小时后前血小板被延伸进入微管的腔室中。通过在微管中以60/s的剪切速率输注培养基,血小板(140万)被回收。使用ecm组件来功能化多孔丝,诸如i型胶原、纤维蛋白、纤连蛋白、iv型胶原或层黏连蛋白,而微管则以纤连蛋白、iv型胶原和层黏连蛋白功能化。最近,同一团队(di buduo等人;“用于工程化骨髓结构和功能的模块化流动腔室”;生物材料。2017;146:60-71)开发了一种简化的系统,所述系统由一个模块化的矩形流动腔室组成,所述腔室固定住丝海绵(3.4×20×5mm;孔直径370μm±115μm),所述丝海绵以细胞外基质成分功能化,所述细胞外基质嵌入在中央腔室中,所述中央腔室与入口和出口连接以允许系统输注。3-4·105个源自cb的成熟mk在功能化的丝支架中被植入24小时。在此期间后,当持续8小时以~90μl/分钟输注培养基时(即,平均壁剪切速率为1.9s-1),流动允许血小板样微粒脱离并在出口处被收集。即使所述系统被描述为旨在扩大血小板生成,但所述出版物并未公开任何有关此目标的表现。此系统被进一步用作预测病人对药物反应的微型化骨组织模型,将干细胞(造血或诱导多能),即mk的前驱体,植入在丝海绵中(di buduo等人;“微型化3d骨髓组织模型用于评估患者对血小板生成素受体激动剂的反应”;elife 2021;10:e58775)。15天或更长时间后,允许干细胞扩展并分化为mk,少量(4·105)的血小板被生成。最后,tozzi等人建议通过在丝海绵(孔径从117μm±4.9μm到126μm±3.7μm)中重新引入功能化通道(直径1mm)来改进此简化系统(tozzi等人;“多通道丝海绵模拟骨髓血管区位用于血小板生成”;生物材料。2018;178:122-133)。大约1.5·106个cd41+cd42b+源自cb的mk被逐滴植入丝支架中(丝中有190mk/mm3)并培养36小时,直到在海绵中形成前血小板。然后,以10μl/分钟的流速输注6小时,允许在通道腔体内收集0.8-4.5·106的血小板。将通道添加到简化系统的原因是要重建骨髓的不同环境,即在海绵、空通道的壁和空通道之间引入不同的流动和剪应力。当流动被引入系统中时,在通道内观察到均匀的流动,而支架内的流动可以忽略不计,并且通道壁和丝海绵之间的剪切值有明显的转变。值得注意的是,生物反应器的设计避免了支架和生物反应器壁之间的“边缘流动”。所有这些丝装置集成了多个连续的生成步骤-植入mk以达到最终阶段的成熟(假足伸长)以形成前血小板,生成并收集血小板,使得用于规模放大的每个步骤的优化变得更加困难。例如,mk细胞在多孔材料中的植入密度是有限的,因为mk需要空间来延伸前血小板(tozzi中190mk/mm3),由此需要大量的材料。在tozzi中,需要~1.3m3的丝海绵来生成3·1011个血小板,这是每次输血给病人的剂量,由此也需要大量的培养基和用于功能化丝海绵的产品。堆迭多个装置并不能解决大量所需消耗品,并使工业化变得复杂。
5、avanzi等人也描述一个从干细胞生成血小板的整合系统(wo 2012/129109a2(纽约血液中心公司)2012年9月27日)。最后一步包含了一系列的血小板释放腔室。每个血小板释放腔室分为上腔室和下腔室,上腔室含有3d基质或支架(孔约在2μm到6μm之间,涂布了能够刺激前血小板形成和血小板释放的因子),下腔室用于收集血小板。如同之前的系统,mk被植入在支架上。在此,两个独立的流动分别施加在上腔室和下腔室,以再次重建血管区位中mk成熟为前血小板的最后步骤以及血液流动中的血小板生成。上腔室中的前血小板形成和下腔室中的血小板收集进行大约1到2天。即使此系统在每个植入mk所收集的血小板数量上具有前景,通过腔室仅可植入少量mk(1·105),释放出1到3.3·106个血小板(avanzi mp等人;"新颖生物反应器和培养方法驱动从干细胞中生成血小板的高产率";输血.2016;56(1):170-178)。
6、在2018年,shepherd等人考虑建立结构逐渐改变的胶原支架,这不仅提供mks结构支撑,还具有基于不同细胞大小的筛选能力(在上部区域中对最大细胞的高度可得,而在底部区域中对最大的细胞较不可得)(shepherd jh等人;"应用于从源自人类多能干细胞的巨核细胞的血小板体外生成的结构逐渐变化的胶原支架:提高产量和纯度";生物材料。2018;182:135–144)。mk细胞植入密度与先前系统在相同范围(在5ml的培养液中,向胶原支架中载入4·105个mk),用于隔夜培养(19小时以上)。留在生物反应器中的每个巨核细胞所生成的血小板数量是29.2±15,但考虑所有引入装置的mk时,所述血小板数量则较低。另外,还对所生成的血小板的质量表达了担忧。
7、微流体装置也被提出,模仿骨髓血管内皮细胞的多孔结构。
8、nakagawa等人公开了两种微流体生物反应器(nakagawa等人;"生物反应器中的两种差异流动促使从源自人类多能干细胞的巨核细胞生成血小板";实验性血液学。2013;41(8):742-748)。在这些系统中,特定方向的流动对被困在多孔结构中的巨核细胞施加压力。第二种流动(主流动)被用于在多孔结构的出口处创造剪切应力以释放血小板。植入的mk数量较低(1.2·105),每个植入的mk所生成的血小板数量也少于1。
9、thon等人描述了一种2通道然后变为3通道的生物反应器,其具有培养基通道与上通道或下通道之间的壁,所述壁上穿刺有缝隙(0.1μm到20μm)(wo 2014/107240 a1(布里格姆和妇女医院公司)2014年7月10日;thon等人;"血小板生物反应器芯片";血液。2014;124:1857-1867;wo 2015/153451a1(布里格姆和妇女医院公司)2015年10月8日)。引入培养基通道的mk被推过间隙,其中它们被困住并接触到上通道和下通道的流动,使它们暴露于剪切应力。在此系统中,剪切速率范围较高(100-2500/s),与先前系统相比,剪切速率的峰值出现在间隙连接处。在2小时中,每个巨核细胞的plt产率为30,但引入系统的mk浓度较低,为1.9×104±1.3×104mk每ml,这是由于每个装置的缝隙/间隙数量有限。为了克服低容量的问题,系统被修改,如wo 2017/044149 a1(布里格姆和妇女医院公司)2017年3月16日所公开的,通过将"mk通道"(入口通道)和"血小板"通道(出口通道)之间的缝隙/间隙替换为形成微流体路径的可渗透膜(孔径在3μm和10μm之间),至少将多个通道中的至少一个横向收缩,以允许对mk的压力和剪切应力进行解联接,并考虑并行的多个入口/出口通道。血小板从第一小时开始生成,在24小时的生成期间血小板数量会增加。然后,每个通道中都添加了重新流通流体的可能性,并且通过将通道拉长成s形或通过调整重新创建两种环境(巨核细胞储存容器和血小板储存容器)的单个储存容器生物反应器上的膜来增加膜的表面积(wo2018/165308 a1(血小板生物生成公司)2018年9月13日)。在所有这些改进中,原理都是相同的:膜孔的尺寸小于mk,以防止它们穿过膜,并且每个装置可以处理的mk数量受膜中可用的孔数量的限制。由此,所述系统通过堆迭多个装置来放大规模(wo 2020/018950 a1(血小板生物生成公司)23.01.202)。
10、最后,在2018年,eto和合作者提出了新的培养系统,其没有两个隔室(us2021/0130781 a1(eto等人)2021年5月6日;ito等人;“湍流激活血小板生物生成以实现临床规模的体外生成”;细胞。2018;174(3):636-648)。基于在小鼠骨髓上进行的体内观察,他们假设湍流是血小板释放的关键物理因素,除了剪切应力。他们开发了液体培养生物反应器,其中包括两个混合叶片,所述混合叶片固定在与电源轴水平的角度处,并且相互垂直。叶片重复上下往复运动,产生湍流、剪切应力和涡流。剪切速率在任何大小的生物反应器中都低于60/s。在含有组合试剂的基础培养基中,以1·105或2·105个immkcl/ml,使从由诱导多能干细胞(ipsc)产生的不死化细胞系(immkcl)衍生的mk在此生物反应器中进行了6至7天的成熟培养。以生物反应器中的8l,他们成功得到了1000亿个血小板。此液体培养方法允许更高量的mk被处理,但仍然是混合了mk成熟步骤和生成步骤,需要低初始浓度的mk。
11、超越骨髓生物模拟和更符合肺血管中的血小板生成的其他装置被开发出来。
12、dunois-lardé等人示出,人类成熟的mk在vwf表面上暴露于高剪切速率下,会导致细胞改变,造成在20分钟内释放出血小板(dunois-lardé等人;“将人类巨核细胞暴露于高剪切速率加速血小板生成”;血液。2009;27 8月27日;114(9):1875-83)。然后,blin等人开发了用于从引入微流体装置的mk体外生成血小板的快速方法(2小时),所述装置由在并行微通道中分布的vwf涂布微柱的宽阵列组成,其中应用了独特的流动(blin等人;“血小板生成器官的微流体模型:超越骨髓生物模拟”;科学报告。6,21700(2016))。在高剪切速率下,自由浮动的mk锚定在柱上,伸长为前血小板,然后释放血小板。悬浮液在装置中再循环,以便给未遇到柱的mk提供新的锚定机会。这个纹理表面由通道壁上的3d图案定义为平面中的六角形阵列盘,并且是一维阵列的柱(wo 2015/075030a1(platod),2015年5月28日)。为了克服因为堵塞的风险,在通道入口处更高密度的锚定的mk阻止处理高mk浓度的问题,提议在通道入口处从柱到柱的更大空间,以及更进入装置中更狭窄的空间(wo 2016/180918 a1(platod),2016年11月17日)。令人惊讶的是,在使用这种微柱多通道装置的实验中,增加微柱的高度,旨在为mk锚定提供额外的表面,并没有造成更高的血小板产率,而且它并没有允许增加输入mk的浓度/体积。
13、kumon等人改造了弯曲形状的3d微通道,其高度沿流动路径逐渐减小,以捕获各种大小的mks(kumon等人;“使用三维微通道的芯片上血小板生成”;2018ieee微机电系统(mems).2018:121-124)。被捕获的mk暴露于微通道中的流体力下,从而生成血小板。在这样的系统中,将通道的高度降低到5μm将迅速导致装置堵塞。
14、单流微流体系统提供了在非常短的期间同步生成血小板的可能性,但一个议题是,当大幅增加通道数量或堆叠装置以实现工业化生成时,每个通道中应用的高剪切速率需要不现实的大泵。
15、当考虑以合理的成本放大血小板生成规模时,最好的系统是能够处理大体积高浓度细胞的系统,这反过来又允许使用低量的培养基,并获得大量的血小板。血小板产率是另一个重要参数,但是对于相同生物反应器而言,(ito等人;“湍流激活血小板生物生成以实现临床规模的体外生成”;细胞。2018;174(3):636-648),会根据许多其他因素而变化(例如,细胞类型、克隆、培养基等)。
技术实现思路
1、本发明涉及一种从巨核细胞中大规模生成血小板的方法和血小板生成装置。特别地,装置包括包括可旋转床反应器,所述可旋转床反应器含有多孔材料,所述装置被用于在短时间期间大规模生成血小板。
2、根据本发明的方法,可以在大约15分钟的短时间期间生成血小板。血小板生成可以持续长达12小时,优选地长达4小时。
3、如欧洲专利申请ep 21155887所公开的多孔结构,它们在此通过引用合并,包括巨孔材料。因此,多孔结构用作流动的障碍,并能够用作mk的锚定点。多孔结构为mk提供用于贴附的支架,同时当受到剪切应力时,保留足够的开放空间(孔)供mk伸长。当mk伸长时,然后它就形成血小板。多孔结构可以有一个孔密度的梯度,目的是增加血小板的生成。以此方式,就可以防止所有巨核细胞只根据流动方向贴附在微结构的入口处,并且由此最大化巨核细胞对多孔结构的占用。
4、据此,在本发明的实施例中,多孔材料被定义为含有孔(空洞、通道、间隙等)的材料。多孔结构可以是自然的或人造的。多孔材料可以是有机材料、无机材料、聚合物(塑料)、金属,陶瓷和非晶体。多孔材料可以包括两种或两种以上的材料的结合。多孔材料可以由一个含有孔的实体制成,或者可以是由几个颗粒、珠子、纤维或元素堆积在一起的组合。这些颗粒的组合形成巨孔结构,其中颗粒之间的空间构成孔。颗粒可以被粘合、熔合或胶粘在一起,或者它们可以只是紧邻靠近。多孔材料可以根据它们的结构有不同的其他命名:泡沫、纤维、气泡状泡沫材料、晶格或填充珠子。
5、在本发明的实施例中,多孔材料可以有不同的孔尺寸;也叫孔宽(直径)这是孔的两个相对壁的距离;从1μm到10μm,优选地从50μm到1μm。大部分的多孔材料可以有相同的孔尺寸或构成一个梯度的一个范围的孔尺寸(即不同的孔尺寸)。大部分的多孔材料可以由相同的材料或两种或更多种材料构成,其具有相同的孔尺寸或具有不同的孔尺寸。
6、在本发明的实施例中,多孔材料的孔可以是半闭合的或开放的,优选是开放的并且相互连接(通过孔或连接孔),即没有尽端路或囊状(呈囊或袋的形状)。孔可以有不同的形状,例如漏斗形、圆柱形、不规则、墨水瓶形状或类似形状)。孔的截面形状可以是卵形的或多边形的(规则的或不规则的、平滑的或直的、凹的或凸的)。多孔材料的孔可以是有序的或不规则的排列或两者的混合。多孔材料可以用不同的方法制备。
7、在本发明的实施例中,多孔材料可以根据其孔隙率(总孔体积vp与表观体积v的比率)基于单位体积的孔数分类为低孔隙率、中孔隙率或高孔隙率。一般而言,低孔隙率和中孔隙率的多孔材料具有闭合的孔。孔隙率可以从20%扩展到99.9%,优选地从80%扩展到99.9%。
8、在本发明的实施例中,多孔材料可以是刚性的或弹性的。一个更刚性的结构,由此在流动压力下变形较小,可以作为对mk抵抗流动剪切应力的更强的锚。
9、在本发明的实施例中,多孔材料可以涂布有对巨核细胞有亲和力的配体,例如,(i)温韦伯氏因子(vwf)或其功能变体,(ii)包含vwf片段的多肽,(iii)纤维蛋白原,(iv)纤连蛋白,(v)层粘连蛋白,(vi)iv型胶原蛋白,(vii)iii型胶原蛋白,(viii)i型胶原蛋白,和(ix)玻连蛋白。
10、在一个实施例中,多孔材料通过以vwf或其功能变体的溶液进行培养被涂布。典型地,用于涂布固体相的vwf浓度在5μg/ml和100μg/ml之间。优选地,vwf的浓度在20μg/ml和40μg/ml之间。例如,多孔材料可以使用选自由重组野生型vwf或突变的vwf多肽所组成的群组的功能变体涂布,所述多肽在大肠杆菌或哺乳动物细胞中表达,作为单体或二聚体多肽。
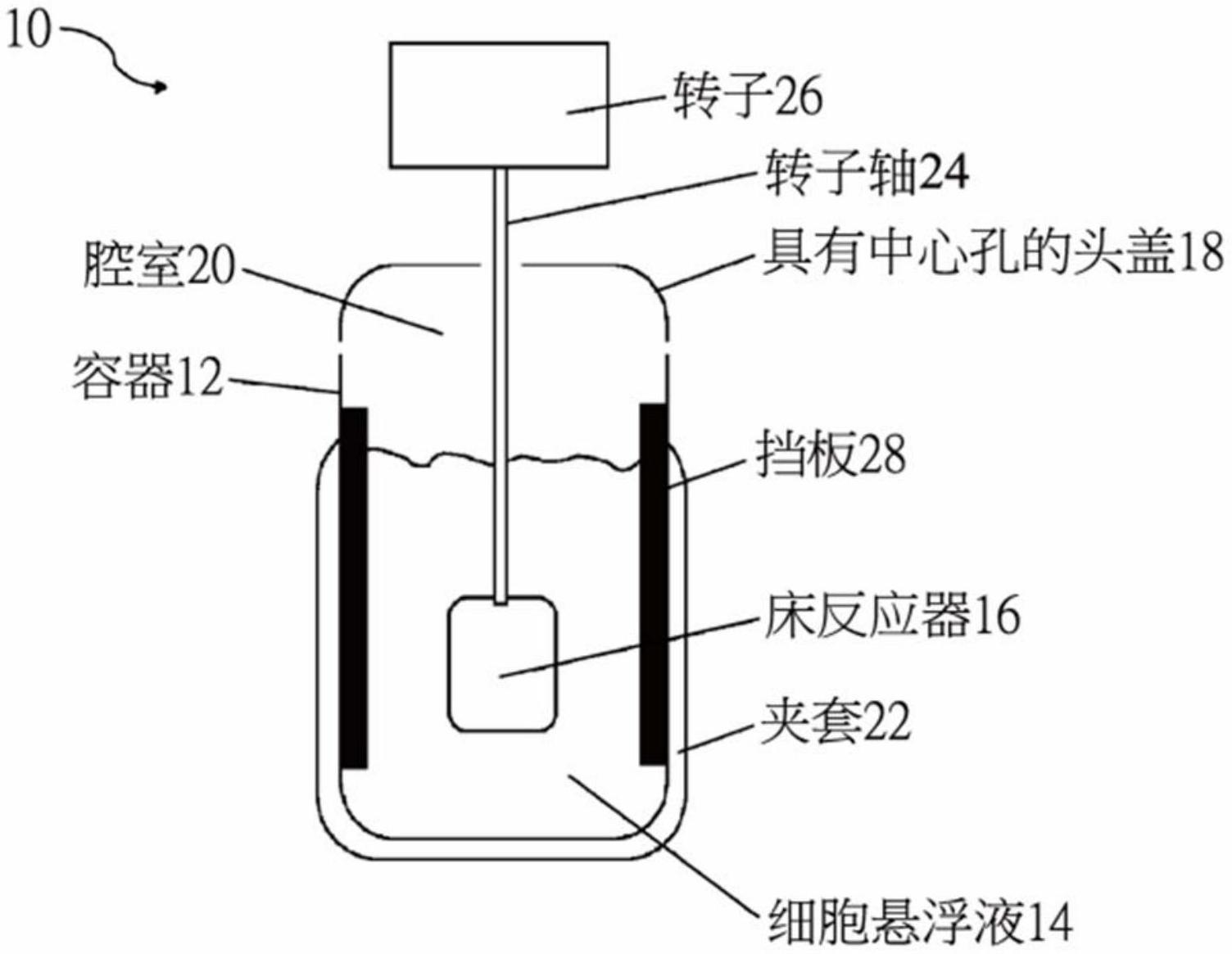
11、在本发明的实施例中,血小板生成装置包括含有细胞悬浮液的容器,以及含有多孔材料的床反应器,其中床反应器被配置为当浸入细胞悬浮液中时旋转。例如,多孔材料包括棉纤维(100%有机棉),所述棉纤维被切割成与床反应器可用空腔的尺寸相对应的薄层。
12、在本发明的实施例中,床反应器包括中空体,所述中空体包括从基板延伸到顶板的外周壁,从而在其间形成空腔以容纳多孔材料。
13、床反应器进一步包括通孔,所述通孔被设置在床反应器的中心处,从顶板延伸到基板,以便协助通过床反应器的流体流动(例如,细胞悬浮液的流动)。以此方式,细胞悬浮液能够经由通孔从床反应器的顶板和底板进入床反应器。
14、优选地,床反应器具有对称形状,例如,圆柱形状。
15、容器被配置为被顶板(头盖)封盖,从而形成腔室。例如,所述腔室被配置为被清空以产生被控制的气体组成。
16、床反应器被配置为能够附接到由转子控制的转子轴。例如,转子轴被配置为穿过在头盖中形成的中心孔。替代地,转子轴被配置为能够通过轴联接机构与头盖联接。
17、床反应器被配置为通过设置在床反应器的顶板上的连接器与转子轴连接。连接器中的开口被配置为引导细胞悬浮液的流动经由通孔进入床反应器。
18、细胞悬浮液可以直接添加到放置头盖之前的容器中。替代地,细胞悬浮液能够通过头盖中的开口被引入。
19、头板被配置为使用例如通过将头板夹紧在容器上的方式而被固定在容器上。
20、进一步,可以使用蠕动泵或其他流通泵将细胞悬浮液倒入或抽入容器中。
21、容器进一步被配置为被套住使用冷却或加热的夹套,以控制其中细胞悬浮液的温度。
22、床反应器包括由网状材料制成的外壁。替代地,外壁包括数个开口。
23、床反应器可以进一步包括内壁,其设置在中空体内并在其上形成多个开口。
24、容器可以以进一步包括设置其中的挡板,以确保流动通过床反应器的流通。
25、床反应器与容器的体积比例可以从仅大于1:1高至1:100,优选为从1:2至1:20。
26、例如,床反应器可以容纳多达28cm3的多孔材料,并被配置为装入500ml的容器中。特别地,此多孔材料与容器体积的比例被发现到有良好匹配。一般来说,也可以使用更高量的多孔材料。如果是这样,容器的体积也可以扩大。由此,能够选择除了28cm3的多孔材料和500ml的容器以外的其他值。
27、床反应器被配置为旋转,例如,可达1000rpm。
28、每立方毫米多孔材料的巨核细胞密度可以在10·103mk/mm3到100·106mk/mm3的范围内,优选在100·103mk/mm3到10·106mk/mm3的范围内。
29、在本发明的实施例中,使用血小板生成装置进行大规模生成血小板的方法可以包括以下步骤:
30、-将细胞悬浮液(即,含有成熟巨核细胞的溶液)添加到血小板生成装置的容器中;
31、-将多孔材料引入到血小板生成装置的床反应器中;
32、-将床反应器安装到转子轴上;
33、-将床反应器放入血小板生成装置的容器中;
34、-可选地,将容器以头盖封闭以便于维持被控制的气氛;
35、-以预定的速度旋转床反应器;以及
36、-可选地,收集细胞和血小板悬浮液的样品,例如,以固定期间,用以计数和特征化血小板和mk。
37、在本发明的实施例中,“细胞悬浮液”用于本发明的方法,例如,可以通过以下步骤获得:
38、-提供选自hsc(例如,来自脐带、周边血液或骨髓)、改造过的hsc或选自由胚胎干细胞、改造过的胚胎干细胞、诱导的多能干细胞和改造过的诱导多能干细胞组成的群组的干细胞;
39、-培养干细胞,即扩展细胞并将扩展的细胞分化为mk。
40、在本发明的实施例中,将多孔材料引入床反应器的步骤包括将床反应器的整个体积以块状形式填充。替代地,多孔材料被布置成数层几百微米的组合,其中多孔材料可以通过设置在床反应器内的中间壁来分隔,例如,与顶板和底板平行。例如,在容器的体积未被层状的多孔材料填充的情况下,床反应器可以被填充物填充,例如,塑料填充物,从而只通过层状多孔材料建立流动。
- 还没有人留言评论。精彩留言会获得点赞!