I型膜蛋白异二聚体及其使用方法与流程
背景技术:
技术实现思路
1、根据本发明的一些实施方式的一个方面,提供了一种异二聚体,其包含选自由sirpα、pd1、tigit、lilrb2和siglec10所组成的组的两种多肽,其中,所述两种多肽中的每一种都能够结合其天然结合对,并且其中所述异二聚体不包含能够结合其天然结合对的ii型膜蛋白的氨基酸序列。
2、根据本发明的一些实施方式,所述异二聚体包含与所述两种多肽连接的二聚化部分。
3、根据本发明的一些实施方式,所述二聚化部分是抗体的fc结构域或其片段。
4、根据本发明的一些实施方式,所述fc结构域被修饰以改变其与fc受体的结合,降低其免疫激活功能和/或提高所述融合的半衰期。
5、根据本发明的一些实施方式,所述异二聚体包含所述sirpα多肽和所述pd1多肽。
6、根据本发明的一些实施方式,所述异二聚体包含所述sirpα多肽和所述lilrb2多肽。
7、根据本发明的一些实施方式,所述异二聚体包含所述sirpα多肽和所述siglec10多肽。
8、根据本发明的一些实施方式,所述异二聚体包含所述sirpα多肽和所述tigit多肽。
9、根据本发明的一些实施方式,所述异二聚体包含所述tigit多肽和所述pd1多肽。
10、根据本发明的一些实施方式,所述异二聚体包含所述tigit多肽和所述lilrb2多肽。
11、根据本发明的一些实施方式,所述异二聚体包含所述tigit多肽和所述siglec10多肽。
12、根据本发明的一些实施方式,所述异二聚体包含所述pd1多肽和所述siglec10多肽。
13、根据本发明的一些实施方式,所述异二聚体包含所述lilrb2多肽和所述siglec10多肽。
14、根据本发明的一些实施方式,所述异二聚体包含所述pd1多肽和所述lilrb2多肽。
15、根据本发明的一些实施方式,所述多肽中的每一种是所述异二聚体中的单体。
16、根据本发明的一些实施方式,所述两种多肽包含在所述异二聚体的单体中。
17、根据本发明的一些实施方式的一个方面,提供了一种包含异二聚体的组合物,其中所述异二聚体是所述组合物中所述两种多肽的主要形式。
18、根据本发明的一些实施方式的一个方面,提供了一种核酸构建体或系统,包含至少一种编码异二聚体的多核苷酸,和用于指导所述多核苷酸在宿主细胞中表达的调节元件。
19、根据本发明的一些实施方式的一个方面,提供了一种包含异二聚体或核酸构建体或系统的宿主细胞。
20、根据本发明的一些实施方式的一个方面,提供了一种生产异二聚体的方法,所述方法包括将所述核酸构建体或系统引入宿主细胞或培养细胞。
21、根据本发明的一些实施方式,所述方法包括分离所述异二聚体。
22、根据本发明的一些实施方式的一个方面,提供了一种治疗有需要的对象中可受益于所述异二聚体治疗的疾病的方法,所述方法包括向所述对象给药治疗有效量的所述异二聚体、组合物、核酸构建体或系统或细胞,从而治疗所述对象的所述疾病。
23、根据本发明的一些实施方式的一个方面,提供了所述异二聚体、组合物、核酸构建体或系统或细胞,用于治疗有需要的对象中可受益于用所述异二聚体治疗的疾病的用途。
24、根据本发明的一些实施方式,所述疾病可受益于激活免疫细胞。
25、根据本发明的一些实施方式,与所述疾病相关的细胞表达所述天然结合对。
26、根据本发明的一些实施方式,所述疾病是癌症。
27、根据本发明的一些实施方式,所述癌症选自由淋巴瘤、白血病、结肠癌、卵巢癌、肺癌、头颈癌和肝细胞癌所组成的组。
28、根据本发明的一些实施方式,所述癌症是非小细胞肺癌(nsclc)或间皮瘤。
29、根据本发明的一些实施方式的一个方面,提供了一种激活免疫细胞的方法,所述方法包括在所述异二聚体、组合物、核酸构建体或系统或细胞的存在下,在体外激活免疫细胞。
30、根据本发明的一些实施方式,所述激活是在表达所述天然结合对的细胞的存在下进行的。
31、除非另有限定,否则本文中使用的所有技术和/或科学术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。尽管可以在本发明的实施方式的实践或测试中使用与本文描述的那些类似或等同的方法和材料,但是下面描述了示例性方法和/或材料。如有冲突,以专利说明书(包括限定)为准。此外,这些材料、方法和实施例仅是说明性的,并不意味着必须是限制性的。
32、附图简要说明
33、本文通过示例的方式参考附图描述了本发明的一些实施方式。现在详细地具体参考附图,需要强调的是,所示的细节是示例性的,并且是为了说明性地讨论本发明的实施方式。在这点上,结合附图所作的描述使得本领域技术人员清楚如何实施本发明的实施方式。
34、在附图中:
35、图1a是异二聚体的可能排列/构象的非限制性示例的示意图。
36、图1b显示了本发明一些实施方式所设想的异二聚体的组成和排列的示意图。
37、图2a是sirpα-pd1异二聚体(在本文称为“dsp120v1”(seq id no:5和7))的示意图。
38、图2b-c显示了sirpα-pd1异二聚体dsp120v1(seq id no:5和7)的所述预测3d结构。图2b是一示意性3d模型,图2c是一完整原子3d模型。sirpα(在“杵(knob)”链中)以深灰色带显示(右下侧)表示。pd1(在“臼(hole)”链中)以灰色带显示(右上侧)表示。“杵”序列的higg4在图右下侧以白色带表示。“臼”序列的higg4在图右上侧以灰色带表示。在sirpα、higg4和pd1的结构元件之间,用灰色带及白色带表示“间隔物”/“连接体(linker)”节段。higg4 fc结构域(其稳定复合物)的铰链半胱氨酸残基用cpk表示。
39、图3a是sirpα-lilrb2异二聚体(在本文称为“dsp216v1”(seq id nos:5和15))的示意图。
40、图3b-c显示了sirpα-lilrb2异二聚体dsp216v1(seq id nos:5和15)的所述预测3d结构。图3b是一示意性3d模型,图3c是一完整原子3d模型。sirpα(在“杵”链中)以深灰色带显示(右下侧)表示。lilrb2(在“臼”链中)以深灰色带显示(右上侧)表示。“杵”序列的higg4在图右下侧以白色带表示。“臼”序列的higg4在图右上侧以灰色带表示。在sirpα、higg4和lilrb2的结构元件之间,以灰色及白色带表示“间隔物”/“连接体”节段。higg4 fc结构域(稳定复合物)的铰链半胱氨酸残基用cpk表示。
41、图4a是tigit-siglec10异二聚体(在本文称为“dsp404v1”(seq id nos:13和30))的示意图。
42、图4b-c显示了tigit-siglec10异二聚体dsp404v1(seq id nos:13和30)的所述预测3d结构。图4b是一示意性3d模型,图4c是一完整原子3d模型。tigit(在“杵”链中)以灰色表面显示(右下侧)表示。siglec10(在“臼”链中)以灰色表面显示(右上侧)表示。“杵”序列的higg4在图右下侧以白色表面表示。“臼”序列的higg4在图右上侧以灰色表面表示。tigit、higg4和siglec10的结构元件之间,用灰色及白色带表示“间隔物”/“连接体”节段。higg4 fc结构域(稳定复合物)的铰链半胱氨酸残基用cpk表示。
43、图5a是tigit-pd1异二聚体(在本文称为“dsp502v1”(seq id nos:13和7))的示意图。
44、图5b-c显示了tigit-pd1异二聚体dsp502v1(seq id nos:13和7)的所述预测3d结构。图5b是一示意性3d模型,图5c是一完整原子3d模型。tigit(在“杵”链中)以灰色带显示(右下侧)表示。pd1(在“臼”链中)以灰色带显示(右上侧)表示。“杵”序列的higg4在图右下侧以白色带表示。“臼”序列的higg4在图右上侧以灰色带表示。在tigit、higg4和pd1的结构元件之间,用灰色及白色带表示“间隔物”/“连接体”节段。higg4 fc结构域(稳定复合物)的铰链半胱氨酸残基用cpk表示。
45、图6a-b显示了几种产生的异二聚体(参见下文表1中的描述和序列)的sds-聚丙烯酰胺凝胶电泳(sds-page)分析。图6a显示了用编码所示异二聚体的质粒转染的expi293f细胞的粗(非纯化)-五天上清液样品的sds-page图像,在还原(r)和/或非还原(nr)条件下分离上清液。对照样品为未转染的expi293f细胞的培养5天的上清液。图6b显示了如所示的使用蛋白-a或阴离子交换层析从用编码所示异二聚体的构建体转染的细胞的5天上清液中纯化的样品的sds-page图像。
46、图7a-c显示了几种产生的异二聚体(参见下文表1中的描述和序列)的蛋白印迹分析。图中提供的样品是用编码所示异二聚体的质粒转染的expi293f细胞的粗(非纯化)-五天上清液。在非还原(nr)和/或还原(r)条件下,在sds-page上分离上清液,然后用抗pd1(图7a)、抗sirpα(图7b)或抗lilrb2(图7c)抗体进行免疫印迹。
47、图8a-b显示了sirpα-pd1异二聚体(本文中称为“dsp120”(seq id nos:1和3))与cd47和pdl1的结合。将含有异二聚体的上清液或对照上清液(来自未转染的expi293f细胞)温育在cd47或pdl1预包被的96孔板中。温育后,用抗pd-1(对于cd47包被的板)或兔抗人sirpα抗体(对于pdl1包被的板)进行检测,然后与相应的hrp缀合的二抗一起温育。根据标准elisa协议,使用酶标仪(plate reader)(thermo scientific,multiscan fc)在450nm处,使用tmb底物进行检测,参考波长为620nm。图8a显示了dsp120以浓度依赖方式与cd47包被的板结合,图8b显示了dsp120以浓度依赖方式与pdl1包被的板结合。
48、图9a-c显示了sirpα-lilrb2异二聚体(本文中称为“dsp216”(seq id nos:1和11,图9a)和“dsp216v1”(seq id nos:5和15,图9b-c))与hla-g的结合。将含有异二聚体(来自未转染的expi293f细胞)的上清液或对照上清液在hla-g预包被的96孔板中温育。通过先与兔抗人sirpα抗体温育,然后与山羊抗兔igg-hrp和tmb底物温育,根据标准elisa协议,使用酶标仪(thermo scientific,multiscan fc)在450nm处检测结合,参考波长为620nm。图9a显示了dsp216与hla-g蛋白包被的板以浓度依赖方式结合。未观察到与对照上清液(对照)的结合。图9b-c显示了含有dsp216v1(图9b)或纯化的dsp216v1(图9c)的粗上清液以浓度依赖方式与hla-g包被的板结合。
49、图10a-b显示出pd1-tigit异二聚体(本文中称为“dsp502”(seq id nos:9和3))与其pvr对应物的结合。将含有异二聚体的上清液或对照上清液(来自未转染的expi293f细胞)(图10a)或纯化的蛋白质(图10b)在pvr预包被的96孔板中温育。温育后,用抗pd1抗体进行检测,然后与相应的hrp缀合的二抗一起温育。根据标准elisa协议,使用酶标仪(thermoscientific,multiscan fc)在450nm处,使用tmb底物进行检测,参考波长为620nm。图10a-b显示出dsp502以浓度依赖方式结合到pvr包被的板上。
50、图11a-e显示出dsp120和dsp120v1与表达pdl1或cd47的细胞的结合,如通过流式细胞术分析所确定的。所给出的mfi值用于通过flowjo软件创建结合曲线图。图11a是显示出dld1-pdl1过表达细胞系上pdl1表达的直方图。pdl1的表面表达水平通过用荧光标记的抗pdl1抗体对dld1 wt和pdl1过表达细胞系(dld1-pdl1)进行免疫染色,然后进行流式细胞术分析来确定。图11b是显示出cho-k1-cd47 hb9克隆细胞上cd47受体表达的直方图。cd47的表面表达水平通过使用抗cd47抗体对cho-k1 wt和cd47过表达细胞系(克隆hb9)进行免疫染色,然后进行流式细胞术分析来确定。图11c-d显示出与dld1-wt相比,dsp120(图11c)和dsp120v1(图11d)与dld1-pdl1过表达细胞系的结合。温育后,使用抗sirpα抗体对其sirpα结构域进行免疫染色,然后进行流式细胞术分析,从而确定异二聚体与细胞系的结合。图11e显示出dsp120v1与cho-k1-cd47hb9克隆细胞的结合。温育后,通过使用抗igg4抗体对其igg-fc结构域进行免疫染色,然后进行流式细胞术分析,确定异二聚体与hcd47过表达细胞系的结合。cho-k1 wt细胞用作结合测定的阴性细胞对照。
51、图12e-f显示出dsp216和dsp216v1与表达cd47和hla-g的细胞的结合,如通过流式细胞术分析所确定的。图12a和12c显示出cd47在ht1080(图12a)和ht1080-hla-g(图12c)细胞系上的表达。cd47的细胞表面表达通过用抗人cd47抗体和igg1同种型对照对细胞系进行免疫染色,然后进行流式细胞术分析来确定。图12b和12d显示出hla-g在ht1080(图12b)和ht1080-hla-g(图12d)细胞系上的表达。通过用抗人hla-g抗体和igg2a同种型对照对细胞系进行免疫染色来确定hla-g的表面表达水平。图12e显示出dsp216与表达cd47的细胞ht1080的结合。温育后,使用lilrb2抗体对其lilrb2结构域进行免疫染色,然后进行流式细胞术分析,从而确定异二聚体与细胞系的结合。显示了lilrb2阳性细胞的百分比,并用于通过graphpad prism软件来创建结合曲线图。图12f显示出含有异二聚体dsp216v1的上清液与ht1080-hla-g细胞系的结合。通过使用抗igg4抗体对igg4主链进行免疫染色,然后进行流式细胞术分析来确定异二聚体与细胞系的结合。给出了mfi值,并用于通过graphpadprism软件创建结合曲线图。
52、图13显示出siglec10-pd1异二聚体(本文中称为“dsp402”(seq id nos:24和3))与dld1 wt和pdl1过表达细胞系的结合,如通过流式细胞术分析所确定的。细胞与dsp402温育后,使用抗pd1抗体对其pd1结构域进行免疫染色,然后进行流式细胞术分析,从而确定异二聚体与dld1 pdl1过表达细胞系的结合。dld-1wt细胞用作结合测定的阴性细胞对照。给出了mfi值,并用于通过flowjo软件创建结合曲线图。
53、图14a-g显示出tigit-pd1异二聚体(在本文中称为“dsp502”(seq id nos:9和3))与表达pvr和pdl1的细胞的结合。图14a-c显示出pvr在dld-1wt(图14a)、dld-1pdl1(图14b)和ht1080(图14c)细胞系上的表达。通过用apc标记的抗pvr抗体对细胞系进行免疫染色,然后进行流式细胞术分析,来确定pvr的细胞表面表达。给出了mfi值。图14d显示出pdl1在ht1080细胞上的表达。通过用apc标记的抗pdl1抗体或同种型对照对细胞系进行免疫染色,随后进行流式细胞术分析,来确定pdl1的表面表达水平。图14e-f显示出dsp502与dld1pdl1(图14e)或ht1080(图14f)细胞的结合。温育后,使用抗人igg1抗体对其igg1-fc结构域进行免疫染色,然后进行流式细胞术分析,从而确定异二聚体与细胞系的结合。通过将细胞与针对pvr或pd-l1的封闭抗体一起温育来测试与dsp502的每个结构域的结合的特异性。图14g显示出tigit-pd1异二聚体(在本文中称为“dsp502v1”(seq id nos:13和7))、“dsp502v2”(seq id nos:31和7)、“dsp502v3”(seq id nos:33和7)与pvr的特异性结合,这通过与表达pvr但不表达pd1的dld-1wt细胞的结合来证明。使用抗人igg4抗体对其igg4-fc结构域进行免疫染色,然后进行流式细胞术分析,从而确定异二聚体的结合。给出了mfi值,并用于通过flowjo软件创建结合曲线图。
54、图15显示了几种产生的异二聚体(参见下文表1中的描述和序列)的sds-聚丙烯酰胺凝胶电泳(sds-page)分析。该图显示了用编码所示异二聚体的质粒转染的expi293f细胞的粗(非纯化)-五天上清液样品的sds-page图像,在还原(r)和/或非还原(nr)条件下分离上清液。
55、图16a-f显示出与ht1080-wt细胞相比,sirpα-lilrb2异二聚体(在本文中称为“dsp216”(seq id nos:1和11,图16a)、“dsp216v1”(seq id nos:5和15,图16b)、“dsp216v3”(seq id nos:138和11,图16c)、“dsp216v4”(seq id nos:140和15,图16d)、“dsp216v5”(seq id nos:142和150,图16e)或“dsp216v6”(seq id nos:144和150,图16f))与过表达hla-g的细胞(ht1080-hla-g)的结合。如图所示,在与或不与封闭抗体一起温育后,通过使用apc缀合的抗人iggl抗体对igg主链进行免疫染色,或使用dsp216v1和dsp216v4的抗sirpα对sirpα结构域进行免疫染色,然后进行流式细胞术分析,来确定异二聚体与细胞系的结合。给出了mfi值,并用于通过graphpad prism软件创建结合曲线图。
56、图17a-f显示出sirpα-lilrb2异二聚体dsp216(seq id no:1和11,图17c)、dsp216v3(seq id no:138和11,图17d)、dsp216v5(seq id no:142和150,图17e)或dsp216v6(seq id no:144和150,图17f)与同时表达cd47和hla-g的jeg-3细胞的结合(图17a-b)。如所示,在与或不与封闭抗体一起温育后,通过使用抗人igg1抗体对igg主链进行免疫染色,然后进行流式细胞术分析,来确定异二聚体与细胞系的结合。给出了mfi值,并用于通过graphpad prism软件创建结合曲线图。
57、图18a-d显示出sirpα-lilrb2异二聚体dsp216(seq id no:1和11,图18a)、dsp216v1(seq id no:5和15,图18b)、dsp216v3(seq id no:138和11,图18c)和dsp216v4(seq id no:140和15,图18d)与板结合的(pb)重组人cd47的结合。将含有异二聚体的上清液在cd47预包被的96孔板中温育。根据标准elisa协议,使用酶标仪(thermo scientific,multiscan fc)在450nm处,使用tmb底物进行检测,通过与抗人igg1-或igg4-hrp抗体温育来检测结合,参考波长为620nm。o.d.值用于通过graphpad prism软件创建结合曲线图。
58、图18e-h显示出sirpα-lilrb2异二聚体dsp216(seq id nos:1和11,图18e)、dsp216v1(seq id no:5和15,图18f)、dsp216v3(seq id no:138和11,图18g)和dsp216v4(seq id no:140和15,图18h)与板结合的(pb)重组人hla-g的结合。将含有异源二聚体的上清液在hla-g预包被的96孔板中温育。根据标准elisa协议,使用酶标仪(thermoscientific,multiscan fc)在450nm处,使用tmb底物进行检测,通过与抗人igg1-或igg4-hrp抗体温育来检测结合,参考波长为620nm。o.d.值用于通过graphpad prism软件创建结合曲线图。
59、图19a-i显示出tigit-pd1异二聚体dsp502(seq id no:9和3)和异二聚体(本文中称为“dsp502v4”(seq id nos:146和148))与表达pdl1和/或pvr的细胞的结合,如通过流式细胞术分析所确定的。给出了mfi值,并用于通过flowjo software软件创建结合曲线图。图19a显示出dsp502与k562 pd-l1细胞的结合;图19b显示出dsp502与k562 pd-l1/pvr细胞的结合;图19c显示出dsp502v4与k562 pd-l1细胞的结合;图19d显示出dsp502v4与k562 pd-l1/pvr细胞的结合;图19g显示出dsp502与k562 pvr细胞的结合;图19h显示出dsp502v4与k562pvr细胞的结合。图19e、19f和19i是显示pdl1或pvr在k562 pd-l1、k562pvr和k562 pd-l1/pvr细胞上表达的直方图。如所示,通过用荧光标记的抗pdl1或抗pvr抗体进行免疫染色,然后进行流式细胞术分析,来确定pdl1和pvr的表面表达水平。
60、图20a显示出tigit-pd1异二聚体dsp502(seq id nos:9和3)与表达pvr的skov3细胞的结合,如在有或没有封闭抗体的情况下温育后通过流式细胞术分析所确定的,如所示。给出了mfi值,并用于通过flowjo软件创建结合曲线图。
61、图20b是显示出pvr在skov3细胞上表达的直方图。通过用荧光标记的抗pvr抗体对细胞进行免疫染色,然后进行流式细胞术分析,来确定pvr的表面表达水平。
62、图21a显示出tigit-pd1异二聚体dsp502(seq id nos:9和3)与表达小鼠pdl1和pvr的renca细胞的结合,在有或没有封闭抗体的情况下温育后通过流式细胞术分析所确定的,如图所示。给出了mfi值,并用于通过flowjo软件创建结合曲线图。
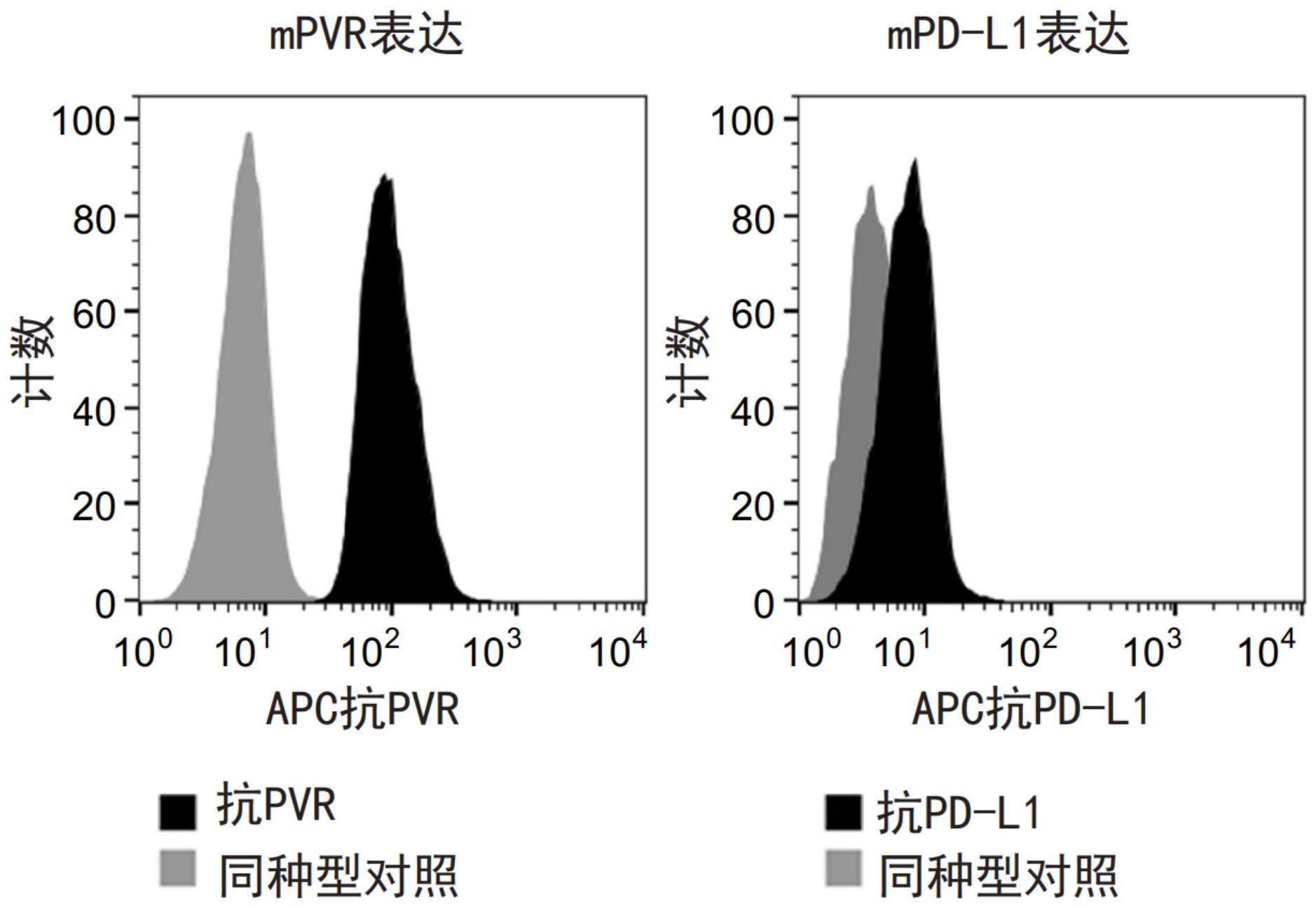
63、图21b显示了表明pdl-1和pvr在renca细胞上表达的直方图。如图所示,通过用荧光标记的抗pdl1或抗pvr抗体对细胞进行免疫染色,然后进行流式细胞术分析,来确定pdl1和pvr的表面表达水平。
64、图22a显示出tigit-pd1异二聚体dsp502(seq id no:9和3)与鼠细胞系ab12的结合,如通过流式细胞术分析所确定的。给出了mfi值,并用于通过flowjo软件创建结合曲线图。
65、图22b是显示出pdl1和pvr在ab12细胞上的表面表达水平的直方图。如图所示,通过用荧光标记的抗pdl1或抗pvr抗体对细胞进行免疫染色,然后进行流式细胞术分析,来测定pdl1和pvr的表面表达水平。
66、图23a显示出tigit-pd1异二聚体dsp502(seq id no:9和3)与jurkat nfat-cd16细胞的结合,在有或没有封闭抗体的情况下温育后通过流式细胞术分析所确定的,如图所示。给出了mfi值,并用于通过flowjo软件创建结合曲线图。
67、图23b是显示出cd16在jurkat nfat-cd16细胞上表达的直方图。如图所示,通过用荧光标记的抗cd16抗体对细胞进行免疫染色,然后进行流式细胞术分析,来确定cd16的表面表达水平。
68、图24显示出在存在不同浓度的dsp502(seq id no:9和3)的情况下,与k562-wt或k562过表达pdl1和pvr细胞共培养后,jurkat nfat-cd16细胞的荧光素酶分泌水平。荧光素酶分泌的水平被测量为发光信号,通过荧光素酶和添加底物(quanti-luc)相互作用产生。
69、图25a显示出dsp502(seq id no:9和3)的tigit和pd1结构域与其对应配体/受体同时结合。图25a显示与板结合的pdl1的结合,然后与人cd155(pvr)-小鼠igg2a fc一起温育。根据标准elisa协议,使用酶标仪在450nm处检测链霉亲和素hrp,然后加入tmb底物,参考波长为540nm。
70、图25b-d显示出在存在不同浓度的tigit-pd1异二聚体dsp502(seq id no:9和3)的情况下,nk细胞和k562 pvr/pd-l1细胞的双峰的形成。图25b是显示nk细胞上cd16表达水平的直方图,通过用荧光标记的抗cd16抗体对细胞进行免疫染色,然后进行流式细胞术分析来确定。图25c显示出在所示浓度的dsp502的存在下双峰的形成。图25d显示出在用如图所示的阻断剂抗体(fc阻断、pvr阻断或pd-l1阻断)温育后,在所示浓度的dsp502的存在下双峰的形成。q1(每个图中的左上四分之一)表示k562 pvr/pd-l1 cfse标记的细胞(y轴上的阳性细胞);q3(每个图中的右下四分之一)表示nk cpd标记的细胞(x轴上的阳性细胞);并且q2(每个图中的右上四分之一)表示具有双峰百分比的nk-k562 pvr/pd-l1细胞的双峰。
71、图26显示出在人源化nsg小鼠的a549-nsclc异种移植物模型中tigit-pd1异二聚体dsp502(seq id no:9和3)的体内抗肿瘤效应,其表现为与媒介物对照相比肿瘤体积减小。在每个实验组中n=5。
72、图27显示出tigit-pd1异二聚体dsp502(seq id no:9和3)在携带ab12间皮瘤肿瘤的小鼠中的体内抗肿瘤效应,其表现为与媒介物对照相比生存时间延长。在每个实验组中n=5。
73、图28显示出sirpα-lilrb2异二聚体dsp216(seq id no:1和11,图16a)对癌细胞被粒细胞吞噬的作用。将ht1080或ht1080-hla-g细胞标记,并用0、1、2或5μg/ml dsp216进行预温育,然后与粒细胞以1:1共培养,并通过流式细胞术分析。显示了取自三个供体的粒细胞的吞噬作用的百分比。
74、图29a显示出tigit-pd1异二聚体dsp502(seq id no:9和3)的细胞毒性作用。示出了在dsp502的存在下,按指定比例将指定的k562细胞与nk细胞共培养后死亡细胞的百分比。条形上方的星号表示相对于未处理的共培养的统计学显著性。
75、图29b显示出tigit-pd1异二聚体dsp502(seq id no:9和3)与所示k562细胞共培养后对nk细胞的颗粒酶b分泌的影响。条形上方的星号表示相对于未处理的共培养的统计学显著性。
- 还没有人留言评论。精彩留言会获得点赞!