免疫调节性抗体及其用途的制作方法
免疫调节性抗体及其用途
1.序列表
2.本技术包含序列表,所述序列表以
ascii
格式电子提交并且通过引用以其整体特此并入
。
所述
ascii
拷贝于
2022
年1月
14
日创建,名为“onr-006wo_sl.txt”并且大小为
37,676
字节
。
3.相关申请的交叉引用
4.本技术要求
2021
年1月
20
日提交的美国临时专利申请第
63/199,732
号和
2021
年4月1日提交的美国临时专利申请第
63/200,897
号的权益,将这两个申请通过引用以其整体并入本文
。
5.公开内容的概述
6.本文提供了可用于治疗癌症和纤维化的抗体,包括抗原结合片段和其他抗原结合多肽
。
7.在某些实施方案中,本文公开了抗体,所述抗体包含:
(a)
具有与选自由以下组成的组的氨基酸序列至少
80
%相同的序列的重链可变区
(vh)
:
seq id no:29、seq id no:31、seq id no:33、seq id no:35、seq id no:37、seq id no:39
和
seq id no:41
;和
(b)
具有与选自由以下组成的组的氨基酸序列至少
80
%相同的序列的轻链可变区
(vl)
:
seq id no:28、seq id no:30、seq id no:32、seq id no:34、seq id no:36、seq id no:38
和
seq id no:40
;条件是所述抗体不包含具有
seq id no:40
中列出的序列的轻链可变区
(vl)
和
seq id no.41
中列出的序列的重链可变区
(vh)。
在一些实施方案中,轻链可变区
(vl)
具有与选自由以下组成的组的氨基酸序列至少
85
%相同的序列:
seq id no:28、seq id no:30、seq id no:32、seq id no:34、seq id no:36、seq id no:38
和
seq id no:40。
在一些实施方案中,轻链可变区
(vl)
具有与选自由以下组成的组的氨基酸序列至少
90
%相同的序列:
seq id no:28、seq id no:30、seq id no:32、seq id no:34、seq id no:36、seq id no:38
和
seq id no:40。
在一些实施方案中,轻链可变区
(vl)
具有与选自由以下组成的组的氨基酸序列至少
95
%相同的序列:
seq id no:28、seq id no:30、seq id no:32、seq id no:34、seq id no:36、seq id no:38
和
seq id no:40。
在一些实施方案中,轻链可变区
(vl)
具有与选自由以下组成的组的氨基酸序列至少
99
%相同的序列:
seq id no:28、seq id no:30、seq id no:32、seq id no:34、seq id no:36、seq id no:38
和
seq id no:40。
在一些实施方案中,轻链可变区
(vl)
具有与选自由以下组成的组的氨基酸序列
100
%相同的序列:
seq id no:28、seq id no:30、seq id no:32、seq id no:34、seq id no:36、seq id no:38
和
seq id no:40。
在一些实施方案中,重链可变区
(vh)
具有与选自由以下组成的组的氨基酸序列至少
85
%相同的序列:
seq id no:29、seq id no:31、seq id no:33、seq id no:35、seq id no:37、seq id no:39
和
seq id no:41。
在一些实施方案中,重链可变区
(vh)
具有与选自由以下组成的组的氨基酸序列至少
90
%相同的序列:
seq id no:29、seq id no:31、seq id no:33、seq id no:35、seq id no:37、seq id no:39
和
seq id no:41。
在一些实施方案中,重链可变区
(vh)
具有与选自由以下组成的组的氨基酸序列至少
95
%相同的序列:
seq id no:29、seq id no:31、seq id no:33、seq id no:35、seq id no:37、seq id no:39
和
seq id no:41。
在一些实施方案中,重链可变区
(vh)
具有与选自由以下组成的组的氨基酸序列至少
99
%相同的序列:
seq id no:29、seq id no:31、seq id no:33、seq id no:35、seq id no:37、seq id no:39
和
seq id no:41。
在一些实施方案中,重链可变区
(vh)
具有与选自由以下组成的组的氨基酸序列
100
%相同的序列:
seq id no:29、seq id no:31、seq id no:33、seq id no:35、seq id no:37、seq id no:39
和
seq id no:41。
在一些实施方案中,可变重链的氨基酸序列在
cdr h1、cdr h2、cdr h3
处
100
%相同,并且可变轻链的氨基酸序列在
cdr l1、cdr l2
和
cdr l3
处
100
%相同
。
在一些实施方案中,
cdr h1
具有如选自由以下组成的组的氨基酸序列中列出的序列:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25。
在一些实施方案中,
cdr h2
具有如选自由以下组成的组的氨基酸序列中列出的序列:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26。
在一些实施方案中,
cdr h3
具有如选自由以下组成的组的氨基酸序列中列出的序列:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27。
在一些实施方案中,
cdr l1
具有如选自由以下组成的组的氨基酸序列中列出的序列:
seq id no:1、seq id no:7
和
seq id no:13。
在一些实施方案中,
cdr l2
具有如选自由以下组成的组的氨基酸序列中列出的序列:
seq id no:2、seq id no:9
和
seq id no:14。
在一些实施方案中,
cdr l3
具有如选自由以下组成的组的氨基酸序列中列出的序列:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15。
8.在某些实施方案中,本文公开了抗体,所述抗体包含:
(a)
具有与由以下组成的组中列出的氨基酸序列至少约
80
%相同的氨基酸序列的轻链
cdr1
:
seq id no:1、seq id no:7
和
seq id no:13
;具有与由以下组成的组中列出的氨基酸序列至少约
80
%相同的氨基酸序列的轻链
cdr2
:
seq id no:2、seq id no:9
和
seq id no:14
;和具有与由以下组成的组中列出的氨基酸序列至少约
80
%相同的氨基酸序列的轻链
cdr3
:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15
;和
(b)
具有与由以下组成的组中列出的氨基酸序列至少约
80
%相同的氨基酸序列的重链
cdr1
:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;具有与由以下组成的组中列出的氨基酸序列至少约
80
%相同的氨基酸序列的重链
cdr2
:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;具有与由以下组成的组中列出的氨基酸序列至少约
80
%相同的氨基酸序列的重链
cdr3
:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27
;条件是所述抗体不包含至少如以下中列出的序列:
seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5
和
seq id no:6。
在一些实施方案中,
cdr l1
具有与选自由以下组成的组的氨基酸序列至少
85
%相同的序列:
seq id no:1、seq id no:7
和
seq id no:13
;
cdr l2
具有与选自由以下组成的组的氨基酸序列至少
85
%相同的序列:
seq id no:2、seq id no:9
和
seq id no:14
;并且
cdr l3
具有与选自由以下组成的组的氨基酸序列至少
85
%相同的序列:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15。
在一些实施方案中,
cdr l1
具有与选自由以下组成的组的氨基酸序列至少
90
%相同的序列:
seq id no:1、seq id no:7
和
seq id no:13
;
cdr l2
具有与选自由以下组成的组的氨基酸序列至少
90
%相同的序列:
seq id no:2、seq id no:9
和
seq id no:14
;并且
cdr l3
具有与选自由以下组成的组的氨基酸序列至少
90
%相同的序列:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15。
在一些实施方案中,
cdr l1
具有与选自由以下组成的组的氨基酸序列至少
95
%相同的序列:
seq id no:1、seq id no:7
和
seq id no:13
;
cdr l2
具有与选自由以下组成的组的氨基酸序列至少
95
%相同的序列:
seq id no:2、seq id no:9
和
seq id no:14
;并且
cdr l3
具有与选自由以下组成的组的氨基酸序列至少
95
%相同的序列:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15。
在一些实施方案中,
cdr l1
具有与选自由以下组成的组的氨基酸序列至少
99
%相同的序列:
seq id no:1、seq id no:7
和
seq id no:13
;
cdr l2
具有与选自由以下组成的组的氨基酸序列至少
99
%相同的序列:
seq id no:2、seq id no:9
和
seq id no:14
;并且
cdr l3
具有与选自由以下组成的组的氨基酸序列至少
99
%相同的序列:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15。
在一些实施方案中,
cdr l1
具有与选自由以下组成的组的氨基酸序列
100
%相同的序列:
seq id no:1、seq id no:7
和
seq id no:13
;
cdr l2
具有与选自由以下组成的组的氨基酸序列
100
%相同的序列:
seq id no:2、seq id no:9
和
seq id no:14
;并且
cdr l3
具有与选自由以下组成的组的氨基酸序列至少
100
%相同的序列:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15。
在一些实施方案中,
cdr h1
具有与选自由以下组成的组的氨基酸序列至少
85
%相同的序列:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;
cdr h2
具有与选自由以下组成的组的氨基酸序列至少
85
%相同的序列:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;并且
cdr h3
具有与选自由以下组成的组的氨基酸至少
85
%相同的序列:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27。
在一些实施方案中,
cdr h1
具有与选自由以下组成的组的氨基酸序列至少
90
%相同的序列:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;
cdr h2
具有与选自由以下组成的组的氨基酸序列至少
90
%相同的序列:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;并且
cdr h3
具有与选自由以下组成的组的氨基酸至少
90
%相同的序列:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27。
在一些实施方案中,
cdr h1
具有与选自由以下组成的组的氨基酸序列至少
95
%相同的序列:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;
cdr h2
具有与选自由以下组成的组的氨基酸序列至少
95
%相同的序列:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;并且
cdr h3
具有与选自由以下组成的组的氨基酸至少
95
%相同的序列:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27。
在一些实施方案中,
cdr h1
具有与选自由以下组成的组的氨基酸序列至少
99
%相同的序列:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;
cdr h2
具有与选自由以下组成的组的氨基酸序列至少
99
%相同的序列:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;并且
cdr h3
具有与选自由以下组成的组的氨基酸至少
99
%相同的序列:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27。
在一些实施方案中,
cdr h1
具有与选自由以下组成的组的氨基酸序列至少
100
%相同的序列:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;
cdr h2
具有与选自由以下组成的组的氨基酸序列至少
100
%相同的序列:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;并且
cdr h3
具有与选自由以下组成的组的氨基酸至
t
细胞
、cd8+ t
细胞
、nk
细胞或其任何组合的增殖
。
在一些实施方案中,
cd4+ t
细胞
、cd8+ t
细胞
、nk
细胞或其任何组合的活化被测量为
ifn-γ
、tnf-α
或穿孔蛋白或其任何组合的增强的水平
。
在一些实施方案中,抗体与巨噬细胞的结合对巨噬细胞没有细胞毒性
。
在一些实施方案中,抗体与巨噬细胞的结合导致以下作用中的至少一种:巨噬细胞对至少一种标志物的表达减少,其中至少一种标志物是
cd16、cd64、tlr2
或
siglec-15
;抗体被巨噬细胞内化;
ifn-γ
、tnf-α
和穿孔蛋白的分泌;
cd4+ t
细胞
、cd8+ t
细胞
、nk
细胞或其任何组合的活化;
cd4+t
细胞
、cd8+ t
细胞
、nk
细胞或其任何组合的增殖;和促进肿瘤微环境中的肿瘤细胞杀伤
。
在一些实施方案中,结合导致:
(a)
至
(e)
中的两种或更多种;
(a)
至
(e)
中的三种或更多种;
(a)
至
(e)
中的四种或更多种;或
(a)
至
(e)
中的全部
。
在一些实施方案中,抗体与巨噬细胞的结合增加肿瘤微环境中的免疫刺激活性
。
在一些实施方案中,抗体与巨噬细胞的结合减少巨噬细胞的免疫抑制活性
。
在一些实施方案中,抗体与巨噬细胞的结合减少巨噬细胞的肿瘤促进活性
。
在一些实施方案中,抗体的结合促进
cd4+ t
细胞活化
、cd4+ t
细胞增殖
、
或
cd4+ t
细胞活化和
cd4+ t
细胞增殖两者
。
在一些实施方案中,结合促进
cd4+ t
细胞对
cd69、icos、ox40、pd1、lag3、ctla4
或其任何组合的表达
。
在一些实施方案中,抗体的结合促进
cd8+t
细胞活化
、cd8+ t
细胞增殖
、
或
cd8+ t
细胞活化和
cd8+ t
细胞增殖两者
。
在一些实施方案中,抗体的结合促进
cd8+ t
细胞对
icos、ox40、pd1、lag3、ctla4
或其任何组合的表达
。
在一些实施方案中,抗体蛋白的结合促进细胞毒性淋巴细胞介导的癌细胞杀伤
。
在一些实施方案中,抗体的结合促进
nk
细胞介导的肿瘤细胞杀伤
。
在一些实施方案中,抗体的结合促进
t
细胞对
il-2
的表达
。
在一些实施方案中,抗体的结合增加
cd4+ t
细胞
、cd196-t
细胞
、cxcr3+ t
细胞
、ccr4
‑ꢀ
t
细胞或其任何组合
。
在一些实施方案中,抗体与巨噬细胞的结合减少对肿瘤微环境中细胞毒性
t
细胞介导的肿瘤细胞杀伤的抑制
。
在一些实施方案中,癌症是肺癌
。
在一些实施方案中,癌症是肺上皮癌
(lung carcinoma)
或肺肉瘤
。
在一些实施方案中,癌症是肺腺癌
。
在一些实施方案中,方法中的任何一种还包括向受试者施用抗癌治疗剂
。
在一些实施方案中,抗体与巨噬细胞的结合减少巨噬细胞的促纤维化功能
。
在一些实施方案中,纤维化疾病或紊乱是肺纤维化
。
在一些实施方案中,纤维化疾病或紊乱是心脏纤维化
。
在一些实施方案中,纤维化疾病或紊乱是肝纤维化
。
在一些实施方案中,纤维化疾病或紊乱是肾纤维化
。
在一些实施方案中,纤维化疾病或紊乱是视网膜纤维化
。
在一些实施方案中,纤维化是原发性纤维化疾病或紊乱
。
在一些实施方案中,原发性纤维化疾病或紊乱是特发性肺纤维化
(ipf)。
在一些实施方案中,原发性纤维化疾病或紊乱是肝硬化
。
在一些实施方案中,原发性纤维化疾病或紊乱是系统性硬化
(ssc)。
在一些实施方案中,原发性纤维化疾病或紊乱是放射性纤维化
。
在一些实施方案中,原发性纤维化疾病或紊乱是与机械损伤相关的疤痕形成
。
在一些实施方案中,纤维化是继发性纤维化疾病
。
在一些实施方案中,继发性纤维化疾病与选自由以下组成的组的疾病或紊乱相关:感染
、
自身免疫性疾病或紊乱
、
癌症和炎性疾病或紊乱
。
在一些实施方案中,继发性纤维化疾病与选自由以下组成的组的疾病或紊乱相关:动脉粥样硬化
、
心房颤动
、
慢性心力衰竭
、
外周动脉疾病
、
急性冠状动脉综合征
、
非酒精性脂肪性肝病
(nafld)、
慢加急性肝衰竭
、
急性肝衰竭
、
急性肾损伤
、
急性肾小管坏死和慢性肾病
。
在一些实施方案中,感染选自由以下组成的组:脓毒症
、hiv
感染
、sars-cov-2
感染
、
急性病毒性肝炎
、
慢性病毒性肝炎和疟疾
。
在一些实施方案中,自身免疫性或炎性疾病或紊乱选自由以下组成的组:急性肺损伤
(ali)、
急性呼吸窘迫综合征
(ards)、
过敏
性肺炎
、
酒精性肝炎
、
非酒精性脂肪性肝炎
、
病毒性肝炎
、
镰状细胞病
、1
型糖尿病
、2
型糖尿病
、
克罗恩病
、
乳糜泻
、
哮喘
、
结节病
、
肾小球肾炎
、
狼疮性肾炎
、
系统性红斑狼疮
、
类风湿性关节炎
、
干燥综合征
、
硬皮病
、
囊性纤维化
(cf)、
移植物抗宿主病
、
同种异体移植物排斥
、
肾同种异体移植物排斥
、
结节病
、
肺结节病
、
噬血细胞性淋巴组织细胞增多症
(hlh)、
炎性关节炎
、
慢性阻塞性肺病
(copd)、
哮喘
、
骨关节炎
、
纤维瘤和多发性硬化
。
在一些实施方案中,方法中的任何一种还包括向受试者施用抗炎疗法
。
13.在某些实施方案中,本文公开了根据前述方面和实施方案的抗体,所述抗体用作药物
。
14.在某些实施方案中,本文公开了根据前述方面和实施方案的抗体,所述抗体用于在治疗有相应需要的受试者中与
m2-巨噬细胞的存在相关的癌症或纤维化疾病或紊乱中使用
。
在一些实施方案中,抗体与巨噬细胞的结合促进免疫细胞功能,如通过以下参数中的一种或两种测量的:
(a)cd4+ t
细胞
、cd8+ t
细胞
、nk
细胞或其任何组合的活化;和
(b)cd4+ t
细胞
、cd8+ t
细胞
、nk
细胞或其任何组合的增殖
。
在一些实施方案中,
cd4+ t
细胞
、cd8+ t
细胞
、nk
细胞或其任何组合的活化被测量为
ifn-γ
、tnf-α
或穿孔蛋白或其任何组合的增强的水平
。
在一些实施方案中,抗体与巨噬细胞的结合对巨噬细胞没有细胞毒性
。
在一些实施方案中,抗体与巨噬细胞的结合导致以下作用中的至少一种:
(a)
巨噬细胞对至少一种标志物的表达减少,其中至少一种标志物是
cd16、cd64、tlr2
或
siglec-15
;
(b)
抗体被巨噬细胞内化;
(c)ifn-γ
、tnf-α
和穿孔蛋白的分泌;
(d)cd4+ t
细胞
、cd8+ t
细胞
、nk
细胞或其任何组合的活化;
(e)cd4+ t
细胞
、cd8+ t
细胞
、nk
细胞或其任何组合的增殖;和
(f)
促进肿瘤微环境中的肿瘤细胞杀伤
。
在一些实施方案中,结合导致:
(a)
至
(e)
中的两种或更多种;
(a)
至
(e)
中的三种或更多种;
(a)
至
(e)
中的四种或更多种;或
(a)
至
(e)
中的全部
。
在一些实施方案中,抗体与巨噬细胞的结合增加肿瘤微环境中的免疫刺激活性
。
在一些实施方案中,抗体与巨噬细胞的结合减少巨噬细胞的免疫抑制活性
。
在一些实施方案中,抗体与巨噬细胞的结合减少巨噬细胞的肿瘤促进活性
。
在一些实施方案中,抗体的结合促进
cd4+ t
细胞活化
、cd4+ t
细胞增殖
、
或
cd4+ t
细胞活化和
cd4+ t
细胞增殖两者
。
在一些实施方案中,结合促进
cd4+ t
细胞对
cd69、icos、ox40、pd1、lag3、ctla4
或其任何组合的表达
。
在一些实施方案中,抗体的结合促进
cd8+ t
细胞活化
、cd8+ t
细胞增殖
、
或
cd8+ t
细胞活化和
cd8+ t
细胞增殖两者
。
在一些实施方案中,抗体的结合促进
cd8+ t
细胞对
icos、ox40、pd1、lag3、ctla4
或其任何组合的表达
。
在一些实施方案中,抗体蛋白的结合促进细胞毒性淋巴细胞介导的癌细胞杀伤
。
在一些实施方案中,抗体的结合促进
nk
细胞介导的肿瘤细胞杀伤
。
在一些实施方案中,抗体的结合促进
t
细胞对
il-2
的表达
。
在一些实施方案中,抗体的结合增加
cd4+ t
细胞
、cd196
‑ꢀ
t
细胞
、cxcr3+ t
细胞
、ccr4
‑ꢀ
t
细胞或其任何组合
。
在一些实施方案中,抗体与巨噬细胞的结合减少对肿瘤微环境中细胞毒性
t
细胞介导的肿瘤细胞杀伤的抑制
。
在一些实施方案中,癌症是肺癌
。
在一些实施方案中,癌症是肺上皮癌或肺肉瘤
。
在一些实施方案中,癌症是肺腺癌
。
在一些实施方案中,抗体被配制为用于与抗癌治疗剂组合向受试者施用
。
在一些实施方案中,抗体与巨噬细胞的结合减少巨噬细胞的促纤维化功能
。
在一些实施方案中,纤维化疾病或紊乱是肺纤维化
。
在一些实施方案中,纤维化疾病或紊乱是心脏纤维化
。
在一些实施方案中,纤维化疾病或紊乱是肝纤维化
。
在一些实施方案中,纤维化疾病或紊乱是肾纤维化
。
在一些实施方案中,纤维化疾病或紊乱是视网膜纤维化
。
在一些实施方案中,纤维
化是原发性纤维化疾病或紊乱
。
在一些实施方案中,原发性纤维化疾病或紊乱是特发性肺纤维化
(ipf)。
在一些实施方案中,原发性纤维化疾病或紊乱是肝硬化
。
在一些实施方案中,原发性纤维化疾病或紊乱是系统性硬化
。
在一些实施方案中,原发性纤维化疾病或紊乱是放射性纤维化
。
在一些实施方案中,原发性纤维化疾病或紊乱是与机械损伤相关的疤痕形成
。
在一些实施方案中,纤维化是继发性纤维化疾病
。
在一些实施方案中,继发性纤维化疾病与选自由以下组成的组的疾病或紊乱相关:感染
、
自身免疫性疾病或紊乱
、
癌症和炎性疾病或紊乱
。
在一些实施方案中,继发性纤维化疾病与选自由以下组成的组的疾病或紊乱相关:动脉粥样硬化
、
心房颤动
、
慢性心力衰竭
、
外周动脉疾病
、
急性冠状动脉综合征
、
非酒精性脂肪性肝病
(nafld)、
慢加急性肝衰竭
、
急性肝衰竭
、
急性肾损伤
、
急性肾小管坏死和慢性肾病
。
在一些实施方案中,感染选自由以下组成的组:脓毒症
、hiv
感染
、sars-cov-2
感染
、
急性病毒性肝炎
、
慢性病毒性肝炎和疟疾
。
在一些实施方案中,自身免疫性或炎性疾病或紊乱选自由以下组成的组:急性肺损伤
(ali)、
急性呼吸窘迫综合征
(ards)、
过敏性肺炎
、
酒精性肝炎
、
非酒精性脂肪性肝炎
、
病毒性肝炎
、
镰状细胞病
、1
型糖尿病
、2
型糖尿病
、
克罗恩病
、
乳糜泻
、
哮喘
、
结节病
、
肾小球肾炎
、
狼疮性肾炎
、
系统性红斑狼疮
、
类风湿性关节炎
、
干燥综合征
、
硬皮病
、
囊性纤维化
(cf)、
移植物抗宿主病
、
同种异体移植物排斥
、
肾同种异体移植物排斥
、
结节病
、
肺结节病
、
噬血细胞性淋巴组织细胞增多症
(hlh)、
炎性关节炎
、
慢性阻塞性肺病
(copd)、
哮喘
、
骨关节炎
、
纤维瘤和多发性硬化
。
在一些实施方案中,抗体被配制为用于与抗炎疗法组合向受试者施用
。
15.附图简述
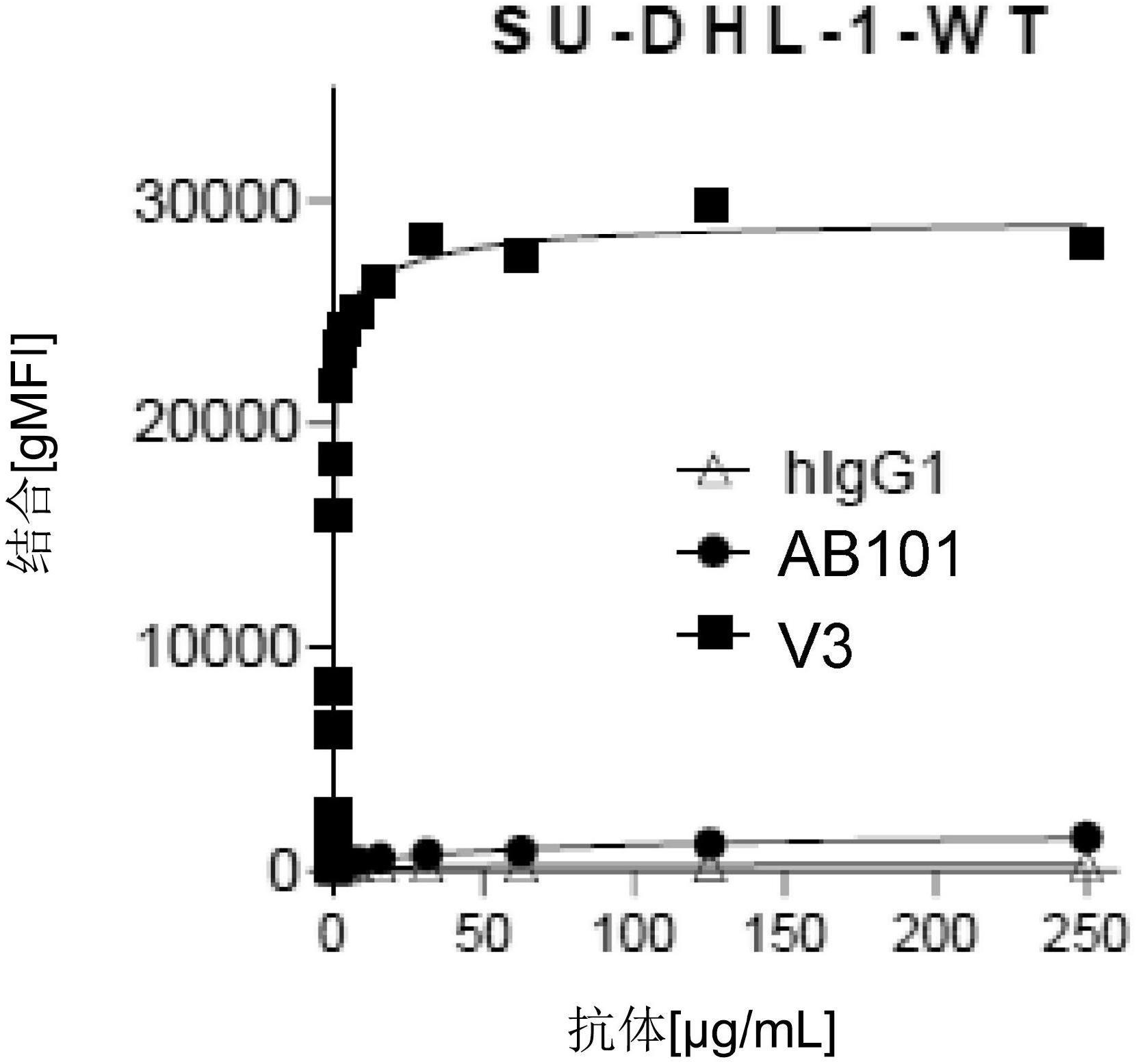
16.图
1a-图
1d
是显示抗
cd163
抗体与
su-dhl-1
淋巴瘤细胞结合的系列图
。
显示
ab101、
人类
igg1
同种型对照
(higg1)
和
ab101
的代表性变体
(v3)
与野生型
su-dhl-1
细胞
(su-dhl-1-wt)
的结合随着抗体浓度变化的图
(
图
1a)。
显示
ab101、
人类
igg1
同种型对照
(higg1)
和
v3
与共表达
cd64
的
su-dhl-1
细胞
(fc
γ
ri
;
su-dhl-1-cd64)
的结合随着抗体浓度变化的图
(
图
1b)。
显示
ab101、
人类
igg1
同种型对照
(higg1)
和
v3
与共表达
cd16
的
su-dhl-1
细胞
(fc
γ
riii
;
su-dhl-1-cd16)
的结合随着抗体浓度变化的图
(
图
1c)。
显示
ab101、
人类
igg1
同种型对照
(higg1)
和
v3
与共表达
cd32
的
su-dhl-1
细胞
(fc
γ
rii
;
su-dhl-1-cd32)
的结合随着抗体浓度变化的图
(
图
1d)。
17.图
2a-图
2f
是显示通过
elisa
测量的抗
cd163
抗体与重组
cd163
蛋白的结合的吸光度系列图
。
显示
ab101
亲本抗体
、v1
和
higg1
同种型对照与重组
cd163
蛋白结合的吸光度图
(
图
2a)。
显示
ab101
亲本抗体
、v2
和
higg1
同种型对照与重组
cd163
蛋白结合的吸光度图
(
图
2b)。
显示
ab101
亲本抗体
、v3
和
higg1
同种型对照与重组
cd163
蛋白结合的吸光度图
(
图
2c)。
显示
ab101
亲本抗体
、v4
和
higg1
同种型对照与重组
cd163
蛋白结合的吸光度图
(
图
2d)。
显示
ab101
亲本抗体
、v5
和
higg1
同种型对照与重组
cd163
蛋白结合的吸光度图
(
图
2e)。
显示
ab101
亲本抗体
、v6
和
higg1
同种型对照与重组
cd163
蛋白结合的吸光度图
(
图
2f)。
18.图3示出了抗
cd163
抗体与
m2c
巨噬细胞的结合,使用荧光激活细胞分选
(facs)
测量为几何中值荧光强度
(gmfi)。
图示出了与亲本
ab101
抗体相比,
v1
和
v4
的改进的结合
。higg1
同种型对照在该测定中未显示结合
。
19.图
4a-图
4c
是显示抗
cd163
抗体与从全血分离的
cd163
阳性细胞
(
树突状细胞
(dc)、
经典单核细胞
、
中间型单核细胞和非经典单核细胞
)
结合的系列柱状图
。
测试的抗体包括商
购可得的抗
cd163
抗体
(r20)、
亲本
ab101
抗体
、v3、higg1
同种型对照
(igg1)
和鼠
igg1
同种型对照
(migg1)。v3
显示出与全血中
cd163
阳性细胞的改进的结合
。
以三种不同浓度施用抗
cd163
抗体:1μ
g/ml(
图
4a)、3
μ
g/ml(
图
4b)
和
10
μ
g/ml(
图
4c)。
20.图
5a-图
5c
是显示
m2c/cd8+ t
细胞共培养物中
m2c
巨噬细胞介导的免疫抑制的缓解的系列图
。
显示用不同浓度抗
cd163
抗体处理后
cd8+ t
细胞计数
(
增殖
)
的恢复的图
(
图
5a)。
测试的抗体包括亲本
ab101
抗体
、v3
和人类
igg1
同种型对照
。v3
在缓解
m2c
巨噬细胞介导的
cd8+ t
细胞增殖抑制方面显示出与
ab101
相比约
40
倍高的效力
。
显示用不同浓度抗
cd163
抗体处理后
cd8+ t
细胞穿孔蛋白分泌的恢复的图
(
图
5b)。v3
在缓解
m2c
巨噬细胞介导的
cd8+ t
细胞穿孔蛋白分泌抑制方面显示出比
ab101
明显更高的效力
。
显示用不同浓度抗
cd163
抗体处理后
cd8+ t
细胞细胞因子
(ifn
γ
)
分泌的恢复的图
(
图
5c)。v3
在缓解
m2c
巨噬细胞介导的
cd8+ t
细胞
ifn
γ
分泌抑制方面显示出比
ab101
明显更高的效力
。
21.公开内容的详细描述
22.本文公开了与
cd163
+
细胞特异性结合的抗体
。
在一些实施方案中,
cd163
+
细胞是免疫抑制性骨髓细胞
。
在一些实施方案中,
cd163
+
细胞是表达人类
cd163
的骨髓细胞
。
在一些实施方案中,
cd163
+
免疫抑制性骨髓细胞是人类巨噬细胞
。
在一些实施方案中,人类
cd163
+
免疫抑制性巨噬细胞是
m2
或
m2
样巨噬细胞
。
在一些实施方案中,免疫抑制性骨髓细胞是骨髓来源的抑制性细胞
(mdsc)。
在一些实施方案中,人类巨噬细胞表达高水平的
cd163(cd163
高
)。
相比之下,其他人类造血细胞或原代非免疫人类细胞不表达
cd163。
例如,
m1
和
m1
样巨噬细胞不表达
cd163。
23.在一些实施方案中,巨噬细胞是肺巨噬细胞
。
在一些实施方案中,巨噬细胞是肺泡巨噬细胞
(am)。
在一些实施方案中,巨噬细胞是间质巨噬细胞
。
24.暴露于某些炎性细胞因子或微生物相关分子模式的单核细胞和巨噬细胞分化为促炎性
(m1
或
m1
样
)
或抗炎性
m2
或
m2
样巨噬细胞
。m1
和
m2
是用于将体外活化的巨噬细胞分别定义为促炎性
(
当用
ifn-γ
和脂多糖经典活化时
)
或抗炎性
(
当用
il-4
或
il-10
替代活化时
)
的分类,而在体内或离体具有
m1
或
m2
表型的巨噬细胞被定义为
m1
样或
m2
样巨噬细胞
。
在一些实施方案中,
m2
巨噬细胞通过它们暴露于某些细胞因子而产生
。
在一些实施方案中,
m2
巨噬细胞通过
il-4、il-10、il-13
或其组合分化
。
25.m2
样巨噬细胞具有对应于
m2
巨噬细胞及其亚型的功能和表型
。m2
样巨噬细胞是任何在体内或离体具有
m2
巨噬细胞的功能或表型特征的子集的巨噬细胞
。
26.在一些实施方案中,本公开内容的抗体对免疫抑制性骨髓细胞
(
特别是巨噬细胞,诸如
m2
和
m2
样巨噬细胞
)
具有高亲合力
(avidity)
和特异性结合
。
在一些实施方案中,抗体与驻留在
、
浸润或募集至纤维化组织的
m2
和
m2
样巨噬细胞特异性结合
。
在一些实施方案中,如本文公开的抗体与
m1
或
m1
样巨噬细胞没有可察觉的结合
。m1
活化的巨噬细胞表达转录因子诸如干扰素调节因子
(irf5)、
κ
轻多肽基因增强子的核因子
(nf-κ
b)、
活化蛋白
(ap-1)
和
stat1。m1
巨噬细胞分泌促炎细胞因子,诸如
ifn-γ
、il-1、il-6、il-12、il-23
和
tnf
α
。m1
巨噬细胞具有对应于
m1
巨噬细胞的功能和表型
。m1
样巨噬细胞是任何在体内或者离体具有
m1
巨噬细胞的功能或表型特征的子集的巨噬细胞
。
27.在一些实施方案中,本公开内容的抗体不与原代人类细胞结合
。
在一些实施方案中,本公开内容的抗体不与造血干细胞
、
白细胞
、t
细胞
、b
细胞
、nk
细胞和粒细胞结合
。
28.根据巨噬细胞的功能特征,包括巨噬细胞与
t
辅助细胞
(cd4
+
)
型
th1
和
th2
的关系,巨噬细胞一般落入两个类别,即
m1
样促炎巨噬细胞和
m2
样免疫抑制性巨噬细胞
。m1
巨噬细胞是“经典”模型,并且可以通过
ifn-γ
和先天免疫活化物诸如病原相关分子模式
(pamp)(
例如,脂多糖
(lps))
或损伤相关分子模式
(damp)
以及炎性细胞因子
(
例如,肿瘤坏死因子-α
(tnf-α
))
产生
。
此外,经由
cd40-cd40
配体途径的
t
细胞依赖性巨噬细胞活化诱导
m1
分化
。m1
巨噬细胞具有促炎
、
杀菌和细胞毒性功能
。
这些巨噬细胞促进
th1
细胞的抗原依赖性诱导以及
th1
和
cd8
+ t
细胞的活化
。
在一些实施方案中,
m1
样巨噬细胞的特征在于通过流式细胞术测量的表面标志物表达,并且具有
cd80
+
cd86
+
cd163
低
/-或
cd206
低
/-表型
。m1
巨噬细胞分泌
il-12
和低水平的
il-10
和
/
或
tgf-β
。
29.相比之下,
m2
样免疫抑制性巨噬细胞是一种“替代”或“非经典”活化模型,其可以通过
il-4
或
il-10
在体外生成,是抗炎的,并促进伤口愈合和组织修复
。
在一些实施方案中,
m2
样免疫抑制性巨噬细胞从单核细胞来源的巨噬细胞极化并被分泌至需要伤口愈合和
/
或其他形式的组织修复的组织的因子募集
。m2
样免疫抑制性巨噬细胞是参与组织再生诸如活化和刺激成纤维细胞的增殖的主要巨噬细胞类型
。m2
样巨噬细胞表达表面标志物
cd15、cd23、cd64、cd68、cd163
高
、cd204
高
、cd206
高
和
/
或其他
m2
巨噬细胞标志物,通过流式细胞术确定
。m2
巨噬细胞分泌高水平的
il-10
和
tgf-β1和低水平的
il-12。
30.m2
巨噬细胞的亚型包括
m2a、m2b、m2c
和
m2d
亚型
。m2a
巨噬细胞由
il-4
和
il-13
诱导,引起
cd163、
精氨酸酶-1、
甘露糖受体
mrc1(cd206)
的表达上调
、mhc ii
系统的抗原呈递以及
il-10
和
tgf-β
的产生,导致组织再生并抑制促炎性分子以防止炎性应答
。m2b
巨噬细胞产生
il-1、il-6、il-10
和
tnf-α
作为对免疫复合物的应答
。m2c
巨噬细胞由
il-10、
转化生长因子
β
(tgf-β
)
和糖皮质激素暴露诱导,并产生
il-10
和
tgf-β
,导致对炎性应答的抑制
。m2d
亚型被活化作为对
il-6
和腺苷的应答
。
31.巨噬细胞群体可以是可塑性的,并且根据环境
(
例如,组织环境
)
诸如以上描述的细胞因子环境分化为
m1
或
m2
表型
。
巨噬细胞群体也可以在应答期间转变表型
。
例如,最初的组织损伤或伤害
(
例如,病原体
、
自身免疫或机械介导的损伤
)
可以首先导致促进
m1
表型的促炎环境,然后在可以包括伤口愈合和
/
或组织再生的消退
/
康复阶段期间转变至
m2
表型
。
然而,并且不希望受理论约束,由
m2
或
m2
样巨噬细胞介导的过度伤口愈合和
/
或组织再生可能导致纤维化发病机理
(
即,“纤维化”)
,潜在地导致广泛的组织疤痕形成和器官功能障碍
。
这样的过度伤口愈合和
/
或组织再生可能是慢性损伤或伤害诸如慢性炎症的结果
。
32.因此,仍然有需要鉴定改进治疗纤维化的免疫治疗的化合物和方法
。
33.cd163(
清道夫受体富含半胱氨酸的1型蛋白
m130
;血红蛋白清道夫受体
)
是一种细胞表面蛋白,其作为血红蛋白-触珠蛋白复合物的清道夫受体起作用,并保护组织免受游离血红蛋白介导的氧化损伤
。
已经报道了
cd163
蛋白的四种亚型,分子量分别为
125,451da、125,982da、121,609da
和
124,958da。
亚型1是
cd163
的最普遍的亚型,分子量为
125,451da
,并且由包含细胞外结构域
、
跨膜区段和胞质尾的
1115
个氨基酸残基多肽组成
。
细胞外结构域包含九个富含半胱氨酸的重复结构域
。cd163
蛋白的亚型1具有四个n连接的糖基化位点,并且在
m2
巨噬细胞中
cd163
蛋白在还原条件下的
sds-page
中显示出在~
150kda
和~
130kda
处的两个不同的条带
。
34.cd163 mrna
表达一般仅限于骨髓细胞,但也由某些人类癌症表达
。
还已报道
cd163
是巨噬细胞清道夫受体并促进免疫抑制
。
在一些实施方案中,血红蛋白-触珠蛋白复合物与
cd163
的相互作用诱导免疫抑制性细胞因子
il-10
的分泌和血红素-加氧酶-1(ho-1)
的表达
。ho-1
产生抗炎代谢物
fe
2+
、co
和胆红素
。
35.在人体中可溶性
cd163
经由胞外域脱落发生,并被报道具有抗炎特性,诸如下调
t
细胞应答,包括由植物凝集素
(pha)
或
12-o-十四烷酰佛波醇-13-乙酸酯
(tpa)
刺激的淋巴细胞增殖
。
36.靶向
cd163
的抗体已显示出调节表达
cd163
的巨噬细胞的先天免疫应答
。
例如,针对
cd163
的抗体
rm3/1
抗体是针对人类单核细胞产生的小鼠单克隆
igg1(
κ
轻链
)。rm3/1
抗体与人类
cd163
的富含半胱氨酸的结构域9结合,减少
lps
诱导的
tnf
α
,并增强巨噬细胞的
il-10
分泌
。
37.某些术语
38.除非另外定义,否则本文使用的所有技术术语和科学术语具有与要求保护的主题所属领域的技术人员通常理解的相同的含义
。
一般来说,本文描述的结合免疫学
、
肿瘤学
、
细胞和组织培养
、
分子生物学以及蛋白和寡核苷酸或多核苷酸化学和杂交使用的命名和技术是本领域熟知且常用的那些
。
应理解,前述一般描述和以下详细描述仅是示例性的和说明性的,而不限制任何要求保护的主题
。
本文使用的章节标题仅用于组织目的,并且不被解释为限制所描述的主题
。
39.如本文使用的,单数形式“一
(a)”、“一
(an)”和“该
(the)”包括复数指代物,除非上下文另外清楚指示
。
因此,例如,提及“抗体”包括多于一种抗体,并且在一些实施方案中提及“抗体”包括多种抗体,等等
。
40.除非上下文另外清楚指示,否则如本文使用的,所有数值或数值范围包括这样的范围内或涵盖这样的范围的全部整数以及范围内或涵盖范围的值或整数的分数
。
因此,例如,提及
90
%-100
%的范围包括
91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%等,以及
91.1
%
、91.2
%
、91.3
%
、91.4
%
、91.5
%等,
92.1
%
、92.2
%
、92.3
%
、92.4
%
、92.5
%等,诸如此类
。
在另一实例中,提及
1-5,000
倍的范围包括
1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20
倍等,以及
1.1、1.2、1.3、1.4、1.5
倍等,
2.1、2.2、2.3、2.4、2.5
倍等,诸如此类
。
41.如本文使用的,“约”数字,是指包括该数字并且范围从低于该数字
10
%至高于该数字
10
%
。“约”范围是指低于该范围下限
10
%,跨越至高于该范围上限
10
%
。
[0042]“同一性百分比”和“%同一性”是指两个序列
(
核苷酸或氨基酸
)
在比对中的相同位置处具有相同残基的程度
。
例如,“氨基酸序列与
seq id no:y x
%相同”是指氨基酸序列与
seq id no:y
的%同一性并且详细说明为氨基酸序列中
x
%的残基与
seq id no:y
中公开的序列的残基相同
。
通常,应用计算机程序进行这样的计算
。
比较和比对序列对的示例性程序包括
align(myers
和
miller,comput appl biosci.1988mar
;
4(1):11-7)、fasta(pearson
和
lipman,proc natl acad sci usa.1988apr
;
85(8):2444-8
;
pearson,methods enzymol.1990
;
183:63-98)
和带空位的
blast(altschul
等人,
nucleic acids res.1997sep 1
;
25(17):3389-40)、blastp、blastn
或
gcg(devereux
等人,
nucleic acids res.1984jan 11
;
12(1pt 1):387-95)。
[0043]
如本文使用的,“抗体”是指结合抗原的蛋白
。
抗体通常在每个重链和轻链中包含可变结构域和恒定结构域
。
相应地,大多数抗体具有重链可变结构域
(vh)
和轻链可变结构
域
(v
l
)
,它们一起形成与抗原结合的抗体部分,有时称为“抗原受体”。
每个可变结构域内存在三个互补决定区
(cdr)
,它们在重链可变结构域
(vh)
和轻链可变结构域
(v
l
)
中形成环并接触抗原的表面
。“抗体”包括但不限于,多克隆抗体
、
单克隆抗体
、
单特异性抗体
、
多特异性抗体
(
例如双特异性抗体
)、
天然抗体
、
人源化抗体
、
人类抗体
、
嵌合抗体
、
合成抗体
、
重组抗体
、
杂合抗体
、
突变抗体
、
接枝抗体
、
抗体片段
(
例如,全长抗体的一部分,通常是抗原结合片段或其可变区,例如,
fab
片段
、f(ab’)
片段
、f(ab’)2片段和
fv
片段
)
以及体外产生的具有抗原结合活性的抗体
。
该术语还包括单链抗体,例如,单链
fv(sfv
或
scfv)
抗体,其中可变重链和可变轻链连接在一起
(
直接或通过肽接头
)
以形成连续多肽
。
[0044]
如本文使用的,“互补决定区”、“cdr”和“高变区”是指抗体中决定抗体与其特异性抗原结合特异性的可变结构域的部分
。
如提到的,抗体多肽的单个可变区将通常包含三个
cdr
,通常指定为
cdr1、cdr2
和
cdr3。
更特别地,重链可变区可以包含指定为
h1、h2
和
h3
的
cdr
;同样,轻链可变区可以包含
cdr l1、l2
和
l3。
可以使用多于一种方法来定义
cdr。
当前技术利用对
cdr
长度和位置有不同定义的不同编号方案
。
例如,
kabat
编号方案是基于序列比对,并且使用给定氨基酸位置的“可变性参数”(
给定位置处的不同氨基酸的数目除以该位置处最常出现的氨基酸的频率
)
来预测
cdr。
另一方面,
chothia
编号方案是基于结构的编号方案,其中对比抗体晶体结构将环结构定义为
cdr。martin
编号方案侧重于非常规长度的不同框架区的结构比对
。imgt
编号方案是基于来自完整参考基因数据库
(
包括整个免疫球蛋白超家族
)
的序列比对的标准化编号系统
。honneger
编号方案
(aho's)
是基于可变区的
3d
结构的结构比对,并使用结构上保守的cα
位置来推断框架和
cdr
长度
。
本领域技术人员将注意到,
cdr
的定义将根据所使用的方法而变化
。
对于本文公开的序列考虑了定义
cdr
的任何方法
。
[0045]
术语“接受者”、“个体”、“受试者”、“宿主”和“患者”在本文中可互换使用,并且指需要诊断
、
治疗或疗法的任何哺乳动物受试者,特别是人类
。
为了治疗的目的,“哺乳动物”是指被归类为哺乳动物的任何动物,包括人类
、
家畜和农场动物,以及实验室动物
、
动物园动物
、
运动动物或宠物动物,诸如犬
、
马
、
猫
、
牛
、
绵羊
、
山羊
、
猪
、
小鼠
、
大鼠
、
兔
、
豚鼠
、
猴等
。
在一些实施方案中,哺乳动物是人类
。
[0046]
如本文使用的,术语“治疗
(treatment)”、“治疗
(treating)”等,在一些情况下,是指为了获得某种效果的目的而施用某种剂或进行某种程序
。
在一些实施方案中,该效果在完全或部分阻止疾病或其症状方面是预防性的,和
/
或在实现部分或完全治愈疾病和
/
或疾病的症状方面是治疗性的
。
如本文使用的“治疗”包括哺乳动物中,特别是人类中疾病或紊乱
(
例如纤维化
)
的治疗,并且包括:
(a)
阻止疾病或疾病的症状在易患该疾病但尚未被诊断患有该疾病
(
例如,包括与原发疾病相关或由原发疾病引起的疾病
)
的受试者中发生;
(b)
抑制疾病,即,阻止其发展;以及
(c)
缓解疾病,即,引起疾病消退
。
在一些实施方案中,治疗是指在治疗或改善或预防纤维化方面的任何成功征象,包括任何客观或主观的参数,诸如症状的减少
、
缓解
、
减弱或者使疾病状况对受试者来说更可耐受;减缓退化或衰退的速率;或者使退化的终点不那么虚弱
。
症状的治疗或改善是基于一个或更多个客观或主观的参数,包括医师检查的结果
。
相应地,术语“治疗”包括施用本公开内容的化合物或剂,以预防或延迟
、
减轻或阻止或抑制与疾病
(
例如,纤维化
)
相关的症状或状况的发展
。
术语“治疗作用”是指减少
、
消除或预防受试者的疾病
、
疾病的症状或疾病的副作用
。
如果在接受治疗量的本公
开内容的抗体后,患者显示出疾病或紊乱的参数或症状的可观察和
/
或可测量的改变,则受试者的疾病或紊乱被“治疗”。
[0047]
在一些实施方案中,“诱导响应”是指减轻或减少受试者的疾病的病征或症状,并且特别地包括但不限于,存活期的延长
。
[0048]
术语“亲合力”是指两种或更多种剂的复合物在稀释后对解离的抗性
。
[0049]
在一些实施方案中,抗体“效应子功能”是指可归因于抗体的
fc
区
(
天然序列
fc
区或氨基酸序列变体
fc
区
)
并且随抗体同种型而变化的那些生物活性
。
[0050]“fc
受体”或“fcr”是指与抗体的
fc
区结合的受体
。
[0051]
如本文使用的“人类效应细胞”是指表达一种或更多种
fcr
并执行效应子功能的白细胞
。
例如,该细胞至少表达
fc
γ
riii
并执行
adcc
效应子功能
。
介导
adcc
的人类白细胞的实例包括但不限于,外周血单个核细胞
(pbmc)、nk
细胞
、
单核细胞
、
巨噬细胞
、
细胞毒性
t
细胞和中性粒细胞
。
[0052]“补体依赖性细胞毒性”或“cdc”是指在存在补体的情况下靶细胞的裂解
。
经典补体途径的活化通过补体系统的第一组分
(c1q)
与结合其同源抗原的抗体
(
适当的亚类的抗体
)
结合而启动
。
为了评估补体活化,进行例如
cdc
测定
。
[0053]“内化”的抗体是在与哺乳动物细胞上的抗原
(
例如,细胞表面多肽或受体
)
结合后被细胞摄取
(
即,进入
)
的抗体
。
内化性抗体包括抗体片段
、
人类或嵌合抗体和抗体缀合物
。
在一些情况下,抗体的内化
(
例如,诸如本文公开的
)
改变细胞的生物学,引起其改变其功能
。
[0054]“抗原结合结构域”、“抗原结合区”或“抗原结合位点”是抗体中包含与抗原相互作用并贡献抗体对抗原的特异性和亲和力的氨基酸残基
(
或其他部分
)
的部分
。
对于与其抗原特异性结合的抗体,这将包括抗体的至少一个
cdr
结构域的至少一部分
。
[0055]
抗体的抗原结合区称为“互补位”,其结合抗原决定簇,即抗原的“表位”,也就是抗原分子中能够被抗体结合的部分
。
在一些实施方案中,抗原物质具有可被抗体识别的一个或更多个部分,即多于一个表位,并且因此单个抗原物质被不同的抗体特异性结合,每个抗体对不同的表位具有特异性
。
在一些实施方案中,表位包含抗原的非连续部分
。
例如,在多肽中,在该多肽的一级序列中不连续但在该多肽的三级和四级结构中彼此足够靠近以被抗原结合蛋白结合的氨基酸残基构成表位
。
[0056]“抗体片段”包含完整抗体的一部分
。
在一些实施方案中,抗体片段包含完整抗体的抗原结合区或可变区
。
[0057]
术语“抗体的抗原结合部分”、“抗原结合片段”、“抗原结合结构域”、“抗体片段”在本文中可互换使用,以指抗体的保留与抗原特异性结合的能力的一个或更多个片段
。
包括在这样的术语内的抗体片段的非限制性实例包括但不限于,
(i)fab
片段,由vl
、vh、c
l
和ch1
结构域组成的单价片段;
(ii)f(ab’)2片段,包含通过铰链区处的二硫桥连接的两个
fab
片段的二价片段;
(iii)
由vh
和ch
结构域组成的
fd
片段;
(iv)
包含抗体单臂的vl
和vh
结构域的
fv
片段;
(v)
包含vh
结构域的
dab
片段
(ward
等人,
nature 341(6242):544-6(1989))
;和
(vi)
分离的
cdr。
还包括包含单条重链和单条轻链的“半”抗体
。
其他形式的单链抗体诸如双抗体也包括在本文中
。
[0058]
如本文使用的“功能抗体片段”在上下文中是指不仅结合抗体的抗原而且具有表
征完整抗体的功能属性的抗体片段
。
例如,如果抗体的功能依赖于具有能够实现效应子功能
(
诸如
adcc)
的
fc
结构域,则功能片段将具有这样的功能
。
假设当本公开内容的抗体包含与巨噬细胞
fc
受体
(
诸如在一些实施方案中的
cd16(fc
γ
riiia)
或
cd64(fc
γ
ri))
结合的
fc
部分时,本公开内容的抗体在调节巨噬细胞诸如组织驻留或浸润性巨噬细胞的功能状态或重新定向或抑制
m2
状态巨噬细胞方面是有效的
。
[0059]
措辞抗体的“功能片段或类似物”是与全长抗体具有共同的定性的生物学活性的化合物
。
例如,抗
ige
抗体的功能片段或类似物是结合
ige
免疫球蛋白以阻止或大幅减少这样的分子与高亲和力受体
fc
γ
ri
结合的能力的抗体功能片段或类似物
。
[0060]“抗原结合蛋白”是包含含有抗体的抗原结合部分的部分,任选地还包含允许抗原结合部分采取促进抗原结合蛋白与抗原结合的构象的支架或框架部分的蛋白
。
[0061]“完整”抗体是包含抗原结合位点以及cl
和至少重链恒定结构域ch
1、c
h2和ch3的抗体
。
在一些实施方案中,恒定结构域是天然序列恒定结构域
(
例如,人类天然序列恒定结构域
)
或其氨基酸序列变体
。
[0062]
如本文使用的术语“重组抗体”是指包含第一抗体的抗原结合结构域
(
诸如,例如
cdr、vh区或完整轻链
)
和来自一种或更多种其他抗体或蛋白的结构域的抗体
。
嵌合抗体
、
杂合抗体和人源化抗体是重组抗体的实例
。
[0063]“cdr
接枝抗体”是包含源自一种物种的抗体或同种型的一个或更多个
cdr
和相同或不同物种的另一种抗体或同种型的框架的抗体
。
[0064]
术语“人类抗体”包括具有一个或更多个源自人类免疫球蛋白序列的可变区和恒定区的所有抗体
。
在一种实施方案中,抗体的所有可变结构域和恒定结构域都源自人类免疫球蛋白序列
(
称为“完全人类抗体”)。
[0065]
如本文使用,术语“亲和力”是指两种剂可逆结合的平衡常数,并且表示为平衡解离常数
kd。
在一种实施方案中,抗体或其抗原结合片段表现出如通过
kd测量的对于
cd163
在
10-6m或更少的范围内或范围低至
10-16m或更低
(
例如,约
10-7
m、10-8
m、10-9
m、10-10
m、10-11
m、10-12
m、10-13
m、10-14
m、10-15
m、10-16m或更少
)
的结合亲和力
。
在某些实施方案中,如本文描述的抗体以以下的
kd与人类
cd163(hucd163)
多肽特异性结合:少于或等于
10-4
m、
少于或等于约
10-5
m、
少于或等于约
10-6
m、
少于或等于
10-7m或少于或等于
10-8
m。
[0066]
术语“优先结合”或“特异性结合”意指,抗体或其片段以比其结合无关氨基酸序列更大的亲和力与表位结合,并且如果与含有该表位的其他多肽交叉反应,则在它们被配制用于人类使用的施用水平是无毒性的
。
在一些实施方案中,这样的亲和力比抗体或其片段对不相关氨基酸序列的亲和力大至少1倍
、
大至少2倍
、
大至少3倍
、
大至少4倍
、
大至少5倍
、
大至少6倍
、
大至少7倍
、
大至少8倍
、
大至少9倍
、
大
10
倍
、
大至少
20
倍
、
大至少
30
倍
、
大至少
40
倍
、
大至少
50
倍
、
大至少
60
倍
、
大至少
70
倍
、
大至少
80
倍
、
大至少
90
倍
、
大至少
100
倍或大至少
1000
倍
。
[0067]
术语“特异性”是指其中抗体将不会优先与含有被抗体识别的表位的抗原以外的分子结合的情况
。
该术语也适用于例如抗原结合结构域对由许多抗原携带的特定表位具有特异性的情况,在这种情况下,携带抗原结合结构域的抗体或其抗原结合片段将能够与携带该表位的不同抗原结合
。
[0068]
如本文使用的,如果抗体以可检测到的水平
(
优选地以大于或等于约
104m-1
、
或大
于或等于约
105m-1
、
大于或等于约
106m-1
、
大于或等于约
107m-1
、
或大于或等于
109m-1
的亲和力常数
(
缔合常数
)ka)
与抗原反应,则称抗体对抗原具有“免疫特异性”或“特异性”或与抗原“特异性结合”。
[0069]
如本文使用的,术语“单特异性”是指含有对一种特定表位表现出优先亲和力的抗体的抗体组合物
。
在一些实施方案中,单特异性抗体制品由对特定抗原具有特异性结合活性的约
10
%
、20
%
、30
%
、40
%
、50
%
、60
%
、70
%
、75
%
、80
%
、85
%
、90
%
、95
%
、97
%
、99
%或
99.9
%抗体组成
。
[0070]
术语“多肽”以其常规含义即以氨基酸序列使用
。
多肽不限于特定长度的产物
。
肽
、
寡肽和蛋白包括在多肽的定义内,并且这些术语在本文中可互换使用,除非另外特别指示
。
该术语也不指或排除多肽的表达后修饰,例如糖基化
、
乙酰化
、
磷酸化等,以及本领域已知的其他修饰,天然存在的和非天然存在的
。
在一些实施方案中,多肽是完整蛋白或其子序列
。
在本公开内容的抗体的上下文中,感兴趣的特定多肽是包含
cdr
并且能够结合人类
m2
巨噬细胞或由这样的细胞表达的
cd163
蛋白的氨基酸子序列
。
[0071]
如本文使用的,“基本上纯”和“基本上不含”是指含有少于例如约
20
%或更少的外来物质
、
约
10
%或更少的外来物质
、
约5%或更少的外来物质
、
约4%或更少的外来物质
、
约3%或更少的外来物质
、
约2%或更少的外来物质
、
或约1%或更少的外来物质的溶液或悬浮液
。
[0072]
术语“分离的”是指基本上不含其他细胞物质和
/
或化学品的蛋白
(
例如,抗体
)、
核酸或其他物质
。
在一些实施方案中,本公开内容的抗体或其抗原结合片段和核酸是分离的
。
在一些实施方案中,本公开内容的抗体或其抗原结合片段和核酸是基本上纯的
。
[0073]
当应用于多肽时,“分离的”一般意指与一起天然存在的其他蛋白和核酸分开的多肽
。
优选地,多肽也与用于纯化它的物质诸如抗体或凝胶基质
(
聚丙烯酰胺
)
分离
。
在一些情况下,该术语意指多肽或其一部分,鉴于其来源或操作,所述多肽或其一部分:(i)存在于宿主细胞中作为表达载体的一部分的表达产物;或
(ii)
连接至它在自然界中连接的那些蛋白或其他化学部分之外的蛋白或其他化学部分;或
(iii)
在自然界中不存在,例如,通过向蛋白附加或添加至少一个疏水部分而进行化学操作使得蛋白呈自然界中不存在的形式
。“分离的”还意指以下蛋白:(i)化学合成的;或
(ii)
在宿主细胞中表达并从相关蛋白和污染蛋白纯化的
。
[0074]
如本文使用的术语“有效量”是指当施用至受试者时足以诱导应答,例如,如本文描述的,足以实现与巨噬细胞活性相关的疾病的治疗
、
预后或诊断的如本文描述的抗体或其抗原结合部分的量
。
本文提供的抗体的治疗有效量,当单独或组合使用时,将取决于抗体和组合物的相对活性
(
例如,在治疗
/
减少
/
改善纤维化方面
)
并取决于所治疗的受试者和疾病状况
、
受试者的体重和年龄
、
疾病状况的严重程度
、
施用方式等而变化,在一些情况下,抗体的治疗有效量由本领域普通技术人员容易地确定
。
[0075]
术语“治疗有效量”一般是指有效“治疗”受试者或哺乳动物的疾病或紊乱的抗体或药物的量
。
在一些实施方案中,本文描述的组合物以通过以可适用于任何医学治疗的合理益处
/
风险比率抑制如本文描述的疾病或紊乱而有效产生一些期望的治疗效果的量施用至受试者
。
治疗有效量是在器官或组织中至少部分地实现期望治疗或预防效果的量
。
带来对疾病或紊乱的预防和
/
或治疗性治疗所需的抗体的量本身不是固定的
。
在一些实施方案
中,施用的抗体的量随疾病类型
、
疾病的广泛性和罹患疾病或紊乱的哺乳动物的尺寸而变化
。
当与涉及在受试者出现疾病或紊乱的症状后施用治疗剂的治疗方法结合使用时,术语“治疗有效的”意指在治疗后,疾病或紊乱的一种或更多种病征或症状得到改善或消除
。
[0076]
当受试者经历疾病的病征或症状的部分或全部缓解或减少时,实现本公开内容的有效响应,并且在纤维化治疗的情况下,特别包括但不限于,改善症状
、
延长进展
、
治愈
、
缓解
、
延长存活期或其他客观响应
。
在一些实施方案中,取决于预后因素包括复发次数
、
疾病阶段和其他因素,预期的无进展存活时间以数月至数年测量
。
延长存活期包括但不限于至少1个月
(mo.)、
约至少2个月
、
约至少3个月
、
约至少4个月
、
约至少6个月
、
约至少1年
、
约至少2年
、
约至少3年等的时间
。
总存活期也例如以数月至数年测量
。
可选地,在一些实施方案中,有效响应是受试者的症状保持静态
。
治疗适应症的进一步指示在下文更详细地描述
。
[0077]
在一些实施方案中,在不期望的疾病或紊乱的症状表现之前,以预防性方法进行治疗剂的施用,使得疾病或紊乱被预防或可选地延迟其进展
。
因此,当与预防性方法结合使用时,术语“治疗有效”意指在治疗后,更少数量的受试者
(
平均而言
)
发展不期望的疾病或紊乱或症状严重程度进展
。
[0078]
措辞“药学上可接受的”是指当向人类施用时生理学上可耐受并且通常不产生过敏或类似的不良反应
(
诸如胃部不适
、
头晕等
)
的分子实体和组合物
。
[0079]
术语“接触”在本文中定义为使如本文提供的组合物与如本文描述的细胞
、
器官
、
组织或流体物理接近的方式
。
[0080]
如本文使用的,术语“原发性纤维化疾病”意指疾病的病理学由纤维化驱动的疾病
。
示例性原发性纤维化疾病包括但不限于囊性纤维化
、
特发性肺纤维化
、
肝硬化
、
系统性硬化
(ssc)、
硬皮病移植物抗宿主病
(gvhd)、
肾源性系统性纤维化和放射性纤维化
。
[0081]
如本文使用的,术语“继发性纤维化疾病”意指其中纤维化作为非纤维化疾病的后遗症发生的疾病
。
在某些情况下,继发性纤维化是与癌症相关的纤维化
。
继发性纤维化疾病的另一个实例是与副球孢子菌病
(paracoccidioidomycosis)
相关的肺纤维化
。
[0082]
抗体
[0083]
在某些实施方案中,本文公开了与人类
cd163
+
细胞上表达的
cd163
蛋白特异性结合的抗体
。
在一些实施方案中,
cd163
+
细胞是免疫抑制性骨髓细胞
。
在一些实施方案中,免疫抑制性骨髓细胞是人类巨噬细胞
。
在一些实施方案中,本文公开的抗体的结合改变人类巨噬细胞上至少一种标志物的表达
。
[0084]
在一些实施方案中,本文公开的抗体与人类
m2
或
m2
样免疫抑制性巨噬细胞上表达的
hucd163
蛋白结合
。
在一些实施方案中,抗体与
cd163
蛋白特异性结合,该
cd163
蛋白是约
140kda
的
hucd163
糖型
。
在一些实施方案中,抗体与
hucd163
的细胞外结构域3特异性结合
。
在一些实施方案中,抗体与
hucd163
的细胞外结构域4特异性结合
。
在一些实施方案中,抗体与
hucd163
的细胞外结构域3和细胞外结构域4特异性结合
。
在一些实施方案中,抗体与
hucd163
特异性结合,导致
hucd163
的构象改变
。
在一些实施方案中,
hucd163
的构象变化使
hucd163
的细胞外结构域
2、5
和9暴露
。
在一些实施方案中,抗体不特异性结合较低分子量
(
~
115kda)
的
hucd163
糖型
。
[0085]
在一些实施方案中,本文公开的抗体与树突状细胞
(dc)
,诸如,例如,骨髓
dc(mdc)(
例如,
cd14-hla-dr
+
cd11c
+
mdc)
结合
。
在一些实施方案中,本文公开的抗体与经典单核细胞
(
例如,
cd14
+
hla-dr
+
cd16-单核细胞
)
结合
。
在一些实施方案中,本文公开的抗体与中间型单核细胞
(
例如,
cd14
+
hla-dr
+
cd16
+
单核细胞
)
结合
。
在一些实施方案中,本文公开的抗体与非经典单核细胞
(
例如,
cd14-hla-dr
+
cd16
+
单核细胞
)
结合
。
在一些实施方案中,本文公开的抗体与癌细胞结合
。
在一些实施方案中,癌细胞是淋巴瘤细胞
。
[0086]
在一些实施方案中,本文公开的抗体与人类
cd163
+
免疫抑制性骨髓细胞结合,并且引起表征
m2
或
m2
样免疫抑制性巨噬细胞
(
诸如
m2c
巨噬细胞
)
的某些细胞标志物表达的改变,指示巨噬细胞向非免疫抑制性或较低免疫抑制以及较低促纤维化状态的功能分化
。
在一些实施方案中,本文公开的抗体与
m2
或
m2
样免疫抑制性巨噬细胞结合,并且导致表征
m2
或
m2
样巨噬细胞的某些细胞标志物的表达降低,指示巨噬细胞向改变的分化状态的功能分化
。
在一些实施方案中,本文公开的抗体减少
cd163
+
免疫抑制性骨髓细胞对
cd16、cd64、tlr2
和
siglec-15
中的一种或更多种的表达
。
[0087]
在一些实施方案中,本文公开的抗体与
cd163
+
免疫抑制性骨髓细胞的结合导致
cd163
+
免疫抑制性骨髓细胞的功能改变
。
在一些实施方案中,本文公开的抗体与
cd163
+
免疫抑制性骨髓细胞的结合导致
m2
或
m2
样免疫抑制性巨噬细胞中标志物表达的改变
。
[0088]
在一些实施方案中,本公开内容的抗体减少由肿瘤微环境中的肿瘤相关巨噬细胞引起的免疫抑制
。
在一些实施方案中,肿瘤微环境中的肿瘤相关巨噬细胞的免疫抑制的减少对应于免疫刺激的增加,例如,促进
t
细胞活化
、t
细胞增殖
、nk
细胞活化
、nk
细胞增殖或其任何组合的产生
。
在一些实施方案中,
t
细胞活化和
/
或
nk
细胞活化导致
t
细胞和
/
或
nk
细胞的
ifn-γ
、tnf-α
、
穿孔蛋白或其组合的增加的产生
。
在一些实施方案中,本公开内容的抗体增加免疫刺激,例如,促进
t
细胞活化
、t
细胞增殖
、nk
细胞活化
、nk
细胞增殖或其任何组合的产生
。
在一些实施方案中,
t
细胞活化和
/
或
nk
细胞活化导致
t
细胞和
/
或
nk
细胞的
ifn-γ
、tnf-α
、
穿孔蛋白或其组合的增加的产生
。
在一些实施方案中,本公开内容的抗体与人类巨噬细胞上表达的
cd163
蛋白特异性结合,其中人类巨噬细胞在结合抗体之前具有第一免疫抑制活性并在结合抗体之后具有第二免疫抑制活性,并且其中第二免疫抑制活性低于第一免疫抑制活性
。
在各种实施方案中,第一和第二免疫抑制活性各自是非零的
。
[0089]
在一些实施方案中,本公开内容的抗体促进
t
细胞活化和增殖
。
在一些实施方案中,抗体使
t
细胞群体偏向抗肿瘤
t
细胞表型
。
在一些实施方案中,抗体减少或阻断骨髓细胞对
t
细胞活化的抑制
。
在一些实施方案中,抗体减少
tam
抑制
t
细胞活化的能力,导致更大的
t
细胞刺激和
il-2
产生
。
在一些实施方案中,抗体阻断
tam
抑制
t
细胞活化的能力,导致更大的
t
细胞刺激和
il-2
产生
。
[0090]
在一些实施方案中,本文公开的抗体减少骨髓对
t
细胞增殖的抑制
。
在一些实施方案中,抗体减少
tam
对
cd4
+ t
细胞和
cd8
+ t
细胞活化和增殖两者的抑制
。
在一些实施方案中,抗体减少
tam
对
th1
细胞增殖的抑制
。
增殖的
t
细胞显示
cd4
+ t
细胞上活化标志物的增强表达
。
[0091]
在一些实施方案中,本公开内容的抗体改变
m2
极化的巨噬细胞,使得巨噬细胞表现出减轻
m2
巨噬细胞的免疫抑制性作用的
m1
样表型
。
在一些实施方案中,本文描述的抗体影响单核细胞来源的巨噬细胞向较少免疫抑制性和较多抗肿瘤的分化状态分化
。
[0092]
在一些实施方案中,本公开内容的抗体减少纤维化组织中组织驻留或浸润性巨噬细胞的促纤维化功能
。
在一些实施方案中,纤维化组织中组织驻留或浸润性巨噬细胞的促
纤维化功能的减少对应于成纤维细胞的活化和
/
或增殖的减少
。
在一些实施方案中,本公开内容的抗体减少成纤维细胞的活化和
/
或增殖
。
在一些实施方案中,本公开内容的抗体与人类巨噬细胞诸如
m2
巨噬细胞上表达的
cd163
蛋白特异性结合,其中人类巨噬细胞在结合抗体之前具有第一促纤维化活性,并且在结合抗体之后具有第二促纤维化活性,并且其中第二促纤维化活性低于第一促纤维化活性
。
在多种实施方案中,第一促纤维化活性和第二促纤维化活性各自是非零的
。
在一些实施方案中,纤维化是原发性纤维化疾病
。
在一些实施方案中,纤维化是继发性纤维化疾病
。
[0093]
在一些实施方案中,本公开内容的抗体改变
m2
极化的巨噬细胞,使得巨噬细胞表现出减轻
m2
巨噬细胞的免疫抑制性或促纤维化活性的
m1
样表型
。
在一些实施方案中,本文描述的抗体影响单核细胞来源的巨噬细胞分化向较少促纤维化和
/
或较少免疫抑制性的分化状态分化
。
例如,本文描述的抗体可以破坏
il-10
信号传导轴,包括破坏
il-10
介导的巨噬细胞向
m2
表型的极化和
/
或破坏
m2
巨噬细胞的
il-10
产生
。
在一些实施方案中,本公开内容的抗体改变
m2-极化的巨噬细胞,使得巨噬细胞产生和
/
或分泌较少的免疫抑制性或促纤维化的细胞因子,包括但不限于
tgf-β
、pdgf、vegf、igf-1、il-10
和半乳凝素-3。
在一些实施方案中,本公开内容的抗体改变
m2-极化的巨噬细胞,使得巨噬细胞产生和
/
或分泌较少的
tgf-β
、pdgf、vegf、igf-1、
半乳凝素-3、il-10
或其组合
。
[0094]
在一些实施方案中,本文提供了与人类巨噬细胞上表达的
hucd163
特异性结合并减少巨噬细胞对
cd16、cd64、tlr2
或
siglec-15
中至少一种的表达的抗体
。
在一些实施方案中,人类巨噬细胞是免疫抑制性巨噬细胞
。
在一些实施方案中,人类巨噬细胞是
m2
样免疫抑制性巨噬细胞
。
在一些实施方案中,人类巨噬细胞是组织驻留的巨噬细胞
。
在一些实施方案中,组织驻留的巨噬细胞驻留在肺
、
肾
、
心或肝中
。
在一些实施方案中,人类巨噬细胞是肺巨噬细胞
。
在一些实施方案中,人类巨噬细胞是肺泡巨噬细胞
(am)。
在一些实施方案中,人类巨噬细胞是间质巨噬细胞
。
在一些实施方案中,人类巨噬细胞是浸润性巨噬细胞
。
[0095]
在一些实施方案中,本文公开的抗体与巨噬细胞表达的
cd163
蛋白结合,所述
cd163
蛋白作为包含由巨噬细胞表达的至少一种其他蛋白的复合物的组分
。
在一些实施方案中,该复合物是细胞表面复合物
。
在一些实施方案中,该复合物包含选自半乳凝素-1
蛋白
、lilrb2
蛋白和酪蛋白激酶
ii
蛋白的至少一种其他蛋白
。
[0096]
在一些实施方案中,本文公开的抗体促进
cd4
+ t
细胞活性或增殖
。
在一些实施方案中,抗体促进
cd4
+ t
细胞对
cd69、icos、ox40、pd1、lag3
或
ctla4
的表达
。
[0097]
在一些实施方案中,本文公开的抗体促进
cd8
+ t
细胞活性或增殖
。
在一些实施方案中,抗体促进
cd8
+ t
细胞对
icos、ox40、pd1、lag3
或
ctla4
的表达
。
[0098]
在一些实施方案中,本文公开的抗体通过促进
cd8
+ t
细胞活性或增殖而促进肿瘤微环境中的肿瘤细胞杀伤
。
在一些实施方案中,抗体促进细胞毒性淋巴细胞介导的癌细胞杀伤
。
在一些实施方案中,抗体促进
nk
细胞介导的肿瘤细胞杀伤
。
[0099]
在一些实施方案中,本文公开的抗体促进
t
细胞对
il-2
的表达
。
在一些实施方案中,本公开内容的抗体与
cd163
蛋白的结合增加
cd4
+ t
细胞
、cd196
‑ t
细胞
、cxcr3
+ t
细胞
、ccr4
‑ t
细胞或其任何组合
。
在一些实施方案中,抗体增加
cd4
+
cd196-cxcr3
+
ccr4
‑ t
细胞
。
[0100]
在一些实施方案中,本文公开的抗体具有与巨噬细胞上表达的
fc
受体结合的恒定结构域
。
在一些实施方案中,抗体特异性结合
hucd163
并具有与
fc
受体结合的恒定结构域
。
在一些实施方案中,抗体具有与
cd163
+
免疫抑制性骨髓细胞上表达的
fc
受体
(
诸如
cd16(fc
γ
riiia)
或
cd64(fc
γ
ri))
结合的恒定结构域
。
在一些实施方案中,
hucd163
和
fc
受体在同一细胞上表达
。
在一些实施方案中,
hucd163
和
fc
受体在不同细胞上表达
。
在一些实施方案中,抗体可变结构域特异性结合
hucd163
并且抗体恒定结构域同时与
fc
受体结合
。
[0101]
在一些实施方案中,本文公开的抗体与巨噬细胞上的
cd163
蛋白结合并被巨噬细胞内化
。
[0102]
在一些实施方案中,本文公开的抗体对与其结合的巨噬细胞没有细胞毒性
。
[0103]
在一些实施方案中,本文公开的抗体具有与巨噬细胞上表达的
fc
受体结合的恒定结构域
。
在一些实施方案中,抗体特异性结合
hucd163
并具有与
fc
受体结合的恒定结构域
。
在一些实施方案中,抗体具有与
cd163
+
免疫抑制性骨髓细胞上表达的
fc
受体
(
诸如
cd16(fc
γ
riiia)
或
cd64(fc
γ
ri))
结合的恒定结构域
。
在一些实施方案中,
hucd163
和
fc
受体在同一细胞上表达
。
在一些实施方案中,
hucd163
和
fc
受体在不同细胞上表达
。
在一些实施方案中,抗体可变结构域特异性结合
hucd163
并且抗体恒定结构域同时与
fc
受体结合
。
[0104]
在某些实施方案中,本文公开了与人类
m2
和
m2
样巨噬细胞上表达的
cd163
蛋白特异性结合的抗体,其中所述结合导致以下作用中的至少一种:
[0105]
(a)
人类巨噬细胞对至少一种标志物的表达减少,其中至少一种标志物是
cd16、cd64、tlr2
或
siglec-15
;
[0106]
(b)
抗体被人类巨噬细胞内化;
[0107]
(c)
减少成纤维细胞的活化和
/
或增殖;以及
[0108]
(d)
减少巨噬细胞对
tgf-β
、pdgf、vegf、igf-1、
半乳凝素-3、il-10
或其组合的分泌
。
[0109]
在一些实施方案中,本文公开的抗体与组织驻留的巨噬细胞群体中的人类
cd163
+
免疫抑制性骨髓细胞选择性地结合,其中抗体与组织驻留的群体的
m2
巨噬细胞上表达的
cd163
蛋白特异性结合
。
在一些实施方案中,本文公开的抗体与浸润性巨噬细胞群体中的人类
cd163
+
免疫抑制性骨髓细胞选择性地结合,其中抗体与
m2
巨噬细胞上表达的
cd163
蛋白特异性结合,并且减少浸润性群体的免疫抑制性活性
。
[0110]
在一些实施方案中,本文公开的抗体与肿瘤微环境或纤维化组织中的人类
cd163
+
免疫抑制性骨髓细胞选择性地结合,其中抗体与
m2
巨噬细胞上表达的
cd163
蛋白特异性结合,并且减少
m2
巨噬细胞介导的促纤维化功能或免疫抑制
。
在一些实施方案中,本文公开的抗体是人类的
、
人源化的或嵌合的
。
在一些实施方案中,本文公开的抗体是其如描述地结合的抗原结合片段
。
[0111]
在一些实施方案中,本公开内容的抗体是完整的免疫球蛋白分子,诸如,例如,人类抗体,以及人源化
ig
分子中包含抗原结合位点
(
即,互补位
)
的那些部分或单条重链和单条轻链,包括本领域已知的那些部分,如
fab、f(ab’)、f(ab’)2、fd、scfv、
可变重结构域
、
可变轻结构域
、
可变
nar
结构域
、
双特异性
scfv、
双特异性
fab2、
三特异性
fab3、
单链结合多肽
、dab
片段
、
双抗体和也称为抗原结合片段的其他部分
。
在构建免疫球蛋白分子或其片段时,在一些实施方案中,可变区或其部分与一个或更多个恒定区或其部分融合
、
连接或以其他方式连接以产生本文描述的任何抗体或其片段
。
因此,在一些实施方案中,以上描述的抗体中的任何一种的抗原结合片段是
fab、f(ab’)、fd、f(ab’)2、fv、scfv、
单链结合多肽
(
例如,
具有
fc
部分的
scfv)
或如本文描述的其任何其他功能片段
。
[0112]
在一些实施方案中,本公开内容的抗体属于任何免疫球蛋白类别,并因此,在一些实施方案中,具有
γ
、
μ
、
α
、
δ
或
ε
重链
。
在一些实施方案中,
γ
链是
γ
1、
γ
2、
γ3或
γ
4。
在一些实施方案中,
α
链是
α1或
α
2。
[0113]
在一些实施方案中,本公开内容的抗体是
igg
免疫球蛋白
。
在一些实施方案中,本公开内容的抗体是任何
igg
亚类
。
在一些实施方案中,抗体是
igg1。
[0114]
在一些实施方案中,本公开内容的抗体包含是
κ
或
λ
的可变轻链
。
在一些实施方案中,
λ
链属于包括例如
λ
1、
λ
2、
λ3和
λ4在内的任何亚型
。
在一些实施方案中,轻链是
κ
。
[0115]
在一些实施方案中,本文公开的抗体包含人类可变框架区和人类恒定区
。
在一些实施方案中,抗体包含人类轻链可变框架区和人类轻链恒定区
。
在一些实施方案中,抗体包含人类重链可变框架区和人类重链恒定区
。
在一些实施方案中,抗体包含人类轻链可变框架区
、
人类轻链恒定区
、
人类重链可变框架区和人类重链恒定区
。
[0116]
在一些实施方案中,本公开内容的抗体包含人类可变框架区和鼠恒定区
。
在一些实施方案中,本公开内容的抗体包含人类重链可变框架区和鼠重链恒定区
。
在一些实施方案中,本公开内容的抗体包含人类轻链可变框架区
、
鼠轻链恒定区
、
人类重链可变框架区和鼠重链恒定区
。
[0117]
在一些实施方案中,抗体或抗原结合片段与
m2
巨噬细胞上表达的
cd163
蛋白的结合部分地
(
例如,5%
、10
%
、20
%
、30
%
、40
%
、50
%
、60
%
、70
%
、80
%
、90
%
、95
%
、98
%
、99
%或其中的任何数字
)
或完全地调节这样的
m2
巨噬细胞的生物学功能
。
抗体或抗原结合片段的活性,例如,使用体外测定和
/
或在体内使用本领域熟知的测定来确定,诸如本文描述的或其他本领域已知的那些
。
[0118]
在一些实施方案中,如果需要,则进一步修饰本公开内容的抗体以改变抗体的特定特性同时保留期望的功能性
。
例如,在一种实施方案中,修饰本公开内容的抗体以改变抗体的药代动力学特性,包括但不限于,体内稳定性
、
溶解性
、
生物可利用度或半衰期
。
[0119]
在一些实施方案中,本文描述的抗体具有以下的解离常数
(kd)
:约
1pm
至约
10pm、
约
10pm
至约
20pm、
约
1pm
至约
29pm、
约
30pm
至约
40pm、
约
10pm
至约
100pm
或约
20pm
至约
500pm。
[0120]
在一些实施方案中,本文描述的抗体具有以下的解离常数
(kd)
:少于约
500pm、
少于约
400pm、
少于约
300pm、
少于约
200pm、
少于约
100pm、
少于约
75pm、
少于约
50pm、
少于约
30pm、
少于约
25pm、
少于约
20pm、
少于约
18pm、
少于约
15pm、
少于约
10pm、
少于约
75.pm、
少于约
5pm、
少于约
2.5pm
或少于约
1pm。
[0121]
在一些实施方案中,本文描述的抗体对
hucd163
蛋白或肽具有以下的亲和力:约
10-9m至约
10-14
m、
约
10-10m至约
10-14
m、
约
10-11m至约
10-14
m、
约
10-12m至约
10-14
m、
约
10-13m至约
10-14
m、
约
10-10m至约
10-11
m、
约
10-11m至约
10-12
m、
约
10-12m至约
10-13m或
10-13m至约
10-14
m。
[0122]
在一些实施方案中,本文描述的抗体具有多于一个结合位点
。
在一些实施方案中,结合位点彼此相同
。
在一些实施方案中,结合位点彼此不同
。
天然存在的人类免疫球蛋白通常具有两个相同的结合位点,而工程化抗体,例如,具有两个或更多个不同的结合位点
。
[0123]
在一些实施方案中,本公开内容的抗体是双特异性或多特异性的
。
双特异性抗体是对至少两个不同表位具有结合特异性的抗体
。
在一些实施方案中,示例性双特异性抗体与单个抗原的两个不同表位结合
。
在一些实施方案中,其他这样的抗体组合了第一抗原结
合位点与针对第二抗原的结合位点
。
在一些实施方案中,双特异性抗体结合至少两个不同的表位,并具有与
fc
受体结合的恒定结构域
。
在一些实施方案中,双特异性抗体对一个或更多个表位的结合与双特异性抗体的恒定结构域对
fc
受体的结合是同时的
。
[0124]
在一些实施方案中,本公开内容的抗体具有两个或更多个化合价,其也称为多价
。
在一些实施方案中,本公开内容的抗体是三特异性的
。
在一些实施方案中,多价抗体比二价抗体被表达与抗体结合的抗原的细胞更快内化
(
和
/
或分解代谢
)。
在一些实施方案中,本公开内容的抗体是具有三个或更多个抗原结合位点的多价抗体
(
例如,四价抗体
)。
在一些实施方案中,本公开内容的多价抗体通过编码抗体多肽链的核酸的重组表达产生
。
在一些实施方案中,多价抗体包含二聚化结构域和三个或更多个抗原结合位点
。
在一些实施方案中,二聚化结构域包含
fc
区或铰链区
(
或由
fc
区或铰链区组成
)。
在这种情况下,抗体将包含
fc
区和
fc
区的氨基末端的三个或更多个抗原结合位点
。
在一些实施方案中,本文的多价抗体包含约三个至约八个
(
但优选地四个
)
抗原结合位点
。
多价抗体包含至少一条多肽链
(
并且优选地两条多肽链
)
,其中一条或更多条多肽链包含两个或更多个可变区
。
例如,一条或更多条多肽链包含
vd1-(x1)
n-vd2-(x2)
n-fc
,其中
vd1
是第一可变区,
vd2
是第二可变区,
fc
是
fc
区的一条多肽链,
x1
和
x2
代表氨基酸或多肽,并且n是0或
1。
在一些实施方案中,一条或更多条多肽链各自独立地包含:vh-ch1-柔性接头-v
h-ch1-fc
区链;或vh-ch1-v
h-ch1-fc
区链
。
在一些实施方案中,本文的多价抗体还包含至少两个
(
并且优选地四个
)
轻链可变区多肽
。
在一些实施方案中,本文的多价抗体包含约二个至约八个轻链可变区多肽
。
在一些实施方案中,本文描述的轻链可变区多肽包含轻链可变区
。
在一些实施方案中,本文描述的轻链可变区多肽还包含cl
结构域
。
[0125]
在一些实施方案中,本公开内容的抗体被构建为折叠成多价形式,这在一些实施方案中改进了结合亲和力
、
特异性和
/
或增加了在血液中的半衰期
。
多价形式的抗体,例如,通过本领域已知的技术制备
。
[0126]
在一些实施方案中,本公开内容的抗体是对靶蛋白特异性的
smip
或结合结构域免疫球蛋白融合蛋白
。
这些构建体是包含融合到实现抗体效应子功能必需的免疫球蛋白结构域的抗原结合结构域的单链多肽
。
[0127]
在一些实施方案中,本公开内容的抗体包含单链结合多肽,该单链结合多肽具有结合本文公开的表位的重链可变区和
/
或轻链可变区,并且任选地具有免疫球蛋白
fc
区
。
这样的分子是单链可变片段
(scfv)
,任选地通过免疫球蛋白
fc
区的存在而具有效应子功能或增加的半衰期
。
[0128]
抗
cd163
抗体
[0129]
在某些实施方案中,本文提供了与
cd163
蛋白特异性结合的抗体
。
在一些实施方案中,
cd163
结合抗体包含至少一条重链和至少一条轻链
。
在一些实施方案中,
cd163
结合抗体包含至少一条包含重链可变结构域
(vh)
的重链和至少一条包含轻链可变结构域
(v
l
)
的轻链
。
每个vh
和vl
包含三个互补决定区
(cdr)。vh和vl
和
cdr
的氨基酸序列决定抗体的抗原结合特异性和抗原结合强度
。vh和vl
结构域总结于表1中
。cdr
的氨基酸序列总结于表2和表3中
。
[0130]
在一些实施方案中,本文公开的抗体是单克隆抗体
。
在一些实施方案中,本文公开的抗体是抗原结合片段
。
在一些实施方案中,本文公开的抗体选自完整免疫球蛋白
、scfv、fab、f(ab’)2或二硫键连接的
fv。
在一些实施方案中,本文公开的抗体是
igg
或
igm。
在一些
实施方案中,本文公开的抗体是人源化的
。
在一些实施方案中,本文公开的抗体是嵌合的
。
[0131]
抗
cd163
抗体可变结构域
[0132]
表
1.
抗
cd163
可变结构域序列
。
[0133][0134][0135]
*
表1中加下划线的文本指示
cdr
,其中结构域边界注释基于
imgt
数据库,并且
cdr
区注释基于
honegger(aho)
编号方案
。
[0136]
在某些实施方案中,本文公开了抗体,所述抗体包含具有与如
seq id no:28
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与如
seq id no:28
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与如
seq id no:28
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0137]
在某些实施方案中,本文公开了抗体,所述抗体包含具有与如
seq id no:30
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与如
seq id no:30
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与如
seq id no:30
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0138]
在某些实施方案中,本文公开了抗体,所述抗体包含具有与如
seq id no:32
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与如
seq id no:32
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与如
seq id no:32
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0139]
在某些实施方案中,本文公开了抗体,所述抗体包含具有与如
seq id no:34
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与如
seq id no:34
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与如
seq id no:34
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0140]
在某些实施方案中,本文公开了抗体,所述抗体包含具有与如
seq id no:36
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与如
seq id no:36
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与如
seq id no:36
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0141]
在某些实施方案中,本文公开了抗体,所述抗体包含具有与如
seq id no:38
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与如
seq id no:38
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,
vl
具有与如
seq id no:38
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0142]
在某些实施方案中,本文公开了抗体,所述抗体包含具有与如
seq id no:29
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与如
seq id no:29
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与如
seq id no:29
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0143]
在某些实施方案中,本文公开了抗体,所述抗体包含具有与如
seq id no:31
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与如
seq id no:31
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与如
seq id no:31
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0144]
在某些实施方案中,本文公开了抗体,所述抗体包含具有与如
seq id no:33
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与如
seq id no:33
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与如
seq id no:33
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0145]
在某些实施方案中,本文公开了抗体,所述抗体包含具有与如
seq id no:35
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与如
seq id no:35
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与如
seq id no:35
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0146]
在某些实施方案中,本文公开了抗体,所述抗体包含具有与如
seq id no:37
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与如
seq id no:37
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与如
seq id no:37
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0147]
在某些实施方案中,本文公开了抗体,所述抗体包含具有与如
seq id no:39
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与如
seq id no:39
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与如
seq id no:39
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0148]
在某些实施方案中,本文公开了抗体,所述抗体包含具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%
、99
%或
100
%相同的氨基酸序列的轻链可变结构域
(v
l
)
:
seq id no:28、seq id no:30、seq id no:32、seq id no:34、seq id no:36
和
seq id no:38
;和具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%
、99
%或
100
%相同的氨基酸序列的重链可变结构域
(vh)
:
seq id no:29、seq id no:31、seq id no:33、seq id no:35、seq id no:37
和
seq id no:39
,条件是所述抗体不包含
seq id no:40
的轻链可变序列和
seq id no:41
的重链可变序列
。
在一些实施方案中,抗体的序列在
cdr h1、cdr h2、cdr h3、cdr l1、cdr l2
和
cdr l3
处
100
%相同
。
[0149]
在某些实施方案中,本文公开了抗体,所述抗体包含具有与由以下组成的组中列出的氨基酸序列至少约
80
%相同的氨基酸序列的轻链可变结构域
(v
l
)
:
seq id no:28、seq id no:30、seq id no:32、seq id no:34、seq id no:36
和
seq id no:38
;和具有与由以下组成的组中列出的氨基酸序列至少约
80
%相同的氨基酸序列的重链可变结构域
(vh)
:
seq id no:29、seq id no:31、seq id no:33、seq id no:35、seq id no:37
和
seq id no:39
,条件是所述抗体不包含
seq id no:40
的轻链可变序列和
seq id no:41
的重链可变序列
。
在一些实施方案中,抗体的序列在
cdr h1、cdr h2、cdr h3、cdr l1、cdr l2
和
cdr l3
处
100
%相同
。
[0150]
示例性抗
cd163
互补决定区
[0151]
表
2.
抗
cd163
轻链
cdr
序列
[0152][0153][0154]
表
3.
抗
cd163
重链
cdr
序列
[0155][0156]
在某些实施方案中,本文公开了与
cd163
结合的抗体,所述抗体包含具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr1(cdr l1)
:
seq id no:1、seq id no:7
和
seq id no:13
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr2(cdr l2)
:
seq id no:2、seq id no:9
和
seq id no:14
;和具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr3(cdr l3)
:
seq id no:3、seq id no:8、seq idno:10、seq id no:11、seq id no:12
和
seq id no:15
;条件是所述抗体不包含以下中列出的序列:
seq id no:1、seq id no:2
和
seq id no:3。
[0157]
在一些实施方案中,与
cd163
结合的抗体包含具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的轻链
cdr1
:
seq id no:1、seq id no:7
和
seq id no:13
;具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的轻链
cdr2
:
seq id no:2、seq id no:9
和
seq id no:14
;和具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的轻链
cdr3
:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15
;条件是所述抗体不包含以下中列出的序列:
seq id no:1、seq id no:2
和
seq id no:3。
[0158]
在某些实施方案中,本文公开了与
cd163
结合的抗体,所述抗体包含具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr1(cdr h1)
:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、
97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr2(cdr h2)
:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr3(cdr h3)
:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27
;条件是所述抗体不包含以下中列出的序列:
seq id no:4、seq id no:5
和
seq id no:6。
[0159]
在一些实施方案中,与
cd163
结合的抗体包含具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的重链
cdr1
:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的重链
cdr2
:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的重链
cdr3
:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27
;条件是所述抗体不包含与以下中列出的序列至少约
100
%相同的序列:
seq id no:4、seq id no:5
和
seq id no:6。
[0160]
在某些实施方案中,本文公开了抗体,所述抗体包含
(a)
具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr1
:
seq id no:1、seq id no:7
和
seq id no:13
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr2
:
seq id no:2、seq id no:9
和
seq id no:14
;和具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr3
:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15
;和
(b)
具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr1
:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr2
:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr3
:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27
;条件是所述抗体不包含以下中列出的序列:
seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5
和
seq id no:6。
[0161]
在一些实施方案中,与
cd163
结合的抗体包含
(a)
具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr1
:
no:20
列出的氨基酸序列的
cdr h2
和具有如
seq id no:21
列出的氨基酸序列的
cdr h3。
[0171]
在一些实施方案中,抗体是
v3
并且包含具有如
seq id no:7
列出的氨基酸序列的
cdr l1、
具有如
seq id no:2
列出的氨基酸序列的
cdr l2
和具有如
seq id no:11
列出的氨基酸序列的
cdr l3
;以及具有如
seq id no:22
列出的氨基酸序列的
cdr h1、
具有如
seq id no:23
列出的氨基酸序列的
cdr h2
和具有如
seq id no:24
列出的氨基酸序列的
cdr h3。
[0172]
在一些实施方案中,抗体是
v4
并且包含具有如
seq id no:7
列出的氨基酸序列的
cdr l1、
具有如
seq id no:2
列出的氨基酸序列的
cdr l2
和具有如
seq id no:8
列出的氨基酸序列的
cdr l3
;以及具有如
seq id no:22
列出的氨基酸序列的
cdr h1、
具有如
seq id no:17
列出的氨基酸序列的
cdr h2
和具有如
seq id no:18
列出的氨基酸序列的
cdr h3。
[0173]
在一些实施方案中,抗体是
v5
并且包含具有如
seq id no:7
列出的氨基酸序列的
cdr l1、
具有如
seq id no:2
列出的氨基酸序列的
cdr l2
和具有如
seq id no:10
列出的氨基酸序列的
cdr l3
;以及具有如
seq id no:16
列出的氨基酸序列的
cdr h1、
具有如
seq id no:17
列出的氨基酸序列的
cdr h2
和具有如
seq id no:24
列出的氨基酸序列的
cdr h3。
[0174]
在一些实施方案中,抗体是
v6
并且包含具有如
seq id no:7
列出的氨基酸序列的
cdr l1、
具有如
seq id no:2
列出的氨基酸序列的
cdr l2
和具有如
seq id no:12
列出的氨基酸序列的
cdr l3
;以及具有如
seq id no:19
列出的氨基酸序列的
cdr h1、
具有如
seq id no:17
列出的氨基酸序列的
cdr h2
和具有如
seq id no:18
列出的氨基酸序列的
cdr h3。
[0175]
在一些实施方案中,抗体包含具有如
seq id no:13
列出的氨基酸序列的
cdr l1、
具有如
seq id no:14
列出的氨基酸序列的
cdr l2
和具有如
seq id no:15
列出的氨基酸序列的
cdr l3
;以及具有如
seq id no:25
列出的氨基酸序列的
cdr h1、
具有如
seq id no:26
列出的氨基酸序列的
cdr h2
和具有如
seq id no:27
列出的氨基酸序列的
cdr h3
;条件是所述抗体不包含具有如
seq id no:1
列出的氨基酸序列的
cdr l1、
具有如
seq id no:2
列出的氨基酸序列的
cdr l2
和具有如
seq id no:3
列出的氨基酸序列的
cdr l3、
具有如
seq id no:4
列出的氨基酸序列的
cdr h1、
具有如
seq id no:5
列出的氨基酸序列的
cdr h2
和具有如
seq id no:6
列出的氨基酸序列的
cdr h3。
[0176]
结合亲和力和免疫反应性
[0177]
抗体或其抗原结合片段的结合亲和力和
/
或亲合力通过修饰框架区来改进
。
用于修饰框架区的任何合适的方法是本领域已知的并在本文中被考虑
。
对待改变的一个或更多个相关框架氨基酸位置的选择取决于许多标准
。
用于选择待改变的相关框架氨基酸的一种标准是,例如,供体分子和受体分子之间氨基酸框架残基的相对差异
。
使用这种方法选择待改变的相关框架位置具有避免残基决定中的任何主观偏差或残基对
cdr
结合亲和力贡献的任何偏差的优点
。
[0178]
在一些实施方案中,结合相互作用表现为与一个或更多个
cdr
的一个或更多个氨基酸残基的分子间接触
。
抗原结合涉及,例如,
cdr
或
cdr
对,或在一些情况下,vh
链和vl
链的多达所有六个
cdr
的相互作用
。
[0179]
抗体或抗原结合片段的结合亲和力和亲合力可以通过表面等离子体共振
(spr)
测量
、alphalisa
测定或平衡解离常数
(kd)
的流式细胞术测量
。
[0180]
本文公开了以
0.1nm
至
1000nm
的
kd与人类
cd163
特异性结合的抗体
。
在一些实施方案中,抗体以以下的
kd与人类
cd163
特异性结合:约
0.1nm
至约
500nm、
约
0.1nm
至约
100nm、
约
0.1nm
至约
50nm、
约
0.1nm
至约
20nm、
约
0.1nm
至约
10nm、
约
0.1nm
至约
5nm、
约
0.1nm
至约
2nm、
约
0.1nm
至约
1nm、
约
0.1nm
至约
0.5nm、
约
0.5nm
至约
1000nm、
约
0.5nm
至约
500nm、
约
0.5nm
至约
100nm、
约
0.5nm
至约
50nm、
约
0.5nm
至约
20nm、
约
0.5nm
至约
10nm、
约
0.5nm
至约
5nm、
约
0.5nm
至约
2nm、
约
0.5nm
至约
1nm、
约
1nm
至约
1000nm、
约
1nm
至约
500nm、
约
1nm
至约
100nm、
约
1nm
至约
50nm、
约
1nm
至约
20nm、
约
1nm
至约
10nm、
约
1nm
至约
5nm、
约
1nm
至约
2nm、
约
2nm
至约
1000nm、
约
2nm
至约
500nm、
约
2nm
至约
100nm、
约
2nm
至约
50nm、
约
2nm
至约
20nm、
约
2nm
至约
10nm、
约
2nm
至约
5nm、
约
5nm
至约
1000nm、
约
5nm
至约
500nm、
约
5nm
至约
100nm、
约
5nm
至约
50nm、
约
5nm
至约
20nm、
约
5nm
至约
10nm、
约
10nm
至约
1000nm、
约
10nm
至约
500nm、
约
10nm
至约
100nm、
约
10nm
至约
50nm、
约
10nm
至约
20nm、
约
20nm
至约
1000nm、
约
20nm
至约
500nm、
约
20nm
至约
100nm、
约
20nm
至约
50nm、
约
50nm
至约
1000nm、
约
50nm
至约
500nm、
约
50nm
至约
100nm、
约
100nm
至约
500nm、
约
100nm
至约
1000nm、
约
500nm
至约
1000nm。
在一些实施方案中,抗体以
1.8nm、12nm、45nm
或
89nm
的
kd与人类
cd163
特异性结合
。
[0181]
在一些实施方案中,本文公开的抗体以
0.824nm
的
kd与人类
cd163
特异性结合
。
在一些实施方案中,本文公开的抗体以
0.937nm
的
kd与人类
cd163
特异性结合
。
在一些实施方案中,本文公开的抗体以
0.964nm
的
kd与人类
cd163
特异性结合
。
在一些实施方案中,本文公开的抗体以
0.991nm
的
kd与人类
cd163
特异性结合
。
在一些实施方案中,本文公开的抗体以
1.03nm
的
kd与人类
cd163
特异性结合
。
在一些实施方案中,本文公开的抗体以
1.25nm
的
kd与人类
cd163
特异性结合
。
[0182]
本文公开的抗体与骨髓清道夫受体
cd163
结合,骨髓清道夫受体
cd163
在
m2
巨噬细胞上高度表达
。
本文公开的抗体与
il-10
极化的
m2c
巨噬细胞之间的结合亲和力通过流式细胞术测定来测量
。
[0183]
本文公开了以
0.1nm
至
1000nm
的
kd与
m2c
巨噬细胞特异性结合的抗体
。
在一些实施方案中,抗体以以下的
kd与
m2c
巨噬细胞特异性结合:约
0.1nm
至约
500nm、
约
0.1nm
至约
100nm、
约
0.1nm
至约
50nm、
约
0.1nm
至约
20nm、
约
0.1nm
至约
10nm、
约
0.1nm
至约
5nm、
约
0.1nm
至约
2nm、
约
0.1nm
至约
1nm、
约
0.1nm
至约
0.5nm、
约
0.5nm
至约
1000nm、
约
0.5nm
至约
500nm、
约
0.5nm
至约
100nm、
约
0.5nm
至约
50nm、
约
0.5nm
至约
20nm、
约
0.5nm
至约
10nm、
约
0.5nm
至约
5nm、
约
0.5nm
至约
2nm、
约
0.5nm
至约
1nm、
约
1nm
至约
1000nm、
约
1nm
至约
500nm、
约
1nm
至约
100nm、
约
1nm
至约
50nm、
约
1nm
至约
20nm、
约
1nm
至约
10nm、
约
1nm
至约
5nm、
约
1nm
至约
2nm、
约
2nm
至约
1000nm、
约
2nm
至约
500nm、
约
2nm
至约
100nm、
约
2nm
至约
50nm、
约
2nm
至约
20nm、
约
2nm
至约
10nm、
约
2nm
至约
5nm、
约
5nm
至约
1000nm、
约
5nm
至约
500nm、
约
5nm
至约
100nm、
约
5nm
至约
50nm、
约
5nm
至约
20nm、
约
5nm
至约
10nm、
约
10nm
至约
1000nm、
约
10nm
至约
500nm、
约
10nm
至约
100nm、
约
10nm
至约
50nm、
约
10nm
至约
20nm、
约
20nm
至约
1000nm、
约
20nm
至约
500nm、
约
20nm
至约
100nm、
约
20nm
至约
50nm、
约
50nm
至约
1000nm、
约
50nm
至约
500nm、
约
50nm
至约
100nm、
约
100nm
至约
500nm、
约
100nm
至约
1000nm、
约
500nm
至约
1000nm。
在一些实施方案中,抗体以
7.7nm
的
kd与
m2c
巨噬细胞特异性结合
。
[0184]
结合表位
[0185]
抗体表位可以是线性肽序列
(
即“连续的”)
或可以由不连续的氨基酸序列组成
(
即“构象的”或“不连续的”)。
在一些实施方案中,抗体识别一种或更多种氨基酸序列;因此,一个表位定义多于一种不同的氨基酸序列
。
抗体识别的表位例如通过本领域技术人员熟知的
肽映射和序列分析技术来确定
。
结合相互作用表现为与
cdr
的一个或更多个氨基酸残基的分子间接触
。
[0186]
人类
cd163
蛋白是在人类中由
cd163
基因编码的蛋白
。
人类
cd163
的氨基酸序列为:
msklrmvlledsgsadfrrhfvnlspftitvvlllsacfvtsslggtdkelrlvdgenkcsgrvevkvqeewgtvcnngwsmeavsvicnqlgcptaikapgwanssagsgriwmdhvscrgnesalwdckhdgwgkhsncthqqdagvtcsdgsnlemrltrggnmcsgrieikfqgrwgtvcddnfnidhasvicrqlecgsavsfsgssnfgegsgpiwfddlicngnesalwnckhqgwgkhncdhaedagvicskgadlslrlvdgvtecsgrlevrfqgewgticddgwdsydaavackqlgcptavtaigrvnaskgfghiwldsvscqghepaiwqckhhewgkhycnhnedagvtcsdgsdlelrlrgggsrcagtveveiqrllgkvcdrgwglkeadvvcrqlgcgsalktsyqvyskiqatntwlflsscngnetslwdcknwqwggltcdhyeeakitcsahreprlvggdipcsgrvevkhgdtwgsicdsdfsleaasvlcrelqcgtvvsilggahfgegngqiwaeefqcegheshlslcpvaprpegtcshsrdvgvvcsryteirlvngktpcegrvelktlgawgslcnshwdiedahvlcqqlkcgvalstpggarfgkgngqiwrhmfhctgteqhmgdcpvtalgaslcpseqvasvicsgnqsqtlsscnssslgptrptipeesavaciesgqlrlvngggrcagrveiyhegswgticddswdlsdahvvcrqlgcgeainatgsahfgegtgpiwldemkcngkesriwqchshgwgqqncrhkedagvicsefmslrltseasreacagrlevfyngawgtvgkssmsettvgvvcrqlgcadkgkinpasldkamsipmwvdnvqcpkgpdtlwqcpsspwekrlaspseetwitcdnkirlqegptscsgrveiwhggswgtvcddswdlddaqvvcqqlgcgpalkafkeaefgqgtgpiwlnevkckgnesslwdcparrwghsecghkedaavnctdisvqktpqkattgrssrqssfiavgilgvvllaifvalffltkkrrqrqrlavssrgenlvhqiqyremnsclnaddldlmnssgghseph(seq id no:42)。
[0187]
本文公开了与人类
cd163
中的表位特异性结合的抗体
。
在一些实施方案中,本文公开的抗体与包含非连续性氨基酸序列的表位结合
。
在一些实施方案中,抗体与包含氨基酸序列
igrvnaskgfghiwldsvscqghepai(seq id no:43)
的人类
cd163
的表位结合
。
在一些实施方案中,抗体与包含氨基酸序列
vvcrqlgcgsa(seq id no:44)
的人类
cd163
的表位结合
。
在一些实施方案中,抗体与包含氨基酸序列
wdcknwqwggltcd(seq id no:45)
的人类
cd163
的表位结合
。
在一些实施方案中,抗体与包含
seq id no
:
43-45
的氨基酸序列的人类
cd163
的表位结合
。
[0188]
本文还公开了与本文公开的表位特异性结合的另外的抗体
。
与本文公开的表位特异性结合的这些另外的抗体或其抗原结合片段可以使用本领域已知的技术来鉴定
。
例如,计算方法用于设计表位特异性抗体
。nimrod
等人,
computational design of epitope-specific functional antibodies,cell reports 25,2121-2131,nov.20,2018,(
通过引用并入本文
)。
另一种方法可以用于从与抗原结合的抗体的文库中鉴定与特定表位结合的抗体,诸如以下:首先将非典型氨基酸
(ncaa)p-苯甲酰基-l-苯丙氨酸
(pbpa)
和
p-叠氮基-l-苯丙氨酸
(pazf)
掺入靶表位中,并且然后选择在紫外线照射后与
ncaa
掺入的表位交联的抗体
。
因为只有当抗体和表位之间的距离足够近时才会发生交联,所以本方法可以有效地选择与靶表位特异性结合的抗体
。chen
等人
epitope-directed antibody selection by site-specific photocrosslinking,science advances,6(14),eaaz7825,01apr 2020(
通过引用并入本文
)。
[0189]
抗体的修饰
[0190]
在一些情况下,出于各种目的使用本领域已知的技术,诸如,例如,通过添加聚乙二醇
(peg)
,来修饰抗体或其抗原结合片段
。
在一些实施方案中,
peg
修饰
(peg
化
)
导致以下
中的一种或更多种:改进的循环时间
、
改进的溶解性
、
改进的蛋白水解耐受性
、
减少的抗原性和免疫原性
、
改进的生物可利用度
、
减少的毒性
、
改进的稳定性和更容易的配制
。
[0191]
在一些情况下,当抗原结合片段不含
fc
部分时,将
fc
部分添加到
(
例如,重组地
)
该片段,例如,以增加向受试者施用时抗原结合片段在血液循环中的半衰期
。
适当的
fc
区的选择和掺入这样的片段的方法是本领域已知的
。
例如,通过使用本领域已知的常规技术,将
igg
的
fc
区掺入感兴趣的多肽以便增加其循环半衰期但不丧失其生物活性
。
在一些实施方案中,进一步修饰抗体的
fc
部分以增加向受试者施用时抗原结合片段在血液循环中的半衰期
。
修饰,例如,使用本领域的常规手段来确定
。
[0192]
另外地,在一些实施方案中,产生或表达抗体及其抗原结合片段使得它们在其复合
n-糖苷连接的糖链上不含岩藻糖
。
已知从复合
n-糖苷连接的糖链去除岩藻糖会增加抗体和抗原结合片段的效应子功能,包括但不限于,抗体依赖性细胞介导的细胞毒性
(adcc)
和补体依赖性细胞毒性
(cdc)。
类似地,在一些情况下,结合表位的抗体或其抗原结合片段在其c末端附接至源自任何抗体同种型
(
例如,
igg、iga、ige、igd
和
igm)
和任何同种型亚类
(
特别是
igg1、igg2、igg3
和
igg4)
的免疫球蛋白重链的全部或一部分
。
[0193]
另外地,在一些实施方案中,本文描述的抗体或抗原结合片段还被修饰使得它们能够穿过血脑屏障
。
本文描述的抗体或抗原结合片段的这样的修饰允许用于治疗脑疾病诸如多形性成胶质母细胞瘤
(gbm)。
允许蛋白诸如抗体或抗原结合片段穿过血脑屏障的示例性修饰在美国专利公布
2007/0082380
中描述
。
[0194]
免疫球蛋白的糖基化已被显示对其效应子功能
、
结构稳定性和从抗体产生细胞的分泌速率具有显著影响
。
负责这些特性的糖类基团一般附接到抗体的恒定
(c)
区
。
例如,
igg
在ch2结构域中的天冬酰胺
297
处的糖基化对
igg
活化补体依赖性细胞裂解的经典途径的全部能力是必需的
(tao
和
morrison,j immunol 143:2595(1989))。igm
在ch3结构域中的天冬酰胺
402
处的糖基化对抗体的正确组装和细胞裂解活性是必需的
(muraoka
和
shulman,j immunol 142:695(1989))。
对
iga
抗体的ch1和ch3结构域中如位置
162
和
419
的糖基化位点的去除导致细胞内降解和对分泌的至少
90
%的抑制
(taylor
和
wall,mol cell biol 8:4197(1988))。
另外地,在一些实施方案中,产生或表达抗体及其抗原结合片段使得它们在其复合
n-糖苷连接的糖链上不含岩藻糖
。
已知从复合
n-糖苷连接的糖链去除岩藻糖会增加抗体和抗原结合片段的效应子功能,包括但不限于,抗体依赖性细胞介导的细胞毒性
(adcc)
和补体依赖性细胞毒性
(cdc)。
在一些实施方案中,这些“去岩藻糖基化”抗体和抗原结合片段通过利用本领域已知的分子克隆技术的各种系统产生,包括但不限于,已经遗传工程化使其不再含有将岩藻糖纳入复合
n-糖苷连接的糖链中所必需的酶和生物化学途径的转基因动物
、
转基因植物或细胞系
(
也称为岩藻糖基转移酶敲除动物
、
植物或细胞
)。
被工程化为岩藻糖基转移酶敲除细胞的细胞的非限制性实例包括
cho
细胞
、sp2/0
细胞
、ns0
细胞和
yb2/0
细胞
。
[0195]
也已经观察到免疫球蛋白在可变
(v)
区中的糖基化
。sox
和
hood
报道,约
20
%的人类抗体在v区被糖基化
(proc natl acad sci usa 66:975(1970))。v
结构域的糖基化被认为是由v区序列中n连接的糖基化信号
asn-xaa-ser/thr
的偶然出现引起,并且在本领域中尚未被认为在免疫球蛋白功能中起作用
。
[0196]
在一些情况下,可变结构域框架残基处的糖基化改变抗体与抗原的结合相互作
用
。
本公开内容包括选择人源化免疫球蛋白链的框架或
cdr
中有限数量的氨基酸进行突变
(
例如,通过残基的取代
、
缺失或添加
)
以增加抗体亲和力的标准
。
[0197]
在一些实施方案中,在抗体的
fc
区或含
fc
的多肽中去除或引入半胱氨酸残基,从而消除或增加该区域中的链间二硫键形成
。
在一些实施方案中,使用这样的方法产生的同源二聚体特异性结合剂或抗体表现出改进的内化能力和
/
或增加的补体介导的细胞杀伤和抗体依赖性细胞的细胞毒性
(adcc)。
[0198]
已经显示,
cdr
内的序列引起抗体与
mhc ii
类结合并在一些情况下触发不需要的辅助
t
细胞应答
。
在一些实施方案中,保守取代允许抗体保留结合活性但减少其触发不需要的
t
细胞应答的能力
。
在一种实施方案中,去除重链或轻链的n末端的
20
个氨基酸中的一个或更多个
。
[0199]
在一些实施方案中,产生具有改变的糖类结构的抗体分子,导致改变的效应子活性,包括表现出改进的
adcc
活性的岩藻糖基化不存在或减少的抗体分子
。
本领域已知各种方法以完成这一点
。
例如,
adcc
效应子活性是通过抗体分子与
fc
γ
riii
受体的结合介导的,这已被显示依赖于ch2结构域的
asn-297
处的
n-连接糖基化的糖类结构
。
与天然岩藻糖基化抗体相比,非岩藻糖基化抗体以增加的亲和力结合
fc
γ
riii
受体并更有效地触发
fc
γ
riii
介导的效应子功能
。
一些宿主细胞株,例如
lec13
或大鼠杂交瘤
yb2/0
细胞系天然产生具有较低岩藻糖基化水平的抗体
。
二等分糖类的水平的增加
(
例如通过在过表达
gntiii
酶的细胞中重组产生抗体
)
也已被确定增加
adcc
活性
。
在一些实施方案中,两个岩藻糖残基中仅一个不存在足以增加
adcc
活性
。
[0200]
抗体的共价修饰也包括在本文中
。
在一些实施方案中,如果可适用,则抗体的共价修饰通过化学合成或通过对抗体的酶促裂解或化学裂解来进行
。
在一些实施方案中,其他类型的共价修饰通过使靶向的氨基酸残基与能够与所选侧链或n末端或c末端残基反应的有机衍生剂反应来引入
。
[0201]
半胱氨酰残基最常与
α-卤代乙酸酯
(
和相应的胺
)(
诸如氯乙酸或氯乙酰胺
)
反应以生成羧甲基或羧酰胺甲基衍生物
。
半胱氨酰残基也通过与以下反应来衍生化:溴三氟丙酮
、
α-溴-β-(5-咪唑基
(imidozoyl))
丙酸
、
氯乙酰磷酸酯
、n-烷基马来酰亚胺
、3-硝基-2-吡啶基二硫化物
、
甲基
2-吡啶基二硫化物
、
对氯汞苯甲酸酯
、2-氯汞-4-硝基苯酚或氯-7-硝基苯并-2-氧杂-1,3-二唑
。
[0202]
在一些实施方案中,组氨酰残基通过在
ph 5.5-7.0
与焦碳酸二乙酯反应来衍生化,因为该剂对组氨酰侧链是相对特异性的
。
在一些实施方案中,对溴苯甲酰基溴也是可用的;在一些实施方案中,反应在
ph 6.0
在
0.1m
二甲基砷酸钠中进行
。
[0203]
在一些实施方案中,赖氨酰和氨基末端残基与琥珀酸酐或其他羧酸酐反应
。
用这些剂来衍生化具有逆转赖氨酰残基的电荷的作用
。
用于使含
α-氨基的残基衍生化的其他合适的试剂包括亚氨酸酯类,诸如甲基吡啶亚胺酸酯
、
磷酸吡哆醛
、
吡哆醛
、
氯硼氢化物
、
三硝基苯磺酸
、o-甲基异脲
、2,4-戊二酮和转氨酶催化的与乙醛酸的反应
。
[0204]
在一些实施方案中,精酰残基通过与一种或数种常规试剂
(
诸如苯基乙二醛
、2,3-丁二酮
、1,2-环己二酮和茚三酮
)
反应来修饰
。
由于胍官能团的高
pka
,因此精氨酸残基的衍生化要求反应在碱性条件下进行
。
此外,在一些实施方案中,这些试剂与赖氨酸的基团以及精氨酸
ε-氨基基团反应
。
[0205]
在一些实施方案中,由于对将光谱标记引入到酪氨酰残基的特别的兴趣,通过与芳族重氮鎓化合物或四硝基甲烷反应对酪氨酰残基进行特定修饰
。
在一些实施方案中,最常见的是,
n-乙酰咪唑和四硝基甲烷分别用于形成
o-乙酰基酪氨酰物质和
3-硝基衍生物
。
使用
125i或
131i碘化酪氨酰残基来制备用于放射免疫测定的标记蛋白
。
[0206]
羧基侧基
(
天冬氨酰或谷氨酰
)
通过与碳二亚胺
(r-n
=c=
n-r’)
反应进行特定修饰,其中r和
r’是不同的烷基
(alkyl)
基团,碳二亚胺例如
1-环己基-3-(2-吗啉基-4-乙基
)
碳二亚胺或
1-乙基-3-(4-氮阳离子-4,4-二甲基戊基
)
碳二亚胺
。
此外,天冬氨酰残基和谷氨酰残基通过与铵离子反应转化为天冬酰胺酰残基和谷氨酰胺酰残基
。
[0207]
在一些实施方案中,谷氨酰胺酰残基和天冬酰胺酰残基分别脱酰胺化为相应的谷氨酰残基和天冬氨酰残基
。
这些残基在中性或碱性条件下脱酰胺
。
[0208]
其他修饰包括脯氨酸和赖氨酸的羟基化
、
丝氨酰残基或苏氨酰残基的羟基基团的磷酸化
、
赖氨酸
、
精氨酸和组氨酸侧链的
α-氨基基团的甲基化
、n
末端胺的乙酰化以及任何c末端羧基基团的酰胺化
。
[0209]
另一种类型的共价修饰包括将糖苷化学或酶促偶联到特定结合剂或抗体
。
这些程序不需要在具有进行n连接或o连接糖基化的糖基化能力的宿主细胞中产生多肽或抗体
。
在一些实施方案中,取决于所使用的偶联模式,将糖附接至
(a)
精氨酸和组氨酸,
(b)
游离羧基基团,
(c)
游离巯基基团诸如半胱氨酸的那些,
(d)
游离羟基基团诸如丝氨酸
、
苏氨酸或羟脯氨酸的那些,
(e)
芳族残基诸如苯丙氨酸
、
酪氨酸或色氨酸的那些,或
(f)
谷氨酰胺的酰胺基团
。
[0210]
在一些实施方案中,存在于多肽或抗体上的任何糖类部分的去除被化学或酶促地完成
。
化学去糖基化包括将抗体暴露于化合物三氟甲磺酸或等效化合物
。
这种处理导致除连接糖
(n-乙酰葡糖胺或
n-乙酰半乳糖胺
)
之外的大部分或所有糖类的裂解,同时保持抗体完整
。
在一些实施方案中,抗体上糖类部分的酶促裂解通过使用各种内切和外切糖苷酶来实现
。
[0211]
另一种类型的共价修饰包括将抗体与各种非蛋白性聚合物中的一种连接,例如聚乙二醇
、
聚丙二醇
、
聚氧乙烯化多元醇
、
聚氧乙烯化山梨醇
、
聚氧乙烯化葡萄糖
、
聚氧乙烯化甘油
、
聚氧化烯或多糖聚合物诸如葡聚糖
。
这样的方法是本领域已知的
。
[0212]
结合预定多肽抗原的亲和力一般通过将一个或更多个突变引入v区框架中
(
通常在与一个或更多个
cdr
相邻的区域中和
/
或在一个或更多个框架区中
)
来调节
。
通常,这样的突变包括引入破坏糖基化位点序列或产生糖基化位点序列但基本上不影响多肽的亲水
/
疏水结构特性的保守氨基酸取代
。
通常,避免引入脯氨酸残基的突变
。
[0213]
效应子功能
[0214]
抗体效应子功能的实例包括:
c1q
结合和补体依赖性细胞毒性
、fc
受体结合
、
抗体依赖性细胞介导的细胞毒性
(adcc)、
吞噬作用
、
细胞表面受体
(
例如,b细胞受体
)
的下调和b细胞活化
。
通常,
fc
介导的功能涉及抗体的
fc
部分与特化受体分子“fc
受体”或“fcr”的结合,这些受体分子由细胞功能待受到影响的细胞表达
。
[0215]
igg
被认为是最多功能的免疫球蛋白,因为它在一些实施方案中执行免疫球蛋白分子的所有功能
。igg
是血清中的主要
ig
,并且也是唯一一类穿过胎盘的
ig。igg
也固定补体,尽管
igg4
亚类并不固定补体
。
巨噬细胞
、
单核细胞
、
多形核白细胞
(pmn)
和一些淋巴细胞
具有针对
igg
的
fc
区的受体
。
并非所有的亚类都同样好地结合:
igg2
和
igg4
不与
fc
受体结合
。
与
pmn、
单核细胞和巨噬细胞上的
fc
受体结合的结果是,在一些情况下,细胞现在可以更好地内化抗原
。igg
是增强吞噬作用的调理素
。igg
与其他类型的细胞上的
fc
受体的结合导致其他功能的活化
。
[0216]
在某些实施方案中,
fcr
是天然序列人类
fcr。
此外,优选的
fcr
是结合
igg
抗体
(gamma(“γ”))
的
fcr
,并且包括
fc
γ
ri、fc
γ
rii
和
fc
γ
riii
亚类的受体,包括这些受体的等位基因变体和可变剪接形式
。fc
γ
rii
受体包括
fc
γ
riia(“活化性受体”)
和
fc
γ
riib(“抑制性受体”)
,它们具有类似的氨基酸序列,主要区别在于其细胞质结构域
。
活化性受体
fc
γ
riia
在其细胞质域中含有基于免疫受体酪氨酸的活化基序
(itam)。
抑制性受体
fc
γ
riib
在其细胞质域中含有基于免疫受体酪氨酸的抑制基序
(itim)。
[0217]“抗体依赖性细胞介导的细胞毒性”或“adcc”是指一种细胞毒性形式,其中分泌的
ig
与某些细胞毒性细胞
(
例如,自然杀伤
(nk)
细胞
、
中性粒细胞和巨噬细胞
)
上存在的
fc
受体
(fcr)
结合,使得这些细胞毒性效应细胞能够与携带抗原的靶细胞特异性结合,并随后用细胞毒素杀伤靶细胞
。
抗体“武装”细胞毒性细胞,并且是这样的杀伤所需的
。
介导
adcc
的主要细胞中,
nk
细胞仅表达
fc
γ
riii
,而单核细胞表达
fc
γ
ri、fc
γ
rii
和
fc
γ
riii。
为了评估感兴趣分子的
adcc
活性,在一些实施方案中进行体外
adcc
测定
。
可用于这样的测定的效应细胞包括外周血单个核细胞
(pbmc)
和自然杀伤
(nk)
细胞
。
[0218]
可选地或另外地,在一些实施方案中,感兴趣分子的
adcc
活性在体内,例如,在动物模型中评估
。
[0219]
在一些实施方案中,本公开内容的抗体与
m2
样巨噬细胞的表面膜蛋白结合并被
m2
样巨噬细胞内化
。
这种内化过程被认为参与观察到的这些细胞的功能性免疫抑制特征的改变,即细胞从
m2
状态分化为微弱的活化状态,而不杀伤它们或抑制它们的增殖
。
在一些实施方案中,在内化后,抗体降低免疫抑制性可溶性因子的表达,同时使刺激或促进
t
细胞
(
包括
cd4
+
辅助性
t
细胞和细胞毒性淋巴细胞
)
活性或增殖的可溶性因子的表达增加
。
[0220]
对于某些治疗性应用,采用内化过程用于杀伤表达
cd163
蛋白的靶细胞或降低表达
cd163
蛋白的靶细胞的活性或增殖的目的
。
内化的抗体分子的数量将足以或足够杀伤细胞或抑制其生长
。
取决于抗体或抗体缀合物的效力,在一些情况下,单个抗体分子被摄取到细胞中足以杀伤抗体结合的靶细胞
。
例如,某些毒素具有高效的杀伤力,使得与抗体缀合的毒素的一个分子的内化就足以杀伤靶细胞
。
[0221]
在一些实施方案中,本文提供的抗体或抗原结合片段与治疗部分
、
成像或可检测部分或亲和标签缀合或连接
。
用于缀合或连接多肽的方法是本领域熟知的
。
化合物与标记之间的缔合
(
结合
)
包括本领域已知的任何方式,包括但不限于,共价和非共价相互作用
、
化学缀合以及重组技术
。
在一些实施方案中,抗体或其抗原结合片段被缀合至亲和标签
(
例如,纯化标签
)
或被重组工程化为具有亲和标签
(
例如,纯化标签
)。
亲和标签,诸如,例如聚组氨酸
(
例如,
his6)
标签是本领域中常规的
。
[0222]
在一些实施方案中,抗体或抗原结合片段还包含可检测部分
。
检测,例如,在体外
、
在体内或者离体完成
。
使用抗体或其抗原结合片段用于,例如,由巨噬细胞表达的
hucd163
蛋白的检测和
/
或确定
(
定量
、
定性等
)
的体外测定包括但不限于,例如,
elisa、ria
和蛋白印迹
。
在一些实施方案中,抗体的抗原的体外检测
、
诊断或监测通过从受试者获得样品
(
例如,
血液样品
)
并在例如标准
elisa
测定中测试该样品而发生
。
[0223]
治疗癌症的方法
[0224]
在某些实施方案中,本文公开了治疗有相应需要的个体中的癌症的方法,该方法包括向个体施用本文公开的抗体
。
在一些实施方案中,本公开内容提供了如本文描述的抗体用于制备用于治疗人类受试者中的癌症的药物的用途
。
在一些实施方案中,抗体与人类肿瘤相关巨噬细胞上表达的
cd163
蛋白特异性结合并减少巨噬细胞对
cd16、cd64、tlr2
或
siglec-15
中至少一种的表达
。
[0225]
在某些实施方案中,本文公开了调节有相应需要的受试者中的免疫活性的方法,该方法包括向所述受试者施用本文描述的抗体
。
在一些实施方案中,抗体与人类肿瘤相关巨噬细胞上表达的
cd163
蛋白特异性结合并减少巨噬细胞对
cd16、cd64、tlr2
或
siglec-15
中至少一种的表达
。
[0226]
在某些实施方案中,本文公开了治疗有病理性或不适当升高的
m2
巨噬细胞水平
(
例如,相对于可用于促进受试者中免疫介导的肿瘤细胞杀伤的水平的不适当升高
)
的受试者的方法,该方法包括向所述受试者施用本文描述的抗体
。
在一些实施方案中,抗体与人类肿瘤相关巨噬细胞上表达的
cd163
蛋白特异性结合并减少巨噬细胞对
cd16、cd64、tlr2
或
siglec-15
中至少一种的表达
。
[0227]
在某些实施方案中,本文公开了调节肿瘤微环境中的肿瘤相关巨噬细胞活性的方法,该方法包括使肿瘤相关巨噬细胞与本文公开的抗体接触,其中该方法导致以下作用中的至少一种:
[0228]
(a)
人类巨噬细胞对至少一种标志物的表达减少,其中至少一种标志物是
cd16、cd64、tlr2
或
siglec-15
;
[0229]
(b)
抗体被人类巨噬细胞内化;
[0230]
(c)cd4
+ t
细胞
、cd8
+ t
细胞
、nk
细胞或其任何组合的活化;
[0231]
(d)cd4
+ t
细胞
、cd8
+ t
细胞
、nk
细胞或其任何组合的增殖;和
[0232]
(e)
促进肿瘤微环境中肿瘤细胞杀伤
。
[0233]
在某些实施方案中,本文公开了调节肿瘤微环境中的肿瘤相关巨噬细胞活性的方法,该方法包括使肿瘤相关巨噬细胞与本文公开的抗体接触,其中该方法导致以下作用中的至少两种:
[0234]
(a)
人类巨噬细胞对至少一种标志物的表达减少,其中至少一种标志物是
cd16、cd64、tlr2
或
siglec-15
;
[0235]
(b)
抗体被人类巨噬细胞内化;
[0236]
(c)cd4
+ t
细胞
、cd8
+ t
细胞
、nk
细胞或其任何组合的活化;
[0237]
(d)cd4
+ t
细胞
、cd8
+ t
细胞
、nk
细胞或其任何组合的增殖;和
[0238]
(e)
促进肿瘤微环境中肿瘤细胞杀伤
。
[0239]
在某些实施方案中,本文公开了调节肿瘤微环境中的肿瘤相关巨噬细胞活性的方法,该方法包括使肿瘤相关巨噬细胞与本文公开的抗体接触,其中该方法导致以下作用中的至少三种:
[0240]
(a)
人类巨噬细胞对至少一种标志物的表达减少,其中至少一种标志物是
cd16、cd64、tlr2
或
siglec-15
;
[0241]
(b)
抗体被人类巨噬细胞内化;
[0242]
(c)cd4
+ t
细胞
、cd8
+ t
细胞
、nk
细胞或其任何组合的活化;
[0243]
(d)cd4
+ t
细胞
、cd8
+ t
细胞
、nk
细胞或其任何组合的增殖;和
[0244]
(e)
促进肿瘤微环境中肿瘤细胞杀伤
。
[0245]
在某些实施方案中,本文公开了调节肿瘤微环境中的肿瘤相关巨噬细胞活性的方法,该方法包括使肿瘤相关巨噬细胞与本文公开的抗体接触,其中该方法导致以下作用中的至少四种:
[0246]
(a)
人类巨噬细胞对至少一种标志物的表达减少,其中至少一种标志物是
cd16、cd64、tlr2
或
siglec-15
;
[0247]
(b)
抗体被人类巨噬细胞内化;
[0248]
(c)cd4
+ t
细胞
、cd8
+ t
细胞
、nk
细胞或其任何组合的活化;
[0249]
(d)cd4
+ t
细胞
、cd8
+ t
细胞
、nk
细胞或其任何组合的增殖;和
[0250]
(e)
促进肿瘤微环境中肿瘤细胞杀伤
。
[0251]
在某些实施方案中,本文公开了调节肿瘤微环境中的肿瘤相关巨噬细胞活性的方法,该方法包括使肿瘤相关巨噬细胞与本文公开的抗体接触,其中该方法导致以下作用中的至少五种:
[0252]
(a)
人类巨噬细胞对至少一种标志物的表达减少,其中至少一种标志物是
cd16、cd64、tlr2
或
siglec-15
;
[0253]
(b)
抗体被人类巨噬细胞内化;
[0254]
(c)cd4
+ t
细胞
、cd8
+ t
细胞
、nk
细胞或其任何组合的活化;
[0255]
(d)cd4
+ t
细胞
、cd8
+ t
细胞
、nk
细胞或其任何组合的增殖;和
[0256]
(e)
促进肿瘤微环境中肿瘤细胞杀伤
。
[0257]
在某些实施方案中,本文公开了功能性重新定向
(reorienting)
肿瘤相关巨噬细胞以减少患有癌症的患者中的免疫抑制的方法,该方法包括向患者施用对改进肿瘤微环境中的
cd4
+
或
cd8
+ t
细胞活性或增殖有效的量的包含如本文描述的抗体的药物组合物
。
[0258]
在某些实施方案中,本文公开了促进有相应需要的人类受试者中的淋巴细胞介导的肿瘤细胞杀伤的方法,该方法包括向受试者施用有效量的包含如本文描述的抗体的药物组合物
。
[0259]
在一些实施方案中,抗体包含具有与
seq id no:28
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与
seq id no:28
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与
seq id no:28
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0260]
在一些实施方案中,抗体包含具有与
seq id no:30
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与
seq id no:30
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与
seq id no:30
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0261]
在一些实施方案中,抗体包含具有与
seq id no:32
列出的氨基酸序列至少约
70
%
相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与
seq id no:32
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与
seq id no:32
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0262]
在一些实施方案中,抗体包含具有与
seq id no:34
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与
seq id no:34
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与
seq id no:34
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0263]
在一些实施方案中,抗体包含具有与
seq id no:36
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与
seq id no:36
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与
seq id no:36
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0264]
在一些实施方案中,抗体包含具有与
seq id no:38
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与
seq id no:38
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与
seq id no:38
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0265]
在一些实施方案中,抗体包含具有与
seq id no:29
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与
seq id no:29
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与
seq id no:29
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0266]
在一些实施方案中,抗体包含具有与
seq id no:31
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与
seq id no:31
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与
seq id no:31
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0267]
在一些实施方案中,抗体包含具有与
seq id no:33
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与
seq id no:33
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与
seq id no:33
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0268]
在一些实施方案中,抗体包含具有与
seq id no:35
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与
seq id no:35
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与
seq id no:35
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0269]
在一些实施方案中,抗体包含具有与
seq id no:37
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与
seq id no:37
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与
seq id no:37
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0270]
在一些实施方案中,抗体包含具有与
seq id no:39
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与
seq id no:39
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与
seq id no:39
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0271]
在一些实施方案中,抗体包含具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%
、99
%或
100
%相同的氨基酸序列的轻链可变结构域
(v
l
)
:
seq id no:28、seq id no:30、seq id no:32、seq id no:34、seq id no:36、seq id no:38
和
seq id no:40
;和具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%
、99
%或
100
%相同的氨基酸序列的重链可变结构域
(vh)
:
seq id no:29、seq id no:31、seq id no:33、seq id no:35、seq id no:37、seq id no:39
和
seq id no:41
,条件是所述抗体不包含
seq id no:40
的轻链可变序列和
seq id no:41
的重链可变序列
。
在一些实施方案中,抗体的序列在
cdr h1、cdr h2、cdr h3、cdr l1、cdr l2
和
cdr l3
处
100
%相同
。
[0272]
在一些实施方案中,抗体包含具有与由以下组成的组中列出的氨基酸序列至少约
80
%相同的氨基酸序列的轻链可变结构域
(v
l
)
:
seq id no:28、seq id no:30、seq id no:32、seq id no:34、seq id no:36、seq id no:38、seq id no:40
;和具有与由以下组成的组中列出的氨基酸序列至少约
80
%相同的氨基酸序列的重链可变结构域
(vh)
:
seq id no:29、seq id no:31、seq id no:33、seq id no:35、seq id no:37、seq id no:39
和
seq id no:41
,条件是所述抗体不包含
seq id no:40
的轻链可变序列和
seq id no:41
的重链可变序列
。
在一些实施方案中,抗体的序列在
cdr h1、cdr h2、cdr h3、cdr l1、cdr l2
和
cdr l3
处
100
%相同
。
[0273]
在一些实施方案中,抗体包含具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr1
:
seq id no:1、seq id no:7
和
seq id no:13
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr2
:
seq id no:2、seq id no:9
和
seq id no:14
;和具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr3
:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15
;条件是所述抗体不包含以下中列出
的序列:
seq id no:1、seq id no:2
和
seq id no:3。
[0274]
在一些实施方案中,抗体包含具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的轻链
cdr1
:
seq id no:1、seq id no:7
和
seq id no:13
;具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的轻链
cdr2
:
seq id no:2、seq id no:9
和
seq id no:14
;和具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的轻链
cdr3
:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15
;条件是所述抗体不包含以下中列出的序列:
seq id no:1、seq id no:2
和
seq id no:3。
[0275]
在一些实施方案中,抗体包含具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr1
:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr2
:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr3
:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27
;条件是所述抗体不包含以下中列出的序列:
seq id no:4、seq id no:5
和
seq id no:6。
[0276]
在一些实施方案中,抗体包含具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的重链
cdr1
:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的重链
cdr2
:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的重链
cdr3
:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27
;条件是所述抗体不包含以下中列出的序列:
seq id no:4、seq id no:5
和
seq id no:6。
[0277]
在一些实施方案中,抗体包含:
(a)
具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr1
:
seq id no:1、seq id no:7
和
seq id no:13
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr2
:
seq id no:2、seq id no:9
和
seq id no:14
;和具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr3
:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15
;和
(b)
具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr1
:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;
具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr2
:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr3
:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27
;条件是所述抗体不包含以下中列出的序列:
seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5
和
seq id no:6。
[0278]
在一些实施方案中,抗体包含:
(a)
具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr1
:
seq id no:1、seq id no:7
和
seq id no:13
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr2
:
seq id no:2、seq id no:9
和
seq id no:14
;和具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr3
:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15
;和
(b)
具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr1
:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr2
:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr3
:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27
;条件是所述抗体不包含以下中列出的序列:
seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5
和
seq id no:6。
[0279]
在一些实施方案中,本公开内容提供了如本文描述的抗体用于制备减少患有癌症的人类受试者中的肿瘤相关巨噬细胞的免疫抑制的药物的用途
。
[0280]
在一些实施方案中,本公开内容提供了如本文描述的抗体用于制备促进患有癌症的人类受试者中的
t
细胞介导的肿瘤细胞杀伤的药物的用途
。
[0281]
在一些实施方案中,本公开内容提供了治疗患有癌症的人类受试者的方法,该方法包括向受试者施用治疗有效量的如本文描述的抗体,由此减少受试者中的肿瘤相关巨噬细胞的免疫抑制
。
[0282]
在一些实施方案中,本公开内容提供了治疗患有癌症的人类受试者的方法,该方法包括向受试者施用治疗有效量的如本文描述的抗体,由此增加受试者中的
t
细胞介导的肿瘤细胞杀伤
。
[0283]
在一些实施方案中,本文公开的方法减少骨髓细胞对
cd8+ t
细胞活化和增殖的抑制
。
[0284]
在一些实施方案中,抗体减少骨髓细胞对
car t
细胞介导的癌细胞杀伤的抑制
。
[0285]
在一些实施方案中,抗体减少骨髓细胞对
nk
细胞介导的通过
adcc
的癌细胞杀伤的抑制
。
[0286]
在一些实施方案中,癌症是肺上皮癌或肉瘤
。
在一些实施方案中,肺癌是肺腺癌
。
在一些实施方案中,肺癌是非小细胞肺癌
。
[0287]
在一些情况下,本文公开的方法中的任何一种还包括向所述受试者施用另外的抗癌疗法
。
抗癌疗法包括但不限于手术疗法
、
化学疗法
、
放射性疗法
、
冷冻疗法
、
激素疗法
、
免疫疗法和细胞因子疗法及其组合
。
在一种实施方案中,抗体或其抗原结合片段和抗癌疗法同时或顺序地施用
。
[0288]
在一些实施方案中,另外的抗癌疗法是免疫疗法
。
在一些实施方案中,免疫疗法是包含检查点抑制剂的组合物
。
在一些实施方案中,另外的抗癌疗法是免疫检查点抑制剂
。
[0289]
治疗纤维化的方法
[0290]
在某些实施方案中,本文公开了治疗有相应需要的受试者中的纤维化
(
诸如与
m2-巨噬细胞的存在相关的纤维化
)
的方法,该方法包括向受试者施用本文公开的抗体
。
在一些实施方案中,纤维化是原发性纤维化疾病
。
在一些实施方案中,纤维化是继发性纤维化疾病
。
在一些实施方案中,本公开内容提供了如本文描述的抗体用于制备用于治疗人类受试者中的纤维化的药物的用途
。
在一些实施方案中,抗体与人类巨噬细胞
(
诸如组织驻留或浸润性巨噬细胞
)
上表达的
cd163
蛋白特异性结合并减少巨噬细胞对
cd16、cd64、tlr2
或
siglec-15
中至少一种的表达
。
[0291]
在某些实施方案中,本文公开了调节有相应需要的受试者中的免疫活性的方法,该方法包括向所述受试者施用本文描述的抗体
。
在一些实施方案中,抗体与人类巨噬细胞
(
诸如组织驻留或浸润性巨噬细胞
)
上表达的
cd163
蛋白特异性结合并减少巨噬细胞对
cd16、cd64、tlr2
或
siglec-15
中至少一种的表达
。
[0292]
在某些实施方案中,本文公开了治疗有病理性或不适当升高的
m2
巨噬细胞水平
(
例如,相对于可用于促进受试者中适当的伤口愈合和
/
或组织再生的水平的不适当升高
)
的受试者的方法,该方法包括向所述受试者施用本文描述的抗体
。
在一些实施方案中,抗体与人类巨噬细胞
(
诸如组织驻留或浸润性巨噬细胞
)
上表达的
cd163
蛋白特异性结合并减少巨噬细胞对
cd16、cd64、tlr2
或
siglec-15
中至少一种的表达
。
[0293]
在某些实施方案中,本文公开了功能性重新定向巨噬细胞
(
诸如组织驻留或浸润性
m2
巨噬细胞
)
以减少患有纤维化
(
诸如与
m2-巨噬细胞的存在相关的纤维化
)
的患者中巨噬细胞的促纤维化功能的方法,该方法包括向患者施用对减少纤维化组织中成纤维细胞的活化和
/
或增殖有效的量的包含如本文描述的抗体的药物组合物
。
在一些实施方案中,纤维化是原发性纤维化疾病
。
在一些实施方案中,纤维化是继发性纤维化疾病
。
[0294]
在某些实施方案中,本文公开了减少有相应需要的人类受试者中巨噬细胞
(
诸如组织驻留或浸润性
m2
巨噬细胞
)
对
tgf-β
、pdgf、vegf、igf-1、
半乳凝素-3、il-10
或其组合的分泌的方法,该方法包括向受试者施用有效量的包含如本文描述的抗体的药物组合物
。
[0295]
在某些实施方案中,本文公开了调节纤维化组织中的巨噬细胞
(
诸如
m2
巨噬细胞
)
的活性的方法,该方法包括使巨噬细胞与本文公开的抗体接触,其中该方法导致以下作用中的至少一种:
[0296]
(a)
人类巨噬细胞对至少一种标志物的表达减少,其中至少一种标志物是
cd16、cd64、tlr2
或
siglec-15
;或
[0297]
(b)
抗体被人类巨噬细胞内化
。
[0298]
在一些实施方案中,纤维化是原发性纤维化疾病
。
在一些实施方案中,纤维化是继发性纤维化疾病
。
[0299]
在一些实施方案中,抗体包含具有与
seq id no:28
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与
seq id no:28
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与
seq id no:28
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0300]
在一些实施方案中,抗体包含具有与
seq id no:30
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与
seq id no:30
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与
seq id no:30
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0301]
在一些实施方案中,抗体包含具有与
seq id no:32
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与
seq id no:32
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与
seq id no:32
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0302]
在一些实施方案中,抗体包含具有与
seq id no:34
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与
seq id no:34
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与
seq id no:34
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0303]
在一些实施方案中,抗体包含具有与
seq id no:36
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与
seq id no:36
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与
seq id no:36
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0304]
在一些实施方案中,抗体包含具有与
seq id no:38
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与
seq id no:38
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与
seq id no:38
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0305]
在一些实施方案中,抗体包含具有与
seq id no:29
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与
seq id no:29
列出
的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与
seq id no:29
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0306]
在一些实施方案中,抗体包含具有与
seq id no:31
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与
seq id no:31
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与
seq id no:31
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0307]
在一些实施方案中,抗体包含具有与
seq id no:33
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与
seq id no:33
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与
seq id no:33
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0308]
在一些实施方案中,抗体包含具有与
seq id no:35
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与
seq id no:35
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与
seq id no:35
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0309]
在一些实施方案中,抗体包含具有与
seq id no:37
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与
seq id no:37
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与
seq id no:37
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0310]
在一些实施方案中,抗体包含具有与
seq id no:39
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与
seq id no:39
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与
seq id no:39
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0311]
在一些实施方案中,抗体包含具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%
、99
%或
100
%相同的氨基酸序列的轻链可变结构域
(v
l
)
:
seq id no:28、seq id no:30、seq id no:32、seq id no:34、seq id no:36、seq id no:38
和
seq id no:40
;和具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%
、99
%或
100
%相同的氨基酸序列的重链可变结构域
(vh)
:
seq id no:29、seq id no:31、seq id no:33、seq id no:35、seq id no:37、seq id no:39
和
seq id no:41
,条件是所述抗体不包含
seq id no:40
的轻链可变序列和
seq id no:41
的重链可变序列
。
在一些实施方案中,抗体的序列在
cdr h1、cdr h2、cdr h3、cdr l1、cdr l2
和
cdr l3
处
100
%相同
。
[0312]
在一些实施方案中,抗体包含具有与由以下组成的组中列出的氨基酸序列至少约
80
%相同的氨基酸序列的轻链可变结构域
(v
l
)
:
seq id no:28、seq id no:30、seq id no:32、seq id no:34、seq id no:36、seq id no:38、seq id no:40
;和具有与由以下组成的组中列出的氨基酸序列至少约
80
%相同的氨基酸序列的重链可变结构域
(vh)
:
seq id no:29、seq id no:31、seq id no:33、seq id no:35、seq id no:37、seq id no:39
和
seq id no:41
,条件是所述抗体不包含
seq id no:40
的轻链可变序列和
seq id no:41
的重链可变序列
。
在一些实施方案中,抗体的序列在
cdr h1、cdr h2、cdr h3、cdr l1、cdr l2
和
cdr l3
处
100
%相同
。
[0313]
在一些实施方案中,抗体包含具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr1
:
seq id no:1、seq id no:7
和
seq id no:13
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr2
:
seq id no:2、seq id no:9
和
seq id no:14
;和具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr3
:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15
;条件是所述抗体不包含以下中列出的序列:
seq id no:1、seq id no:2
和
seq id no:3。
[0314]
在一些实施方案中,抗体包含具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的轻链
cdr1
:
seq id no:1、seq id no:7
和
seq id no:13
;具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的轻链
cdr2
:
seq id no:2、seq id no:9
和
seq id no:14
;和具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的轻链
cdr3
:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15
;条件是所述抗体不包含以下中列出的序列:
seq id no:1、seq id no:2
和
seq id no:3。
[0315]
在一些实施方案中,抗体包含具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr1
:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr2
:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr3
:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27
;条件是所述抗体不包含以下中列出的序列:
seq id no:4、seq id no:5
和
seq id no:6。
[0316]
在一些实施方案中,抗体包含具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的重链
cdr1
:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的重链
cdr2
:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的重链
cdr3
:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27
;条件是所述抗体不包含以下中列出的序列:
seq id no:4、seq id no:5
和
seq id no:6。
[0317]
在一些实施方案中,抗体包含:
(a)
具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr1
:
seq id no:1、seq id no:7
和
seq id no:13
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr2
:
seq id no:2、seq id no:9
和
seq id no:14
;和具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr3
:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15
;和
(b)
具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr1
:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr2
:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr3
:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27
;条件是所述抗体不包含以下中列出的序列:
seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5
和
seq id no:6。
[0318]
在一些实施方案中,抗体包含:
(a)
具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr1
:
seq id no:1、seq id no:7
和
seq id no:13
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr2
:
seq id no:2、seq id no:9
和
seq id no:14
;和具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr3
:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15
;和
(b)
具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr1
:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;
具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr2
:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr3
:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27
;条件是所述抗体不包含以下中列出的序列:
seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5
和
seq id no:6。
[0319]
在一些实施方案中,本公开内容提供了如本文描述的抗体用于制备药物的用途,该药物减少患有纤维化
(
诸如与
m2-巨噬细胞的存在相关的纤维化
)
的人类受试者中的巨噬细胞
(
诸如组织驻留或浸润性
m2
巨噬细胞
)
的促纤维化功能
。
在一些实施方案中,纤维化是原发性纤维化疾病
。
在一些实施方案中,纤维化是继发性纤维化疾病
。
[0320]
在一些实施方案中,本公开内容提供了如本文描述的抗体用于制备用于减少患有纤维化
(
诸如与
m2-巨噬细胞的存在相关的纤维化
)
的人类受试者中的成纤维细胞的活化和
/
或增殖的药物的用途
。
在一些实施方案中,纤维化是原发性纤维化疾病
。
在一些实施方案中,纤维化是继发性纤维化疾病
。
[0321]
在一些实施方案中,本公开内容提供了一种治疗患有纤维化
(
诸如与
m2-巨噬细胞的存在相关的纤维化
)
的人类受试者的方法,该方法包括向受试者施用治疗有效量的如本文描述的抗体,由此减少受试者中的巨噬细胞
(
诸如组织驻留或浸润性
m2
巨噬细胞
)
的促纤维化功能
。
在一些实施方案中,纤维化是原发性纤维化疾病
。
在一些实施方案中,纤维化是继发性纤维化疾病
。
[0322]
在一些实施方案中,本公开内容提供了一种治疗患有纤维化
(
诸如与
m2-巨噬细胞的存在相关的纤维化
)
的人类受试者的方法,该方法包括向受试者施用治疗有效量的如本文描述的抗体,由此减少成纤维细胞的活化和
/
或增殖
。
在一些实施方案中,纤维化是原发性纤维化疾病
。
在一些实施方案中,纤维化是继发性纤维化疾病
。
[0323]
在一些实施方案中,本公开内容提供了一种治疗患有纤维化
(
诸如与
m2-巨噬细胞的存在相关的纤维化
)
的人类患者的方法,该方法包括向患者施用有效量的如本文描述的抗体
。
[0324]
在一些实施方案中,纤维化是原发性纤维化疾病
。
在一些实施方案中,原发性纤维化疾病是囊性纤维化
、
特发性肺纤维化
、
肝硬化
、
系统性硬化
(ssc)、
硬皮病移植物抗宿主病
(gvhd)、
肾源性系统性纤维化和放射性纤维化
。
示例性放射性纤维化包括例如由放射性疗法引起的肺炎症
(
肺炎
)
后的组织修复导致的肺纤维化
。
经历例如用于癌症治疗的放射性疗法的其他软组织也可以表现出放射性纤维化,例如乳腺组织
、
头部和颈部组织
、
神经
、
心脏组织
、
血管
、
骨以及肌肉
、
肌腱和韧带的放射性纤维化
。“放射性纤维化综合征”可以用于指由放射性治疗导致的进行性纤维化组织硬化的临床表现
。
[0325]
在一些实施方案中,纤维化是继发性纤维化疾病
。
在一些实施方案中,纤维化是急性疾病或慢性疾病的后遗症
。
在一些实施方案中,纤维化作为后遗症的疾病或紊乱是癌症
、
病毒感染或自身免疫性或炎性疾病
。
与纤维化相关的示例性感染是脓毒症
、hiv
感染
、sars-cov-2
感染和疟疾
。
与纤维化相关的示例性自身免疫性和炎性疾病和紊乱是镰状细胞病
、1
型糖尿病
、2
型糖尿病
、
克罗恩病
、
乳糜泻
、
哮喘
、
结节病
、
肾小球肾炎
、
狼疮性肾炎
、
系统性红斑狼疮
、
类风湿性关节炎
、
干燥综合征
、
硬皮病
、
囊性纤维化
(cf)、
移植物抗宿主病
、
同种异体移植物排斥
、
结节病
、
噬血细胞性淋巴组织细胞增多症
(hlh)、
炎性关节炎
、
慢性阻塞性肺病
(copd)、
哮喘
、
骨关节炎和多发性硬化
。
[0326]
在一些实施方案中,纤维化是肺纤维化
。
肺纤维化可能与肺部疾病或紊乱相关
。
一种示例性肺部疾病是特发性肺纤维化
(ipf)。
其他示例性肺部疾病和紊乱包括但不限于间质性肺病
(ild)、
弥漫性间质性肺病
、
肺结节病
、
急性肺损伤
(ali)、
急性呼吸窘迫综合征
(ards)、covid-19
和过敏性肺炎
。
[0327]
在一些实施方案中,纤维化是心脏纤维化
。
心脏纤维化可能与心脏疾病或紊乱相关
。
示例性心脏疾病和紊乱包括但不限于动脉粥样硬化
、
心房颤动
、
慢性心力衰竭
、
外周动脉疾病和急性冠状动脉综合征
。
[0328]
在一些实施方案中,纤维化是肝纤维化
。
肝纤维化可能与肝部疾病或紊乱相关
。
示例性肝部疾病和紊乱包括但不限于肝纤维化
、
非酒精性脂肪性肝病
(nafld)、
慢性加急性肝衰竭
、
急性肝衰竭
、
酒精性肝炎
、
非酒精性脂肪性肝炎
、
肝硬化和病毒性肝炎
。
[0329]
在一些实施方案中,纤维化是肾纤维化
。
肾纤维化可能与肾部疾病或紊乱相关
。
示例性肾部疾病和紊乱包括但不限于急性肾损伤
、
急性肾小管坏死
、
慢性肾病和肾同种异体移植物排斥反应
。
[0330]
在一些实施方案中,纤维化是视网膜纤维化
。
[0331]
在一些实施方案中,本文公开的方法中的任何一种还包括向所述受试者施用另外的抗纤维化疗法
。
抗纤维化疗法包括但不限于尼达尼布
(nintedanib)、
吡非尼酮
、
皮质类固醇
(
例如,泼尼松
)、
霉酚酸酯
/
霉酚酸
、
硫唑嘌呤
、ace
抑制剂
(
例如,贝那普利
、
赖诺普利和雷米普利
)、
血管紧张素
ii
受体阻断物
(arb)、
抗病毒剂
(
例如,丙型肝炎疗法
)
和
tgf-β
抑制剂
。
[0332]
在一些实施方案中,本文公开的方法中的任何一种还包括向所述受试者施用另外的抗炎疗法
。
抗炎疗法包括但不限于皮质类固醇
(
例如,泼尼松
)、
非甾体抗炎药
(nsaid
,例如,布洛芬
)、
吡非尼酮和其他免疫调节剂
。
[0333]
在一些实施方案中,其他抗体
、
小分子治疗剂和
/
或其他剂在单独的组合物中被组合用于同时或顺序地施用
。
在一种实施方案中,同时施用包括同时施用或彼此相隔
30
分钟内施用一种或更多种组合物
。
在一些实施方案中,施用发生在相同或不同部位
。
[0334]
在一些实施方案中,这样的成分的毒性和治疗功效在细胞培养物或实验动物中通过标准制药学程序确定,例如,用于确定
ld
50
(
对群体的
50
%致死的剂量
)
和
ed
50
(
对群体的
50
%治疗有效的剂量
)。
在一些实施方案中,毒性作用和治疗作用之间的剂量比率为治疗指数,并且它被表示为
ld
50
/ed
50
比率
。
在一些实施方案中,虽然使用表现出毒性副作用的化合物,但应注意设计将这样的化合物靶向受影响的组织部位的递送系统,以使对健康细胞的潜在损害最小化,从而减少副作用
。
[0335]
在一些实施方案中,从细胞培养测定和动物研究获得的数据用于配制用于人类的剂量范围
。
优选地,这样的化合物的剂量处于包括具有很少毒性或没有毒性的
ed
50
的循环浓度的范围内
。
在一些实施方案中,取决于采用的剂型和利用的施用途径,剂量在该范围内变化
。
在一些实施方案中,对于本公开内容的方法中使用的任何化合物,治疗有效剂量最初根据细胞培养测定估计
。
在一些实施方案中,在动物模型中配制剂量以实现包括如在细胞培
养物中确定的
ic
50
(
即,实现半最大抑制的测试化合物的浓度
)
的循环血浆浓度范围
。
血浆中的水平,例如,通过高效液相色谱法测量
。
这样的信息,在一些情况下,用于更精确地确定在人类中有用的剂量
。
[0336]
在一些实施方案中,本公开内容提供了一种治疗患有纤维化
(
诸如与
m2-巨噬细胞的存在相关的纤维化
)
的患者的方法,该方法包括向患者施用治疗有效量的如本文描述的抗体,并且还包括用选自手术疗法或细胞因子疗法的纤维化疗法治疗受试者
。
在一些实施方案中,纤维化是原发性纤维化疾病
。
在一些实施方案中,纤维化是继发性纤维化疾病
。
在一些实施方案中,抗体或其抗原结合片段和另一种纤维化疗法
(
例如,抗炎剂
)
同时或顺序地施用
。
[0337]
诊断产品和方法
[0338]
在一些实施方案中,本文公开了检测样品或受试者中的
hucd163
蛋白或
m2
巨噬细胞的方法,以评估患者的治疗状态或诊断与
m2
巨噬细胞或组织驻留的巨噬细胞或浸润性巨噬细胞的活性相关或关联的疾病或紊乱,诸如本文描述的那些纤维化疾病和紊乱
。
[0339]
在对细胞或组织的可溶性
hucd163
蛋白
、hucd163
蛋白的表达
、
或
m2
巨噬细胞的存在或活性的体内检测
、
诊断或监测中,受试者被施用如本文描述的抗体或抗原结合片段,该抗体或抗原结合片段与可检测部分结合
。
在一些实施方案中,可检测部分使用诸如但不限于以下的本领域公认的方法可视化:磁共振成像
(mri)、
荧光
、
放射成像
、
由内窥镜
、
腹腔镜或血管内导管提供的光源
(
即,经由光活性剂的检测
)、
光扫描
、
正电子发射断层成像术
(pet)
扫描
、
全身核磁共振
(nmr)、
放射闪烁照相法
、
单光子发射计算机断层成像术
(spect)、
靶向近红外区域
(nir)
扫描
、x
射线
、
超声
。
用于使用这样的方法检测化合物的标记也是本领域已知的
。
在一些实施方案中,可检测部分的可视化允许检测
、
诊断和
/
或监测与
m2
巨噬细胞活性或表达
hucd163
蛋白的另一种细胞的活性相关的状况或疾病
。
利用对期望的靶蛋白
(
即
hucd163
蛋白
)
特异性的抗体的另外的诊断测定是本领域已知的并且也在本文中被设想
。
[0340]
对于体外检测方法,待从受试者获得的样品包括但不限于,血液
、
组织活检样品和来自其的流体
。
[0341]
因此,本公开内容提供了可用于检测或诊断与纤维化疾病或紊乱相关的
m2
巨噬细胞
、
组织驻留的巨噬细胞或浸润性巨噬细胞的水平
(
潜在地指示对治疗性治疗的需要
)
的抗体及其抗原结合片段
。
在其他实施方案中,抗体还包含第二剂
。
在一些实施方案中,这样的剂是诸如,例如,报道物分子或可检测的标记的分子或部分
。
用于这样的检测方法的可检测的标记
/
部分是本领域已知的并且在下文更详细地描述
。
例如,报道物分子是使用测定检测的任何部分
。
与多肽缀合的报道物分子的非限制性实例包括酶
、
放射性标记
、
半抗原
、
荧光标记
、
磷光分子
、
化学发光分子
、
生色团
、
发光分子
、
光亲和分子
、
着色颗粒或配体,诸如生物素
。
在一些实施方案中,可检测的标记包括由于其特定的功能特性和
/
或化学特征而被检测的化合物和
/
或元素,它们的使用允许它们附接的多肽被检测,和
/
或如果需要的话进一步定量
。
许多适合的可检测
(
成像
)
剂是本领域已知的,用于附接至多肽的方法也是如此
。
[0342]
在一些实施方案中,多肽与各种各样的荧光染料
、
猝灭剂和半抗原诸如荧光素
、r-藻红蛋白和生物素缀合
。
在一些实施方案中,缀合发生在多肽合成期间或多肽合成和纯化之后
。
[0343]
可选地,在一些实施方案中,抗体
、
抗原结合片段或结合蛋白与荧光部分缀合
。
例如,将多肽与荧光部分
(
例如,
r-藻红蛋白
、
异硫氰酸荧光素
(fitc)
等
)
缀合是使用本领域公认技术完成的
。
用于特定应用
(
诸如荧光显微术
、
流式细胞术
、
荧光激活细胞分选
(facs)
等
)
的许多可商购的荧光染料和染料缀合试剂盒是可商购的
。
[0344]
在一种非限制性实施方案中,抗体或抗原结合片段与可检测的标记缔合
(
缀合
)
,可检测的标记诸如放射性核素
、
染料
、
成像剂或用于与抗原结合的免疫检测的荧光剂,其用于在体外和
/
或体内使抗体与
m2
巨噬细胞或者可溶性或结合的
hucd163
蛋白的结合可视化
。
[0345]
放射性标记的非限制性实例包括例如,
32
p、
33
p、
43
k、
52
fe、
57
co、
64
cu、
67
ga、
67
cu、
68
ga、
71
ge、
75
br、
76
br、
77
br、
77
as、
77
br、
81
rb/
81m
kr、
87m
sr、
90
y、
97
ru、
99
tc、
99m
tc、
100
pd、
101
rh、
103
pb、
105
rh、
109
pd、
111
ag、
111
in、
113
in、
119
sb、
121
sn、
123
i、
125
i、
127
cs、
128
ba、
129
cs、
131
i、
131
cs、
143
pr、
153
sm、
161
tb、
166
ho、
169
eu、
177
lu、
186
re、
188
re、
189
re、
191
os、
193
pt、
194
ir、
197
hg、
199
au、
203
pb、
211
at、
212
pb、
212
bi
和
213
bi。
在一些实施方案中,使用抗体成像领域已知的常规化学将放射性标记附接至化合物
。
放射性标记的化合物可用于体外诊断技术和体内放射成像技术和放射免疫疗法
。
[0346]
在一些实施方案中,本文描述的抗体和抗原结合片段的组合物也用作非治疗剂
(
例如,作为亲和纯化剂
)。
[0347]
药物组合物和施用
[0348]
在某些实施方案中,本文公开了包含本文公开的抗体和药学上可接受的赋形剂的药物组合物
。
[0349]
在一些实施方案中,抗体包含具有与如
seq id no:28
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与如
seq id no:28
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与如
seq id no:28
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0350]
在一些实施方案中,抗体包含具有与如
seq id no:30
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与如
seq id no:30
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与如
seq id no:30
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0351]
在一些实施方案中,抗体包含具有与如
seq id no:32
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与如
seq id no:32
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与如
seq id no:32
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0352]
在一些实施方案中,抗体包含具有与如
seq id no:34
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与如
seq id no:34
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与如
seq id no:34
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0353]
在一些实施方案中,抗体包含具有与如
seq id no:36
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与如
seq id no:36
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与如
seq id no:36
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0354]
在一些实施方案中,抗体包含具有与如
seq id no:38
列出的氨基酸序列至少约
70
%相同的氨基酸序列的轻链可变结构域
(v
l
)。
在一些实施方案中,vl
具有与如
seq id no:38
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vl
具有与如
seq id no:38
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0355]
在一些实施方案中,抗体包含具有与如
seq id no:29
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与如
seq id no:29
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与如
seq id no:29
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0356]
在一些实施方案中,抗体包含具有与如
seq id no:31
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与如
seq id no:31
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与如
seq id no:31
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0357]
在一些实施方案中,抗体包含具有与如
seq id no:33
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与如
seq id no:33
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与如
seq id no:33
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0358]
在一些实施方案中,抗体包含具有与如
seq id no:35
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与如
seq id no:35
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与如
seq id no:35
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0359]
在一些实施方案中,抗体包含具有与如
seq id no:37
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与如
seq id no:37
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与如
seq id no:37
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0360]
在一些实施方案中,抗体包含具有与如
seq id no:39
列出的氨基酸序列至少约
70
%相同的氨基酸序列的重链可变结构域
(vh)。
在一些实施方案中,vh
具有与如
seq id no:39
列出的氨基酸序列至少约
75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列
。
在一些实施方案中,vh
具有与如
seq id no:39
列出的氨基酸序列
100
%相同的氨基酸序列
。
[0361]
在一些实施方案中,抗体包含具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%
、99
%或
100
%相同的氨基酸序列的轻链可变结构域
(v
l
)
:
seq id no:28、seq id no:30、seq id no:32、seq id no:34、seq id no:36、seq id no:38
和
seq id no:40
;和具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%
、99
%或
100
%相同的氨基酸序列的重链可变结构域
(vh)
:
seq id no:29、seq id no:31、seq id no:33、seq id no:35、seq id no:37、seq id no:39
和
seq id no:41
,条件是所述抗体不包含
seq id no:40
的轻链可变序列和
seq id no:41
的重链可变序列
。
在一些实施方案中,抗体的序列在
cdr h1、cdr h2、cdr h3、cdr l1、cdr l2
和
cdr l3
处
100
%相同
。
[0362]
在一些实施方案中,抗体包含具有与由以下组成的组中列出的氨基酸序列至少约
80
%相同的氨基酸序列的轻链可变结构域
(v
l
)
:
seq id no:28、seq id no:30、seq id no:32、seq id no:34、seq id no:36、seq id no:38、seq id no:40
;和具有与由以下组成的组中列出的氨基酸序列至少约
80
%相同的氨基酸序列的重链可变结构域
(vh)
:
seq id no:29、seq id no:31、seq id no:33、seq id no:35、seq id no:37、seq id no:39
和
seq id no:41
,条件是所述抗体不包含
seq id no:40
的轻链可变序列和
seq id no:41
的重链可变序列
。
在一些实施方案中,抗体的序列在
cdr h1、cdr h2、cdr h3、cdr l1、cdr l2
和
cdr l3
处
100
%相同
。
[0363]
在一些实施方案中,抗体包含具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr1
:
seq id no:1、seq id no:7
和
seq id no:13
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr2
:
seq id no:2、seq id no:9
和
seq id no:14
;和具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr3
:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15
;条件是所述抗体不包含以下中列出的序列:
seq id no:1、seq id no:2
和
seq id no:3。
[0364]
在一些实施方案中,抗体包含具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的轻链
cdr1
:
seq id no:1、seq id no:7
和
seq id no:13
;具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的轻链
cdr2
:
seq id no:2、seq id no:9
和
seq id no:14
;和具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的轻链
cdr3
:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15
;条件是所述抗体不包含以下中列出的序列:
seq id no:1、seq id no:2
和
seq id no:3。
[0365]
在一些实施方案中,抗体包含具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、
93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr1
:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr2
:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr3
:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27
;条件是所述抗体不包含以下中列出的序列:
seq id no:4、seq id no:5
和
seq id no:6。
[0366]
在一些实施方案中,抗体包含具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的重链
cdr1
:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的重链
cdr2
:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;具有与由以下组成的组中列出的氨基酸序列
100
%相同的氨基酸序列的重链
cdr3
:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27
;条件是所述抗体不包含以下中列出的序列:
seq id no:4、seq id no:5
和
seq id no:6。
[0367]
在一些实施方案中,抗体包含:
(a)
具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr1
:
seq id no:1、seq id no:7
和
seq id no:13
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr2
:
seq id no:2、seq id no:9
和
seq id no:14
;和具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr3
:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15
;和
(b)
具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr1
:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr2
:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr3
:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27
;条件是所述抗体不包含以下中列出的序列:
seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5
和
seq id no:6。
[0368]
在一些实施方案中,抗体包含:
(a)
具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、
92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr1
:
seq id no:1、seq id no:7
和
seq id no:13
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr2
:
seq id no:2、seq id no:9
和
seq id no:14
;和具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的轻链
cdr3
:
seq id no:3、seq id no:8、seq id no:10、seq id no:11、seq id no:12
和
seq id no:15
;和
(b)
具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr1
:
seq id no:4、seq id no:16、seq id no:19、seq id no:22
和
seq id no:25
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr2
:
seq id no:5、seq id no:17、seq id no:20、seq id no:23
和
seq id no:26
;具有与由以下组成的组中列出的氨基酸序列至少约
70
%
、75
%
、80
%
、81
%
、82
%
、83
%
、84
%
、85
%
、86
%
、87
%
、88
%
、89
%
、90
%
、91
%
、92
%
、93
%
、94
%
、95
%
、96
%
、97
%
、98
%或
99
%相同的氨基酸序列的重链
cdr3
:
seq id no:6、seq id no:18、seq id no:21、seq id no:24
和
seq id no:27
;条件是所述抗体不包含以下中列出的序列:
seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5
和
seq id no:6。
[0369]
这样的组合物可用于体外或体内分析,或者在药物组合物的情况下,用于体内或离体施用至受试者以用所公开的抗体治疗受试者
。
[0370]
在一些实施方案中,赋形剂是载体
、
缓冲液
、
稳定剂或本领域技术人员已知的其他合适的物质
。
这样的物质应是无毒性的并且不应干扰活性成分的功效
。
载体或其他物质的确切性质将取决于施用途径
。
[0371]
在一些实施方案中,包含通过本文描述的方法鉴定的抗体或抗原结合片段的药物制剂通过将具有期望纯度的蛋白与任选的生理学上可接受的载体
、
赋形剂或稳定剂混合
(
参见例如,
remington’s pharmaceutical sciences,
第
16
版
,osol,a.
编著
(1980))
,以冻干制剂或水性溶液的形式制备用于储存
。
可接受的载体或稳定剂是在所采用的剂量和浓度对接受者是无毒性的那些,并且包括:缓冲剂,诸如磷酸盐
、
柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂
(
诸如十八烷基二甲基苄基氯化铵;氯化六甲双铵;苯扎氯铵,苄索氯铵;苯酚
、
丁醇或苯甲醇;对羟基苯甲酸烷基酯,诸如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;
3-戊醇;和间甲酚
)
;低分子量
(
少于约
10
个残基
)
多肽;蛋白,诸如血清白蛋白
、
明胶或免疫球蛋白;亲水性聚合物,诸如聚乙烯基吡咯烷酮;氨基酸,诸如甘氨酸
、
谷氨酰胺
、
天冬酰胺
、
组氨酸
、
精氨酸或赖氨酸;单糖
、
二糖和其他糖类,包括葡萄糖
、
甘露糖或糊精;螯合剂,诸如
edta
;糖,诸如蔗糖
、
甘露醇
、
海藻糖或山梨醇;盐形成抗衡离子,诸如钠;金属络合物
(
例如,
zn-蛋白络合物
)
;和
/
或非离子表面活性剂,诸如或聚乙二醇
(peg)。
在某些实施方案中,药物组合物包含
5mg/ml-200mg/ml
之间的浓度的抗体;优选在
10mg/ml-100mg/ml
之间
。
[0372]
可接受的载体对施用的受试者是生理学上可接受的,并保留与其一起施用
/
在其
中施用的化合物的治疗特性
。
可接受的载体及其制剂一般描述于例如以下中:
remington’spharmaceutical sciences,
同上
。
一种示例性载体是生理盐水
。
如本文使用的措辞“药学上可接受的载体”意指药学上可接受的物质
、
组合物或媒介物,诸如液体或固体填充剂
、
稀释剂
、
赋形剂
、
溶剂或包封材料,参与将主题化合物从身体的一个器官或一部分的施用部位向身体的另一个器官或一部分运载或运输或在体外测定系统中运载或运输
。
在与制剂的其他成分相容并且对施用至的受试者无损伤的意义上,每种载体是“可接受的”。
可接受的载体也不应改变主题化合物的特定活性
。
[0373]
在另一种实施方案中,本文公开的药物组合物还包含可接受的添加剂,以改进组合物中化合物的稳定性和
/
或控制组合物的释放速率
。
可接受的添加剂不改变主题化合物的比活性
。
示例性的可接受的添加剂包括但不限于,糖,诸如甘露醇
、
山梨醇
、
葡萄糖
、
木糖醇
、
海藻糖
、
山梨糖
、
蔗糖
、
半乳糖
、
葡聚糖
、
右旋糖
、
果糖
、
乳糖及其混合物
。
在一些实施方案中,可接受的添加剂与可接受的载体和
/
或赋形剂诸如右旋糖组合
。
可选地,示例性的可接受的添加剂包括但不限于,表面活性剂,诸如聚山梨醇酯
20
或聚山梨醇酯
80
,以增加肽的稳定性并减少溶液的胶凝
。
在一些实施方案中,表面活性剂以溶液的
0.01
%至5%的量添加到组合物中
。
这样的可接受的添加剂的添加增加组合物在储存中的稳定性和半衰期
。
[0374]
在一种实施方案中,本文公开的药物组合物含有等渗缓冲剂诸如磷酸盐
、
乙酸盐或
tris
缓冲液,与张力剂诸如多元醇
、
山梨醇
、
蔗糖或氯化钠组合,其增加张度并进行稳定化
。
在一种实施方案中,张度剂以约5%的量存在于组合物中
。
[0375]
在另一种实施方案中,本文公开的药物组合物包含
0.01
%至
0.02
%
wt/vol
的表面活性剂,以便防止聚集并用于稳定化
。
[0376]
在另一种实施方案中,本文公开的药物组合物的
ph
范围为
4.5-6.5
或
4.5-5.5。
[0377]
在一些实施方案中,本文公开的药物组合物也含有被治疗的适应症所必需的多于一种活性化合物,诸如不会相互产生不利影响的具有互补活性的那些
。
例如,治疗方法还提供免疫抑制剂
。
这样的分子以对所意图的目的有效的量合适地组合存在
。
[0378]
在一些实施方案中,将活性成分包埋在例如通过凝聚技术或通过界面聚合制备的微胶囊中,例如分别包埋在羟甲基纤维素或明胶微胶囊和聚
(
甲基丙烯酸甲酯
)
微胶囊中,包埋在胶体药物递送系统
(
例如,脂质体
、
白蛋白微球
、
微乳液
、
纳米颗粒和纳米胶囊
)
或粗滴乳液中
。
这样的技术公开于以下中:
remington’s pharmaceutical sciences
,同上
。
[0379]
本文还设想了抗体的悬浮液和晶体形式;制备悬浮液和晶形的方法是本领域技术人员已知的
。
[0380]
在一些实施方案中,本文公开的药物组合物是无菌的
。
在一些实施方案中,本文公开的药物组合物通过常规
、
熟知的灭菌技术进行灭菌
。
例如,灭菌由通过无菌过滤膜过滤容易地完成
。
在一些实施方案中,将所得溶液包装用于使用或在无菌条件下过滤并冻干,在施用前将冻干制品与无菌溶液组合
。
[0381]
在一些实施方案中,采用冷冻干燥以稳定多肽用于长期储存,诸如当多肽在液体组合物中相对不稳定时
。
[0382]
在一些实施方案中,一些赋形剂,诸如,例如多元醇
(
包括甘露醇
、
山梨醇和甘油
)
;糖
(
包括葡萄糖和蔗糖
)
;和氨基酸
(
包括丙氨酸
、
甘氨酸和谷氨酸
)
,作为冷冻干燥产品的稳定剂
。
在一些实施方案中,多元醇和糖也用于保护多肽免受冷冻和干燥诱导的损伤,并增强
在干燥状态下储存期间的稳定性
。
在一些实施方案中,糖在冷冻干燥过程和储存期间都是有效的
。
其他类别的分子,包括单糖和二糖以及聚合物诸如
pvp
,也已被报道为冻干产品的稳定剂
。
[0383]
对于注射,在一些实施方案中,本文公开的药物组合物是适于与以上描述的适当溶液重构的粉末
。
这些的实例包括但不限于,冷冻干燥粉末
、
旋转干燥粉末或喷雾干燥粉末
、
无定形粉末
、
颗粒
、
沉淀物或微粒
。
对于注射,组合物任选地含有稳定剂
、ph
调节剂
、
表面活性剂
、
生物可利用度调节剂和这些的组合
。
[0384]
在一些实施方案中制备持续释放制品
。
持续释放制品的合适的实例包括含有抗体的固体疏水性聚合物的半透性基质,其中基质呈成型物品的形式,例如,膜或微胶囊
。
持续释放基质的实例包括聚酯
、
水凝胶
(
例如,聚
(
甲基丙烯酸-2-羟乙酯
)
或聚
(
乙烯醇
))、
聚丙交酯
(
参见例如,美国专利第
3,773,919
号
)、l-谷氨酸和
γ
乙基-l-谷氨酸的共聚物
、
不可降解的乙烯-乙酸乙烯酯
、
可降解的乳酸-乙醇酸共聚物诸如
lupron depot.tm.(
包括乳酸-乙醇酸共聚物和乙酸亮丙瑞林的可注射微球
)
和聚-d-(-)-3-羟基丁酸
。
聚合物诸如乙烯-乙酸乙烯酯和乳酸-乙醇酸使得分子释放能够超过
100
天,而某些水凝胶使蛋白释放较短的时间段
。
在一些实施方案中,虽然包封的抗体在体内长时间保留,但它们由于暴露于
37℃
的水分而变性或聚集,导致生物活性的损失和免疫原性的可能变化
。
在一些情况下,为稳定化设计的合理策略取决于所涉及的机制
。
例如,如果发现聚集机制是通过硫代-二硫化物交换形成分子间s‑‑s键,则在一些情况下通过修饰巯基残基
、
从酸性溶液冻干
、
控制水分含量
、
使用适当的添加剂和开发特定的聚合物基质组合物来实现稳定化
。
[0385]
在一些实施方案中,将本文公开的药物组合物设计为如本文描述的短效
、
快速释放
、
长效或持续释放
。
在一种实施方案中,将本文公开的药物组合物配制用于受控释放或用于缓慢释放
。
[0386]
药物组合物,例如,通过注射施用,包括但不限于,皮下
、
玻璃体内
、
皮内
、
静脉内
、
动脉内
、
腹膜内
、
脑脊内或肌内注射
。
本文设想了用于配制用于每种注射类型的组合物的赋形剂和载体
。
以下描述仅是实例性的,并不意在限制组合物的范围
。
用于注射的组合物包括但不限于,水性溶液
(
在水溶性的情况下
)
或分散体以及用于临时制备无菌的可注射溶液或分散体的无菌粉末
。
对于静脉内施用,合适的载体包括生理盐水
、
抑菌水
、cremophor el.tm.(basf,parsippany,n.j.)
或磷酸盐缓冲盐水
(pbs)。
在一些实施方案中,载体是含有例如水
、
乙醇
、
多元醇
(
例如,甘油
、
丙二醇和液体聚乙二醇等
)
及其合适的混合物的溶剂或分散介质
。
维持流动性,例如,通过使用包衣诸如卵磷脂,在分散体的情况下通过维持要求的粒径,以及通过使用表面活性剂
。
抗细菌剂和抗真菌剂包括,例如,对羟基苯甲酸酯
、
氯丁醇
、
苯酚
、
抗坏血酸和硫柳汞
。
在一些实施方案中,组合物中包含等渗剂,例如,糖
、
多元醇诸如甘露醇
、
山梨醇和氯化钠
。
在一些实施方案中,将所得的溶液包装用于原样使用或冻干;在一些实施方案中,冻干的制品以后在施用前在与无菌溶液组合
。
对于静脉内注射或在病变部位注射,活性成分将是不含热原且具有合适的
ph、
等渗性和稳定性的肠胃外可接受的水性溶液形式
。
本领域技术人员能够很好地使用,例如,等渗媒介物诸如氯化钠注射液
、
林格氏注射液或乳酸林格氏注射液制备合适的溶液
。
在一些实施方案中,按需要包含防腐剂
、
稳定剂
、
缓冲剂
、
抗氧化剂和
/
或其他添加剂
。
在一些实施方案中,无菌可注射溶液通过以下来制备:将所需量的活性成分根据需要与上文列举的成分中的一种或组合一起掺入适当的
溶剂中,然后过滤灭菌
。
通常,通过将活性成分掺入到包含基础分散介质和来自上文列举的那些的所需的其他成分的无菌媒介物中来制备分散体
。
在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥,其产生活性成分加上来自其先前无菌过滤的溶液的任何另外的所需成分的粉末
。
[0387]
在一些实施方案中,组合物常规地静脉内施用,例如,诸如通过注射单位剂量
。
对于注射,在一些实施方案中,活性成分是基本上不含热原且具有合适的
ph、
等渗性和稳定性的肠胃外可接受的水性溶液形式
。
在一些实施方案中,人们使用例如等渗媒介物
(
诸如氯化钠注射液
、
林格氏注射液
、
乳酸林格氏注射液
)
制备合适的溶液
。
在一些实施方案中,按需要包含防腐剂
、
稳定剂
、
缓冲剂
、
抗氧化剂和
/
或其他添加剂
。
另外地,在一些实施方案中,组合物经由气溶胶化施用
。(lahn
等人
,int arch allergy immunol 134:49-55(2004))。
[0388]
对于肠胃外施用,将抗体连同药学上可接受的肠胃外媒介物配制成单位剂量可注射形式
(
溶液
、
悬浮液
、
乳液
)。
这样的媒介物的实例是水
、
盐水
、
林格氏溶液
、
右旋糖溶液和5%人类血清白蛋白
。
也使用非水性媒介物诸如非挥发性油和油酸乙酯
。
脂质体用作载体
。
媒介物含有少量添加剂,诸如增强等渗性和化学稳定性的物质,例如缓冲剂和防腐剂
。
抗体通常以约
1mg/ml
至
10mg/ml
的浓度配制在这样的媒介物中
。
[0389]
在一种实施方案中,将本文公开的药物组合物冻干,例如,以增加储存中的保质期
。
当考虑将组合物用于本文提供的药物或任何方法时,在一些实施方案中,设想组合物基本上不含热原,使得组合物在施用至人类受试者时不会引起炎症反应或不安全的过敏反应
。
测试组合物的热原和制备基本上不含热原的组合物是本领域普通技术人员熟知的,并且在一些实施方案中使用可商购的试剂盒完成
。
[0390]
在一些实施方案中,可接受的载体含有稳定
、
增加或延迟吸收或清除的化合物
。
这样的化合物包括,例如,糖类,诸如葡萄糖
、
蔗糖或葡聚糖;低分子量蛋白;减少肽的清除或水解的组合物;或赋形剂或其他稳定剂和
/
或缓冲剂
。
延迟吸收的剂包括,例如,单硬脂酸铝和明胶
。
在一些实施方案中,去污剂也用于稳定或增加或降低药物组合物包括脂质体载体的吸收
。
为了防止消化,在一些实施方案中,将化合物与组合物复合,使其对酸水解和酶促水解具有抗性,或者在一些实施方案中,化合物复合在适当的抗性载体诸如脂质体中
。
保护化合物免于消化的方法是本领域已知的
。
[0391]
在一些实施方案中,组合物以与剂量制剂相容的方式并以治疗有效量施用
。
待施用的量取决于待治疗的受试者
、
受试者的免疫系统利用活性成分的能力以及期望的结合能力的程度
。
待施用的需要的活性成分的精确量取决于专业人员的判断并且对每个个体是独特的
。
初始施用和加强注射的合适方案也是可变的,但以初始施用随后通过后续注射或其他施用以一个或更多个小时的间隔重复给药为典型
。
可选地,设想了足以在血液中维持浓度的连续静脉内输注
。
[0392]
在一些实施方案中,本公开内容提供了本文描述的组合物制备用于治疗本文描述的状况
、
疾病或紊乱的药物的用途
。
在一些实施方案中,药物基于需要治疗的受试者的身体特征配制,并且基于状况
、
疾病或紊乱的阶段配制为单一或多于一种制剂
。
在一些实施方案中,药物被包装在具有适当标签的合适的包装中用于向医院和诊所分配,其中标签用于指示治疗患有本文描述的疾病的受试者
。
在一些实施方案中,药物被包装为单一或多于一种单位
。
在一些实施方案中,组合物的剂量和施用的说明书与包装一起如以下描述地被包含
。
本公开内容还涉及包含本文描述的抗体或其抗原结合片段和药学上可接受的载体的药物
。
[0393]
在一些实施方案中,变化因素包括组合物中活性成分的量
、
组合物配方和施用方式,以提供对实现每个受试者期望的治疗响应有效的而不对受试者有过度毒性的活性成分的量
。
所选的剂量水平将取决于各种因素,包括采用的特定化合物的活性
、
施用途径
、
施用时间
、
采用的特定化合物的排泄或代谢率
、
治疗的持续时间
、
与采用的特定组合物组合使用的其他药物
、
化合物和
/
或物质
、
被治疗的受试者的年龄
、
性别
、
体重
、
状况
、
一般健康
、
饮食
、
和先前病史以及医学领域中熟知的类似的因素
。
[0394]
在一些实施方案中,将本文描述的抗体和抗原结合片段以不同剂量并在不同时间框架内施用至受试者
。
非限制性剂量包括约
0.01mg/kg、
约
0.05mg/kg、
约
0.1mg/kg、
约
0.5mg/kg、
约
1mg/kg、
约
5mg/kg、
约
10mg/kg、
约
20mg/kg、
约
30mg/kg、
约
40mg/kg、
约
50mg/kg、
约
60mg/kg、
约
70mg/kg、
约
80mg/kg、
约
90mg/kg、
约
100mg/kg、
约
125mg/kg、
约
150mg/kg、
约
175mg/kg、
约
200mg/kg
或其间的任何整数
。
另外地,在一些实施方案中,抗体或抗原结合片段的一种或更多种剂量被一周两次
、
每周一次
、
每两周一次
、
每三周一次
、
每4周一次
、
每6周一次
、
每8周一次
、
每
12
周一次或其中任何几周的组合施用
。
还设想了给药周期,诸如,例如,每周一次或两次施用抗体或其抗原结合片段持续4周,然后两周不进行治疗
。
本公开内容内也设想了另外的给药周期,包括,例如,本文描述的剂量和周周期的不同组合
。
[0395]
在一些实施方案中,组合物的治疗有效量是变化的并取决于疾病的严重程度和被治疗的受试者的体重和一般状态,但一般范围为每次应用约
1.0
μ
g/kg
至约
100mg/kg
体重
、
或约
10
μ
g/kg
至约
30mg/kg
,或约
0.1mg/kg
至约
10mg/kg
或约
1mg/kg
至约
10mg/kg。
取决于对紊乱或状况的响应和受试者对治疗的耐受性,根据需要施用可以是每日一次
、
数日一次
、
每周一次
、
每月两次
、
每月一次或更高或更低的频繁
。
在一些实施方案中,需要在较长的时间段内维持剂量,诸如4周
、5
周
、6
周
、7
周
、8
周
、10
周或
12
周或更长时间,直到出现对紊乱症状的期望抑制,并且根据需要调整剂量
。
该疗法的进展容易通过常规技术和测定监测
。
[0396]
在一些实施方案中,本公开内容的抗体在生理溶液中以范围在
0.01mg/kg
至
100mg/kg
之间的剂量
、
以范围在每日一次至每周一次至每月一次的频率
(
例如,每日一次
、
每两日一次
、
每三日一次,或每周2次
、3
次
、4
次
、5
次或6次
)
静脉内施用,优选地剂量范围为
0.1mg/kg
至
45mg/kg、0.1mg/kg
至
15mg/kg、
或
0.1mg/kg
至
10mg/kg
,以每周2次或3次的频率,或最多
45mg/kg
每月一次
。
[0397]
当受试者经历疾病的病征或症状的部分或全部缓解或减轻并特别地包括但不限于存活期的延长时,响应被实现
。
取决于包括复发次数
、
疾病阶段和其他因素的预后因素,预期的无进展存活时间例如以数月至数年测量
。
延长存活期包括但不限于至少1个月
(mo)、
约至少2个月
(mo)、
约至少3个月
、
约至少4个月
、
约至少6个月
、
约至少1年
、
约至少2年
、
约至少3年或更长的时间
。
在一些实施方案中,总存活期也以数月至数年测量
。
在一些实施方案中,受试者的症状保持静态或减少
。
[0398]
在一些情况下,本领域具有普通技术的医师或兽医容易地确定和规定所需组合物的有效量
(ed
50
)。
例如,医师或兽医可以以低于实现期望的治疗效果所需水平的水平开始组合物中采用的化合物的剂量,并逐渐增加剂量直到实现期望的效果
。
可选地,在一些实施方案中剂量保持恒定
。
[0399]
在一些实施方案中,组合物
(
本文描述的抗体或抗原结合片段
)
根据待治疗的状况
单独施用或与第二组合物组合同时或顺序施用
。
在一种实施方案中,第二治疗性治疗是纤维化疗法
(fibrosis therapy)
或纤维化治疗
(fibrosis therapeutic)。
在一种实施方案中,第二治疗性治疗是与纤维化相关的疾病或紊乱的治疗,诸如感染
、
自身免疫性疾病或紊乱
、
炎性疾病或紊乱或机械损伤
。
当施用两种或更多种组合物时,组合物,例如,以组合
(
顺序或同时
)
施用
。
在一些实施方案中,组合物以单剂量或多于一次剂量施用
。
[0400]
在一些实施方案中,当配制用于向人类受试者施用时,组合物被配制为不含热原
。
测试组合物的热原和制备不含热原的药物组合物是本领域普通技术人员熟知的
。
[0401]
在一些实施方案中,抗体或其抗原结合片段被配制为用于向受试者以任何合适的途径施用,包括但不限于注射
。
注射包括,例如,皮下注射
、
腹膜注射
、
静脉内注射
、
肌内注射或脊髓注射到脑脊液
(csf)
中
。
在一些实施方案中,在一个
、
二个
、
三个
、
四个
、
五个
、
六个
、
七个或更多个注射部位施用
。
在一种实施方案中,经由六个注射部位施用
。
[0402]
对于体内应用,接触例如经由以任何合适的方式向受试者施用组合物
(
诸如本文描述的
)
发生
。
在一些实施方案中,本文描述的抗体通过任何合适的方式全身或局部施用,包括经由肠胃外
、
皮下
、
腹膜内
、
脑脊内
、
肺内和鼻内施用,并且如果期望局部治疗,则病灶内施用
。
肠胃外途径包括,例如,静脉内
、
动脉内
、
腹膜内
、
硬膜外
、
肌内和鞘内施用
。
在一些实施方案中,这样的施用是如推注
(bolus)、
连续输注或脉冲输注
。
在一些实施方案中,部分地取决于施用是短暂的还是长期的,组合物通过注射被施用
。
设想了施用方法的其他方式,包括表面施用,特别是经皮
、
经粘膜
、
直肠
、
口服或局部施用,例如,通过放置在期望部位附近的导管
。
[0403]
抗体技术
[0404]
如本领域技术人员将理解的,本文的抗体及其制备和使用方法的一般描述也适用于个体抗体多肽成分和抗体片段
。
[0405]
本公开内容的抗体是多克隆抗体或单克隆抗体
。
然而,在优选的实施方案中,它们是单克隆的
。
在特定实施方案中,本公开内容的抗体是人类抗体
。
产生多克隆抗体和单克隆抗体的方法是本领域已知的
。
[0406]
在一些实施方案中,测试使用这样的方法产生的结合由
m2
巨噬细胞表达的
hucd163
的抗体
、
抗原结合片段和其他蛋白的结合亲和力
、
亲合力和调节能力中的一种或更多种
。
[0407]
在一些实施方案中,利用常规方法来鉴定与
hucd163
蛋白结合的抗体或其抗原结合片段
。
在一些实施方案中,评估抗体和抗原结合片段的结合亲和力
、
结合速率
、
解离速率和亲合力中的一种或更多种
。
这样的参数的测量,例如,使用包括但不限于以下的测定来完成:酶联免疫吸附测定
(elisa)、elispot
测定
、scatchard
分析
、
表面等离子体共振
(
例如,
biacore)
分析等
、
竞争结合测定等等
。
在一种非限制性实施方案中,
elisa
测定用于测量与
hucd163
蛋白结合的特定抗体或抗原结合片段的结合能力
。liljeblad
等人
glyco j 17:323-9(2000)
描述了一种表面等离子体共振技术
。
[0408]
在一些实施方案中,使用本领域可用的载体和方法重组产生根据本公开内容的抗体,如以下进一步描述的
。
在一些实施方案中,人类抗体也通过体外活化的b细胞产生
(
参见美国专利第
5,567,610
号和第
5,229,275
号
)。
[0409]
在一些实施方案中,人类抗体在能够在不存在内源性免疫球蛋白产生的情况下产
生完整的人类抗体库的转基因动物
(
例如,小鼠
)
中产生
。
例如,已描述,在嵌合和种系突变小鼠中的抗体重链连接区
(jh)
基因的纯合缺失导致内源性抗体产生的完全抑制
。
将人类种系免疫球蛋白基因阵列转移到这样的种系突变小鼠中导致在抗原攻击时产生人类抗体
。
参见例如
jakobovits
等人,
proc natl acad sci usa,90:2551(1993)
;
jakobovits
等人,
nature 362:255-58(1993)
;
bruggemann
等人,
year in immunol.,7:33(1993)
;美国专利第
5,545,806
号
、
第
5,569,825
号
、
第
5,591,669
号;美国专利第
5,545,807
号;和
wo 97/17852。
在一些实施方案中,这样的动物被遗传工程化以产生包含本公开内容的多肽的人类抗体
。
[0410]
例如,使用本领域已知的方法,诸如通过饱和硫酸铵沉淀
、
优球蛋白沉淀方法
、
己酸方法
、
辛酸方法
、
离子交换色谱法
(deae
或
de52)
,或使用抗
ig
柱或蛋白
a、g
或
l
柱的亲和色谱法,从培养物上清液或腹水
(
如果在动物中产生抗体
)
分离和纯化抗体
。
[0411]
如以上所述,本公开内容还提供了抗体片段
。
在某些情况下,使用抗体片段而不是完整抗体具有优势
。
例如,在一些实施方案中,较小尺寸的片段允许快速清除,并导致对某些组织诸如器官
(
例如,肺
、
肾
、
肝或心脏
)
的改进的接近
。
抗体片段的实例包括:
fab、f(ab’)、f(ab’)2和
fv
片段;双抗体;线性抗体;单链抗体和由抗体片段形成的多特异性抗体
。
[0412]
已经开发了各种技术来产生抗体片段
。
传统上,这些片段是经由完整抗体的蛋白水解消化获得的
(
参见例如,
morimoto
等人,
j biochem biophys methods 1992 24(1-2):107-17
;和
brennan
等人,
science 1985 229:81)。
然而,在一些实施方案中,这些片段现在由重组宿主细胞直接产生
。
在一些实施方案中,
fab、fv
和
scfv
抗体片段都在大肠杆菌
(e.coli)
中表达并从大肠杆菌分泌,从而允许这些片段的大量的容易的产生
。
在一些实施方案中,
f(ab’)-sh
片段直接从大肠杆菌回收并化学偶联以形成
f(ab’)2片段
(carter
等人
,bio/technology 10:163-167(1992))。
根据另一种方法,在一些实施方案中,
f(ab’)2片段直接从重组宿主细胞培养物分离
。
包含取自
igg
的
fc
区的ch2结构域的两个环的补救受体结合表位的具有增加的体内半衰期的
fab
和
f(ab’)2片段描述于美国专利第
5,869,046
和第
6,121,022
号中
。
用于产生抗体片段的其他技术对技术人员将是明显的
。
[0413]
在其他实施方案中,选择的抗体是单链
fv
片段
(scfv)。
参见
wo 93/16185
;美国专利第
5,571,894
号;和第
5,587,458
号
。fv
和
sfv
是不含恒定区的具有完整结合位点
(combining sites)
的仅有的物质
。
因此,它们适于在体内使用期间减少非特异性结合
。
在一些实施方案中,构建
sfv
融合蛋白以在
sfv
的氨基末端或羧基末端产生效应蛋白的融合
。
参见
antibody engineering
,编著
borrebaeck
,同上
。
在一些实施方案中,抗体片段是“线性抗体”,例如,如例如美国专利第
5,641,870
号中描述的
。
在一些实施方案中,这样的线性抗体片段是单特异性或双特异性的
。
[0414]
用于制备双特异性或其他多特异性抗体的方法是本领域已知的,并且包括化学交联
、
亮氨酸拉链的使用
(kostelny
等人,
j immunol 148:1547-53(1992))
;双抗体技术
(hollinger
等人,
proc natl acad sci usa 90:6444-8(1993))
;
scfv
二聚体
(gruber
等人,
j immunol 152:5368(1994))
,线性抗体
(zapata
等人,
protein eng 8:1057-62(1995))
;和螯合重组抗体
(neri
等人,
jmol biol 246:367-73(1995))。
[0415]
全长双特异性抗体的传统产生是基于两条免疫球蛋白重链-轻链对的共表达,其中两条链具有不同的特异性
(millstein
等人,
nature 305:537-9(1983))。
由于免疫球蛋白重链和轻链的随机组合,这些杂交瘤
(
四源杂交瘤
)
产生十种不同抗体分子的潜在混合物,
其中只有一种具有正确的双特异性结构
。
对正确分子的纯化,例如,通过亲和色谱法完成
。
类似的程序公开于
wo 93/08829
中和
traunecker
等人,
embo j 10:3655-9(1991)
中
。
[0416]
根据不同的方法,具有期望的结合特异性
(
抗体-抗原结合位点,
antibody-antigen combining sites)
的抗体可变区与免疫球蛋白恒定结构域序列融合
。
优选地,融合是与
ig
重链恒定结构域,包含至少部分的铰链
、c
h2区和ch3区
。
优选的是,第一重链恒定区
(ch1)
包含用于轻链键合所需的位点,存在于至少一种融合中
。
将编码免疫球蛋白重链融合体和
(
如果期望
)
免疫球蛋白轻链的
dna
插入到单独的表达载体中,并共转染到合适的宿主细胞中
。
当构建中使用的四条多肽链的不相等比率提供期望的双特异性抗体的最佳产率时,这为在实施方案中调整四种多肽片段的相互比例方面提供了更大的灵活性
。
然而,当至少两条多肽链以相等比率的表达导致高产率或当该比率对期望的链组合的产率没有显著影响时,可以将两条或所有四条多肽链的编码序列插入到单个表达载体中
。
[0417]
双特异性抗体由例如一臂中具有第一结合特异性的杂合免疫球蛋白重链和另一臂中的杂合免疫球蛋白重链-轻链对
(
提供第二结合特异性
)
组成
。
这种不对称结构有助于从不需要的免疫球蛋白链组合分离期望的双特异性化合物,因为仅在双特异性分子的一半中存在免疫球蛋白轻链,提供了容易的分离方式
。
该方法公开于
wo 94/04690
中
。
关于产生双特异性抗体的进一步细节,参见例如
suresh
等人,
methods enzymol 121:210(1986)。
[0418]
在一些实施方案中,根据美国专利第
5,731,168
号中描述的另一种方法,将一对抗体分子之间的界面工程化,以使从重组细胞培养物回收的异源二聚体的百分比最大化
。
优选的界面包含ch3结构域的至少一部分
。
在该方法中,来自第一抗体分子的界面的一个或更多个小氨基酸侧链被较大的侧链
(
例如,酪氨酸或色氨酸
)
替换
。
通过用较小的氨基酸侧链
(
例如,丙氨酸或苏氨酸
)
替换大氨基酸侧链,在第二抗体分子的界面上产生与大侧链相同或相似尺寸的补偿“腔”。
这提供了增加异源二聚体而不是其他不需要的终产物诸如同源二聚体的产率的机制
。
[0419]
双特异性抗体包括交联或“异源缀合”抗体
。
例如,异源缀合物中的抗体中的一个与亲和素偶联,另一个与生物素偶联
。
例如,已提出这样的抗体将免疫系统细胞靶向不需要的细胞
(
美国专利第
4,676,980
号
)
,并用于治疗
hiv
感染
(wo 91/00360、wo 92/20373
和
ep 03089)。
在一些实施方案中,使用任何方便的交联方法制备异源缀合抗体
。
合适的交联剂是本领域熟知的,并且与一些交联技术一起公开于美国专利第
4,676,980
号中
。
另一种方法设计为通过在
scfv
的c末端添加链霉抗生物素蛋白编码序列来制备四聚体
。
链霉抗生物素蛋白由四个亚基组成,因此当
scfv-链霉抗生物素蛋白折叠时,四个亚基缔合以形成四聚体
(kipriyanov
等人,
hum antibodies hybridomas 6(3):93-101(1995))。
[0420]
在一些实施方案中,根据用于制备双特异性抗体的另一种方法,将一对抗体分子之间的界面工程化,以便使从重组细胞培养物回收的异源二聚体的百分比最大化
。
一种界面包含抗体恒定结构域的ch3结构域的至少一部分
。
在该方法中,来自第一抗体分子的界面的一个或更多个小氨基酸侧链被较大的侧链
(
例如,酪氨酸或色氨酸
)
替换
。
通过用较小的氨基酸侧链
(
例如,丙氨酸或苏氨酸
)
替换大氨基酸侧链,在第二抗体分子的界面上产生与大侧链相同或相似尺寸的补偿“腔”。
这提供了增加异源二聚体而不是其他不需要的终产物诸如同源二聚体的产率的机制
。
参见
wo 96/27011。
[0421]
文献中也描述了用于从抗体片段产生双特异性抗体的技术
。
例如,使用化学连接
制备双特异性抗体
。brennan
等人,
science 229:81(1985)
描述了一种程序,其中完整的抗体被蛋白水解裂解以产生
f(ab’)2片段
。
这些片段在存在二硫醇复合剂亚砷酸钠的情况下被还原,以稳定邻位二硫醇,并防止分子间二硫化物的形成
。
然后将产生的
f(ab’)
片段转化为硫代硝基苯甲酸酯
(tnb)
衍生物
。
然后通过用巯基乙胺还原将
f(ab’)-tnb
衍生物中的一种重新转化为
f(ab’)-硫醇,并与等摩尔量的另一种
f(ab’)-tnb
衍生物混合以形成双特异性抗体
。
在一些实施方案中,产生的双特异性抗体用作用于酶的选择性固定的剂
。
[0422]
最近的进展促进了
f(ab’)-sh
片段从大肠杆菌的直接回收,
f(ab’)-sh
片段被例如化学偶联以形成双特异性抗体
。shalaby
等人,
j exp med 175:217-25(1992)
描述了人源化双特异性抗体
f(ab’)2分子的产生
。
每种
f(ab’)
片段由大肠杆菌单独分泌,并经历体外定向化学偶联以形成双特异性抗体
。
由此形成的双特异性抗体能够与过表达
erbb2
受体的细胞和正常人类
t
细胞结合,以及触发人类细胞毒性淋巴细胞针对人类乳腺肿瘤靶的裂解活性
。
[0423]
还描述了直接从重组细胞培养物制备和分离双特异性抗体片段的各种技术
。
例如,已经使用亮氨酸拉链来产生双特异性抗体
。kostelny
等人,
j immunol 148(5):1547-53(1992)。
来自
fos
和
jun
蛋白的亮氨酸拉链肽通过基因融合连接至两种不同抗体的
f(ab’)
部分
。
抗体同源二聚体在铰链区被还原以形成单体,并且然后再氧化以形成抗体异源二聚体
。
在一些实施方案中,该方法用于产生抗体同源二聚体
。
[0424]
抗体的鉴定和制备
[0425]
在一些实施方案中,编码抗体
、
其可变区或其抗原结合片段的多核苷酸序列使用常规测序技术来确定,并被亚克隆到表达载体中以用于抗体的重组产生
。
这通过以下来完成:从受试者的血液获得单个核细胞;从单个核细胞产生b细胞克隆;将b细胞诱导成为产生抗体的浆细胞;并筛选浆细胞产生的上清液以确定其是否包含抗体
。
在一些实施方案中,使用类似方法完成对具有本公开内容的抗体的特异性的其他抗体的鉴定
。
例如,在鉴定出产生抗体的b细胞克隆后,进行逆转录聚合酶链式反应
(rt-pcr)
以克隆编码抗体可变区或其部分的
dna。
然后将这些序列亚克隆到适于重组产生人类抗体的表达载体中
。
在一些实施方案中,通过确定抗体结合
m2
细胞或表达由
m2
细胞表达的人类
cd163
多肽的其他细胞的能力来确认结合特异性
。
[0426]
在本文描述的方法的特定实施方案中,对从外周血或淋巴结分离的b细胞进行分选,例如,基于它们是
cd19
阳性的,并在例如
96
孔
、384
孔或
1536
孔配置中,以例如低至每个孔单细胞特异性铺板
。
细胞被诱导以分化为产生抗体的细胞,例如浆细胞,并收获培养物上清液,并使用例如
fmat
或
facs
分析来测试与在其表面上表达靶多肽的细胞的结合
。
然后阳性孔经历全孔
rt-pcr
以扩增由克隆子代浆细胞表达的
igg
分子的重链可变区和轻链可变区
。
将所得的编码重链可变区和轻链可变区或其部分的
pcr
产物亚克隆到人类抗体表达载体中用于重组表达
。
然后测试所得重组抗体以确认其原始结合特异性,并在一些实施方案中进一步测试针对其他细胞或蛋白的交叉反应性
。
[0427]
因此,在一种实施方案中,鉴定抗体的方法如下实施
。
首先,将全长或约全长的
cd163cdna
转染到细胞系中用于表达
cd163
多肽
。
其次,测试个体人类血浆或血清样品中结合细胞表达的多肽的抗体
。
并且最后,表征源自血浆或血清阳性个体的
mab
与相同细胞表达的
cd163
多肽的结合
。
此时在一些实施方案中对
mab
的精细特异性进行进一步确定
。
[0428]
在一些实施方案中,根据本领域可用的方法和本文描述的方法包括使用对人类抗
体多肽的保守区特异的引物通过聚合酶链式反应进行扩增,从表达抗体的细胞分离编码本公开内容的抗体或其部分的多核苷酸
。
例如,根据描述于以下的分子生物学技术,从b细胞克隆轻链和重链可变区:
wo 92/02551
;美国专利第
5,627,052
号;或
babcook
等人,
proc natl acad sci usa 93:7843-48(1996)。
在某些实施方案中,对编码由表达抗体的克隆子代浆细胞表达的
igg
分子的重链可变区和轻链可变区两者的所有或一部分的多核苷酸进行亚克隆和测序
。
在一些实施方案中,所编码的多肽的序列根据多核苷酸序列容易地被确定
。
[0429]
使用本领域已知的程序和本文描述的程序,将编码本公开内容的多肽的分离的多核苷酸亚克隆到表达载体中,以重组产生本公开内容的抗体和多肽
。
[0430]
在一些实施方案中,抗体
(
或其片段
)
与
cd163
多肽或
m2
细胞的结合特性一般使用免疫检测方法来确定和评估,包括,例如,基于免疫荧光的测定,诸如免疫组织化学
(ihc)
和
/
或荧光激活细胞分选
(facs)。
在一些实施方案中,免疫测定方法包括对照和程序以确定抗体是否与
cd163
多肽或
m2
巨噬细胞特异性结合,并且不识别对照细胞,例如,
m1
细胞,或被转染以表达对照蛋白的宿主细胞或与它们交叉反应
。
[0431]
在血清预筛选以鉴定产生针对
cd163
多肽或针对
m2
巨噬细胞的抗体的患者后,本公开内容的方法通常包括从先前从患者或受试者获得的生物样品分离或纯化b细胞
。
在一些实施方案中,患者或受试者当前或之前已被诊断为患有或怀疑患有纤维化,或者患者或受试者被认为没有纤维化
。
通常,患者或受试者是哺乳动物,并且在特定实施方案中是人类
。
在一些实施方案中,生物样品是包含b细胞的任何样品,包括但不限于,纤维化组织
、
淋巴结或淋巴结组织
、
胸腔积液
、
外周血
、
腹水或脑脊液
(csf)。
在一些实施方案中,b细胞从不同类型的生物样品分离,诸如纤维化组织的活检或受纤维化影响的其他生物样品
。
然而,在一些实施方案中,应理解包含b细胞的任何生物样品用于本公开内容的任何实施方案
。
[0432]
分离后,b细胞被诱导以产生抗体,例如,通过在支持b细胞增殖或发育成浆细胞
(plasmacyte)、
浆母细胞或浆细胞
(plasma cell)
的条件下培养b细胞
。
然后筛选抗体,通常使用高通量技术,以鉴定与靶抗原例如特定组织
、
细胞或多肽特异性结合的抗体
。
在某些实施方案中,特异性抗原,例如,抗体结合的细胞表面多肽是未知的,而在其他实施方案中,抗体特异性结合的抗原是已知的
。
[0433]
在一些实施方案中,根据本公开内容,b细胞通过本领域已知和可用的任何方式从生物样品例如,组织
、
外周血或淋巴结样品或纤维化组织分离
。b
细胞通常基于其表面存在b细胞特异性标志物
(
例如,
cd19、cd138
和
/
或表面
igg)
通过
facs
进行分选
。
然而,在一些实施方案中采用本领域已知的其他方法,诸如,例如,使用
cd19
磁珠或
igg
特异性磁珠进行柱纯化,然后从柱洗脱
。
然而,在一些实施方案中,利用任何标志物对b细胞进行磁分离导致某些b细胞的损失
。
因此,在某些实施方案中,不分选分离的细胞,而是将从纤维化组织分离的
ficoll
纯化的单个核细胞直接铺板至每孔适当或期望数量的特异性
。
[0434]
为了鉴定产生抗体的b细胞,b细胞通常以低密度
(
例如,每孔单个细胞特异性,每孔
1-10
个细胞,每孔
10-100
个细胞,每孔
1-100
个细胞,每孔少于
10
个细胞,或每孔少于
100
个细胞
)
在多孔板或微量滴定板中,例如,在
96
孔
、384
孔或
1536
孔配置中铺板
。
在一些实施方案中,当b细胞以每孔多于一个细胞的密度初始铺板时,则本公开内容的方法包括随后稀释被鉴定为产生抗原特异性抗体的孔中的细胞直至达到每孔单个细胞特异性的步骤,从而有助于鉴定产生抗原特异性抗体的b细胞
。
在一些实施方案中,将细胞上清液或其一部分
和
/
或细胞冷冻并储存用于将来的测试和之后抗体多核苷酸的回收
。
[0435]
在某些实施方案中,b细胞在有利于b细胞产生抗体的条件下培养
。
例如,在有利于b细胞增殖和分化的条件下培养b细胞,以得到产生抗体的浆母细胞
、
浆细胞
(plasmacyte)
或浆细胞
(plasma cell)。
在特定实施方案中,在存在b细胞有丝分裂原诸如脂多糖
(lps)
或
cd40
配体的情况下培养b细胞
。
在一种特定实施方案中,通过将b细胞与饲养细胞和
/
或其他b细胞活化剂诸如
cd40
配体一起培养,使b细胞分化为产生抗体的细胞
。
[0436]
在一些实施方案中,使用本领域可用的常规方法,包括本文描述的那些,测试细胞培养物上清液或从其获得的抗体与靶抗原结合的能力
。
在特定实施方案中,使用高通量方法测试培养物上清液中与靶抗原结合的抗体的存在
。
例如,b细胞在多孔微量滴定皿中培养,使得使用机器人板处理器用于同时对多于一个细胞上清液进行采样,并测试与靶抗原结合的抗体的存在
。
在特定的实施方案中,抗原与珠
(
例如,顺磁性珠或胶乳珠
)
结合以促进抗体
/
抗原复合物的捕获
。
在其他实施方案中,抗原和抗体被荧光标记
(
用不同的标记
)
并且进行
facs
分析以鉴定与靶抗原结合的抗体的存在
。
在一种实施方案中,使用
fmat
tm
分析和仪器
(applied biosystems,foster city,calif.)
确定抗体结合
。fmat
是用于高通量筛选的荧光宏观共聚焦平台,其使得能够使用活细胞或珠进行混合及读取
、
非放射性测定
。
[0437]
在比较抗体与特定靶抗原
(
例如,生物样品诸如病变组织或细胞
、
纤维化组织或细胞或感染原
)
的结合和抗体与对照样品
(
例如,生物样品诸如正常细胞
、
来自另一物种的比较细胞
(comparator cells)、
不同纤维化组织或细胞
、
不同组织或细胞或不同感染原
)
的结合时,在一些实施方案中,如果与结合对照样品的量相比,与特定靶抗原结合的抗体多至少两倍
、
至少三倍
、
至少五倍或至少十倍,则认为抗体优先结合特定靶抗原
。
[0438]
在一些实施方案中,编码抗体链
、
其可变区或其片段的多核苷酸利用本领域可用的任何手段从细胞分离
。
在一种实施方案中,使用本领域可用的常规程序使用寡核苷酸引物利用聚合酶链式反应
(pcr)
例如逆转录
pcr(rt-pcr)
来分离多核苷酸,该寡核苷酸引物与重链或轻链编码多核苷酸序列或其互补物特异性结合
。
在一种实施方案中,阳性孔经历全孔
rt-pcr
以扩增由克隆子代浆细胞表达的
igg
分子的重链可变区和轻链可变区
。
在一些实施方案中,根据本领域的常规程序,对这些
pcr
产物测序,并且然后将编码重链可变区和轻链可变区或其部分的产物亚克隆到人类抗体表达载体中,并重组表达
(
参见例如,美国专利第
7,112,439
号
)。
在一些实施方案中,编码如本文描述的
m2
巨噬细胞特异性抗体或其片段的核酸分子根据用于核酸切下
、
连接
、
转化和转染的各种熟知程序中的任何进行增殖和表达
。
因此,在某些实施方案中,抗体片段的表达优选在原核宿主细胞诸如大肠杆菌中
(
参见例如,
pluckthun
等人,
methods enzymol 178:497-515(1989))。
在某些其他实施方案中,抗体或其抗原结合片段的表达优选在真核宿主细胞诸如酵母
(
例如,酿酒酵母
(saccharomyces cerevisiae)、
粟酒裂殖酵母
(s.pombe)、
巴斯德毕赤酵母
(pichia pastoris))
;动物细胞
(
包括哺乳动物细胞
)
或植物细胞中
。
合适的动物细胞的实例包括但不限于,骨髓瘤
、cos、cho
或杂交瘤细胞
。
植物细胞的实例包括烟草细胞
、
玉米细胞
、
大豆细胞和水稻细胞
。
在一些实施方案中,通过本领域普通技术人员已知的方法并基于本公开内容,设计用于在特定宿主系统中表达外源序列的核酸载体,并且然后将编码
m2
巨噬细胞特异性抗体
(
或其片段
)
的多核苷酸序列插入
。
调节元件将根据特定宿主而变化
。
[0439]
在一些实施方案中,包含编码可变区和
/
或恒定区的多核苷酸的一种或更多种可
复制表达载体被制备并用于转化适当的细胞系,例如,非生产骨髓瘤细胞系诸如小鼠
nso
系,或者细菌诸如大肠杆菌,其中将发生抗体的产生
。
为了获得有效的转录和翻译,每个载体中的多核苷酸序列应包含适当的调节序列,特别是可操作地连接至可变区序列的启动子和前导序列
。
[0440]
以这种方式产生抗体的特定方法一般是熟知的并被常规使用
。
例如,
sambrook
等人,
molecular cloning,a laboratory manual,
第2版,
cold spring harbor laboratory,new york,1989
描述了分子生物学程序;还参见
sambrook
等人,第3版,
cold spring harbor laboratory,new york,(2001)。
虽然不是必需的,但在某些实施方案中,对编码重组抗体的多核苷酸区域测序
。dna
测序例如以本领域已知的任何方式或使用本领域已知的任何系统进行
。
基本测序技术描述于例如
sanger
等人,
proc natl acad sci usa 74:5463(1977))
和
amersham international plc
测序手册中并且包括其改进
。
[0441]
在特定实施方案中,然后测试所得重组抗体或其片段以确认其原始特异性,并在一些实施方案中进一步测试交叉反应性,例如与相关多肽的交叉反应性
。
在特定实施方案中,使用常规方法测试根据本文描述的方法鉴定或产生的抗体的内化能力或其他效应子功能
。
[0442]
包装
、
试剂盒和预填充容器
[0443]
本文还提供了包含一种或更多种以上描述的化合物的试剂盒
。
在一些实施方案中,试剂盒在合适的容器装置中包含如本文描述的抗体或其抗原结合片段
。
[0444]
在一些实施方案中,提供了包含本文描述的组合物的容器装置
。
在一些实施方案中,容器装置是容纳例如液体或冻干组合物的任何合适的容器,包括但不限于小瓶
、
注射器
、
瓶
、
静脉内
(iv)
袋或安瓿
。
在一些实施方案中,注射器容纳适于注射到受试者体内的任何体积的液体,包括但不限于
0.5cc、1cc、2cc、5cc、10cc
或更多
。
[0445]
本文提供了试剂盒,其包含本文描述的一种组合物或更多种组合物
。
在一些实施方案中,本文提供了用于治疗患有纤维化的受试者的试剂盒,所述试剂盒包含如本文描述的抗体和纤维化疗法
。
[0446]
在一些实施方案中,本文提供了用于治疗纤维化的试剂盒,所述试剂盒包含如本文描述的抗体和附于容器或与容器一起包装的标签,该标签描述抗体与纤维化疗法组合的使用
。
[0447]
在一些实施方案中,本文提供了用于治疗纤维化的试剂盒,所述试剂盒包含纤维化疗法和附于容器或与容器一起包装的标签,该标签描述纤维化疗法
(
例如,抗炎剂
)
与如本文描述的抗体的使用
。
[0448]
在一些实施方案中,试剂盒的容器装置一般将包括至少一个小瓶
、
试管
、
烧瓶
、
瓶
、
安瓿
、
注射器
、
静脉内
(iv)
袋
、
和
/
或其他容器装置,在其中放置和
/
或优选地合适地等分至少一种多肽
。
本文提供了包含本文描述的组合物的容器装置
。
[0449]
在一些实施方案中,试剂盒包含用于商业销售的紧密封闭的用于容纳至少一种融合蛋白
、
可检测部分
、
报告物分子的装置和
/
或其他试剂容器
。
在一些实施方案中,这样的容器包括在其中保存期望的小瓶的注射和
/
或吹塑模制的塑料容器
。
在一些实施方案中,试剂盒还包括印刷的材料以用于试剂盒中的材料的用途
。
[0450]
在一些实施方案中,包装和试剂盒另外包含药物制剂中的缓冲剂
、
防腐剂和
/
或稳
定剂
。
在一些实施方案中,将试剂盒的每种组分封装在单独的容器内并且所有的不同容器可以在单个包装内
。
在一些实施方案中,公开内容的试剂盒设计成用于冷藏或室温储存
。
[0451]
另外,在一些实施方案中,制剂含有稳定剂以增加试剂盒的保质期并且包括,例如,牛血清白蛋白
(bsa)。
在一些实施方案中,在组合物被冻干的情况下,试剂盒含有另外的溶液制品以重构冻干制剂
。
可接受的重构溶液是本领域熟知的并且包括,例如,药学上可接受的磷酸盐缓冲盐水
(pbs)。
[0452]
在一些实施方案中,包装和试剂盒还包含用于测定诸如例如
elisa
测定的一种或更多种组分
。
本技术中待测试的样品包括,例如,血液
、
血浆
、
组织切片和分泌物
、
尿液
、
淋巴液及其产物
。
在一些实施方案中,包装和试剂盒还包含用于收集样品的一种或更多种组件
(
例如,注射器
、
杯
、
拭子等
)。
[0453]
在一些实施方案中,包装和试剂盒还包含指定由美国
fda
或类似监管机构要求的信息的标签,例如,产品描述
、
施用的量和方式和
/
或治疗适应症
。
本文提供的包装可以包含如本文描述的任何组合物
。
[0454]
术语“包装材料”是指容纳试剂盒的组分的物理结构
。
在一些实施方案中,包装材料维持组分无菌,并且由通常用于这样的目的的材料
(
例如,纸
、
波纹纤维
、
玻璃
、
塑料
、
箔
、
安瓿等
)
制成
。
在一些实施方案中,标签或包装插页包含适当的书面说明书
。
因此,在一些实施方案中,试剂盒另外包含用于以本公开内容的任何方法使用试剂盒组分的标签或说明书
。
在一些实施方案中,试剂盒包含包装或分配器中的化合物以及用于以本文描述的方法施用化合物的说明书
。
[0455]
在仍另外的实施方案中,试剂盒还包含用于纤维化疗法的容器装置
。
[0456]
在一些实施方案中,说明书包含用于实施本文描述的任何的方法
(
包括治疗方法
)
的说明
。
在一些实施方案中,说明书另外包含令人满意的临床终点或发生的任何不良症状的指示,或监管机构
(
诸如食品和药物管理局
(food and drug administration))
要求的用于人类受试者的另外的信息
。
[0457]
在一些实施方案中,说明书在“印刷品”上,例如,在试剂盒内或贴到试剂盒的纸或纸板上,或在贴到试剂盒的标签或包装材料上,或附于含有试剂盒的组分的小瓶或管
。
在一些实施方案中,说明书另外地包含在计算机可读介质上,诸如,例如,
cd-rom、dvd、
闪存设备
、
固态存储器
、
磁盘和磁盘设备
、
磁带
、
云计算系统和服务器等
。
在一些情况下,程序和说明书永久地
、
基本上永久地
、
半永久地或非暂时性地编码在介质上
。
[0458]
本文提供了包含本文描述的组合物的容器装置
。
在一些实施方案中,容器装置是容纳液体或冻干组合物的任何合适的容器,包括但不限于小瓶
、
注射器
、
瓶
、
静脉内
(iv)
袋或安瓿
。
在一些实施方案中,注射器容纳适于注射到受试者体内的任何体积的液体,包括但不限于
0.5cc、1cc、2cc、5cc、10cc
或更多
。
[0459]
本文提供了包含本文描述的组合物的试剂盒
。
在一些实施方案中,本文提供了用于治疗纤维化的试剂盒,所述试剂盒包含如本文描述的抗体与纤维化治疗剂的组合
。
[0460]
在一些实施方案中,本文提供了用于治疗纤维化
(
诸如与
m2-巨噬细胞的存在相关的纤维化
)
的试剂盒,所述试剂盒包含如本文描述的抗体和附于容器或与容器一起包装的标签,该标签描述抗体或其抗原结合片段与另外的抗纤维化疗法或抗炎疗法的使用
。
在一些实施方案中,纤维化是原发性纤维化疾病
。
在一些实施方案中,纤维化是继发性纤维化疾
病
。
[0461]
在一些实施方案中,本文提供了用于治疗纤维化
(
诸如与
m2-巨噬细胞的存在相关的纤维化
)
的试剂盒,所述试剂盒包含另外的抗纤维化疗法或抗炎疗法和附于容器或与容器一起包装的标签,该标签描述另外的抗纤维化疗法或抗炎疗法与如本文描述的抗体的使用
。
在一些实施方案中,纤维化是原发性纤维化疾病
。
在一些实施方案中,纤维化是继发性纤维化疾病
。
实施例
[0462]
本公开内容将在以下实施例中进一步说明,提供这些实施例仅用于说明目的,并不意图以任何方式限制本公开内容
。
[0463]
实施例
1-亲和力成熟
[0464]
噬菌体
elisa
的结果显示,
ab101-scfv-hl
可以通过大肠杆菌
tg1/pcantab 5e
噬菌体展示系统展示在噬菌体尾部处的
piii
蛋白的n末端处
。ab101-e
和
ab101-c
与
hucd163
的结合的
ec
50
值分别是
4.34nm
和
5.44nm。
[0465]
经由易错
pcr
设计并构建了
vh
和
vl
突变的噬菌体展示
scfv
文库
(
标记为
scfv-ab101vhmu-vlwt
文库和
vhwt-vlmu
文库
)。
[0466]
scfv-ab101 vhmu-vlwt
文库
[0467][0468]
scfv-ab101 vhwt-vlmu
文库
[0469][0470]
根据基于抗体数据库的序列比对分析和
discovery studio
的结构建模分析,经由
nnk
引物设计并构建了热点突变噬菌体展示
scfv
文库
(
标记为
scfv-ab101
热点突变文库
)。
[0471]
scfv-ab101
热点突变文库
[0472][0473]
[0474]3个突变文库的容量分别是
1.13
×
10
10
(vhmu-vlwt
文库
)、1.03
×
10
10
(vhwt-vlmu
文库
)
和
1.0
×
109(
热点突变文库
)。
通过用
s1
引物测序来测试每个文库的质量
。
每个突变文库的正确率分别是
77.8
%
(vhmu-vlwt
文库
)、70
%
(vhwt-vlmu
文库
)
和
75
%
(
热点突变文库
)。
这些结果指示,构建了三个高质量的文库
。
[0475]
对标记为
scfv-ab101 vhmu-vlwt
文库
、vhwt-vlmu
文库和热点突变文库的三个突变文库进行文库筛选
。
[0476]
对靶抗原人类
cd163
进行
sds-page
分析
。
人类
cd163
的分子量是约
140kd
,纯度高于
90
%,无任何降解
。
产生生物素标记的人类
cd163(
标记为
b-hucd163)
,并进行
qc
测试
。
详细地,使用与链霉抗生物素蛋白关联的
sds-page
评价生物素标记效率,并且结果显示效率高于
95
%
。
所有结果指示,人类
cd163
和
b-hucd163
的质量具有高水平
。
[0477]
基于针对
b-hucd163
的三个突变文库进行四轮文库筛选
。
发现了所有三个文库,即
scfv-ab101 vhmu-vlwt
文库
、vhwt-vlmu
文库和热点突变文库的富集作用
。
[0478]
vhmu-vlwt
文库
[0479]
从
vhmu-vlwt
文库筛选的第4轮输出中随机选择
138
个克隆,并放置在
96
孔板
(
标记为
1-46、137-182
和
273-318)
中,使用
ab101
亲本噬菌体作为对照进行
qc
单克隆噬菌体
elisa。
根据噬菌体
elisa
结果,从批次
1-3
中选择
40
个高度阳性克隆用于
dna
测序
(
克隆
178
和
181
未能测序
)。
[0480]
vhwt-vlmu
文库
[0481]
从
vhwt-vlmu
文库筛选的第4轮输出中随机选择
138
个克隆,并放置在
96
孔板
(
标记为
47-92、183-228
和
319-364)
中,使用
ab101
亲本噬菌体作为对照进行
qc
单克隆噬菌体
elisa。
根据噬菌体
elisa
结果,从批次
1-3
中选择
42
个高度阳性克隆用于
dna
测序
。
[0482]
热点突变文库
[0483]
从热点突变文库筛选的第4轮输出中随机选择
138
个克隆,并放置在
96
孔板
(
标记为
93-136、229-272、365-408)
中,使用
ab101
亲本噬菌体作为对照进行
qc
单克隆噬菌体
elisa。
根据噬菌体
elisa
结果,从批次
1-3
中选择
17
个高度阳性克隆用于
dna
测序
。
总计选择
97
个高度阳性克隆用于
dna
测序
。
[0484]
亚文库构建和筛选
[0485]
分别扩增来自
vhm-vlwt
文库的第4轮输出池的
vhm(vh
中包含突变
)
序列和来自
vhwt-vlm
文库的第4轮输出池的
vlm(vl
中包含突变
)
序列,并经由重叠
pcr
将其随机组装至
scfvs
中,以构建亚文库
。
构建了终点亚文库,并且文库容量是
3.8
×
109。
针对抗原基于亚文库进行两轮文库筛选
。
在此之后,从亚文库的第2轮输出中随机选择
180
个克隆
(
标记为克隆
409-588)
以进行单克隆噬菌体
elisa。
基于单克隆噬菌体
elisa
结果,选出具有最高阳性信号的
60
个克隆用于测序
。
根据
dna
测序结果,对
56
个克隆成功测序,并且4个克隆
(
克隆
411、462、520
和
556)
未能获得正确的序列
。
基于序列特征,选择5个序列用于进一步的
igg
抗体真核表达和亲和力评价
。
[0486]
实施例
2-抗体结合亲和力的确定
[0487]
使用
ab101
亲本
ab
作为对照,用一种
ab
浓度对6个克隆进行
bli
亲和力检测
。
所有克隆具有较低
kd值,指示与
ab101
亲本
ab
相比,它们具有增强的亲和力
。
[0488]
材料
[0489]
抗原:人类
cd163
蛋白
(
生物素化
)
[0490]
测试了以下抗体:变体
1(v1)-变体
6(v6)。
分子量
(mw)
和浓度如表4中描述的:
[0491]
表4[0492][0493]
缓冲液:
pbs、pbst
[0494]
设备:
fortebio octet red96(pall),sa biosensor
[0495]
方案
[0496]
样品制备如下:用
pbs
缓冲液将抗原
b-hucd163
稀释至2μ
g/ml
;用
pbst
缓冲液将
ab101
亲本
ab
稀释至一系列浓度
(100nm/150nm/200nm/250nm)。
结果描述于表5中:
[0497]
表5[0498]
克隆名称
kd(m)ka(m-1
·
s-1
)kd(s-1
)ab
浓度
(nm)ab101
亲本
ab8.78
×
10-7
3.37
×
1042.96
×
10-2
50.0nmv11.25
×
10-9
8.95
×
1051.12
×
10-3
50.0nmv29.91
×
10-10
8.78
×
1058.70
×
10-4
50.0nmv39.37
×
10-10
9.87
×
1059.25
×
10-4
50.0nmv48.24
×
10-10
1.06
×
1068.74
×
10-4
50.0nmv51.03
×
10-9
9.51
×
1059.78
×
10-4
50.0nmv69.64
×
10-10
9.21
×
1058.87
×
10-4
50.0nm
[0499]
选出
v4
用于4种
ab
浓度的
bli
亲和力测量
。
用
pbst
缓冲液将
v4
抗体稀释至一系列浓度
(6.25nm/12.5nm/25nm/50nm)。
结果描述于表6中:
[0500]
表6[0501][0502]
亲和力确定如下:
[0503][0504]
将
sa
传感器放置于
pbs
缓冲液中
15
分钟
。
根据以下顺序向
96
孔板中添加不同的溶液,每孔
200
μ
l。
[0505]
pbs
缓冲液2μ
g/ml b-hucd163pbst
缓冲液
ab
溶液
pbs
缓冲液2μ
g/ml b-hucd163pbst
缓冲液
ab
溶液
pbs
缓冲液2μ
g/ml b-hucd163pbst
缓冲液
ab
溶液
pbs
缓冲液2μ
g/ml b-hucd163pbst
缓冲液
ab
溶液
pbs
缓冲液2μ
g/ml b-hucd163pbst
缓冲液
pbst
缓冲液
[0506]
值得注意的是,克隆4具有
1.76
×
10-10
的
kd,当与具有
6.61
×
10-7
的
kd值的
ab101
亲本
ab
相比时,克隆4亲和力增强约
3755
倍
。
[0507]
实施例
3-肺上皮癌的治疗
[0508]
向被诊断为或怀疑患有肺上皮癌的受试者施用一种或更多种治疗有效剂量的本文公开的抗体
。
肺上皮癌在治疗后被改善或消除
。
[0509]
实施例
4-肺肉瘤的治疗
[0510]
向被诊断为或怀疑患有肺肉瘤的受试者施用一种或更多种治疗有效剂量的本文公开的抗体
。
肺肉瘤在治疗后被改善或消除
。
[0511]
实施例
5-患有原发性纤维化疾病的受试者中的纤维化病理的减轻
[0512]
向被诊断为或怀疑患有原发性纤维化疾病
(
例如间质性肺病
(ild)、
特发性肺纤维化
(ipf)、
弥漫性间质性肺病
、
肝纤维化和肝硬化
)
的受试者施用一种或更多种治疗有效剂量的本文公开的抗体
。
纤维化病理在治疗后被改善或消除
。
[0513]
实施例
6-患有纤维化作为继发性疾病的受试者中的纤维化病理的减轻
[0514]
向被诊断为或怀疑患有纤维化作为非纤维化疾病
(
例如,感染
、
自身免疫性疾病或紊乱
、
癌症或炎性疾病或紊乱
)
的并发症并且被确定或怀疑具有纤维化组织中存在的
m2
巨噬细胞的受试者施用一种或更多种治疗有效剂量的本文公开的抗体
。
纤维化病理在治疗后被改善或消除
。
[0515]
实施例
7-患有由组织损伤引起的纤维化的受试者中的纤维化病理的减轻
[0516]
向被诊断为或怀疑患有纤维化作为组织损伤
(
例如,放射诱导的损伤或机械损伤
)
的并发症并且被确定或怀疑具有损伤组织中存在的
m2
巨噬细胞的受试者施用一种或更多种治疗有效剂量的本文公开的抗体
。
纤维化病理在治疗后被改善或消除
。
[0517]
实施例
8-ab101
的高亲和力变体显示出与
su-dhl-1wt
细胞上的
cd163
的较强结合
[0518]
dhl-1(atcc
;编号
crl-2955)
是吞噬性人类间变性大细胞淋巴瘤细胞系,其组成型表达
cd163
,但在细胞表面上缺乏
fc
受体
(fcr)
的表达
。
将这些细胞悬浮培养在补充有
10
%胎牛血清
(hyclone
;编号
sh30396.03)
的
rpmi-1640
培养基
(hyclone
;编号
sh30027.02)
中
。
[0519]
为了评价
fcr
在结合
ab101
及其高亲和力变体中的作用,将表达
cd163
的
su-dhl-1
细胞用编码人类
cd64
或
fc
γ
ri(origene
;编号
rc207487l3v)、cd32a
或
fc
γ
riia(g&pbiosciences
;编号
ltv2124p)
和
cd16
或
fc
γ
riii(origene
;编号
rc206429l3v)
的慢病毒转导
。
将
su-dhl-1
细胞
(5
×
104个
)
用编码各自
fcr(cd16、cd32a
和
cd64)
的慢病毒颗粒在存在8μ
g/ml
聚凝胺
(millipore
;编号
tr-1003-g)
的情况下以每细胞
20-50
个颗粒进行处理以产生具有稳定
fcr
表达的
su-dhl-1
细胞系
。
将细胞在室温
(rt)
通过以
800
×g离心1小时进行感染,并且随后转移至培养箱
(37℃、5
% co2)
中持续4小时
。
然后去除包含病毒的培养基,并且允许细胞在新鲜培养基中恢复3天,然后在包含
0.3
μ
g/ml
嘌呤霉素
(thermofisher
;编号
a1113803)
的培养基中选择
。
慢病毒颗粒在感染时将各自的
fcr
基因递送到靶细胞中,并且
然后将内容物以高效率整合到宿主基因组中
。
通过利用嘌呤霉素作为选择标志选择稳定的
fcr
表达,将表达
cd16、cd32
和
cd64
的细胞的群体分离并培养
。
嘌呤霉素抗性的细胞群体上
fcr
的表达使用
bd facsymphony
细胞仪和
fcr
特异性抗体通过流式细胞术确认
。
[0520]
通过流式细胞术评价
ab101、
代表性变体
v3
和
higg1
同种型对照与
su-dhl-1
野生型
(wt)
细胞或表达
fc
γr的细胞的结合
。
同种型对照是专有的人类
igg1 mab
,具有已知的特异性和与
ab101
和
v3
相同的
igg1 fc
区
。
将
su-dhl-1
细胞用
pbs
洗涤一次,并且在
rt
重悬于
zombie uv
活
/
死染色剂
(biolegend
,编号
423107)(1:500)
中持续
20
分钟
。
然后用
facs
缓冲液
(pbs+1
% fbs+1mm edta(fisher scientific
,编号
15575-038))
洗涤细胞,并且在
rt
重悬于
facs
封闭液
(
包含
10
% fbs
和
0.5mg/ml higg1
的
facs
缓冲液
)
中持续
20
分钟
。
将封闭缓冲液中的细胞以
2.5
×
104个细胞
/
孔转移至
384
孔板中,并且将滴定的抗体
(ab101、v3
和
higg1
同种型对照
)
以2×
最终测定浓度直接添加至每个孔中
。
将细胞与抗体在
rt
孵育
20
分钟
。
将细胞用
facs
缓冲液洗涤三次,然后重悬于
facs
缓冲液中,用于在
facsymphony
tm
细胞仪
(bd biosciences)
上采集
。
[0521]
尽管
su-dhl-1
野生型细胞组成型表达
cd163
,但未观察到可察觉的
ab101
结合
(
图
1a)。
在该测定中
ab101
与
su-dhl-1
细胞的最佳结合需要
fc
受体,例如,
fc
γ
riii(
图
1b)、fc
γ
ri(
图
1c)
或
fc
γ
rii(
图
1d)
的共表达
。
相比之下,
v3
即使在不存在表达的
fc
受体的情况下,也与野生型细胞上表达的
cd163
良好结合
(
图
1a)
,并且这种结合不被
fc
γr的共表达显著改变
(
图
1b-图
1d)。
在这些测定中,
higg1
对照抗体显示可忽略不计的结合或没有结合,这表明在该测定中,单独的
fc
受体结合不足以显示
igg1
抗体的可测量结合
。
[0522]
实施例
9-ab101
的高亲和力变体显示出与重组
cd163
蛋白的较强结合
(
根据
elisa)
[0523]
使用
elisa
确定
cd163
变体抗体与加
his
标签的重组人类
cd163(r&d systems
,编号
1607-cd-050)
蛋白的结合
。
将重组蛋白在
pbs
中稀释至5μ
g/ml
,并且以每孔
25
μ
l
添加至
384
孔高结合
elisa
板
(greiner bio-one
,编号
781061)
中,并且在
4℃
孵育过夜
。
使用
biotek elx405 select
微孔板洗涤器
(
洗涤程序
elisa_384_pbs_3
×
_wash)
将板用
pbs
洗涤三次,并且然后用
90
μ
l/
孔的封闭缓冲液
(2
%脱脂奶粉
/pbs+0.05
% tween 20)
在室温封闭1小时
。
[0524]
封闭之后,将每孔
25
μ
l
的一抗添加至板中,并且在
rt
孵育1小时
。
同种型对照是具有已知的特异性的在人类
igg1
框架中的专有
mab。
一抗结合后,使用
el405x(
洗涤程序
elisa_384_pbs_3
×
_wash)
用
pbs
洗涤板三次
。
二抗是山羊抗人类
igg f(ab’)2hrp(jackson immunoresearch
,编号
109-035-097)。
将二抗在2%脱脂奶粉
/pbs
中稀释至
1:2500
,并且以每孔
25
μ
l
添加至孔中,并且在
rt
孵育1小时
。
使用
el405
×
(
洗涤程序
elisa_384_pbs_4
×
_wash)
将板用
pbs
洗涤四次
。
去除最后一次洗涤液之后,添加
25
μ
l/
孔的纯
1-step
tm
ultra tmb-elisa
底物溶液
(thermofisher
,编号
34028)
,并且将板在室温孵育
10-15
分钟,避光
。
显色之后,通过添加每孔
25
μ
l
的
0.3m hcl
停止反应,并且使用
spectramax m5e
仪器在
450nm
处读取板
。
[0525]
如图
2a-图
2f
中示出的,在该测定中
ab101
的变体,即
v1(
图
2a)、v2(
图
2b)、v3(
图
2c)、v4(
图
2d)、v5(
图
2e)
和
v6(
图
2f)
以及
ab101
亲本抗体与
hucd163
结合,而同种型对照没有显示出可察觉的结合
。ab101
亲本抗体与
hucd163
结合的
ec
50
值是
84.39pm
,而
ab101
的变体的
ec
50
值范围为
1.87pm
至
3.05pm
,显示出比
ab101
亲本抗体强
27
倍至
45
倍的结合
(
表
7)。
[0526]
表7:抗体与
hucd163
结合的
ec
50
值
[0527]
抗体
ec
50
(nm)ab10184.39v11.87v22.23v32.79v43.05v52.83v62.68
[0528]
实施例
10
:从供体样品制备分离的单核细胞
[0529]
可以从供体收集单采血液成分术产物
(apheresis products)
,并且使用本领域常用的技术分离自体单核细胞和
t
细胞
。
这里,根据标准技术从白细胞
(wbc)
中分离人类单核细胞和
t
细胞
。
在收集过程期间,
wbc
被捕获在集成的
leukoreduction
系统
(lrs)
室
(trima
,编号
2490-08)
或
leukopaks(
编号
4510-01
,
full leukopak,bloodworks northwest,seattle,wa)
中
。
通过标准密度梯度离心
(premium 1.073,ge healthcare
,编号
17-5449-52)
从
lrs
室或
leukopaks
纯化外周血单个核细胞
(pbmc)。
弃去上清液,并且将沉淀物
(pellet)
重悬于
20ml easysep
tm
缓冲液
(stemcell technologies
,编号
20144)
中,用于
pbmc
计数以及用于单核细胞和
t
细胞的进一步分离
。
[0530]
使用
easysep
tm
人类单核细胞分离试剂盒
(stemcell technologies
,编号
19359)
按照制造商的说明书分离单核细胞
。
[0531]
可以使用
easysep
tm
人类
cd3+ t
细胞
、cd4+ t
细胞
、
和
cd8+ t
细胞分离试剂盒
(stemcell technologies
,编号
19051、17952
和
17953)
按照制造商的说明书分离总
cd3+ t
细胞
、cd4+ t
细胞和
cd8+ t
细胞
。
这些负选择试剂盒使用抗体来标记不需要的细胞类型进行去除,允许期望的靶细胞以未触及的方式
(untouched)
从样品分离
。
[0532]
巨噬细胞可以使用本领域常用的技术从
pbmc
来源的单核细胞产生,诸如以下例示的那些
。
[0533]
m0
巨噬细胞的产生:在第0天,将来自个体供体的单核细胞以在
m0
培养基
(90
%
x-vivo
tm
15(lonza
编号
o4-418q)+10
%热灭活
fbs(hyclone
,编号
sh30396.03)+100ng/ml
人类
m-csf(peprotech
,编号
300-25))
中的
25,000-50,000
个细胞
/100
μ
l/
孔铺板在
96
孔培养板
(thermofisher(costar)
,编号
09-761-145)
中
。
将细胞在
37℃
和5% co2孵育5天至6天以产生
m0
巨噬细胞
。
[0534]
m2c
巨噬细胞的产生:在培养的第
5-6
天,通过从每个板温和抽吸培养基并用
100
μ
l/
孔的
m2c
培养基
(
具有
20ng/ml
人类
il-10(peprotech
,编号
200-10)
的
m0
培养基
)
替换,将
m0
巨噬细胞极化为
m2c
巨噬细胞
。
将细胞在
37℃
和5% co2孵育两天
。
在培养的第
7-8
天,
m2c
巨噬细胞准备用于测定设置
。
[0535]
实施例
11-ab101
的高亲和力变体显示出与
m2c
巨噬细胞的较强结合
(
根据
facs)
[0536]
为了评估变体抗体与细胞上表达的
cd163
的结合动力学,用免疫抑制性
m2c
巨噬细胞进行结合研究
。
根据标准方法诸如例如以上实施例
10
中描述的方法分离和制备巨噬细胞
。
[0537]
将
m2c
细胞在巨噬细胞解离溶液
dxf(promocell
,编号
c-41330)
中在
rt
孵育
15
分
钟,并且从烧瓶中取出到
x-vivo
tm
15
无血清培养基中
(lonza
,编号
o4-418q)。
[0538]
离心后,将细胞用
pbs
洗涤一次,并且在
rt
重悬于
zombie uv
活
/
死染色剂
(biolegend
,编号
423107)(1:500)
持续
20
分钟
。
然后用
facs
缓冲液
(pbs+1
% fbs+1mm edta(fisher scientific
,编号
15575-038))
洗涤细胞,并且在
rt
重悬于
facs
封闭液
(
包含
10
% fbs
和
0.5mg/ml
人类
igg1
的
facs
缓冲液
)
中
20
分钟
。
将封闭缓冲液中的细胞以
2.5
×
104个细胞
/
孔转移至
384
孔板,并且将滴定的抗体以2×
最终测定浓度直接添加至每个孔
。
将细胞与抗体在
rt
孵育
20
分钟
。
将细胞用
facs
缓冲液洗涤三次,然后重悬于
facs
缓冲液中,用于在
facsymphony
tm
细胞仪
(bd biosciences)
上采集
。
[0539]
如图3中示出的,与亲本
ab101
抗体相比,这些代表性变体显示出与
m2c
巨噬细胞的改进的结合
。
人类
igg1(higg1)
同种型对照表现出不与
m2c
巨噬细胞结合
。
[0540]
实施例
12-ab101
的高亲和力变体保留特异性并显示出与全血中
cd163+
细胞的改进的结合
[0541]
通过流式细胞术评估抗体与人类免疫细胞谱系子集的结合
。
简言之,获得以肝素作为抗凝剂的全血
(bloodworks northwest)。
将
fc
受体封闭试剂直接添加至全血中,至在
400
μ
l
的最终样品体积中为
10
% fbs、0.5mg/ml
人类
igg1
和
0.05
%叠氮化钠的最终浓度
。
在
rt
封闭
20
分钟后,添加
apc
标记的抗
cd163
抗体
ab101、v3、
人类
igg1
同种型对照
、
抗
cd163
克隆
r20
和鼠
igg1
同种型对照
。30
分钟之后,将红细胞
(rbc)
用
rbc
裂解缓冲液裂解,随后是
zombie uv
存活力染色
。
然后,将细胞用
facs
缓冲液
(
包含1% fbs、2mm edta
和
0.05
% nan3的
pbs)
洗涤,并且重悬于包含
10
% fbs
和
10
% fcx
封闭液的
facs
缓冲液中
。
然后,添加抗体表型分析混合物
(
表
8a)
并且在室温在黑暗中孵育
30
分钟
。
将细胞用
facs
缓冲液洗涤,并且重悬于
facs
缓冲液中,用于使用
acsymphony
tm
细胞仪
(bd biosciences)
采集数据
。
使用
flowjo
软件进行分析
。
根据如表
8b
中描述的门控参数鉴定群体
。
[0542]
表
8a
:抗体表型分析混合物
[0543]
表
8b
:免疫细胞谱系
[0544]
细胞类型门控
cd4
+ t
细胞
cd3
+
cd4
+
cd8
+ t
细胞
cd3
+
cd8
+b细胞
cd19
+
hla-dr
+
nk
细胞
cd3-cd56
+
中性粒细胞
ssc
高
cd15
+
经典单核细胞
cd14
+
hla-dr
+
cd16-中间型单核细胞
cd14
+
hla-dr
+
cd16
+
非经典单核细胞
cd14-hla-dr
+
cd16
+
骨髓树突状细胞
cd14-hla-dr
+
cd11c
+
[0545]
如图
4a-图
4c
中示出的,使用商购可得的抗
cd163
克隆
r20(r&d systems
,编号:
fab16072r10)
在经典单核细胞
、
中间型单核细胞和一部分骨髓树突状细胞
(mdc)
上检测
cd163
表达
。
使用抗
cd163
克隆
r20
对跨单核细胞和
dc
的染色比较显示,
cd163
的表达跨细胞类型不同
(
经典单核细胞
》
中间型单核细胞
》mdc)。
未观察到与
cd4+ t
细胞和
cd8+ t
细胞
、b
细胞
、nk
细胞
、
中性粒细胞
、
非经典单核细胞和中性粒细胞的可察觉的结合
(
数据未示出
)。
[0546]
与
cd163
表达一致,
ab101
及
v3
与单核细胞特异性结合,而与人类中性粒细胞
、b
细胞
、nk
细胞
、cd4+ t
细胞或
cd8+ t
细胞没有可察觉的结合
。
人类
igg1
同种型对照
(igg1)
未显示出与任何评价的免疫细胞谱系的可检测结合
。v3
显示了与全血中
cd163+
细胞的改进的结合
。
与
ab101
的几何
mfi
相比,
v3
与
dc、
经典单核细胞
、
中间型单核细胞和非经典单核细胞结合的
gmfi
增加了
4.3
倍
、9.8
倍
、9.2
倍和3倍
(
图
4a-图
4c)。
[0547]
实施例
13a-cd163
抗体缓解
m2c/cd8+ t
细胞共培养物中
m2c
介导的免疫抑制,如通过
t
细胞增殖测量的
[0548]
肿瘤相关巨噬细胞对肿瘤微环境中
t
细胞的抑制对免疫抑制性肿瘤微环境有贡献
。
这种活性可以通过自体单核细胞来源的
m2
巨噬细胞与活化的
cd8+ t
细胞或
cd4+ t
细胞的共培养物来建模,并且
t
细胞增殖和细胞因子表达水平可以用作
t
细胞活化的替代物
。
[0549]
将
m0
巨噬细胞极化为
m2c
巨噬细胞之后,将上清液从
m2c
巨噬细胞
96
孔培养板中取出,并且用包含
0.625
μ
g/ml okt3(thermofisher
,编号
14-0037-82)+/-cd163
抗体的
100
μ
l
测定培养基
(x-vivo
tm
15
培养基
+10
% fbs)
替换,并且在
37℃、5
% co2孵育持续
1-2
小时
。
当
m2c
巨噬细胞与抗体接触时,将如以上描述分离的自体
cd8+ t
细胞用5μ
m celltrace
tm
紫增殖染料
(thermofisher
,编号
c34571)
在
37℃、5
% co2标记
20
分钟
。
将过量的
celltrace
tm
用冰冷的测定培养基洗去,将标记的
cd8+ t
细胞重悬于测定培养基中,并且然后以
1:1
的
m2c:cd8+ t
细胞的比率添加至
m2c/
抗体制品中
。
然后将细胞在
37℃、5
% co2孵育
72
小时
。
[0550]
将包含
t
细胞的上清液转移至
v-底
96
孔板中,离心以使
t
细胞沉淀,并且收集培养上清液并在-20℃
冷冻,用于通过
elisa
进行人类
ifn
γ
细胞因子分析
(r&d systems
;
duoset elisa
,编号
dy285b)。
将
t
细胞沉淀物用
true stain fc
封闭液
(biolegend)
封闭,并且用抗人类
cd8-buv395(bd biosciences)
在
4℃
染色
20
分钟
。
将细胞洗涤并且用
e780
存活力染料在
rt
在黑暗中染色
15
分钟,用
facs
缓冲液洗涤并且重悬于
200
μ
l
的
facs
缓冲液中,用于在
bd symphony
流式细胞仪
(bd biosciences)
上采集
。
使用
flowjo
软件分析增殖的
cd8+t
细胞的百分比,并且报告为
cd8+celltrace
阴性分裂细胞的百分比
。
在
m2c/t
细胞共培养测定中,
cd163
抗体通过恢复
cd8+ t
细胞增殖来缓解
m2c-巨噬细胞介导的免疫抑制
(
图
5a)。
在缓解
m2c
介导的
cd8+ t
细胞增殖抑制方面,
v3
比亲本
ab101
抗体有效约
40
倍
(
表
9)。
[0551]
表9:抗体引发的
t
细胞增殖的
ec
50
值
[0552]
抗体
ec
50
(nm)ab10110.10
v30.27
[0553]
实施例
13b-cd163
抗体缓解
m2c/cd8+ t
细胞共培养物中
m2c
介导的免疫抑制,如通过穿孔蛋白分泌测量的
[0554]
m2c/t
细胞共培养期间的抗体处理缓解
m2c
介导的免疫抑制,并且通过抗
cd3
活化的
cd8+ t
细胞诱导有效的细胞毒性响应
。
在存在
m2c
巨噬细胞的情况下,将从2个至3个研究受试者分离的
cd8+ t
细胞用抗
cd3
抗体
(okt3
,
0.25
μ
g/ml)
活化
。
将
m2c/t
细胞共培养物用
20
μ
g/ml
抗
cd163
抗体
、
人类
igg1
同种型对照或单独的培养基
(m2c)
处理
。
在抗
cd3
刺激
72
小时之后取出上清液,并且通过基于磁珠的免疫测定定量穿孔蛋白分泌
。
在该测定中,
cd163
抗体挽救耗尽的
t
细胞的穿孔蛋白响应免于
m2c
巨噬细胞介导的免疫抑制
(
图
5b)
,而对照
igg1
抗体没有显示出活性
。
在缓解
m2c
介导的
cd8+ t
细胞对穿孔蛋白分泌抑制方面,
v3
抗体比亲本
ab101
抗体有效约
100
倍
(
表
10)。
[0555]
表
10
:抗体引发的穿孔蛋白分泌的
ec
50
值
[0556]
抗体
ec
50
(nm)ab10136.45v30.33
[0557]
实施例
13c-cd163
抗体缓解
m2c/t
细胞母细胞共培养物中
m2c
介导的免疫抑制,如通过
ifn
γ
分泌测量的
[0558]
肿瘤微环境中的大多数
t
细胞被耗尽,显示出细胞因子表达和效应子功能下降,这对癌症免疫逃避有贡献
。
逆转
t
细胞耗尽和恢复抗肿瘤潜力代表了治疗癌症的有希望的策略
。
我们使用耗尽的
t
细胞和
m2c
的共培养物
(
一种模拟由巨噬细胞介导的免疫抑制的系统
)
,评价
cd163
抗体挽救耗尽的
t
细胞的功能活性免于免疫抑制的能力
。
通过重复
(3
×
)
植物血凝素
(pha)
刺激,可以从人类
pbmc
中产生具有母细胞样形态的耗尽的
t
细胞
。
[0559]
将冷冻的
pbmc
或新鲜分离的
pbmc
以在培养基
(imdm(thermo fisher
,编号
12440053)+10
%人类
ab
血清
(sigma aldrich
,编号
h4522)+2
μ
g/ml pha-l(sigma aldrich
,编号
11249738001)+4ng/ml
重组人类
il-2(r&d systems
,编号
202-il))
中的1×
106个细胞
/ml
在
37℃、5
% co2孵育
10
天,其中细胞传代和培养基更换在第4天和第7天进行
。
在第
10
天,使用标准方法收集
t
细胞母细胞
。
[0560]
为了测量
cd163
抗体挽救
t
细胞母细胞的功能活性免于
m2c
介导的免疫抑制的能力,从培养的
m2c
巨噬细胞去除旧培养基,并且用包含4×
最终浓度的
cd163
或同种型对照抗体的
50
μ
l
的
x-vivo
tm
15
培养基
+10
% fbs
替换,并且在
37℃、5
% co2孵育2小时
。
将
okt3
抗体稀释至
0.25
μ
g/ml
并且添加至
m2c/
抗体样品中,并且在
37℃、5
% co2孵育
30
分钟
。
最后将
t
细胞母细胞以
1:1
的
t
细胞母细胞与
m2c
的比率添加至样品中,并且在
37℃、5
% co2孵育
24
小时
。
收集上清液,通过
elisa
进行人类
γ
干扰素
(ifn
γ
)
细胞因子分析
。
每个处理条件以一式三份设置
。
[0561]
在该测定中,
cd163
抗体挽救耗尽的
t
细胞的
ifn
γ
响应免于
m2c
巨噬细胞介导的免疫抑制
(
图
5c)
,而对照
igg1
抗体没有显示出活性
。
在缓解
m2c
介导的由
cd8 t
细胞释放
ifn
γ
的抑制方面,
v3
显示出比
ab101
抗体强超过
10
倍
(
表
11)。
[0562]
表
11
:抗体引发的
ifn
γ
分泌的
ec
50
值
[0563]
抗体
ec
50
(nm)
ab1016.84v30.47。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1