具有酰基CoA化合物还原活性的重组多肽的制作方法
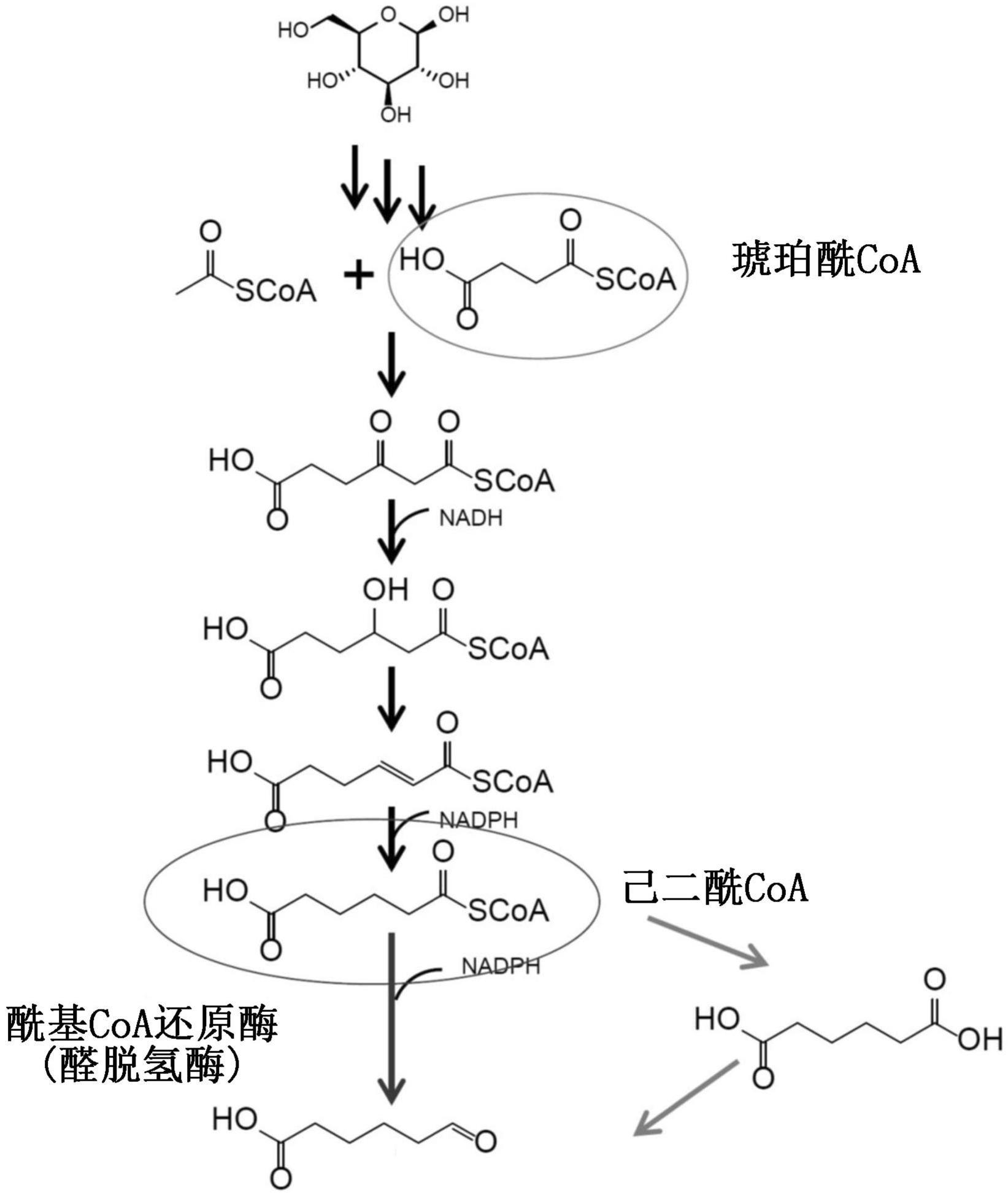
本发明涉及具有酰基coa化合物还原活性的重组多肽、以及使用了该肽的脂肪族化合物的制造方法。
背景技术:
1、近年来为了应对与地球温室化相伴的气象灾害、气候变化,以与地球环境的共生和环境保全为目标的可持续创新的必要性日渐提高。其中,对于能够利用可再生原料、并且利用了生物体反应的物质生产工序即生物工艺寄予很大期待。截至目前已经开发出了各种化学合成品的发酵生产工艺。作为一例,对于被用于聚氨酯原料、聚酯原料、增塑剂原料和药物中间体等中的多元醇类的制造,已经研究了利用微生物的发酵生产法(专利文献1、2和8)。
2、作为除此以外的具有发酵生产工艺的报告例的化合物,可以举出包含氨基的胺化合物。例如,1,5-二氨基戊烷和1,6-二氨基己烷是有望作为聚合物原料的能够发酵生产的单体化合物(专利文献3~7)。
3、作为c6单体化合物、例如1,6-己二醇、6-氨基己酸和1,6-二氨基己烷的发酵生产路径的一例,可以举出己二酸发酵路径(非专利文献1和2)。作为己二酸发酵路径的应用,已经发现了包括使用醛脱氢酶将己二酰coa经过1步或多步转换成5-甲酰基戊酸的反应的路径、以及可构成催化该反应的候选物的现有酶(专利文献4、5和9)。但是,这些不过显示出了在该路径的酶反应中现有酶的可利用性,并未显示催化反应的酶的实际存在。现有技术还提出了将丁醛脱氢酶或琥珀酸半醛脱氢酶用于从己二酰coa合成己二酸半醛(非专利文献3和4),但产物量不足。作为得不到足够量的产物的理由,据认为是由于各酶针对己二酰coa的活性低所致的。另外,琥珀酸半醛脱氢酶对于生物生长而言是重要的酶,并且对于作为上述己二酸路径的中间体的琥珀酰coa具有高活性。因此,为了得到足够量的产物,需要一种对于琥珀酰coa的活性低的酶。
4、现有技术文献
5、专利文献
6、专利文献1:国际公开第2019/159831号
7、专利文献2:日本特开2018-046843号公报
8、专利文献3:日本特开2012-188407号公报
9、专利文献4:日本特表2012-525856号公报
10、专利文献5:日本特表2016-538870号公报
11、专利文献6:日本特表2016-501031号公报
12、专利文献7:日本特表2017-533734号公报
13、专利文献8:日本特表2016-533162号公报
14、专利文献9:日本特表2011-512868号公报
15、非专利文献
16、非专利文献1:yu,et.al.direct biosynthesis of adipic acid from asynthetic pathway in recombinant escherichia coli,biotechinology andbioengineering,wiley periodicals,inc.,2014,vol.111,pp.2580.
17、非专利文献2:yu zhou,et.al.biosynthesis of adipic acid by a highlyefficient induction-free systemin escherichia coli,journal of biotechnology,elsevier,2020,8,pp.314-315
18、非专利文献3:cheong,et.al.energy-and carbon-efficient synthesis offunctionalized small molecules in bacteria using non-decarboxylative claisencondensation reactions,nature biothechnology,2016
19、非专利文献4:turk et.al.metabolic engineering toward sustainableproduction of nylon-6,acs synth.biol.2016,5,pp.65-73
技术实现思路
1、发明所要解决的课题
2、本发明的课题在于提供具有酰基coa化合物还原活性的新颖的重组多肽。进一步在于提供使用了该重组多肽的脂肪族化合物的新颖制造方法。
3、用于解决课题的手段
4、本发明人为了解决上述课题反复进行了深入研究,结果发现,通过在野生型的琥珀酸半醛脱氢酶中导入特定的突变,可得到能够有效地生成目标脂肪族化合物的重组多肽。即,本发明如下所述:
5、[1]一种重组多肽,其中,
6、(a)由与序列编号1所示的氨基酸序列的序列一致性为60%以上、65%以上、70%以上、75%以上、80%以上、85%以上、88%以上、90%以上、93%以上、95%以上、97%以上、98%以上或99%以上的氨基酸序列a构成,
7、(b)上述氨基酸序列a中,与由序列编号1所示的氨基酸序列构成的多肽的底物结合部位相对应的位置的氨基酸中的至少一个被置换,
8、(c)具有将酰基coa化合物的coa硫酯转换成醛基的还原活性r,
9、上述还原活性r为下述(c-1)和(c-2):
10、(c-1)将己二酰coa一步转换成5-甲酰基戊酸的还原活性r1,
11、(c-2)将琥珀酰coa转换成琥珀酸半醛的还原活性r2;
12、[2]如[1]中所述的重组多肽,其中,上述(c-2)的还原活性r2比由序列编号1所示的氨基酸序列构成的多肽的将琥珀酰coa转换成琥珀酸半醛的还原活性r2’低;
13、[3]如[1]或[2]中所述的重组多肽,其选自琥珀酸半醛脱氢酶(ec 1.2.1.76)的组;
14、[4]如[1]~[3]中任一项所述的重组多肽,其来源于梭菌(clostridium)属的微生物;
15、[5]如[1]~[4]中任一项所述的重组多肽,其中,以序列编号1所示的氨基酸序列为基准,上述(b)中的与由序列编号1所示的氨基酸序列构成的多肽的上述底物结合部位相对应的位置是与75位、78位、79位、245位、250位、252位、405位、406位、410位、418位、419位、420位和926位相对应的位置;
16、[6]如[1]~[5]中任一项所述的重组多肽,其中,与由序列编号1所示的氨基酸序列构成的多肽的将己二酰coa一步转换成5-甲酰基戊酸的还原活性r1’相比,上述(c-1)的还原活性r1增高;
17、[7]如[1]~[6]中任一项所述的重组多肽,其中,(b)上述氨基酸序列a中,与由序列编号1所示的氨基酸序列构成的多肽的底物结合部位相对应的位置的氨基酸中的至少两个被置换;
18、[8]如[1]~[7]中任一项所述的重组多肽,其中,上述氨基酸序列a中,以序列编号1所示的氨基酸序列为基准,满足下述(i)~(xii)中的至少一者:
19、(i)与75位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换,
20、(ii)与78位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换,
21、(iii)与79位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换,
22、(iv)与245位相对应的位置的氨基酸残基被丙氨酸、苯丙氨酸、精氨酸、谷氨酸、丝氨酸、天冬酰胺、谷氨酰胺、甘氨酸、亮氨酸和色氨酸中的任一者置换,
23、(v)与250位相对应的位置的氨基酸残基被丙氨酸、苯丙氨酸、赖氨酸、精氨酸、组氨酸、苏氨酸、天冬酰胺、谷氨酰胺、甘氨酸、亮氨酸、缬氨酸、脯氨酸和色氨酸中的任一者置换,
24、(vi)与252位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换,
25、(vii)与405位相对应的位置的氨基酸残基被丙氨酸、苯丙氨酸、赖氨酸、组氨酸、谷氨酸、丝氨酸、天冬酰胺、谷氨酰胺、亮氨酸、缬氨酸、酪氨酸、脯氨酸和色氨酸中的任一者置换,
26、(viii)与406位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换,
27、(ix)与410位相对应的位置的氨基酸残基被苯丙氨酸置换,
28、(x)与418位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换,
29、(xi)与419位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换,
30、(xii)与420位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换;
31、[9]如[1]~[8]中任一项所述的重组多肽,其中,上述氨基酸序列a中,以序列编号1所示的氨基酸序列为基准,满足下述(i)~(xii)中的至少一者:
32、(i)与75位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换,
33、(ii)与78位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换,
34、(iii)与79位相对应的位置的氨基酸残基被丙氨酸置换,
35、(iv)与245位相对应的位置的氨基酸残基被丙氨酸、苯丙氨酸、精氨酸、谷氨酸、丝氨酸、天冬酰胺、谷氨酰胺、甘氨酸、亮氨酸和色氨酸中的任一者置换,
36、(v)与250位相对应的位置的氨基酸残基被丙氨酸、苯丙氨酸、赖氨酸、精氨酸、组氨酸、苏氨酸、天冬酰胺、谷氨酰胺、甘氨酸、亮氨酸、缬氨酸、脯氨酸和色氨酸中的任一者置换,
37、(vi)与252位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换,
38、(vii)与405位相对应的位置的氨基酸残基被丙氨酸、苯丙氨酸、赖氨酸、组氨酸、谷氨酸、丝氨酸、天冬酰胺、谷氨酰胺、亮氨酸、缬氨酸、酪氨酸、脯氨酸和色氨酸中的任一者置换,
39、(viii)与406位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换,
40、(ix)与410位相对应的位置的氨基酸残基被苯丙氨酸置换,
41、(x)与418位相对应的位置的氨基酸残基被丙氨酸置换,
42、(xi)与419位相对应的位置的氨基酸残基被丙氨酸置换,
43、(xii)与420位相对应的位置的氨基酸残基被丙氨酸置换;
44、[10]如[1]~[9]中任一项所述的重组多肽,其中,上述氨基酸序列a中,以序列编号1所示的氨基酸序列为基准,满足下述(i)~(xii)中的至少一者:
45、(i)与75位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换,
46、(ii)与78位相对应的位置的氨基酸残基被苯丙氨酸置换,
47、(iii)与79位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换,
48、(iv)与245位相对应的位置的氨基酸残基被精氨酸、谷氨酰胺、甘氨酸、丝氨酸和色氨酸中的任一者置换,
49、(v)与250位相对应的位置的氨基酸残基被丙氨酸、苯丙氨酸、亮氨酸和脯氨酸中的任一者置换,
50、(vi)与252位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换,
51、(vii)与405位相对应的位置的氨基酸残基被丙氨酸、苯丙氨酸、赖氨酸、组氨酸、谷氨酸、丝氨酸、谷氨酰胺、酪氨酸和色氨酸中的任一者置换,
52、(viii)与406位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换,
53、(ix)与410位相对应的位置的氨基酸残基被苯丙氨酸置换,
54、(x)与418位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换,
55、(xi)与419位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换,
56、(xii)与420位相对应的位置的氨基酸残基被丙氨酸和苯丙氨酸中的任一者置换;
57、[11]如[1]~[10]中任一项所述的重组多肽,其中,上述氨基酸序列a中,以序列编号1所示的氨基酸序列为基准,满足下述(iv)、(v)、(vii)中的至少一者:
58、(iv)与245位相对应的位置的氨基酸残基被精氨酸、丝氨酸和色氨酸中的任一者置换,
59、(v)与250位相对应的位置的氨基酸残基被亮氨酸置换,
60、(vii)与405位相对应的位置的氨基酸残基被赖氨酸、组氨酸、丝氨酸、谷氨酰胺、酪氨酸和色氨酸中的任一者置换;
61、[12]如[1]~[11]中任一项所述的重组多肽,其中,上述氨基酸序列a中,以序列编号1所示的氨基酸序列为基准,下述位置中的任一者被置换:
62、·与245位相对应的位置以及与250位相对应的位置,
63、·与245位相对应的位置以及与405位相对应的位置,
64、·与250位相对应的位置以及与405位相对应的位置,
65、·与405位相对应的位置以及与418位相对应的位置;
66、[13]如[1]~[12]中任一项所述的重组多肽,其中,上述氨基酸序列a中,以序列编号1所示的氨基酸序列为基准,满足下述中的任一者:
67、·与245位相对应的位置的氨基酸残基为精氨酸,与250位相对应的位置的氨基酸为亮氨酸,
68、·与245位相对应的位置的氨基酸残基为精氨酸,与405位相对应的位置的氨基酸为酪氨酸,
69、·与245位相对应的位置的氨基酸残基为色氨酸,与405位相对应的位置的氨基酸为酪氨酸,
70、·与245位相对应的位置的氨基酸残基为精氨酸,与405位相对应的位置的氨基酸为组氨酸,
71、·与250位相对应的位置的氨基酸残基为亮氨酸,与405位相对应的位置的氨基酸为酪氨酸,
72、·与418位相对应的位置的氨基酸残基为丙氨酸,与405位相对应的位置的氨基酸为苯丙氨酸;
73、[14]一种dna,其编码[1]~[13]中任一项所述的重组多肽;
74、[15]一种重组质粒,其具有[14]中所述的dna;
75、[16]一种重组微生物,其导入有[14]中所述的dna;
76、[17]如[16]中所述的重组微生物,其具有己二酰coa生产能力;
77、[18]一种目标化合物的制造方法,其包括在[1]~[13]中任一项所述的重组多肽、或者[16]或[17]中所述的重组微生物的培养物和/或该培养物的提取物的存在下将己二酰coa转换成5-甲酰基戊酸的步骤,其中,
78、上述目标化合物选自由5-甲酰基戊酸、6-氨基己酸、1,6-二氨基己烷、6-羟基己酸、己烷二醛、6-氨基己醛、6-羟基己醛和1,6-己烷二醇组成的组;
79、[19]如[18]中所述的制造方法,其进一步包括将上述5-甲酰基戊酸转换成6-氨基己酸的步骤,
80、上述目标化合物为6-氨基己酸;
81、[20]如[18]中所述的制造方法,其进一步包括将上述5-甲酰基戊酸转换成6-羟基己酸的步骤,
82、上述目标化合物为6-羟基己酸;
83、[21]如[18]中所述的制造方法,其进一步包括以下步骤:
84、i)将上述5-甲酰基戊酸转换成6-羟基己酸,
85、将上述6-羟基己酸转换成6-羟基己醛,以及
86、将上述6-羟基己醛转换成1,6-己二醇;
87、或者进一步包括以下步骤:
88、ii)将上述5-甲酰基戊酸转换成己烷二醛,
89、将上述己烷二醛转换成6-羟基己醛,以及
90、将上述6-羟基己醛转换成1,6-己二醇;
91、上述目标化合物为1,6-己二醇;
92、[22]如[18]中所述的制造方法,其进一步包括以下步骤:
93、i)将上述5-甲酰基戊酸转换成6-氨基己酸,
94、将上述6-氨基己酸转换成6-氨基己醛,以及
95、将上述6-氨基己醛转换成1,6-二氨基己烷;
96、或者进一步包括以下步骤:
97、ii)将上述5-甲酰基戊酸转换成己烷二醛,
98、将上述己烷二醛转换成6-氨基己醛,以及
99、将上述6-氨基己醛转换成1,6-二氨基己烷;
100、上述目标化合物为1,6-二氨基己烷;
101、[23]如[19]或[22]中所述的制造方法,其中,下述转换利用下述酶进行催化,
102、所述转换为将上述5-甲酰基戊酸转换成6-氨基己酸、将上述己烷二醛转换成6-氨基己醛、以及将上述6-氨基己醛转换成1,6-二氨基己烷,
103、所述酶选自由
104、·4-氨基丁酸-2-氧代戊二酸转氨酶(ec 2.6.1.19)、
105、·腐胺-2-氧代戊二酸转氨酶(ec 2.6.1.82)、
106、·4-氨基丁酸-丙酮酸转氨酶(ec 2.6.1.96)、以及
107、·腐胺-丙酮酸转氨酶(ec 2.6.1.113)
108、组成的组;
109、[24]如[23]中所述的制造方法,其中,上述酶来源于选自由弧菌属和埃希氏菌属组成的组中的微生物;
110、[25]如[21]或[22]中所述的制造方法,其中,下述转换利用属于羧酸还原酶(ec1.2.1.30)的酶进行催化,所述转换为从上述6-羟基己酸转换成6-羟基己醛、从上述5-甲酰基戊酸转换成己烷二醛、以及从上述6-氨基己酸转换成6-氨基己醛;
111、[26]如[25]中所述的制造方法,其中,上述羧酸还原酶来源于选自由分枝杆菌属和诺卡氏菌属组成的组中的微生物;
112、[27]如[20]或[21]中所述的制造方法,其中,下述转换利用下述酶进行催化,
113、所述转换为从上述5-甲酰基戊酸转换成6-羟基己酸、从上述己烷二醛转换成6-羟基己醛、以及从上述6-羟基己醛转换成1,6-己二醇,
114、所述酶为选自由
115、·醇脱氢酶(ec 1.1.1.1)、以及
116、·醇脱氢酶(ec 1.1.1.2)
117、组成的组中的酶;
118、[28]如[27]中所述的制造方法,其中,上述醇脱氢酶来源于选自由埃希氏菌属和芽孢杆菌属组成的组中的微生物;
119、[29]一种重组微生物,其中,
120、具有产生选自由5-甲酰基戊酸、6-氨基己酸、1,6-二氨基己烷、6-羟基己酸、己烷二醛、6-氨基己醛、6-羟基己醛和1,6-己烷二醇组成的组中的至少一者的路径,
121、包含编码下述酶的外源性核酸序列,所述酶为:由序列编号1所示的氨基酸序列构成的酶;或者由与序列编号1所示的氨基酸序列的序列一致性为60%以上、65%以上、70%以上、75%以上、80%以上、85%以上、88%以上、90%以上、93%以上、95%以上、97%以上、98%以上或99%以上的氨基酸序列构成且具有将酰基coa化合物的coa硫酯转换成醛基的还原活性r的酶;
122、[30]一种重组多肽,其中,
123、(a)由与序列编号1所示的氨基酸序列的序列一致性为85%以上、88%以上、90%以上、93%以上、95%以上、97%以上、98%以上或99%以上的氨基酸序列a构成,
124、(b)上述氨基酸序列a中,与由序列编号1所示的氨基酸序列构成的多肽的底物结合部位相对应的位置的氨基酸中的至少一个被置换,
125、(c)具有将酰基coa化合物的coa硫酯转换成醛基的还原活性r。
126、发明的效果
127、根据本发明,能够提供具有酰基coa化合物还原活性的新颖的重组多肽、以及使用了该重组多肽的脂肪族化合物的新颖制造方法。
- 还没有人留言评论。精彩留言会获得点赞!