用于合成鞘氨醇-1-磷酸酯受体激动剂的中间体的制备方法与流程
相关申请的交叉引用本技术基于2021年4月14日提交的韩国专利申请号10-2021-0048767要求优先权权益,该韩国专利申请的全部公开内容作为本说明书的一部分并入。本发明涉及一种用于合成鞘氨醇-1-磷酸酯受体激动剂的主要中间体的制备方法。
背景技术:
1、鞘氨醇-1-磷酸酯(s1p)通过细胞内神经酰胺途径产生,其中神经酰胺为起始物质。神经酰胺通过两种途径产生,其中第一种途径为从头生物合成途径。神经酰胺还由细胞中的细胞膜成分鞘磷脂降解产生。各个组织中的s1p水平由两种生物合成鞘氨醇激酶(sphk)和两种生物可降解s1p磷酸酶(s1p溶解酶和溶血磷脂磷酸酶)控制。已知通过鞘氨醇激酶导致鞘氨醇磷酸化而产生的s1p介导各种细胞应答,如细胞增殖、细胞骨架组织和迁移、粘附和紧密连接组装以及形态发生。s1p以与其它血浆蛋白(包括白蛋白)的组合形式以高水平(100-1000nm)存在于血浆中,而它以低水平存在于组织中。
2、s1p与g蛋白偶联受体s1p受体结合,以显示出各种生物功能。作为s1p受体亚型,迄今已知s1p1至s1p5,分别命名为内皮分化基因(edg)受体1、5、3、6和8。已知s1p受体参与多种生物功能,如白细胞再循环、神经细胞增殖、形态变化、迁移、内皮功能、血管调节和心血管发育。
3、近年来,许多研究已经发现通过这些受体的s1p信号传导过程在与多发性硬化相关的一系列应答(包括炎症应答)和修复过程中起重要作用,实际上,最近已批准非选择性s1p1激动剂作为多发性硬化的治疗剂。s1p受体在许多与诱发多发性硬化相关的细胞中广泛表达。尤其,s1p1受体在免疫系统中起非常重要的作用。s1p1受体主要表达于淋巴细胞如t细胞和b细胞的表面上并响应于s1p,从而参与淋巴细胞再循环。在正常条件下,体液中的s1p浓度高于淋巴组织中,因此s1p浓度差异导致淋巴细胞离开淋巴组织,从而沿输出淋巴循环。然而,当淋巴细胞中的s1p1受体被s1p1激动剂下调时,不会发生淋巴细胞从淋巴组织流出,从而减少了会造成中枢神经系统(cns)炎症和组织损伤的自身侵袭性淋巴细胞的浸润。因此,获得了对多发性硬化的治疗效果。已经批准非选择性s1p1激动剂芬戈莫德作为治疗多发性硬化的口服药物。当它结合至s1p1受体并且被激活时,所述受体被降解或从淋巴细胞表面内在化。因此,反常地,芬戈莫德充当功能性s1p1拮抗剂。
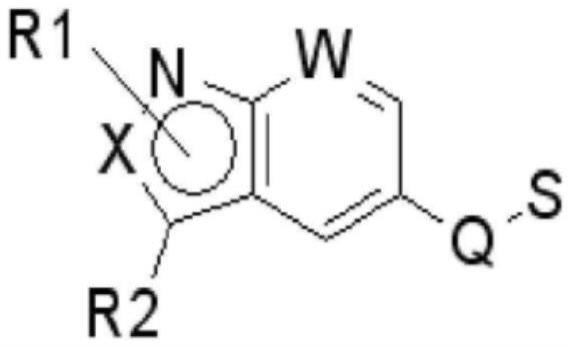
4、关于此类s1p受体激动剂,韩国未审查公开号10-2014-0104376公开了一种新型式1化合物,所述化合物作为s1p受体激动剂是有效的:
5、[式1]
6、
7、其中
8、x为c或n,
9、r1为h或可取代的烷基,
10、r2为h、可取代的烷基、卤素、cn、cf3或cocf3,
11、w为c、n、c-烷氧基、c-卤素或c-cn,
12、q为ch2o或
13、s选自以下部分:
14、
15、在上述结构式中,
16、m和n为0、1、2或3,
17、r3至r10各自为h、烷基、卤素、卤代烷基或烷氧基烷基,
18、r11为h,并且
19、r12为oh,nh2,
20、
21、在上述文件的一个具体示例中,公开了根据以下方案1的1-[1-氯-6-(3-氯-1-异丙基-1h-吲唑-5-基甲氧基)-3,4-二氢-萘-2-基甲基]-哌啶-4-甲酸的制备(在方案1中,“sg35”是指“1-氯-6-羟基-3,4-二氢-萘-2-甲醛”)。
22、[方案1]
23、
24、在上述方案1中,如下更详细地描述1-氯-6-(3-氯-1-异丙基-1h-吲唑-5-基甲氧基)-3,4-二氢-萘-2-甲醛的制备步骤。
25、(1-1)(3-氯-1-异丙基-1h-吲唑-5-基)-甲醇的合成
26、将1h-吲唑-5-甲酸甲酯溶解在二甲基甲酰胺中,在0℃缓慢滴加碘代异丙烷和氢化钠,然后在50℃搅拌8小时。加入1n盐酸溶液,用乙酸乙酯进行萃取。用盐水洗涤萃取物,用无水硫酸镁干燥并过滤。减压蒸馏滤液。通过柱色谱法进行分离,得到1-异丙基-1h-吲唑-5-甲酸甲酯。
27、将上面得到的1-异丙基-1h-吲唑-5-甲酸甲酯溶解在二甲基甲酰胺中,滴加n-氯代琥珀酰亚胺(ncs),然后室温搅拌18小时。加入水,用乙酸乙酯进行萃取。用盐水洗涤萃取物,用无水硫酸镁干燥并过滤。减压蒸馏滤液。通过柱色谱法分离残余物,得到3-氯-1-异丙基-1h-吲唑-5-甲酸甲酯。
28、将上面得到的3-氯-1-异丙基-1h-吲唑-5-甲酸甲酯溶解在四氢呋喃中后,滴加硼氢化锂铝。室温搅拌1小时后,依次加入水、6n氢氧化钠水溶液和水。滴加硅藻土,减压蒸馏滤液。通过柱色谱法分离残余物,得到(3-氯-1-异丙基-1h-吲唑-5-基)-甲醇。
29、(1-2)1-氯-6-羟基-3,4-二氢-萘-2-甲醛的合成
30、首先,在0℃向6-甲氧基-3,4-二氢萘-1(2h)-酮溶解在甲苯中的溶液中滴加n,n-二甲基甲酰胺(dmf)和磷酰氯(氧氯化磷,pocl3),然后在70℃搅拌6小时。将反应混合物倒入冰中,并用乙酸乙酯进行萃取。将有机层用盐水洗涤,干燥并浓缩,然后通过硅胶柱色谱法(己烷:乙酸乙酯=20:1至10:1)纯化所得残余物,得到1-氯-6-甲氧基-3,4-二氢-2-萘甲醛。
31、接下来,在0℃将氯化铝(alcl3)加入到1-氯-6-甲氧基-3,4-二氢-2-萘甲醛溶解在二氯甲烷中的溶液中,然后在50℃搅拌6小时。将反应混合物倒入冰中,并用乙酸乙酯进行萃取。将有机层干燥并浓缩,然后通过硅胶柱色谱法(己烷:四氢呋喃=5:1至3:1)纯化所得残余物,得到1-氯-6-羟基-3,4-二氢-2-萘甲醛。
32、(1-3)1-氯-6-(3-氯-1-异丙基-1h-吲唑-5-基甲氧基)-3,4-二氢-萘-2-甲醛的合成
33、将上面得到的(3-氯-1-异丙基-1h-吲唑-5-基)-甲醇和1-氯-6-羟基-3,4-二氢-2-萘甲醛溶解在甲苯中,然后滴加三丁基膦(pbu3)和1,1'-(偶氮二羰基)二哌啶(add)。将混合物室温搅拌18小时后,向其中加入过量的己烷。过滤并减压蒸馏后,通过柱色谱法纯化残余物,得到1-氯-6-(3-氯-1-异丙基-1h-吲唑-5-基甲氧基)-3,4-二氢-萘-2-甲醛。
34、然而,上述反应在生产临床api时可能存在以下问题:
35、首先,在合成3-氯-1-异丙基-1h-吲唑-5-甲酸甲酯的过程中,可能存在因n2异构体产生比导致的问题。用于合成(3-氯-1-异丙基-1h-吲唑-5-基)-甲醇的氢化锂铝(lah)具有以下缺点:它在用于大规模合成时稳定性非常有限并且容易被水分解。
36、此外,在旨在得到1-氯-6-甲氧基-3,4-二氢-2-萘甲醛的维尔斯迈尔-哈克(vilsmeier-haack)反应的过程中,因在70℃的高温下发生反应而可能存在放热问题。此外,在旨在得到1-氯-6-羟基-3,4-二氢-2-萘甲醛的反应中,可能会因使用alcl3而存在反应器污染问题或因使用危险的试剂而存在稳定性问题。当使用alcl3时,因反应终止或副反应进展导致出现批处理失败而存在稳定性问题,并且总收率为70%,因此需要提高收率。
37、此外,用于(3-氯-1-异丙基-1h-吲唑-5-基)-甲醇与1-氯-6-羟基-3,4-二氢-萘-2-甲醛的偶联的1,1'-(偶氮二羰基)二哌啶(add)就低收率问题和成本而言不是优选的。
38、因此,为了通过更简单的方法以高收率大量生产中间体化合物如1-氯-6-(3-氯-1-异丙基-1h-吲唑-5-基甲氧基)-3,4-二氢-萘-2-甲醛,本发明的发明人发明了一种新合成方法,如下面的方案2所示。
39、[方案2]
40、
41、在上述的方案2中,如下更详细地描述了1-氯-6-(3-氯-1-异丙基-1h-吲唑-6-基甲氧基)-3,4-二氢-萘-2-甲醛的制备步骤(在方案2中,“sg26”是指“6-羟基-3,4-二氢-2h-萘-1-酮”)。
42、(2-1)5-溴甲基-3-氯-1-异丙基-1h-吲唑的合成
43、将二氯甲烷(dcm)、甲基叔丁基醚(mtbe)和(3-氯-1-异丙基-1h-吲唑-5-基)-甲醇放入反应器中,并将内部温度冷却至0℃。将pbr3缓慢滴加到反应中,历时70分钟,然后允许反应进行80分钟。使用hplc进行离子对色谱法(ipc),并完成反应(3%>(3-氯-1-异丙基-1h-吲唑-5-基)-甲醇)。通过缓慢加入氢氧化钠历时120分钟来终止反应。向反应混合物中加入dcm,搅拌30分钟。进行层分离,除去水层,并用水洗涤有机层。然后,减压蒸馏有机层,得到5-溴甲基-3-氯-1-异丙基-1h-吲唑。
44、(2-2)6-羟基-3,4-二氢-2h-萘-1-酮的合成
45、将溶解在水中的hbr和6-甲氧基-3,4-二氢-2h-萘-1-酮放入反应器中,使反应在120℃的外部温度下回流52小时。使用hplc进行ipc,并完成反应(3%>6-甲氧基-3,4-二氢-2h-萘-1-酮)。将内部温度冷却至10℃,并滤出所产生的固体。用水洗涤并用氮气干燥后,得到6-羟基-3,4-二氢-2h-萘-1-酮(sg26)。
46、(2-3)6-(3-氯-1-异丙基-1h-吲唑-5-基甲氧基)-3,4-二氢-2h-萘-1-酮的合成
47、将5-溴甲基-3-氯-1-异丙基-1h-吲唑、6-羟基-3,4-二氢-2h-萘-1-酮、k2co3和dmf放入反应器中,并在25℃的内部温度下反应3小时。使用hplc进行ipc。剩余5%的6-羟基-3,4-二氢-2h-萘-1-酮。因此,额外加入5-溴甲基-3-氯-1-异丙基-1h-吲唑以完成反应(1%>6-羟基-3,4-二氢-2h-萘-1-酮)。向反应器中加入水,将内部温度冷却至0℃,然后滤出所产生的固体。滤出的固体分别用水和mtbe依次洗涤,然后用氮气干燥,得到6-(3-氯-1-异丙基-1h-吲唑-5-基甲氧基)-3,4-二氢-2h-萘-1-酮。
48、(2-4)1-氯-6-(3-氯-1-异丙基-1h-吲唑-6-基甲氧基)-3,4-二氢-萘-2-甲醛的合成
49、将磷酰氯(pocl3)放入反应器中,并将内部温度冷却至0℃。缓慢滴加dmf,在50℃的内部温度下搅拌2小时,加入6-(3-氯-1-异丙基-1h-吲唑-5-基甲氧基)-3,4-二氢-2h-萘-1-酮,并在50℃的内部温度下反应3小时。反应过程中生成了过量的hcl气体。因此,安装通风管线,使得过量的hcl气体可以通过naoh捕集进行中和。使用hplc进行ipc,并完成反应。将内部温度冷却至0℃,然后将冷水、己烷(hex)和mtbe加入另一个反应器。缓慢滴加上述反应混合物,历时90分钟,以形成晶体。滤出所产生的固体,分别用水和mtbe/hex混合溶剂依次洗涤,并干燥,得到1-氯-6-(3-氯-1-异丙基-1h-吲唑-6-基甲氧基)-3,4-二氢-萘-2-甲醛。
50、利用上述方案,可以提高n2异构体的产率,可以解决由维尔斯迈尔-哈克反应导致的放热问题,并且可以在无add的情况下进行偶联反应。因此,有望在确保化合物稳定性和制造条件稳定性的同时,通过更简单的方法大量生产用于鞘氨醇-1-磷酸酯受体激动剂合成的关键中间体。
51、然而,由于在对通过上述合成方法最终产生的物质进行api加工的过程中仍需要进一步减少杂质,因此需要不断地对上述合成方法的每一步进行研究。
技术实现思路
1、技术问题
2、因此,本发明的一个方面是提供一种适用于以高收率和高纯度生产式4化合物的方法,所述化合物是优良的鞘氨醇-1-磷酸酯受体激动剂的新型合成方法中的关键中间体:
3、[式4]
4、
5、其中
6、r1为氢或者取代或未取代的烷基,
7、r2为氢、取代或未取代的烷基、卤素、cn、cf3或cocf3,
8、x为c或n,并且
9、l为离去基团。
10、技术方案
11、根据本发明的一个方面,提供了一种制备下式4的中间体化合物的方法,所述方法包括:1)在醇类溶剂和醇盐的存在下对式2化合物进行还原反应以得到式3化合物的步骤;以及2)用离去基团取代所述式3化合物的醇基团的步骤:
12、[式2]
13、
14、[式3]
15、
16、[式4]
17、
18、其中
19、r1为氢或者取代或未取代的烷基,
20、r2为氢、取代或未取代的烷基、卤素、cn、cf3或cocf3,
21、r3为取代或未取代的烷基,
22、x为c或n,并且
23、l为离去基团。
24、当‘烷基’被取代时,可能有一个或多个取代基,所述取代基可以各自独立地选自卤素、氰基、羟基、烷氧基、酮基、未取代的磺酰基以及烷基取代的磺酰基。
25、根据本发明的一个实施方式,上述各式的r1可以为氢或者c1-c6取代或未取代的烷基,r2可以为氢、c1-c6取代或未取代的烷基、卤素、cn、cf3或cocf3。r3可以为c1-c6取代或未取代的烷基。
26、根据本发明的另一个实施方式,r1可以为c1-c4取代或未取代的烷基,r2可以为卤素(f、cl、br或i)。r3可以为c1-c4取代或未取代的烷基,例如甲基。
27、根据本发明的一个实施方式,离去基团(l)为在式4化合物与醇类化合物进行取代反应时为式4化合物提供取代位置的反应基团,并且可以但不限于选自氯(cl)、溴(br)、碘(i)、甲磺酸酯(oms)、对甲苯磺酸酯(ots)和三氟甲磺酸酯(otf)。
28、根据本发明的另一个实施方式,l可以为br。
29、在本发明中,在步骤1)中,在醇类溶剂和醇盐的存在下进行式2化合物的还原反应,得到式3化合物。
30、具体地,步骤1)旨在将式2化合物的酯基团还原为醇。
31、对于式2化合物的还原反应,可以使用常用于将酯基团还原为醇的还原剂。还原剂可以是但不限于选自硼氢化钠(nabh4)、硼氢化锂(libh4)、硼烷(bh3)和二异丁基氢化铝(dibah)的至少一种。
32、步骤1)中的还原反应可以在极性溶剂中进行,以便为式2化合物和还原剂提供高溶解度。例如,还原反应可以在水、极性有机溶剂或其混合溶剂中进行。
33、在本发明中,用于步骤1)中的还原反应的反应溶剂包括醇类溶剂。取决于式2化合物和还原剂,可以适当地选择和使用醇类溶剂。例如,可以使用选自甲醇、乙醇、正丙醇、异丙醇、正丁醇、仲丁醇、异丁醇和叔丁醇的至少一种,但本发明不限于此。
34、在本发明的一个实施方式中,用于步骤1)中的还原反应的反应溶剂可以包括甲醇。
35、在本发明的另一个实施方式中,用于步骤1)中的还原反应的反应溶剂可以包括水和四氢呋喃(thf)。
36、在本发明中,用于还原反应的还原剂在极性溶剂,如醇类溶剂中会生成氢气,从而导致降低反应稳定性的问题,或者可能导致过度还原式2化合物,进一步导致还原烯烃基团,从而导致形成杂质的问题。
37、因此,本发明提供了一种通过在步骤1)中的反应中使用醇盐作为添加剂并通过抑制过度还原以减少杂质形成来稳定还原反应的制备方法。
38、在本发明的一个实施方式中,可以选择和使用与醇类溶剂无关的醇盐,或者可以选择和使用与醇类溶剂对应的醇盐。
39、在本发明的另一个实施方式中,醇盐可以包括具有与醇类溶剂的烷基基团相同的烷基基团的醇盐。
40、在本发明的另一个实施方式中,醇类溶剂可以包括甲醇,醇盐可以包括甲醇盐。
41、在本发明的一个实施方式中,用于还原反应的还原剂可以包括金属阳离子,其中醇盐中的金属离子可以与还原剂的金属离子不同/相同。
42、在本发明的另一个实施方式中,醇盐可以包括与还原反应中使用的还原剂内的金属离子相同的金属离子。
43、在本发明的另一个实施方式中,在步骤1)中,可以通过在甲醇溶剂和甲醇钠的存在下对式2化合物进行还原反应来得到式3化合物。
44、根据本发明的一个实施方式,在式2化合物的还原反应中,可以在反应开始时将还原剂和溶剂一起加入,然后可以随着反应的进行额外加入还原剂。在额外加入还原剂时,可以将反应开始时加入的溶剂一起加入,也可以只加入还原剂而不加入溶剂。
45、根据本发明的另一个实施方式,通过在步骤1)中使用醇盐作为添加剂,仅使用最初加入的还原剂而在还原反应过程中不额外加入还原剂可以终止还原反应,因此可以改善工艺稳定性。但本发明不限于此。
46、根据本发明的另一个实施方式,通过在步骤1)中使用醇盐作为添加剂,还原反应可以在60℃以下,例如40℃至55℃、45℃至50℃的温度下进行,从而可以降低工艺温度。但本发明不限于此。
47、在本发明的一个实施方式中,步骤1)中的醇盐的含量可以为例如1摩尔%至5摩尔%,具体为2摩尔%至3摩尔%,更具体为2.5摩尔%。使用上述含量的醇盐可以提高产物的纯度和工艺效率。但本发明的效果不限于此。
48、在本发明的另一个实施方式中,与式2化合物相比,步骤1)中使用的醇类溶剂的量可以是例如0.1倍至5倍,例如0.4倍至3.6倍、1倍至3倍、1.5倍至2倍或1.6倍。使用上述量的醇类溶剂可以提高产物的纯度和工艺效率。但本发明的效果不限于此。
49、在本发明的另一个实施方式中,步骤1)中使用的还原剂的量可以为例如1至5当量、1.4至4.6当量、2至4当量或3当量。使用上述量的还原剂可以提高产物的纯度和工艺效率。特别地,在进行还原过程时,使用上述量的还原剂可以使得能够在反应开始时加入还原剂后,在工艺过程中不再加入还原剂的情况下完成反应。因此,可以大大提高工艺稳定性。但本发明的效果不限于此。
50、在本发明的另一个实施方式中,在步骤1)中,在1.6倍量的甲醇溶剂和2.5摩尔%的甲醇钠的存在下,可以使用3当量的nabh4进行还原反应。
51、在本发明中,步骤1)还可以包括纯化以提高产物的纯度。
52、纯化可以在酸性条件下进行,以除去由步骤1)的还原反应过程中过度还原形成的杂质。
53、例如,酸性条件可以通过将酸化合物加入反应产物中来形成,其中所述酸化合物可以是但不限于选自氯化氢(hcl)和溴化氢(hbr)的至少一种。
54、在本发明的一个实施方式中,可以通过向反应产物中加入酸化合物、然后萃取有机层来进行步骤1)中的纯化。
55、在本发明的另一个实施方式中,可以通过洗涤反应产物、加入hcl、搅拌、然后萃取有机层来进行步骤1)中的纯化。
56、在本发明的一个实施方式中,欲加入的氯化氢可以按3n至8n,例如5n至7n或6n使用。
57、在本发明的一个实施方式中,可以在0℃至20℃的温度下进行纯化。
58、在本发明的另一个实施方式中,可以在保持0℃的同时进行纯化。
59、在本发明的一个实施方式中,可以通过向反应产物中额外加入有机溶剂、然后萃取有机层来进行纯化。
60、用于萃取有机层的溶剂可以在需要时适当地选择和使用。例如,可以使用甲苯、乙酸乙酯、甲基叔丁基醚、四氢呋喃、甲醇、二氯甲烷或其混合物。但本发明不限于此。
61、在本发明的一个实施方式中,通过向反应产物中额外加入甲苯,可以在含有甲苯的有机溶剂的存在下进行纯化。在向反应产物中加入甲苯,加入酸化合物,然后萃取有机层时,可以有效地提高反应产物的纯度,但本发明的效果不限于此。
62、在本发明的另一个实施方式中,在纯化时,向反应产物中加入甲苯以溶解残留物、用水洗涤、向有机层中加入氯化氢、搅拌、然后除去水层的程序可以进行至少一次,例如两次。
63、在本发明中,在步骤2)中,式3化合物的醇基团被离去基团取代。
64、在本发明中,通过用离去基团取代式3化合物的末端醇基团,得到了鞘氨醇-1-磷酸酯受体激动剂合成中的关键中间体,即式4化合物。式4化合物中包括离去基团可以提高后续鞘氨醇-1-磷酸酯受体激动剂合成中的偶联反应的收率。
65、在本发明的一个实施方式中,‘用离去基团取代醇基团的步骤’(下文称为‘离去基团取代步骤’)可以在极性有机溶剂的存在下进行。
66、在本发明的另一个实施方式中,可以在dcm和mtbe的存在下进行离去基团取代步骤。
67、在本发明的另一个实施方式中,可以在醚类单一溶剂中进行离去基团取代步骤。在醚类单一溶剂中进行离去基团取代步骤可以显著降低n2异构体的产率。但本发明的效果不限于此。
68、‘单一溶剂’是指反应器中只包括一种用于离去基团取代反应的溶剂。单一溶剂也不排除包括与基本上不影响离去基团取代反应的反应器中的反应产物收率的水平相对应的痕量的异质溶剂。例如,以离去基团取代反应的溶剂总体积计,包括含量为5体积%以下、4体积%以下、3体积%以下、2体积%以下、1体积%以下、0.5体积%以下、或0体积%(即,完全不包括)的异质溶剂可以称为使用了单一溶剂。
69、醚类溶剂的示例包括但不限于二烷基醚类溶剂,如二乙基醚、二丙基醚、二丁基醚、二异戊基醚、乙基甲基醚、甲基丙基醚、甲基丁基醚和乙基丙基醚;芳基烯丙基醚类溶剂,如二苯基醚和苯甲醚;或环醚类溶剂,如四氢呋喃和四氢吡喃;等等。
70、在本发明的一个实施方式中,所述醚类单一溶剂可以是甲基叔丁基醚(mtbe)。
71、在本发明的另一个实施方式中,通过将式3化合物与mtbe混合、冷却至0℃、并使式3化合物与pbr3反应,可以得到式4化合物。
72、在本发明的另一个实施方式中,通过将式3化合物与mtbe混合、冷却至0℃、使式3化合物与pbr3反应、在完成反应后用水洗涤并进行过滤,可以得到式4化合物。
73、在另一个方面,根据本发明,通过将r1和r2取代基引入式5化合物,可以制备式2化合物:
74、[式5]
75、
76、其中r1、r2、r3和x如上式2中所定义。
77、r1和r2的取代可以按以下顺序:r1取代然后r2取代,r2取代然后r1取代,或r1和r2同时取代。
78、在本发明的一个实施方式中,在式5化合物中,r2可以在r1前取代。当体积较大的r1首先取代在式5化合物中时,例如,在体积较大的r1首先取代在x为n的吲唑的3位上时,可以抑制n2异构体产生,并且可以提高收率。
79、用于引入r1和r2取代基的反应可以在相同溶剂或不同的溶剂组合物中进行。
80、在本发明的一个实施方式中,用于引入r1和r2取代基的反应可以在相同的溶剂中进行。
81、在本发明的一个实施方式中,用于引入r1和r2取代基的反应的反应溶剂可以包括例如酰胺类有机溶剂。酰胺类有机溶剂可以包括例如选自二甲基甲酰胺(dmf)和二甲基乙酰胺(dma)的至少一种。
82、在本发明的另一个实施方式中,用于引入r1和r2取代基的反应的反应溶剂可以包括二甲基乙酰胺。
83、在本发明的另一个实施方式中,用于引入r1和r2取代基的反应的反应溶剂可以是单独的二甲基乙酰胺。
84、在用于引入r1和r2取代基的反应中,当反应溶剂不稳定并因此分解时,分解产物可能与合成反应的反应物反应而诱导热的释放,从而产生过量的杂质并降低反应产物的纯度。就此而言,由于以二甲基甲酰胺为反应溶剂的合成反应的合成反应最高温度和绝热温升程度要高于以二甲基乙酰胺为反应溶剂的合成反应,因此可能优选使用二甲基乙酰胺作为合成反应的反应溶剂。
85、在本发明的一个实施方式中,当在二甲基甲酰胺溶剂中进行合成反应时,热的释放可能由二甲基甲酰胺分解形成的二甲胺与用于在r2位置上引入cl的n-氯代琥珀酰亚胺(ncs)之间的反应诱导,而在式5化合物中除r2以外的位置上引入了cl的杂质可能由内部温度升高形成。因此,可能有降低式2化合物和后续工艺的纯度的问题。
86、在本发明的一个实施方式中,通过在用于引入r1和r2的步骤中向式5化合物引入r1和r2取代基并使用包括醇溶剂的结晶溶剂进行结晶,可以制备式2化合物。
87、用于结晶的‘醇溶剂’可以是例如但不限于选自甲醇、乙醇、异丙醇和丁醇的一种或多种溶剂。
88、在本发明的一个实施方式中,结晶溶剂可以是醇溶剂与水的混合溶剂。使用醇溶剂与水的混合溶剂作为结晶溶剂可以降低n2异构体的收率。
89、在本发明的另一个实施方式中,关于用于结晶的混合溶剂,就式5的收率而言,醇溶剂与水的体积比可以是5:1至1:5、4:1至1:4、3:1至1:3、2:1至1:2、2:1至1:1或1.5:1至1:1。
90、在本发明的一个实施方式中,结晶溶剂可以是乙醇与水的混合溶剂。具体地,乙醇和水可以按2:1至1:2、2:1至1:1、1.5:1至1:1或1:1的etoh:h2o体积比使用。
91、在本发明的另一个实施方式中,当结晶溶剂为醇溶剂与水的混合溶剂时,醇溶剂和水可以在结晶过程中依次或同时加入。
92、在本发明的另一个实施方式中,通过向已引入取代基的反应产物中加入醇溶剂如etoh、冷却到0至20℃、或者在室温下加入水以进行结晶,可以得到式5化合物。
93、在本发明的一个实施方式中,在结晶前,可以对已经引入了取代基的反应产物进行纯化,然后结晶。纯化反应产物可以除去反应中使用的未反应的残留化合物,因此提高结晶收率。
94、纯化可以使用例如极性溶剂来进行,所述极性溶剂可以是例如极性有机溶剂、水或其混合溶剂。
95、极性有机溶剂可以是但不限于选自乙酸乙酯(ea)、乙酸异丙酯(ipoac)、二氯甲烷和己烷的一种或多种溶剂。
96、在一个实施方式中,根据本发明,使用极性有机溶剂与水的混合溶剂纯化已经引入了取代基的反应产物,然后进行结晶,可以防止反应中用于引入取代基的k2co3在反应产物结晶过程中沉淀或减少沉淀量,从而提高晶体的纯度。
97、根据本发明制备的化合物可以用作鞘氨醇-1-磷酸酯受体激动剂合成的关键中间体。根据本发明制备的化合物可以用作已知鞘氨醇-1-磷酸酯受体激动剂合成方法的关键中间体,还可以用作在本技术后开发的新合成方法的关键中间体。然而,本发明的用途不局限于具体的鞘氨醇-1-磷酸酯受体激动剂合成方法。
98、此外,根据本发明制备的化合物可以用于除鞘氨醇-1-磷酸酯受体激动剂合成以外的其它目的,并且本发明的用途不局限于鞘氨醇-1-磷酸酯受体激动剂合成。
99、有益效果
100、使用本发明的制备方法可以以高纯度和高收率大量生产式4化合物。
- 还没有人留言评论。精彩留言会获得点赞!