杂芳基衍生物、其制备方法以及包括其作为活性成分的药物组合物与流程
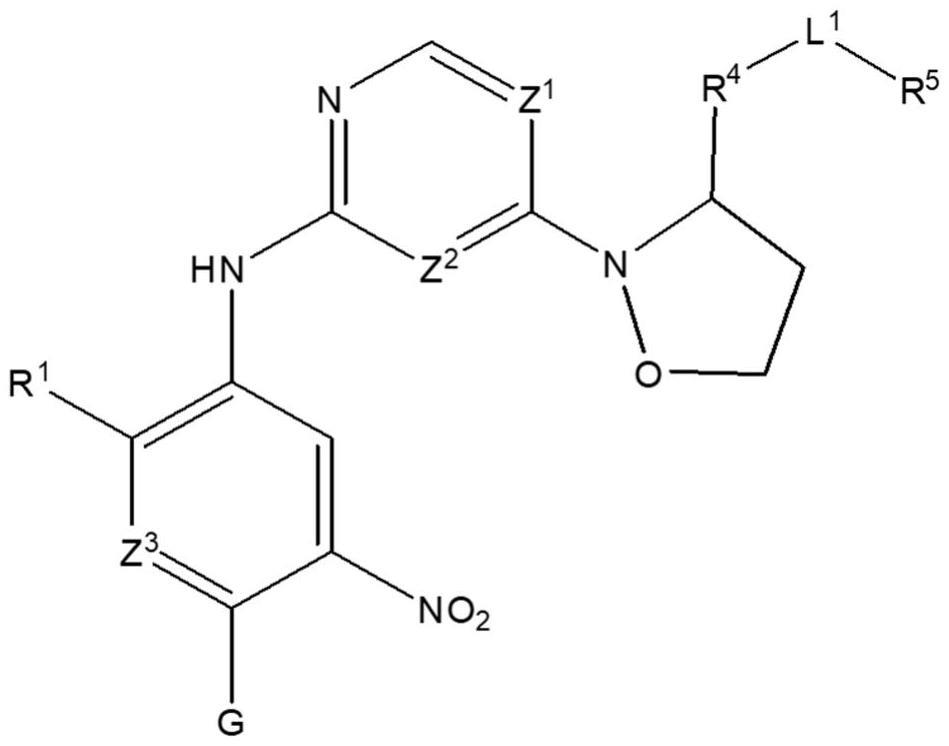
本发明涉及杂芳基衍生物,以及更特别地,涉及异噁唑烷-2-基取代的杂芳基衍生物、其异构体、其溶剂化物、其水合物、其药学上可接受的盐,其制备方法,以及包括其作为活性成分的用于预防或治疗癌症的药物组合物。
背景技术:
1、癌症的发生与各种环境因素相关,包括化学品、辐射和病毒,以及癌基因、肿瘤抑制基因、细胞凋亡和与dna修复相关的基因的变化。近来,随着这样的癌症分子机制被了解,可以进行癌症靶向治疗,这是一种新的治疗方法。靶向治疗可以通过通常靶向特征为癌细胞的分子来发挥它们的作用。分子靶标是参与癌细胞的信号转导途径、血管生成、细胞基质、细胞周期调控或细胞凋亡的基因。目前正在使用的重要靶向治疗包括‘信号转导途径抑制剂’(包括酪氨酸激酶抑制剂)和‘血管生成抑制剂’。已知蛋白酪氨酸激酶在各种恶性肿瘤中起重要作用。特别地,erbb家族的受体酪氨酸激酶具有四种主要亚型(erbb1、erbb2、erbb3和erbb4)。已知erbb家族的受体酪氨酸激酶的激活导致持续的细胞增殖、周围组织的浸润、远处转移以及血管生成,并增加细胞存活。
2、特别地,erbb家族的受体酪氨酸激酶具有细胞外配体结合结构域(ecd)以及包括酪氨酸激酶结构域的细胞内结构域,并且可以包括egfr(称为erbb1或her1)、her2(称为erbb2或her2/neu)、erbb3和erbb4(称为her4)。当配体与形成同二聚体或异二聚体的受体结合时,细胞内酪氨酸激酶被激活,并且以这种方式由erbb刺激的信号激活磷脂酰肌醇3-激酶(pi3k/akt/mtor、ras/raf/mapk、jak/stat)信号转导途径(非专利文件0001)。
3、特别地,已知her2蛋白在包括乳腺癌的各种实体癌中过表达和激活,并且可以通过诱导与上述提及的pi3k相关联的信号转导的激活而导致实体癌的形成。此外,已知癌症不仅由野生型her2诱导,而且由各种突变诱导。作为her2的主要突变,ecd中的s310/y是已知的,并且激酶结构域(kd)中的l755s、v777l、d769h/y和l755_t759del是已知的(非专利文件0002)。
4、代表性的her2单克隆抗体,诸如曲司珠单抗(trastuzumab)(herceptintm)和珀妥珠单抗(pertuzumab)(perjetatm),抑制her2信号传导机制,并因此用作用于治疗乳腺癌的药物。通过缀合对her2选择性抗体具有毒性的药物制成的抗体-药物缀合物(adc)正在被用作或开发为相关的治疗剂,并且t-dm1(kadcylatm)是代表性的实例。此外,药物,诸如小分子化合物拉帕替尼(lapatinib)(tykerbtm)、奈拉替尼(neratinib)(nerlynxtm)和图卡替尼(tucatinib)(tukysatm)已被开发并用作用于治疗乳腺癌的药物。除了用于乳腺癌的药物外,正在积极进行用于各种癌(诸如胃部癌、胆囊癌、结直肠癌、非小细胞肺癌和肾癌)的药物的临床试验(非专利文件0002)。
5、已知当给药上述药物时,通过各种替代信号传导机制,诸如erbb1、erbb3、igf1r、axl和met诱导耐药性。即使在给药小分子药物拉帕替尼或奈拉替尼时,已知作为激酶结构域中的看门(gatekeeper)的苏氨酸残基798(t798)突变为甲硫氨酸(m)或异亮氨酸(i),导致耐药性,以及需要克服对这样的药物的耐性的her2抑制剂(非专利文件0003)。
6、[相关技术文件]
7、[非专利文件]
8、(非专利文件0001)nat rev cancer 2007;7:169-81。
9、(非专利文件0002)nature reviews clinical oncology 2020;17:33-48。
10、(非专利文件0003)clin cancer res 2019;25:2033-2041
11、公开内容
12、[技术问题]
13、本发明涉及提供一种可用于预防或治疗癌症的化合物,其异构体、其溶剂化物、其水合物或其药学上可接受的盐,其对erbb2和erbb4中的一种或多种的野生型或突变体表现出抑制活性。
14、本发明还涉及提供一种制备所述化合物的方法。
15、本发明还涉及提供一种用于预防或治疗癌症的药物组合物,所述药物组合物包含所述化合物、其异构体、其溶剂化物、其水合物或其药学上可接受的盐作为活性成分。
16、本发明还涉及提供一种用于通过抑制erbb2和erbb4中的一种或多种的野生型或突变体来预防或治疗癌症的药物组合物。
17、[技术方案]
18、在一方面,
19、本发明提供了一种由式1表示的化合物、其异构体、其溶剂化物、其水合物或其药学上可接受的盐:
20、[式1]
21、
22、在式1中,
23、z1和z2各自独立地是ch或n,
24、z3是ch、n或cr6,其中r6是哌啶基或哌嗪基,其中所述哌啶基或哌嗪基是未取代的或被c1-8烷基或哌嗪基取代,
25、r1是氢、卤素、c1-8烷氧基、c1-8烷基、c1-8卤代烷氧基或c1-8卤代烷基,
26、r2是氢、卤素、c1-8烷氧基、c1-8硫代烷氧基或-nr7r8,
27、其中r2中的所述c1-8烷氧基或c1-8硫代烷氧基是未取代的或被c1-8烷基氨基取代,
28、其中r7和r8各自独立地是氢或c1-8烷基,或r7和r8与它们所键合的n原子一起连接形成3至12元杂环烷基,
29、其中r7和r8中的所述c1-8烷基或3至12元杂环烷基各自独立地是未取代的或者被选自由以下组成的组中的一个或多个取代基r9取代:卤素、c1-8烷基、c1-8烷氧基、c1-8烷基氨基、c1-8烷基羰基、c1-8烯基、氧亚基(=o)、c1-8烷氧基乙酰基、c1-8烷基磺酰基、羟基-c1-8烷基、3至12元环烷基以及3至12元杂环烷基,
30、其中所述取代基r9各自独立地是未取代的或者进一步被选自由以下组成的组中的一个或多个取代基r10取代:卤素、c1-8烷基、c1-8烷氧基、c1-8烷基羰基、氧亚基(=o)、c1-8烷基磺酰基、3至12元环烷基、3至12元杂环烷基以及c1-8烷基氨基,
31、其中所述取代基r10是未取代的或者进一步被c1-8烷基或3至12元环烷基取代,
32、r3是-nh(c=o)r11c=cr12r13或-nh(c=o)c≡cr14,
33、其中r11、r12、r13和r14各自独立地是氢、卤素、未取代的c1-8烷基或被c1-8烷基氨基取代的c1-8烷基,或未取代的c3-8杂环烷基或被c1-8烷基取代的c3-8杂环烷基,
34、r4是苄基、4至8元芳基或4至8元杂芳基,
35、l1是-o-、-o(ch2)n-、-c≡c-、-(ch2)n-、-c(=o)o-、-c(o)nh-或直接键,其中n是1至3的整数,
36、当l1是直接键、-o-、-(ch2)n-或-o(ch2)n-时,r5是3至12元杂环烷基、4至12元芳基或4至12元杂芳基,
37、当l1是-c≡c-、-c(=o)o-或-c(o)nh-时,r5是氢、c1-8烷基、3至12元环烷基、4至12元芳基或4至12元杂芳基,以及
38、其中r4和r5各自独立地是未取代的或被选自由以下组成的组中的一个或多个非氢取代基取代:卤素、c1-8烷基、c1-8卤代烷基、氧亚基(=o)、羟基、c1-8烷氧基、酰胺、c1-8烷基酰胺、c1-8烷基羧基、c1-8烷基氨基以及氰基,其中当r5是氢或c1-8烷基时,r5是未取代的或被羟基取代。
39、在另一方面,本发明提供了一种制备式1的化合物的方法,所述方法包括:
40、由式2的化合物制备式3的化合物的步骤;
41、由所述式3的化合物制备式4的化合物的步骤;以及
42、由所述式4的化合物制备式1的化合物的步骤。
43、[式2]
44、
45、[式3]
46、
47、[式4]
48、
49、[式1]
50、
51、在上述式中,g是离去基团,z1至z3、l1以及r1至r5各自独立地与上文所定义的相同。
52、在仍另一方面,本发明提供了一种用于预防或治疗癌症的药物组合物,所述药物组合物包含本发明的化合物、其异构体、其溶剂化物、其水合物或其药学上可接受的盐作为活性成分。
53、在又另一方面,本发明提供了一种预防或治疗癌症的方法,所述方法包括向有此需要的受试者给药本发明的化合物、其异构体、其溶剂化物、其水合物或其药学上可接受的盐。
54、在又另一方面,本发明提供了本发明的化合物、其异构体、其溶剂化物、其水合物或其药学上可接受的盐用于预防或治疗癌症的用途。
55、[有益效果]
56、由于在本发明的一个方面中提供的化合物、其异构体、其溶剂化物、其水合物或其药学上可接受的盐对erbb2和erbb4中的一种或多种的野生型或突变体表现出高抑制活性,因此其可有效地用于治疗在其中表达激酶的癌症。
57、发明方式
58、将参照下面实施方式详细地描述本发明。
59、本发明的实施方式可以以许多不同的形式进行修改,并且本发明的范围不限于以下描述的实施方式。此外,提供本发明的实施方式是为了向本领域普通技术人员更完整地解释本发明。
60、在整个本说明书中,当某种部分(part)“包括”某种组分时,这意指,除非另有特别说明,否则可以进一步包括另外的组分,而不是排除其他组分。
61、在本说明书的结构式中,用于键合原子和/或基团的符号“-”可以指单键,并且符号“=”可以指双键。这些符号可以省略,并且可以在必要时显示,例如,当指定键合原子或键合位置时。
62、在本说明书中,原子之间的术语“连接”不仅可以表示直接连接原子的情况,还可以表示经由另外的原子和/或基团间接连接原子的情况。这里,另外的原子和/或基团可以是氧、硫、c1-8烷基氨基或c1-8亚烷基,但本发明不限于此。原子和/或基团可以是取代的或未取代的。
63、在本说明书中,“卤素”可以是f、cl、br或i。
64、在本说明书中,除非另有说明,否则“烷基”可以指直链或支链的非环状烷基;环状烷基;或者在其中这些烷基类型组合的饱和烃。此外,“c1-8烷基”可以指包含1至8个碳原子的烷基。非环状烷基可以包括,例如,甲基、乙基、正丙基、正丁基、异丙基、仲丁基、异丁基、叔丁基、异戊基或2-甲基戊基,但本发明不限于此。环状烷基可以包括例如环丙基、环丁基、环戊基或环己基,但本发明不限于此。在其中非环状烷基和环状烷基组合的烷基可以包括,例如,甲基环丙基、环丙基甲基、乙基环丙基或环丙基乙基,但本发明不限于此。
65、在本说明书中,当描述“环烷基”时,它可以特别意指烷基中的环状烷基,并且这里,烷基如上所述定义。
66、在本说明书中,“烷氧基”可以指烷基醚基团,-(o-烷基),在其中烷基如上所述定义。此外,“c1-8烷氧基”可以指含c1-8烷基的烷氧基,即(o-c1-8烷基)。
67、在本说明书中,“杂环烷基”可以指包含选自为形成环的原子的n、o和s的1至5个杂原子的环,并且可以是饱和的或部分不饱和的。除非另有说明,杂环烷基可以是单环,或多环,诸如螺环、桥环或稠环。此外,“3至12元杂环烷基”可以指包括形成环的3至12个原子的杂环烷基,并且作为实例,杂环烷基可以是吡咯烷、哌啶、n-甲基哌啶、咪唑烷、吡唑烷、丁内酰胺、戊内酰胺、咪唑烷酮、乙内酰脲、二氧戊环、邻苯二甲酰亚胺哌啶、嘧啶-2,4(1h,3h)-二酮、1,4-二噁烷、吗啉、硫代吗啉、硫代吗啉-s-氧化物、硫代吗烷-s,s-氧化物、哌嗪、吡喃、吡啶酮、3-吡咯啉、噻喃、吡喃酮、四氢呋喃、四氢噻吩、奎宁环(quinuclidine)、莨菪烷(tropane)、2-氮杂螺[3.3]庚烷、(1r,5s)-3-氮杂双环[3.2.1]辛烷、(1s,4s)-2-氮杂双环[2.2.2]辛烷或(1r,4r)-2-氧杂-5-氮杂双环[2.2.2]辛烷,但本发明不限于此。
68、在本说明书中,“烷基氨基”可以指-(nr′r″),在其中r′和r″各自独立地选自由氢和烷基组成的组,并且所选的r′和r″各自独立地是取代的或未取代的。此外,“c1-8烷基氨基”可以指含c1-8烷基的氨基,即-n-h(c1-8烷基)或-n-(c1-8烷基)2,并且可以是二甲基氨基、二乙基氨基、甲基乙基氨基、甲基丙基氨基或乙基丙基氨基,但本发明不限于此。
69、在本说明书中,“卤代烷基”可以指-rx(x是一个或多个卤素(f、cl、br或i)),也就是说,“卤代烷基”可以是被一个或多个卤素取代的烷基形式。例如,“c1-8卤代烷基”可以是三氟甲基或二氟甲基,但本发明不限于此。
70、在本说明书中,“卤代烷氧基”可以指-(o-rx)(x是一个或多个卤素(f、cl、br或i)),也就是说,“卤代烷氧基”可以是被一个或多个卤素取代的烷氧基形式。例如,“c1-8卤代烷氧基”可以是三氟甲氧基或二氟甲氧基,但本发明不限于此。
71、在本说明书中,“芳基”可以是指从芳烃环中去除一个氢的芳环,并且可以是单环或多环。“c3-12芳基”可以是指包括形成环的3至12个原子的芳基,并且可以是例如苯基、苄基、萘基、蒽基、菲基、联苯基或三联苯基,但本发明不限于此。
72、在本说明书中,“杂芳基”可以指包含n、o和s中的一个或多个杂原子作为形成环的原子的芳环,并且可以是单环或多环。此外,“c3-12杂芳基”可以是指包括形成环的3至12个原子的杂芳基,并且可以是例如噻吩基(thienyl)、噻吩基(thiophenyl)、呋喃基、吡咯基、吡唑基、咪唑基、噻唑基、噁唑基、异噻唑基、噁二唑基、三唑基、吡啶基、联吡啶基、嘧啶基、三嗪基、吖啶基、哒嗪基、吡嗪基、喹啉基或喹唑啉,但是本发明不限于此。
73、在本说明书中,“羟基”可以指-oh。
74、在本说明书中,“羰基”可以指-(c=(o))-,并且当环状烷基、芳基或杂环烷基被羰基取代时,它可以指在其中氢原子(=o)被取代的情况。
75、在本说明书中,“烷基羰基”可以指-(c(=o)-烷基),在其中烷基如上所述定义。此外,“c1-8烷基羰基”可以指含c1-8烷基的羰基,即-(c(=o)-c1-8烷基),并且可以是例如甲基羰基(乙酰基,-(c=(o)-ch3))、乙基羰基、正丙基羰基、异丙基羰基、正丁基羰基、环戊基羰基或环己基羰基,但是本发明不限于此。
76、在本说明书中,除非另有说明,“烯基”可以指具有一个或多个双键的直链或支链、非环状或环状烃。
77、在本说明书中,“烯基羰基”可以指-(c(=o)-烯基),在其中烯基可以如上所述定义。此外,“c2-8烯基羰基”可以指含c2-8烯基的羰基,即(c(=o)-c2-8烯基)。
78、在本说明书中,“氰基”可以是指-(cn)。
79、在本说明书中,除非另有说明,“炔基”可以指具有一个或多个三键的直链或支链、非环状或环状烃。
80、在本说明书中,“芳烷基”可以指-(烷基-芳基),在其中烷基和芳基可以如上所述定义。此外,“3至8元芳烷基”可以指具有3至8个碳原子的芳烷基。
81、在本说明书中,“烷基磺酰基”可以指-s(=o)2-烷基,在其中烷基可以如上所述定义。在一种实例中,烷基磺酰基可以是甲基磺酰基、乙基磺酰基或丙基磺酰基,但本发明不限于此。
82、在本说明书中,“烷氧基乙酰基”可以指-c(=o)-ch2-烷氧基,在其中烷氧基可以如上所述定义。
83、在本说明书中,“烷基羧基”可以指-c(=o)o-烷基,在其中烷基可以如上所述定义。
84、在本说明书中,“烷基酰胺”可以指-c(=o)-n-(r'r″),在其中r′和r″可以指上文定义的烷基。
85、在本说明书中,“酰胺”可以指在其中r′和r″是氢的“烷基酰胺”。
86、在本说明书中,“水合物”可以指本发明的化合物或其盐,其包括化学计量或非化学计量的量的通过非共价分子间力结合的水。本发明的由式1表示的化合物的水合物可以包括化学计量或非化学计量的量的通过非共价分子间力结合的水。水合物可以包含1当量或更多,并且优选1当量至5当量的水。这样的水合物可以通过将本发明的由式1表示的化合物、其异构体或其药学上可接受的盐从水或含水溶剂中结晶来制备。
87、在本说明书中,“溶剂化物”可以指本发明的化合物或其盐,其包括化学计量或非化学计量的量的通过非共价分子间力结合的溶剂。示例性溶剂是挥发性的、无毒的和/或适合向人给药的溶剂。
88、在本说明书中,“异构体”可以指本发明的化合物或其盐,其具有相同的式或分子式,但在结构或空间上不同。这些异构体包括结构异构体诸如互变异构体、具有不对称碳中心的r或s异构体、异构体诸如几何异构体(反式、顺式)和光学异构体(对映异构体)。所有这些异构体及其混合物也包括在本发明的范围内。
89、本发明的一方面提供了一种下式1的化合物、其异构体、其溶剂化物、其水合物或其药学上可接受的盐。
90、[式1]
91、
92、在式1中,
93、z1和z2各自独立地是ch或n,
94、z3是ch、n或cr6,其中r6是哌啶基或哌嗪基,其中所述哌啶基或哌嗪基是未取代的或被c1-8烷基或哌嗪基取代,
95、r1是氢、卤素、c1-8烷氧基、c1-8烷基、c1-8卤代烷氧基或c1-8卤代烷基,
96、r2是氢、卤素、c1-8烷氧基、c1-8硫代烷氧基或-nr7r8,
97、其中r2中的所述c1-8烷氧基或c1-8硫代烷氧基是未取代的或被c1-8烷基氨基取代,
98、其中r7和r8各自独立地是氢或c1-8烷基,或r7和r8与它们所键合的n原子一起连接形成3至12元杂环烷基,
99、其中r7和r8中的所述c1-8烷基或3至12元杂环烷基各自独立地是未取代的或者被选自由以下组成的组中的一个或多个取代基r9取代:卤素、c1-8烷基、c1-8烷氧基、c1-8烷基氨基、c1-8烷基羰基、c1-8烯基、氧亚基(=o)、c1-8烷氧基乙酰基、c1-8烷基磺酰基、羟基-c1-8烷基、3至12元环烷基以及3至12元杂环烷基,
100、其中所述取代基r9各自独立地是未取代的或者进一步被选自由以下组成的组中的一个或多个取代基r10取代:卤素、c1-8烷基、c1-8烷氧基、c1-8烷基羰基、氧亚基(=o)、c1-8烷基磺酰基、3至12元环烷基、3至12元杂环烷基以及c1-8烷基氨基,
101、其中所述取代基r10是未取代的或者进一步被c1-8烷基或3至12元环烷基取代,
102、r3是-nh(c=o)r11c=cr12r13或-nh(c=o)c≡cr14,
103、其中r11、r12、r13和r14各自独立地是氢、卤素、未取代的c1-8烷基或被c1-8烷基氨基取代的c1-8烷基,或未取代的c3-8杂环烷基或被c1-8烷基取代的c3-8杂环烷基,
104、r4是苄基、4至8元芳基或4至8元杂芳基,
105、l1是-o-、-o(ch2)n-、-c≡c-、-(ch2)n-、-c(=o)o-、-c(o)nh-或直接键,其中n是1至3的整数,
106、当l1是直接键、-o-、-(ch2)n-或-o(ch2)n-时,r5是3至12元杂环烷基、4至12元芳基或4至12元杂芳基,
107、当l1是-c≡c-、-c(=o)o-或-c(o)nh-时,r5是氢、c1-8烷基、3至12元环烷基、4至12元芳基或4至12元杂芳基,以及
108、其中r4和r5各自独立地是未取代的或被选自由以下组成的组中的一个或多个非氢取代基取代:卤素、c1-8烷基、c1-8卤代烷基、氧亚基(=o)、羟基、c1-8烷氧基、酰胺、c1-8烷基酰胺、c1-8烷基羧基、c1-8烷基氨基以及氰基,其中当r5是氢或c1-8烷基时,r5可以是未取代的或被羟基取代。
109、根据本发明的一种实施方式,在由式1表示的化合物中,
110、z1和z2各自独立地是ch或n,
111、z3是ch、n或cr6,其中r6是哌啶基或哌嗪基,其中所述哌啶基或哌嗪基是未取代的或被c1-6烷基或哌嗪基取代,
112、r1是氢、卤素、c1-6烷氧基、c1-6烷基、c1-6卤代烷氧基或c1-6卤代烷基,
113、其中当z3是cr6时,r2是氢,当z3是ch或n时,r2是卤素、c1-6烷氧基、c1-6硫代烷氧基或-nr7r8,
114、其中r2中的所述c1-6烷氧基或c1-6硫代烷氧基是未取代的或被c1-6烷基氨基取代,
115、r7和r8各自独立地是氢或c1-6烷基,或r7和r8与它们所键合的n原子一起连接形成3至12元杂环烷基,
116、其中r7和r8中的所述c1-6烷基或3至12元杂环烷基各自独立地是未取代的或者被选自由以下组成的组中的一个或多个取代基r9取代:卤素、c1-6烷基、c1-6烷氧基、c1-6烷基氨基、c1-6烷基羰基、c1-6烯基、氧亚基(=o)、c1-6烷氧基乙酰基、c1-6烷基磺酰基、羟基-c1-6烷基、3至12元环烷基以及3至12元杂环烷基,
117、其中所述取代基r9各自独立地是未取代的或者进一步被选自由以下组成的组中的一个或多个取代基r10取代:卤素、c1-6烷基、c1-6烷氧基、c1-6烷基羰基、氧亚基(=o)、c1-6烷基磺酰基、3至12元环烷基、3至12元杂环烷基以及c1-6烷基氨基,
118、其中所述取代基r10是未取代的或者进一步被c1-6烷基或3至12元环烷基取代,
119、r3是-nh(c=o)r11c=cr12r13或-nh(c=o)c≡cr14,
120、其中r11、r12、r13和r14各自独立地是氢、卤素、未取代的c1-6烷基或被c1-6烷基氨基取代的c1-6烷基,或未取代的c3-8杂环烷基或被c1-6烷基取代的c3-8杂环烷基,
121、r4是苄基、4至8元芳基或4至8元杂芳基,
122、l1是-o-、-o(ch2)n-、-c≡c-、-(ch2)n-、-c(=o)o-、-c(o)nh-或直接键,其中n是1至3的整数,
123、当l1是直接键、-o-、-(ch2)n-或-o(ch2)n-时,r5是3至12元杂环烷基、4至12元芳基或4至12元杂芳基,
124、当l1是-c≡c-、-c(=o)o-或-c(o)nh-时,r5是氢、c1-6烷基、3至12元环烷基、4至12元芳基或4至12元杂芳基,以及
125、其中r4和r5各自独立地是未取代的或被选自由以下组成的组中的一个或多个非氢取代基取代:卤素、c1-6烷基、c1-6卤代烷基、氧亚基(=o)、羟基、c1-6烷氧基、酰胺、c1-6烷基酰胺、c1-6烷基羧基、c1-6烷基氨基以及氰基,其中当r5是氢或c1-6烷基时,r5是未取代的或被羟基取代。
126、根据本发明的另一种实施方式,在由式1表示的化合物中,
127、z1和z2各自独立地是ch或n,
128、z3是ch、n或cr6,其中r6是哌啶基或哌嗪基,其中所述哌啶基或哌嗪基是未取代的或被c1-6烷基或哌嗪基取代,
129、r1是氢、卤素、c1-6烷氧基、c1-6烷基、c1-6卤代烷氧基或c1-6卤代烷基,
130、其中当z3是cr6时,r2是氢,当z3是ch或n时,r2是卤素、c1-6烷氧基、c1-6硫代烷氧基或-nr7r8,
131、其中r2中的所述c1-6烷氧基或c1-6硫代烷氧基是未取代的或被c1-6烷基氨基取代,
132、r7和r8各自独立地是氢或c1-6烷基,或r7和r8与它们所键合的n原子一起连接形成3至10元杂环烷基,
133、其中r7和r8中的所述c1-6烷基是未取代的或被c1-6烷基氨基取代,
134、其中r7和r8中的所述3至10元杂环烷基是未取代的或者被选自由以下组成的组中的一个或多个取代基r9取代:卤素、c1-6烷基、c1-6烷氧基、c1-6烷基氨基、c1-6烷基羰基、c1-6烯基、氧亚基(=o)、c1-6烷氧基乙酰基、c1-6烷基磺酰基、羟基-c1-6烷基、3至10元环烷基以及3至10元杂环烷基,
135、其中所述取代基r9各自独立地是未取代的或者进一步被选自由以下组成的组中的一个或多个取代基r10取代:卤素、c1-6烷基、c1-6烷氧基、c1-6烷基羰基、氧亚基(=o)、c1-6烷基磺酰基、3至10元环烷基、3至10元杂环烷基以及c1-6烷基氨基,
136、其中所述取代基r10是未取代的或者进一步被c1-6烷基或3至8元环烷基取代,
137、r3是-nh(c=o)r11c=cr12r13或-nh(c=o)c≡cr14,
138、其中r11、r12和r13各自独立地是氢、卤素、未取代的c1-6烷基或被c1-6烷基氨基取代的c1-6烷基,或未取代的c3-8杂环烷基或被c1-6烷基取代的c3-8杂环烷基,以及其中r14是c1-6烷基,
139、r4是苄基、4至8元芳基或4至8元杂芳基,
140、l1是-o-、-o(ch2)n-、-c≡c-、-(ch2)n-、-c(=o)o-、-c(o)nh-或直接键,其中n是1至3的整数,
141、当l1是直接键、-o-、-(ch2)n-或-o(ch2)n-时,r5是3至10元杂环烷基、4至10元芳基或4至10元杂芳基,
142、当l1是-c≡c-、-c(=o)o-或-c(o)nh-时,r5是氢、c1-6烷基、3至10元环烷基、4至10元芳基或4至10元杂芳基,
143、其中r4和r5各自独立地是未取代的或被选自由以下组成的组中的一个或多个非氢取代基取代:卤素、c1-6烷基、c1-6卤代烷基、氧亚基(=o)、羟基、c1-6烷氧基、酰胺、c1-6烷基酰胺、c1-6烷基羧基、c1-6烷基氨基以及氰基,其中当r5是氢或c1-6烷基时,r5是未取代的或被羟基取代。
144、根据本发明的仍另一种实施方式,在由式1表示的化合物中,
145、z1和z2各自独立地是ch或n,
146、z3是ch、n或cr6,其中r6是哌啶基或哌嗪基,其中所述哌啶基或哌嗪基是未取代的或被c1-6烷基或哌嗪基取代,
147、r1是氢、卤素、c1-6烷氧基、c1-6烷基、c1-6卤代烷氧基或c1-6卤代烷基,
148、其中当z3是cr6时,r2是氢,当z3是ch或n时,r2是卤素、c1-6烷氧基、c1-6硫代烷氧基或-nr7r8,
149、其中r2中的所述c1-6烷氧基或c1-6硫代烷氧基是未取代的或被c1-6烷基氨基取代,
150、r7和r8各自独立地是氢或c1-6烷基,或r7和r8与它们所键合的n原子一起连接形成具有选自由n、o和s组成的组中的一个或多个杂原子的3至10元杂环烷基,
151、其中r7和r8中的所述c1-6烷基是未取代的或被c1-6烷基氨基取代,
152、其中r7和r8中的所述3至10元杂环烷基是未取代的或者被选自由以下组成的组中的一个或多个取代基r9取代:卤素、c1-6烷基、c1-6烷氧基、c1-6烷基氨基、c1-6烷基羰基、c1-6烯基、氧亚基(=o)、c1-6烷氧基乙酰基、c1-6烷基磺酰基、羟基-c1-6烷基、3至10元环烷基以及具有选自由n、o和s组成的组中的一个或多个杂原子的3至10元杂环烷基,
153、其中所述取代基r9各自独立地是未取代的或者进一步被选自由以下组成的组中的一个或多个取代基r10取代:卤素、c1-6烷基、c1-6烷氧基、c1-6烷基羰基、氧亚基(=o)、c1-6烷基磺酰基、3至10元环烷基、具有选自由n、o和s组成的组中的一个或多个杂原子的3至10元杂环烷基以及c1-6烷基氨基,
154、其中所述取代基r10是未取代的或者进一步被c1-4烷基或3至6元环烷基取代,
155、r3是-nh(c=o)r11c=cr12r13或-nh(c=o)c≡cr14,
156、其中r11、r12和r13各自独立地是氢、卤素、未取代的c1-6烷基或被c1-6烷基氨基取代的c1-6烷基,或未取代的c3-8杂环烷基或被c1-6烷基取代的c3-8杂环烷基,以及其中r14是c1-6烷基,
157、r4是苄基、4至8元芳基或具有一个或多个氮原子的4至8元杂芳基,
158、l1是-o-、-o(ch2)n-、-c≡c-、-(ch2)n-、-c(=o)o-、-c(o)nh-或直接键,其中n是1至3的整数,
159、当l1是直接键、-o-、-(ch2)n-或-o(ch2)n-时,r5是具有选自由n、o和s组成的组中的一个或多个杂原子的3至10元杂环烷基、4至10元芳基或具有选自由n、o和s组成的组中的一个或多个杂原子的4至10元杂芳基,
160、当l1是-c≡c-、-c(=o)o-或-c(o)nh-时,r5是氢、c1-6烷基、3至10元环烷基、4至10元芳基或具有选自由n、o和s组成的组中的一个或多个杂原子的4至10元杂芳基,以及
161、其中r4和r5各自独立地是未取代的或被选自由以下组成的组中的一个或多个非氢取代基取代:卤素、c1-6烷基、c1-6卤代烷基、氧亚基(=o)、羟基、c1-6烷氧基、酰胺、c1-6烷基酰胺、c1-6烷基羧基、c1-6烷基氨基以及氰基,其中当r5是氢或c1-6烷基时,r5是未取代的或被羟基取代。
162、根据本发明的又另一种实施方式,在由式1表示的化合物中,
163、r2是氢原子、卤素、c1-6烷氧基、c1-6硫代烷氧基或-nr7r8,
164、其中r2中的所述c1-6烷氧基或c1-6硫代烷氧基是未取代的或被c1-6烷基氨基取代,以及特别地,二甲基氨基,
165、其中r7和r8各自独立地是甲基或乙基,或者r7和r8与它们所键合的n原子一起连接形成选自以下的杂环烷基:哌嗪、哌啶、二氮杂环庚烷、吗啉、2-氧杂-5-氮杂双环[2.2.1]庚烷、吡咯烷、硫代吗啉、二氮杂螺[3.3]庚烷、二氮杂双环[2,2,1]庚烷、二氮杂双环[3,2,1]辛烷、六氢吡咯并[1,2-a]吡嗪、六氢吡咯并[3,4-c]吡咯、二氮杂螺[2.5]辛烷、氮杂螺[3.5]壬烷以及二氮杂螺[3.5]壬烷,
166、其中r7和r8中的所述甲基或乙基各自独立地是未取代的或者被甲基氨基或二甲基氨基取代,
167、其中通过键合r7和r8形成的杂环烷基是未取代的或者被选自由以下组成的组中的一个或多个取代基r9取代:卤素、c1-4烷基、c1-4烷氧基、c1-4烷基氨基、c1-4烷基羰基、c1-4烯基、氧亚基(=o)、c1-4烷氧基乙酰基、c1-4烷基磺酰基、羟基-c1-4烷基、环丙基、哌嗪、氮杂环丁烷、吡咯烷、氧杂环丁烷、吗啉、二氮杂环庚烷、哌啶、氧亚基哌嗪以及2-氧杂-5-氮杂双环[2.2.1]庚烷,
168、其中所述取代基r9各自独立地是未取代的或者进一步被选自由以下组成的组中的一个或多个取代基r10取代:卤素、c1-4烷基、c1-4烷基羰基、c1-4烷基氨基、氧亚基(=o)、c1-4烷基磺酰基、环丙基、哌嗪、氮杂环丁烷和氧杂环丁烷,以及
169、其中当所述取代基r10是哌嗪时,所述取代基r10可以是未取代的或者进一步被甲基或环丙基取代。
170、在本发明的一种实施方式中,r4可以是苄基,5至7元芳基或5至7元杂芳基(其具有一个或多个氮原子),并且作为特定的实例,苯基、苄基、吡唑或吡啶。
171、在本发明的一种实施方式中,r5可以是氢、c1-4烷基、5至6元环烷基、苯基、吡啶、呋喃、异噁唑、吡唑、噻吩、噻唑、硫代吗啉、吗啉、三唑、二氧化硫代吗啉(dioxidothiomorpholine)、哌啶、咪唑并[1,2,b]哒嗪、咪唑并[1,2,a]吡啶、三唑并[1,5,a]吡啶或吡唑并[1,5,a]嘧啶。
172、r4可以是未取代的或被选自由以下组成的组中的一个或多个非氢取代基取代:卤素、c1-6烷基和c1-6卤代烷基。特定地,r4可以是未取代的或被选自由以下组成的组中的一个或多个非氢取代基取代:氟、氯、异丙基、仲丁基和甲基。
173、r5是未取代的或被选自由以下组成的组中的一个或多个非氢取代基取代:卤素、c1-6烷基、c1-6卤代烷基、氧亚基(=o)、羟基、c1-6烷氧基、酰胺、c1-6烷基酰胺、c1-6烷基羧基、c1-6烷基氨基以及氰基,其中当r5是氢或c1-6烷基时,r5可以是未取代的或被羟基取代。
174、特定地,r5可以是未取代的或被选自由以下组成的组中的一个或多个非氢取代基取代:氟、甲基、三氟甲基、氧亚基(=o)、羟基、甲氧基、酰胺、二甲基酰胺、甲基羧基、二甲基氨基和氰基。
175、当r5中的非氢取代基是酰胺、c1-8烷基酰胺、c1-8烷基羧基、c1-6卤代烷基或氰基时,r5可以是苯基。
176、在本发明的一种实施方式中,当l1是直接键、-o-、-(ch2)n-或-o(ch2)n-时,r5可以是苯基、吡啶、呋喃、异噁唑、吡唑、噻吩、噻唑、硫代吗啉、吗啉、三唑、二氧化硫代吗啉、哌啶、咪唑并[1,2,b]哒嗪、咪唑并[1,2,a]吡啶、三唑并[1,5,a]吡啶或吡唑并[1,5,a]嘧啶,
177、当l1是-c≡c-、-c(=o)o-或-c(o)nh-时,r5可以是氢、c1-4烷基、环己基、苯基或吡啶。
178、甚至更特定地,当l1是直接键时,r5可以是苯基、吡啶、呋喃、异噁唑、吡唑、噻吩、噻唑、硫代吗啉、吗啉、三唑、二氧化硫代吗啉、哌啶、咪唑并[1,2,b]哒嗪、咪唑并[1,2,a]吡啶、三唑并[1,5,a]吡啶或吡唑并[1,5,a]嘧啶,
179、当l1是-o-时,r5可以是苯基、吡唑或三唑并[1,5,a]吡啶,
180、当l1是-(ch2)n-时,r5可以是苯基,
181、当l1是-o(ch2)n-时,r5可以是噻唑、苯基或吡啶,
182、当l1是-c≡c-时,r5可以是苯基或c1-4烷基,
183、当l1是-c(=o)o-时,r5可以是氢、c1-4烷基或环己基,
184、当l1是-c(o)nh-时,r5可以是c1-4烷基、环己基、苯基或吡啶。
185、在本发明的一种实施方式中,当l1是-(ch2)n-或-o(ch2)n-时,n可以是1。
186、根据又另一种实施方式,在由式1表示的化合物中,
187、r1可以是氢、氟、甲基、甲氧基、乙氧基、
188、z1和z2各自独立地是ch或n,
189、z3是ch、n或cr6,其中r6是哌嗪基(其是未取代的或者被c1-3烷基取代),或者是被哌嗪基取代的哌啶基。
190、当z3是cr6时,r2可以是氢,以及
191、当z3是ch或n时,r2可以是
192、
193、-r4-l1-r5可以是
194、
195、
196、r3是-nh(c=o)r11c=cr12r13或-nh(c=o)c≡cr14,其中r11可以是氢或氟,r12和r13可以各自独立地是氢、未取代的c1-3烷基或被二甲基氨基取代的c1-3烷基、或未取代的c3-6杂环烷基或被c1-3烷基取代的c3-6杂环烷基,并且r14可以是c1-3烷基,并且特别地是甲基。特定地,r3可以是-nh(c=o)ch=ch2、-nh(c=o)cf=ch2、-nh(c=o)-c≡cch3或-nh(c=o)ch=ch(ch2)-n(ch3)2。
197、根据本发明的式1的化合物的实例可以包括以下实施例中的表1中列出的化合物1至343,或游离碱(当表示为表1中的药学上可接受的盐时)、其异构体、其溶剂化物、其水合物和其药学上可接收的盐。
198、本发明的式1的化合物可以以其药学上可接受的盐的形式使用。特别地,药学上可接受的盐可以是由游离酸形成的酸加成盐。这里,酸加成盐可以由无机酸,诸如盐酸、硝酸、磷酸、硫酸、氢溴酸、氢碘酸、亚硝酸或亚磷酸,无毒有机酸,诸如脂族单羧酸盐或二羧酸盐、苯基取代的烷酸盐、羟基烷酸盐或烷二酸盐、芳族酸或脂族或芳族磺酸,或有机酸,诸如三氟乙酸、乙酸盐、苯甲酸、柠檬酸、乳酸、马来酸、葡糖酸、甲磺酸、4-甲苯磺酸、酒石酸或富马酸获得。这样的药学上可接受的盐的类型可以包括硫酸盐、焦硫酸盐、硫酸氢盐、亚硫酸盐、亚硫酸氢盐、硝酸盐、磷酸盐、磷酸一氢盐、磷酸二氢盐、偏磷酸盐、焦磷酸盐氯化物、溴化物、碘化物、氟化物、乙酸盐、丙酸盐、癸酸盐(decanoate)、辛酸盐、丙烯酸盐、甲酸盐、异丁酸盐、癸酸盐(caprate)、庚酸盐、丙炔酸盐、草酸盐、丙二酸盐、琥珀酸盐、辛二酸盐、癸二酸盐、富马酸盐、马来酸盐、丁炔-1,4-二酸盐、己烷-1,6-二酸盐、苯甲酸盐、氯苯甲酸盐、甲基苯甲酸盐、二硝基苯甲酸盐、羟基苯甲酸盐、甲氧基苯甲酸盐、邻苯二甲酸盐、对苯二甲酸盐、苯磺酸盐、甲苯磺酸盐、氯苯磺酸盐、二甲苯磺酸盐、苯乙酸盐、苯丙酸盐、苯丁酸盐、柠檬酸盐、乳酸盐、β-羟基丁酸盐、乙醇酸盐、马来酸盐、酒石酸盐、甲磺酸盐、丙磺酸盐、萘-1-磺酸盐、萘-2-磺酸盐和扁桃酸盐。酸加成盐可以通过常规方法制备,例如,通过将式1的衍生物溶解在有机溶剂诸如甲醇、乙醇、丙酮、二氯甲烷或乙腈中,过滤并干燥通过添加有机酸或无机酸制备的沉淀物,以及在减压下蒸馏溶剂和过量的酸,使所得产物脱水并使脱水产物在有机溶剂中结晶。此外,药学上可接受的盐可以是使用碱获得的盐或金属盐。作为金属盐的实例,碱金属或碱土金属盐可以通过将化合物溶解在过量的碱金属氢氧化物或碱土金属氢氧化物溶液中,过滤未溶解的化合物盐以及蒸发和脱水滤液来获得。作为碱金属盐,钠盐、钾盐或钙盐可以是药学上可接受的。此外,可以通过使碱金属或碱土金属盐与合适的银盐(例如硝酸银)反应来获得相应的盐。
199、此外,本发明可以是由式1表示的化合物及其药学上可接受的盐,以及其异构体,特别是对映异构体,或者可以由其制备的水合物和/或溶剂化物。
200、本发明的另一方面可以提供一种制备式1的化合物的方法。
201、制备式1的化合物的方法可以包括
202、由式2的化合物制备式3的化合物的步骤;
203、由所述式3的化合物制备式4的化合物的步骤;以及
204、由所述式4的化合物制备式1的化合物的步骤。
205、[式2]
206、
207、[式3]
208、
209、[式4]
210、
211、[式1]
212、
213、在上述式中,g是离去基团,z1至z3、l1以及r1至r5可以各自独立地与上文所定义的相同。离去基团可以是官能团诸如卤素、磺酸酯或烷氧基,并且它不受限制,只要它是能够通过从式2的化合物分离而产生式3的化合物的官能团即可。
214、由式2的化合物产生式3的化合物可以是使式2的化合物与r2-h反应。该反应可以在溶剂诸如二甲基亚砜(dmso)中进行。反应温度可以为大约40至100℃,反应时间可以为大约90至150分钟,并且只要反应顺利进行,它可以不限于上述条件。
215、同时,由式2的化合物产生式3的化合物可以通过使式2的化合物与杂环烷基诸如哌啶酮反应,以及然后使所得物与r2-h反应来进行。
216、由式3的化合物产生式4的化合物可以通过用r1还原对位处存在的硝基基团和用r2还原邻位处存在的硝基基团来进行。特别地,该步骤可以是仅还原硝基基团而不还原其他官能团或化合物。可以不受限制地使用任何还原硝基基团的还原剂,并且可以是例如sncl2。
217、由式4的化合物制备式1的化合物可以是通过式4的化合物的胺与化合物诸如丙烯酸或丙烯酰卤反应形成r3。反应时间可以是大约30分钟至2小时,并且只要反应顺利进行,它可以不限于上述条件。
218、此外,式2的化合物可以通过以下制备:由式5的化合物制备式6的化合物;以及由式6的化合物制备化合物2。
219、[式5]
220、
221、[式6]
222、
223、在上述式中,g是离去基团,z1、z2、l1、r4和r5中的每一个可以与本说明书中定义的相同。离去基团可以是官能团诸如卤素、磺酸酯或烷氧基,并且它不受限制,只要它是能够由式5的化合物制备式6的化合物并且由式6的化合物制备式2的化合物的官能团即可。
224、由式5的化合物制备式6的化合物可以在溶剂诸如二甲基亚砜(dmso)中进行。反应温度可以为大约30至120℃,反应时间可以为大约10至90分钟,并且只要反应顺利进行,它可以不限于上述条件。
225、在由式6的化合物制备式2的化合物中,反应温度可以为大约80至120℃,反应时间可以为大约6至18小时,并且只要反应顺利进行,它可以不限于上述条件。
226、本发明的仍另一方面可以提供
227、用于预防或治疗癌症的药物组合物,该药物组合物包含式1的化合物、其异构体、其溶剂化物、其水合物或其药学上可接受的盐作为活性成分。
228、式1的化合物可以对erbb2和erbb4中的一种或多种表现出抑制活性。换句话说,式1的化合物可以抑制erbb2和erbb4中的一种或多种的野生型或突变激酶。
229、erbb2的突变可以包括选自由s310/y、l755s、v777l、d769h/y以及l755_t759del组成的组中的一种或多种。
230、尽管癌症的类型不受限制,但癌症可以包括例如选自由以下组成的组中的一种或多种:假黏液瘤、肝内胆管癌、肝母细胞瘤、肝癌、甲状腺癌、结肠癌、睾丸癌、骨髓增生异常综合征、胶质母细胞瘤、口腔癌、唇癌、蕈样肉芽肿、急性髓系白血病、急性淋巴细胞性白血病、基底细胞癌、卵巢上皮癌、卵巢生殖细胞癌、男性乳腺癌、脑癌、垂体腺瘤、多发性骨髓瘤、胆囊癌、胆道癌、结直肠癌、慢性髓细胞性白血病、慢性淋巴细胞白血病、视网膜母细胞瘤、脉络膜黑素瘤、法特壶腹癌(ampulla of vater cance)、膀胱癌、腹膜癌、甲状旁腺癌、肾上腺癌、鼻腔鼻窦癌(sinonasal cancer)、非小细胞肺癌、舌癌、星形细胞瘤、小细胞肺癌、小儿脑癌、小儿淋巴瘤、小儿白血病、小肠癌、脑膜瘤、食管癌、胶质瘤、肾盂癌、肾癌、心脏癌、十二指肠癌、恶性软组织肿瘤、恶性骨癌、恶性淋巴瘤、恶性间皮瘤、恶性黑素瘤、眼癌、外阴癌、输尿管癌、尿道癌、不明原发部位的癌症、胃部淋巴瘤、胃部癌、胃部类癌、胃肠道间质瘤、维尔姆斯瘤、乳腺癌、肉瘤、阴茎癌、咽癌、妊娠绒毛膜癌、宫颈癌、子宫内膜癌、子宫肉瘤、前列腺癌、转移性骨癌、转移性脑癌、纵隔癌、直肠癌、直肠类癌、阴道癌、脊髓癌、前庭神经鞘瘤、胰腺癌、唾液腺癌、卡波西肉瘤、佩吉特病、扁桃体癌、鳞状细胞癌、肺腺癌、肺癌、肺鳞状细胞癌、皮肤癌、肛门癌、横纹肌肉瘤、喉癌、胸膜癌、血液学癌症和胸腺癌。
231、本发明的用于预防或治疗癌症的药物组合物可以用于临床给药,并且可以被制备成以各种口服和肠胃外制剂给药。
232、式1的化合物或其药学上可接受的盐可以在临床给药中以各种口服和肠胃外制剂,以及更优选地,肠胃外制剂给药。式1的化合物或其药学上可接受的盐可以与稀释剂或赋形剂,诸如通常使用的填充剂、增稠剂、粘结剂、润湿剂、崩解剂或表面活性剂一起配制。用于口服给药的固体制剂可以是片剂、丸剂、散剂、颗粒剂或胶囊,并且这样的固体制剂可以通过将赋形剂(例如淀粉、碳酸钙、蔗糖、乳糖和明胶)中的至少一种与一种或多种化合物混合来制备。此外,除了简单的赋形剂之外,还可以使用润滑剂,诸如硬脂酸镁和滑石。作为用于口服给药的液体制剂,可以使用混悬剂、内部使用的液体、乳剂或糖浆,并且可以包括通常使用的简单稀释剂,诸如水或液体石蜡,以及各种类型的赋形剂,例如润湿剂、甜味剂、香料和防腐剂。用于肠胃外给药的制剂可以是灭菌水性溶液、非水性溶剂、混悬剂或乳剂。作为非水性溶剂或混悬剂,可以使用丙二醇、聚乙二醇、植物油诸如橄榄油或可注射的酯诸如油酸乙酯。
233、包括式1的化合物或其药学上可接受的盐作为活性成分的药物组合物可以肠胃外给药,并且肠胃外给药通过皮下注射、静脉内注射、肌内注射或胸腔内注射进行。
234、这里,为了配制用于肠胃外给药的制剂,可以将式1的化合物或其药学上可接受的盐与稳定剂或缓冲剂在水中混合以制备溶液或混悬剂,以及所得溶液或混悬剂可以以安瓿或小瓶单位剂型制造。该组合物可以是灭菌的,或者可以包含佐剂,诸如防腐剂、稳定剂、水分散性粉末或乳化促进剂、用于控制渗透压的盐和/或缓冲剂,以及其他治疗上有用的材料,并且可以根据常规方法制备,诸如混合、造粒或包衣。
235、除了活性成分之外,用于口服给药的制剂可以包括片剂、丸剂、硬/软胶囊、液体、混悬剂、乳剂、糖浆、颗粒剂、酏剂和糖锭剂,并且这样的制剂可以包含稀释剂(例如,乳糖、右旋糖、蔗糖、甘露醇、山梨糖醇、纤维素和/或甘氨酸)、润滑剂(例如,二氧化硅、滑石、硬脂酸、其镁盐或钙盐和/或聚乙二醇)。
236、片剂可以包含粘结剂,诸如硅酸铝镁、淀粉糊、明胶、甲基纤维素、羧甲基纤维素钠和/或聚乙烯吡咯烷,并且在一些情况下,可以包含崩解剂,诸如淀粉、琼脂、藻酸或其钠盐,或沸腾混合物和/或吸收剂、着色剂、调味剂和甜味剂。
237、包含式1的化合物、其光学异构体或其药学上可接受的盐作为活性成分的用于预防或治疗癌症的药物组合物可以作为单独的治疗剂给药,或与在使用时的另外抗癌剂组合使用。
238、本发明的又另一方面提供了一种预防或治疗癌症的方法,该方法包括向有此需要的受试者给药式1的化合物、其异构体、其溶剂化物、其水合物或其药学上可接受的盐。
239、本发明的又另一方面提供了式1的化合物或其异构体、其溶剂化物、其水合物或其药学上可接受的盐用于预防或治疗癌症的用途。
240、在本发明的用于预防或治疗癌症的方法和用途中,癌症的类型如在药物组合物中所述的。
241、在下文中,将参照实施例和实验实施例详细描述本发明。
242、提供以下实施例和实验实施例仅仅是为了举例说明本发明,并且本发明的内容不限于此。
243、<分析和纯化条件>
244、将本发明的实施例中合成的化合物在以下hplc条件下进行纯化或结构分析。
245、1.用于分析的hplc条件
246、用于分析的hplc条件(acquityuplch-classcore系统)
247、使用在其中由waters制造的uplc系统(acquity uplc pda检测器)配备有由waters制造的质量qda检测器的仪器。所用柱为由waters制造的acquitybeh c18(1.7μm,2.1x50mm),并且柱温为30℃。
248、流动相a为含0.1%甲酸的水,并且流动相b为含0.1%甲酸的乙腈。
249、梯度条件(10-100%b,持续3分钟,流速=0.6ml/min)
250、用于纯化的制备型液相色谱-质谱法(prep-lcms)
251、使用在其中由waters制造的autopurification hplc系统(2767样品管理器(2767sample manager)、2545二元梯度模块(2545binary gradient module)、2998光电二极管阵列检测器(2998photodiode array detector))配备有由waters制造的质量qda检测器的仪器。所用柱为由waters制造的prep c18 obdtm(5μm,19x50mm),并且柱温为室温。
252、流动相a为含0.035%三氟乙酸的水,并且流动相b为含0.035%三氟乙酸的甲醇。
253、梯度条件(15-100%b,持续10分钟,流速=25ml/min)
254、用于纯化的prep-150 lc系统(制备型液相色谱-uv光谱法)
255、使用由waters制造的prep 150lc系统(2545四元梯度模块、2998光电二极管阵列检测器、馏分收集器)。所用柱为由waters制造的preprp18 obdtm(10μm,30x300mm),并且柱温为室温。
256、梯度条件(3-100%b,持续120分钟,流速=40ml/min)
257、用于纯化的prep-hplc系统(制备型液相色谱-uv光谱法)
258、使用由teledyne制造的仪器accqprep hp150。所用柱为由waters制造的prep rp18 obdtm(10μm,30x300mm),并且柱温为室温。
259、梯度条件(10-100%b,持续120分钟,流速=42ml/min)
260、2.nmr分析
261、使用由bruker制造的avance iii 400或avance iii 400 hd进行nmr分析,且数据以百万分率(δ)(ppm)表示。
262、所使用的商业试剂在没有进一步纯化的情况下使用。本发明中使用的“室温”或“环境温度”是指5℃至40℃的温度,作为实例,10℃至30℃,并且作为另外实例,大约20℃至27℃,并且它不严格限制在上述范围内。使用旋转蒸发器在减压或溶剂蒸馏下进行浓缩。
263、<制备实施例>
264、1.制备异噁唑烷衍生物
265、<制备实施例1>制备(r)-3-(3-溴-5-氟苯基)异噁唑烷盐酸盐
266、
267、步骤1:制备3-溴-5-氟-n-甲氧基-n-甲基苯甲酰胺
268、在室温下,将3-溴-5-氟苯甲酸(10g,1当量)溶解在二氯甲烷(110ml)中之后,依次添加n,o-二甲基羟胺盐酸盐(5.4g,1.2当量)、三乙胺(tea;5.7ml,0.9当量)以及1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edci;11.5g,1.2当量)。将反应混合物在室温下搅拌3小时。作为tlc分析(二氯甲烷)的结果,确认所有起始材料消失,并且检测到具有低极性的新斑点。使用乙酸乙酯(ea;300ml)和碳酸氢钠饱和溶液(400ml*2)萃取有机层。将有机层经硫酸钠干燥并在减压下浓缩,从而获得为黄色油的目标化合物(11.2g,产率:94.0%)。
269、步骤2:制备1-(3-溴-5-氟苯基)丙-2-烯-1-酮
270、在0℃下,在将在制备实施例1的步骤1中获得的3-溴-5-氟-n-甲氧基-n-甲基苯甲酰胺(11.2g,1当量)溶解在四氢呋喃(thf;220ml)之后,逐滴添加溴(乙烯基)镁(0.7m,93ml,1.5当量)。之后,将反应混合物在0℃下搅拌1小时。作为tlc分析(己烷:二氯甲烷=1:1)的结果,确认所有起始材料消失,并且检测到具有低极性的新斑点。在添加盐酸(1n,50ml)以终止反应之后,使用乙酸乙酯(ea;300ml)和盐酸(1n,400ml*2)萃取有机层。在用硫酸钠干燥有机层之后,将其在减压下浓缩。将浓缩的化合物通过色谱法(己烷:二氯甲烷=1:1)纯化,从而获得为无色油的目标化合物(7.9g,产率:76%)。
271、步骤3:制备1-(3-溴-5-氟苯基)-3-氯丙烷-1-酮
272、在0℃下,在将制备实施例1的步骤2中获得的1-(3-溴-5-氟苯基)丙-2-烯-1-酮(7.9g,1.0当量)溶解在二氯甲烷(dcm;13ml)中之后,添加盐酸(hcl)/二噁烷(4m,13ml,1.2当量)。之后,将反应混合物在室温下搅拌12小时。作为tlc分析(己烷:二氯甲烷=1:1)的结果,确认所有起始材料消失,并且检测到目标化合物。在减压下浓缩反应混合物,并使用乙酸乙酯(ea;300ml)和碳酸氢钠饱和溶液(400ml*2)萃取有机层,以及将有机层经硫酸钠干燥并在减压下浓缩,从而获得为黄色油的目标化合物(8.9g,产率:97%)。
273、步骤4:制备(s)-1-(3-溴-5-氟苯基)-3-氯丙烷-1-醇
274、在0℃下在氮气流下,在将(3ar)-1-甲基-3,3-二苯基-3a,4,5,6-四氢吡咯并[1,2-c][1,3,2]噁唑硼烷(oxazaborole)(1m,6.7ml,0.2当量)溶解在四氢呋喃(thf;84ml)中之后,逐滴添加硼烷二甲基硫醚(bh3me2s;1m,21.8ml,1.3当量)。将反应混合物在0℃下搅拌30分钟,并且在0℃下逐滴添加在制备实施例1的步骤3中获得的1-(3-溴-5-氟苯基)-3-氯丙烷-1-酮(8.9g,1当量)(其已经在四氢呋喃中稀释)。将反应混合物在0℃下搅拌2小时。作为tlc分析(己烷:二氯甲烷=1:1)的结果,确认所有起始材料消失,并且检测到目标化合物斑点。在20℃下添加甲醇(20ml)以终止反应后,在减压下去除溶剂。用乙酸乙酯(ea;300ml)和盐酸(1n,400ml*2)处理浓缩的化合物以萃取有机层。将有机层经硫酸钠干燥,从而获得为黄色油的目标化合物(8.5g,产率:95%)。
275、步骤5:制备(s)-(3-(3-溴-5-氟苯基)-3-羟基丙氧基)氨基甲酸叔丁酯
276、在0℃下在氮气流下,将羟基氨基甲酸叔丁酯(9.3g,2.2当量)溶解在二甲基甲酰胺(dmf;80ml)后,添加氢化钠(nah;3.1g,纯度:60%,2.4当量)。将反应混合物在0℃下搅拌30分钟,在0℃下逐滴添加在制备实施例1的步骤4中获得的(s)-1-(3-溴-5-氟苯基)-3-氯丙烷-1-醇(8.5g,1当量)(其已在二甲基甲酰胺(dmf;10ml)中稀释),并在室温下搅拌12小时。作为tlc分析(二氯甲烷:ea=9:1)的结果,确认所有起始材料消失,并且检测到目标化合物。在添加盐水(50ml)以终止反应后,用乙酸乙酯(ea;300ml)和碳酸氢钠饱和溶液(400ml*3)处理浓缩的化合物以萃取有机层。将有机层经硫酸钠干燥,从而获得为黄色油的目标化合物(9.2g,产率:79%)。
277、步骤6:制备(r)-3-(3-溴-5-氟苯基)异噁唑烷-2-甲酸叔丁酯
278、在0℃下,在将在制备实施例1的步骤5中获得的(s)-(3-(3-溴-5-氟苯基)-3-羟基丙氧基)氨基甲酸叔丁酯(9.2g,1当量)和三苯基膦(ph3p;8.6g,1.3当量)溶解在二氯甲烷(dcm;110ml)中之后,缓慢添加在二氯甲烷(dcm;20ml)中稀释的偶氮二甲酸二异丙酯(diad;6.6g,1.3当量)。将反应混合物在0℃下搅拌2小时。作为tlc分析(dcm:ea=9:1)的结果,确认所有起始材料消失,并且检测到新斑点。在减压下浓缩反应混合物,将浓缩的化合物通过色谱法(二氯甲烷:ea=10:0至9:1)纯化,从而获得为黄色油的目标化合物(7.7g,产率:88%)。
279、步骤7:制备(r)-3-(3-溴-5-氟苯基)异噁唑烷盐酸盐
280、在室温下,在将在制备实施例1的步骤6中获得的(r)-3-(3-溴-5-氟苯基)异噁唑烷-2-甲酸叔丁酯(7.7g,1当量)溶解在二氯甲烷(dcm;40ml)中之后,添加hcl/二噁烷(4m,28ml,5当量)。之后,将反应混合物在室温下搅拌2小时。作为lcms分析的结果,确认所有起始材料消失,并且通过添加二乙醚(200ml)获得的沉淀物被过滤并脱水,从而获得为白色固体的目标化合物(5.3g,产率:84%)。
281、在步骤7中,为了纯化或分析化合物的光学异构体,使用以下条件。
282、仪器:cas-wh-ana-sfc-c(shimadzu lc-30adsf)
283、柱:chiralpak ay-3 50х4.6mm i.d.,3μm;
284、流动相:相a用于co2,并且相b用于ipa(0.05%dea);
285、梯度洗脱:b在a中,从5%至40%;
286、流速:3ml/min;检测器:pda;
287、柱温:35℃;背压:100巴
288、将步骤7中获得的(r)-3-(3-溴-5-氟苯基)异噁唑烷盐酸盐在sfc条件下如下纯化,从而获得目标光学异构体(纯度:100%,100%e.e.)。
289、(柱:daicel chiralpak ad-h(250mm*30mm,5μm);
290、流动相:[0.1%nh3h2o meoh];b%:15%-15%,3.8min;600min)
291、1h nmr(400mhz,dmso)δ7.62-7.58(m,2h),7.43(dt,j=9.8,2.0hz,1h),4.93(t,j=7.4hz,1h),4.36(td,j=8.1,4.4hz,1h),4.12(q,j=7.8hz,1h),2.81(dtd,j=12.4,7.9,4.4hz,1h),2.49-2.41(m,1h)。
292、以类似于“制备异噁唑烷衍生物”的制备实施例1的方式制备下面的制备实施例2和3的异噁唑胺衍生物。
293、<制备实施例2>制备(r)-3-(3-溴苯基)异噁唑烷
294、
295、<制备实施例3>制备(r)-3-(3-溴-2-氟苯基)异噁唑烷
296、
297、<制备实施例4>制备(r)-3-(异噁唑烷-3-基)苯甲酸异丙酯
298、
299、(r)-3-(异噁唑烷-3-基)苯甲酸异丙酯以类似于<制备实施例1>的方式使用以下<制备实施例4-1>的3-(异丙氧基羰基)苯甲酸作为中间体来制备。
300、<制备实施例4-1>制备3-(异丙氧基羰基)苯甲酸
301、
302、步骤1:制备3-(异丙氧基羰基)苯甲酸
303、将间苯二甲酸(40g,1当量)溶解于异丙醇(150ml)和四氢呋喃(thf;450ml)中之后,添加硫酸(浓h2so4;38.5ml,3当量)。将反应混合物在75℃下搅拌48小时。反应完成后,在减压下浓缩反应产物以浓缩有机溶剂,然后使用乙酸乙酯(ea;500ml)和水(200ml)萃取有机层。将有机层经硫酸钠干燥并在减压下浓缩。使用色谱法(二氯甲烷/甲醇=8/1)纯化浓缩的化合物,从而获得为透明油的目标化合物(23.25g,产率:46.5%)。
304、以类似于“制备异噁唑烷衍生物”的<制备实施例4>的方式制备下面的制备实施例5和6的化合物。
305、<制备实施例5>制备(r)-3-氟-5-(异噁唑烷-3-基)苯甲酸异丙酯
306、
307、<制备实施例6>制备(r)-3-(异噁唑烷-3-基)苯基酸环己酯
308、
309、<制备实施例7>制备(r)-3-(异噁唑烷-3-基)苯甲酸
310、
311、目标化合物通过使用水性碱溶液水解<制备实施例4>中获得的(r)-3-(异噁唑烷-3-基)苯甲酸异丙酯来制备。另外,以下制备实施例8、9、10和11的材料是通过使用目标化合物通过诸如hatu的方法引入酰胺官能团来制备的。
312、<制备实施例8>制备(r)-n-异丙基-3-(异噁唑烷-3-基)苯甲酰胺
313、
314、<制备实施例9>制备(r)-n-环己基-3-(异噁唑烷-3-基)苯甲酰胺
315、
316、<制备实施例10>制备(r)-3-(异噁唑烷-3-基)-n-(吡啶-2-基)苯甲酰胺
317、
318、<制备实施例11>制备(r)-3-(异噁唑烷-3-基)-n-苯基苯甲酰胺
319、
320、<制备实施例12>制备(r)-3-(3-(苄基氧基)苯基)异噁唑烷
321、
322、(r)-3-(3-(苄基氧基)苯基)异噁唑烷以类似于<制备实施例1>的方式使用以下<制备实施例12-1>的3-(苄基氧基)-n-甲氧基-n-甲基苯甲酰胺作为中间体来制备。
323、<制备实施例12-1>制备3-(苄基氧基)-n-甲氧基-n-甲基苯甲酰胺
324、
325、步骤1:制备3-(苄基氧基)苯基酸甲酯
326、将3-羟基苯甲酸甲酯(20g,1.0当量)溶解于丙酮(260ml)之后,添加(溴甲基)苯(18.76ml,1.2当量)和碳酸钾(54.5g,3当量)。将反应混合物在60℃下搅拌16小时。作为tlc分析(己烷:乙酸乙酯=3:2)的结果,确认所有起始材料消失,并且检测到目标化合物。在减压下浓缩反应混合物,并将有机层通过添加二氯甲烷(dcm;300ml*2)和水(200ml)来萃取以及然后经硫酸钠干燥,然后在减压下进行浓缩。将浓缩的化合物使用己烷再结晶,从而获得为白色固体的目标化合物(29.27g,产率:92%)。
327、步骤2:制备3-(苄基氧基)苯甲酸
328、将步骤1中获得的3-(苄基氧基)苯甲酸甲酯(29g,1.0当量)溶解在甲醇(meoh;300ml)中之后,添加氢氧化钾(koh;6m,4.5当量)。之后,将反应混合物在80℃下搅拌3小时。作为tlc分析(己烷:乙酸乙酯=7:3)的结果,确认所有起始材料消失,并且检测到具有低极性的新斑点。在减压下浓缩反应混合物,添加水(100ml),并缓慢逐滴添加盐酸(3n)以将溶液酸化至ph 1。将所得沉淀物在减压下过滤并脱水,从而获得为白色固体的目标化合物(27g,产率:99%)。
329、步骤3:制备3-(苄基氧基)-n-甲氧基-n-甲基苯甲酰胺
330、将步骤2中获得的3-(苄基氧基)苯甲酸(20g,1.0当量)溶解在二氯甲烷(dcm;700ml)中之后,缓慢添加1,1-羧基二咪唑(9.40g,1.1当量)。将反应混合物在室温下搅拌2小时后,添加n,o-二甲基羟胺盐酸盐(15.63g,1.1当量),并在40℃下搅拌18小时。作为uplc/ms分析的结果,确认所有起始材料消失,并且检测到目标化合物。将反应混合物用盐酸(1n,500ml)和碳酸氢钠饱和溶液(500ml)洗涤,经硫酸钠干燥并在减压下浓缩,从而获得为浅黄色油的目标化合物(90g,产率:85%)。
331、以类似于“制备异噁唑烷衍生物”的<制备实施例12>的方式制备下面的制备实施例13至23的化合物。
332、<制备实施例13>制备(r)-3-(3-((3-氟苄基)氧基)苯基)异噁唑烷
333、
334、<制备实施例14>制备(r)-3-(2-((3-氟苄基)氧基)苯基)异噁唑烷
335、
336、<制备实施例15>制备(r)-3-(4-((3-氟苄基)氧基)苯基)异噁唑烷
337、
338、<制备实施例16>制备(r)-3-(4-氟-3-((3-氟苄基)氧基)苯基)异噁唑烷
339、
340、<制备实施例17>制备(r)-3-(4-氯-3-((3-氟苄基)氧基)苯基)异噁唑烷
341、
342、<制备实施例18>制备(r)-3-(3-氟-5-((3-氟苄基)氧基)苯基)异噁唑烷
343、
344、<制备实施例19>制备(r)-3-(3-((3-氟苄基)氧基)-4-甲基苯基)异噁唑烷
345、
346、<制备实施例20>制备(r)-3-(3-(吡啶-2-基甲氧基)苯基)异噁唑烷
347、
348、<制备实施例21>制备(r)-3-(3-((6-甲基吡啶-2-基)甲氧基)苯基)异噁唑烷
349、
350、<制备实施例22>制备(r)-3-(3-氟-5-(吡啶-2-基甲氧基)苯基)异噁唑烷
351、
352、<制备实施例23>制备(r)-3-(3-氟-5-(噻唑-2-基甲氧基)苯基)异噁唑烷
353、
354、<制备实施例24>制备(r)-3-(3-(3-氟苯氧基)苯基)异噁唑烷
355、
356、(r)-3-(3-(3-氟苯氧基)苯基)异噁唑烷以类似于<制备实施例1>的方式使用以下<制备实施例24-1>中获得的3-(3-氟苯氧基)-n-甲氧基-n-甲基苯甲酰胺作为中间体来制备。
357、<制备实施例24-1>制备3-(3-氟苯氧基)-n-甲氧基-n-甲基苯甲酰胺
358、
359、步骤1:制备3-(3-氟苯氧基)苯基酸甲酯
360、将3-溴苯甲酸甲酯(10g,1当量)、3-氟苯酚(7.82g,1.5当量)和碳酸铯(30.3g,2当量)溶解在1,4-二噁烷(116ml)中之后,添加碘化亚铜(4.43g,0.5当量)以及二甲基甘氨酸盐酸盐(9.74g,1.5当量)。将反应混合物在120℃下搅拌20小时。作为tlc分析(己烷:乙酸乙酯=4:1)的结果,确认所有起始材料消失,并且检测到具有高极性的新斑点。使用二氯甲烷(dcm;1000ml)、氢氧化钠溶液(500ml,1n)、盐酸(500ml、1n)和盐水(400ml)萃取有机层。将有机层经硫酸钠干燥并在减压下浓缩,从而获得为黄色油的目标化合物(7.8g,产率:68.1%)。
361、步骤2:制备3-(3-氟苯氧基)-n-甲氧基-n-甲基苯甲酰胺
362、在-20℃下,将3-(3-氟苯氧基)苯甲酸甲酯(7.8g,1当量)溶解在四氢呋喃(64ml)中之后,缓慢添加n,o-二甲基羟胺(4.63g,1.5当量)和异丙基氯化镁(47.5ml,2m)。将反应混合物在60℃下搅拌1小时。作为tlc分析(己烷:乙酸乙酯=4:1)的结果,确认所有起始材料消失,并且检测到具有高极性的新斑点。使用二氯甲烷(dcm;300ml)和氯化铵(200ml)萃取有机层。将有机层经硫酸钠干燥并在减压下浓缩,从而获得为黄色油的目标化合物(7.46g,产率:70%)。
363、以类似于“制备异噁唑烷衍生物”的<制备实施例24>的方式制备下面的制备实施例25至40的化合物。
364、<制备实施例25>制备(r)-3-(2-氟-5-(3-氟苯氧基)苯基)异噁唑烷
365、
366、<制备实施例26>制备(r)-3-(3-(3,5-二氟苯氧基)-5-氟苯基)异噁唑烷
367、
368、<制备实施例27>制备(r)-3-(4-氟-3-苯氧基苯基)异噁唑烷
369、
370、<制备实施例28>制备(r)-3-(4-氟-3-(3-氟苯氧基)苯基)异噁唑烷
371、
372、<制备实施例29>制备(r)-3-(3-(2,5-二氟苯氧基)-5-氟苯基)异噁唑烷
373、
374、<制备实施例30>制备(r)-3-(3-氟-5-苯氧基苯基)异噁唑烷
375、
376、<制备实施例31>制备(r)-3-(3-(3,5-二氟苯氧基)苯基)异噁唑烷
377、
378、<制备实施例32>制备(r)-3-(3-氟-5-(3-氟苯氧基)苯基)异噁唑烷
379、
380、<制备实施例33>制备(r)-3-(3-(2,5-二氟苯氧基)苯基)异噁唑烷
381、
382、<制备实施例34>制备(r)-3-(3-(3-(三氟甲基)苯氧基)苯基)异噁唑烷
383、
384、<制备实施例35>制备(r)-3-(3-氟-5-(3-(三氟甲基)苯氧基)苯基)异噁唑烷
385、
386、<制备实施例36>制备(r)-3-(3-([1,2,4]三唑并[1,5-a]吡啶-7-基氧基)苯基)异噁唑烷
387、
388、<制备实施例37>制备(r)-3-(3-苯氧基苯基)异噁唑烷
389、
390、<制备实施例38>制备(s)-3-(3-(3-氟苯氧基)苄基)异噁唑烷
391、
392、<制备实施例39>制备(r)-3-(3-氟-5-((1-甲基-1h-吡唑-3-基)氧基)苯基)异噁唑烷
393、
394、<制备实施例40>制备(r)-3-(4-氟-3-(3-(三氟甲基)苯氧基)苯基)异噁唑烷
395、
396、<制备实施例41>制备(r)-3-(3',5-二氟-[1,1'-联苯]-3-基)异噁唑烷盐酸盐
397、
398、步骤1:制备(r)-3-(3-溴-5-氟苯基)异噁唑烷-2-甲酸叔丁酯
399、在0℃下,在将在<制备实施例1>中获得的(r)-3-(3-溴-5-氟苯基)异噁唑烷盐酸盐(1g,1当量)和三乙胺(tea;1.5ml,3当量)溶解在四氢呋喃(7ml)之后,缓慢添加二碳酸二叔丁酯(boc2o;1.0ml,1.2当量)。之后,将反应混合物在50℃下搅拌2小时。作为tlc分析(dcm)的结果,确认所有起始材料消失,并且检测到具有不同极性的新斑点。使用乙酸乙酯(ea;70ml)和碳酸氢钠饱和溶液(100ml*2)萃取有机层。将有机层经硫酸钠干燥并在减压下浓缩,从而获得为浅黄色油的目标化合物(1.1g,产率:95%)。
400、步骤2:制备(r)-3-(3',5-二氟-[1,1'-联苯]-3-基)异噁唑烷-2-甲酸叔丁酯
401、在室温下在氮气流下,将步骤1中获得的(r)-3-(3-溴-5-氟苯基)异噁唑烷-2-甲酸叔丁酯(350mg,1当量)、(3-氟苯基)硼酸(170mg,1.2当量)以及k2co3(280mg,2当量)溶解在1,4-二噁烷(5ml)。之后,在80℃下将四(三苯基膦)钯(0)(110mg,0.1当量)添加到反应混合物中并搅拌3小时。作为tlc分析(dcm)的结果,确认所有起始材料消失,并且检测到具有不同极性的新斑点。使用乙酸乙酯(ea;70ml)和碳酸氢钠饱和溶液(100ml*2)萃取有机层。将有机层经硫酸钠干燥并在减压下浓缩。将浓缩的化合物使用色谱法(己烷:二氯甲烷=5:5至0:10)纯化,从而获得为无色油的目标化合物(320mg,产率:88%)。
402、步骤3:制备(r)-3-(3',5-二氟-[1,1'-联苯]-3-基)异噁唑烷盐酸盐
403、在室温下,在将步骤2中获得的(r)-3-(3',5-二氟-[1,1'-联苯]-3-基)异噁唑烷-2-甲酸叔丁酯(320mg,1当量)溶解在二氯甲烷(dcm;2ml)中之后,添加hcl/二噁烷(4m,1ml,5当量)。之后,将反应混合物在室温下搅拌2小时。作为lcms分析的结果,确认所有原料消失,并且为了获得固体,过滤并干燥通过添加二乙醚(10ml)产生的沉淀物,从而获得为白色固体的目标化合物(240mg,产率:91%)。
404、以下制备实施例42至81的组合物使用“制备异噁唑烷衍生物”的制备实施例1至3中合成的化合物以类似于<制备实施例41>的方式来制备。
405、<制备实施例42>制备(r)-3-([1,1'-联苯]-3-基)异噁唑烷
406、
407、<制备实施例43>制备(r)-3-(3-(1-甲基-1h-吡唑-4-基)苯基)异噁唑烷
408、
409、<制备实施例44>制备(r)-3-(3-(呋喃-3-基)苯基)异噁唑烷
410、
411、<制备实施例45>制备(r)-4-(3-(异噁唑烷-3-基)苯基)-3,5-二甲基异噁唑
412、
413、<制备实施例46>制备(r)-3-(3-氟-5-(1-甲基-1h-吡唑-4-基)苯基)异噁唑烷
414、
415、<制备实施例47>制备(r)-3-(3-氟-5-(呋喃-2-基)苯基)异噁唑烷
416、
417、<制备实施例48>制备(r)-3-(3-氟-5-(噻吩-3-基)苯基)异噁唑烷
418、
419、<制备实施例49>制备(r)-3-(3-(噻吩-2-基)苯基)异噁唑烷
420、
421、<制备实施例50>制备(r)-3-(3-(噻唑-2-基)苯基)异噁唑烷
422、
423、<制备实施例51>制备(r)-3-(3-氟-5-(噻吩-2-基)苯基)异噁唑烷
424、
425、<制备实施例52>制备(r)-3-(3-氟-5-(1-甲基-1h-1,2,4-三唑-5-基)苯基)异噁唑烷
426、
427、<制备实施例53>制备(r)-3-(3-(5-甲基噻吩-2-基)苯基)异噁唑烷
428、
429、<制备实施例54>制备(r)-3-(3'-(三氟甲基)-[1,1'-联苯]-3-基)异噁唑烷
430、
431、<制备实施例55>制备((r)-3'-(异噁唑烷-3-基)-[1,1'-联苯基]-3-甲腈
432、
433、<制备实施例56>制备(r)-3-(3',5'-二氟-[1,1'-联苯]-3-基)异噁唑烷
434、
435、<制备实施例57>制备(r)-3-(3-氟-5-(吡啶-3-基)苯基)异噁唑烷
436、
437、<制备实施例58>制备(r)-3-(3-(咪唑并[1,2-b]哒嗪-3-基)苯基)异噁唑烷
438、
439、<制备实施例59>制备(r)-3-(3-(吡唑并[1,5-a]嘧啶-6-基)苯基)异噁唑烷
440、
441、<制备实施例60>制备(r)-3-(3-(咪唑并[1,2-a]吡啶-8-基)苯基)异噁唑烷
442、
443、<制备实施例61>制备(r)-3-(3-([1,2,4]三唑并[1,5-a]吡啶-7-基)苯基)异噁唑烷
444、
445、<制备实施例62>制备(r)-3-(3-([1,2,4]三唑并[1,5-a]吡啶-6-基)苯基)异噁唑烷
446、
447、<制备实施例63>制备(r)-3-(2,3'-二氟-[1,1'-联苯]-3-基)异噁唑烷
448、
449、<制备实施例64>制备(r)-3-(3-([1,2,4]三唑并[1,5-a]吡啶-5-基)-5-氟苯基)异噁唑烷
450、
451、<制备实施例65>制备(r)-3-(3'-氟-[1,1'-联苯]-3-基)异噁唑烷
452、
453、<制备实施例66>制备(r)-3'-氟-5'-(异噁唑烷-3-基)-n,n-二甲基-[1,1'-联苯基]-3-胺
454、
455、<制备实施例67>制备(r)-3-(2',4'-二氟-[1,1'-联苯]-3-基)异噁唑烷
456、
457、<制备实施例68>制备(r)-3-(2'-氟-3'-(三氟甲基)-[1,1'-联苯]-3-基)异噁唑烷
458、
459、<制备实施例69>制备(r)-3-(3'-氟-5'-(三氟甲基)-[1,1'-联苯]-3-基)异噁唑烷
460、
461、<制备实施例70>制备(r)-3-(3-(6-甲氧基吡啶-3-基)苯基)异噁唑烷
462、
463、<制备实施例71>制备(r)-5-(3-(异噁唑烷-3-基)苯基)吡啶-2-醇
464、
465、<制备实施例72>制备(r)-3-(3-(5-氟-6-甲基吡啶-3-基)苯基)异噁唑烷
466、
467、<制备实施例73>制备(r)-3-(3',6-二氟-[1,1'-联苯]-3-基)异噁唑烷
468、
469、<制备实施例74>制备(r)-3'-(异噁唑烷-3-基)-[1,1'-联苯基]-3-甲酰胺
470、
471、<制备实施例75>制备(r)-3-(2',3'-二氟-[1,1'-联苯]-3-基)异噁唑烷
472、
473、<制备实施例76>制备(r)-3'-(异噁唑烷-3-基)-[1,1'-联苯基]-3-甲腈
474、
475、<制备实施例77>制备(r)-3-(4'-(三氟甲基)-[1,1'-联苯]-3-基)异噁唑烷
476、
477、<制备实施例78>制备(r)-3'-(异噁唑烷-3-基)-[1,1'-联苯基]-4-甲腈
478、
479、<制备实施例79>制备(r)-3-(2',3'-二甲基-[1,1'-联苯]-3-基)异噁唑烷
480、
481、<制备实施例80>制备(r)-3'-(异噁唑烷-3-基)-[1,1'-联苯基]-3-甲酸甲酯
482、
483、<制备实施例81>制备(r)-3'-(异噁唑烷-3-基)-n,n-二甲基-[1,1'-联苯基]-3-甲酰胺
484、
485、<制备实施例82>制备3-(3-(苯基乙炔基)苯基)异噁唑烷
486、
487、步骤1:制备3-(3-(苯基乙炔基)苯基)异噁唑烷-2-甲酸叔丁酯
488、在25℃下,将中间体化合物3-(3-溴苯基)异噁唑烷-2-甲酸叔丁酯(400mg,1当量)(以类似于制备实施例2的合成的方式获得的)溶解在乙腈(6ml)中之后,添加碳酸铯(3当量)、2-二环己基膦基-2′,4′,6′-三异丙基联苯(xphos;0.06当量)、双(乙腈)二氯钯(ii)(0.01当量)。将反应混合物在90℃下搅拌2小时。作为lcms分析的结果,确认所有起始材料消失。使用乙酸乙酯(ea;20ml)和蒸馏水(20ml)萃取有机层。将有机层经硫酸镁干燥并在减压下浓缩。将浓缩的化合物通过色谱法(己烷:乙酸乙酯=1:1至1:4)纯化,从而获得目标化合物(298mg,产率:70%)。
489、步骤2:制备3-(3-(苯基乙炔基)苯基)异噁唑烷
490、在25℃下,将步骤1中获得的3-(3-(苯基乙炔基)苯基)异噁唑烷-2-甲酸叔丁酯溶解在二氯甲烷(3ml)中后,添加hcl/二噁烷(4m,5当量)。之后,将反应混合物在25℃下搅拌2小时。作为lcms分析的结果,确认所有起始材料消失。在减压下浓缩反应混合物,并添加二氯甲烷(dcm;20ml)和水(20ml*2)以萃取有机层。将有机层经硫酸镁干燥并在减压下浓缩,从而获得目标化合物(265mg,产率:93%)。
491、以类似于“制备异噁唑烷衍生物”的<制备实施例82>的方式制备下面的制备实施例83至86的化合物
492、<制备实施例83>制备3-(3-(3,3-二甲基丁-1-炔-1-基)苯基)异噁唑烷
493、
494、<制备实施例84>制备(r)-4-(3-(异噁唑烷-3-基)苯基)-2-甲基丁-3-炔-2-醇
495、
496、<制备实施例85>制备(r)-3-((3-(异噁唑烷-3-基)苯基)乙炔基)苯酚
497、
498、<制备实施例86>制备(r)-3-(3-((3-氟苯基)乙炔基)苯基)异噁唑烷
499、
500、2.制备本发明的实施例的化合物
501、<实施例1>制备(r)-n-(4-甲氧基-2-(4-甲基哌嗪-1-基)-5-((6-(3-(3-苯氧基苯基)异噁唑烷-2-基)嘧啶-4-基)氨基)苯基)丙烯酰胺
502、
503、步骤1:制备(r)-2-(6-氯嘧啶-4-基)-3-(3-苯氧基苯基)异噁唑烷
504、在将4,6-二氯嘧啶(644mg,1.2当量)和(r)-3-(3-苯氧基苯基)异噁唑烷(1g,1当量)溶解在二甲基亚砜(dmso,12ml)溶剂中之后,添加n,n-二异丙基乙胺(dipea;2.52ml,4当量)。将反应溶液在60℃下搅拌30分钟。反应完成后,使用乙酸乙酯和水进行萃取。将收集的有机层用盐水洗涤,经无水硫酸钠干燥,在减压下浓缩,并通过中压液相色谱法(mplc;乙酸乙酯/己烷)纯化,从而获得为澄清液体的目标化合物(1.12g,88%)。
505、步骤2:制备(r)-n-(4-氟-2-甲氧基-5-硝基苯基)-6-(3-(3-苯氧基苯基)异噁唑烷-2-基)嘧啶-4-胺
506、将在实施例1的步骤1中获得的(r)-2-(6-氯嘧啶-4-基)-3-(3-苯氧基苯基)异噁唑烷(1.12g,1当量)、4-氟-2-甲氧基-5-硝基苯胺(648mg,1.1当量)和甲磺酸(1.2g,2当量)添加到仲丁醇(11ml)中并溶解,然后在100℃下搅拌12小时。反应完成后,使用二氯甲烷(dcm)和水进行萃取。将收集的有机层用盐水洗涤,经无水硫酸钠干燥,在减压下浓缩并通过mplc(乙酸乙酯/己烷)纯化,从而获得目标化合物(1.02g,产率:64%)。
507、步骤3:制备(r)-n-(2-甲氧基-4-(4-甲基哌嗪-1-基)-5-硝基苯基)-6-(3-(3-苯氧基苯基)异噁唑烷-2-基)嘧啶-4-胺
508、在将实施例1的步骤2中获得的(r)-n-(4-氟-2-甲氧基-5-硝基苯基)-6-(3-(3-苯氧基苯基)异噁唑烷-2-基)嘧啶-4-胺(40mg,1当量)和碳酸钾(33mg,3当量)溶解在二甲基亚砜(dmso;0.8ml)中之后,添加1-甲基哌嗪(0.010ml,1.2当量)并在70℃下搅拌2小时。反应完成后,使用乙酸乙酯和水进行萃取。将收集的有机层用盐水洗涤,经无水硫酸钠干燥,并在减压下浓缩,从而获得目标化合物(40mg,86%),并且将目标化合物用于以下反应而不纯化。
509、步骤4:制备(r)-6-甲氧基-4-(4-甲基哌嗪-1-基)-n1-(6-(3-(3-苯氧基苯基)异噁唑烷-2-基)嘧啶-4-基)苄基-1,3-二胺
510、将在实施例1的步骤3中获得的(r)-n-(2-甲氧基-4-(4-甲基哌嗪-1-基)-5-硝基苯基)-6-(3-(3-苯氧基苯基)异噁唑烷-2-基)嘧啶-4-胺(40mg,1当量)和sncl22h2o(77mg,5当量)溶解于乙酸乙酯(0.7ml)中,并且然后在50℃下搅拌1小时。将反应溶液的温度降低至室温,并逐滴添加氨水溶液直到ph达到5。通过添加无水碳酸钠将反应混合物调节至ph 7。将反应混合物通过硅藻土过滤,并用乙酸乙酯洗涤数次。在减压下浓缩滤液以获得目标化合物(33mg,87%),并且将目标化合物用于以下反应而不纯化。
511、步骤5:制备(r)-n-(4-甲氧基-2-(4-甲基哌嗪-1-基)-5-((6-(3-(3-苯氧基苯基)异噁唑烷-2-基)嘧啶-4-基)氨基)苯基)丙烯酰胺
512、在将实施例1的步骤4中获得的(r)-6-甲氧基-4-(4-甲基哌嗪-1-基)-n1-(6-(3-(3-苯氧基苯基)异噁唑烷-2-基)嘧啶-4-基)苄基-1,3-二胺(33mg,1当量)溶解在乙酸乙酯(0.6ml)中之后,添加二氯化乙烯(edc;14mg,1.2当量)、丙烯酸(0.05ml,1.2当量)和n,n-二异丙基乙胺(dipea;0.012ml,1.5当量)。反应溶液在室温下反应1小时后,用碳酸氢钠的水性溶液终止反应。用乙酸乙酯溶剂和盐水萃取化合物。将有机层在减压下脱水并在减压下浓缩,并通过mplc(二氯甲烷/甲醇)纯化,从而获得目标化合物(产率:69%)。
513、本发明的所有实施例(实施例1至343)的化合物以类似于“2”的实施例1的方式制备。本发明的实施例的化合物的制备,以及每个实施例的化合物的化合物名称、化学结构、nmr和lcms分析结果总结在下表1中。
514、[表1]
515、
516、
517、
518、
519、
520、
521、
522、
523、
524、
525、
526、
527、
528、
529、
530、
531、
532、
533、
534、
535、
536、
537、
538、
539、
540、
541、
542、
543、
544、
545、
546、
547、
548、
549、
550、
551、
552、
553、
554、
555、
556、
557、
558、
559、
560、
561、
562、
563、
564、
565、
566、
567、
568、
569、
570、
571、
572、
573、
574、
575、
576、
577、
578、
579、
580、
581、
582、
583、
584、
585、
586、
587、
588、
589、
590、
591、
592、
593、
594、
595、
596、
597、<实验实施例1>对sk-br-3和bt-474癌细胞增殖的抑制活性的评价
598、为了评价根据本发明的化合物对erbb2-过表达的癌细胞增殖的抑制活性,进行以下实验。
599、添加10%fbs的mccoy's 5a用于sk-br-3癌细胞。添加20%fbs的rpmi-1640用于bt-474癌细胞。转导的ba/f3细胞在rpmi-1640培养基中培养,向其中添加1μg/ml嘌呤霉素(invitrogen)。
600、在化合物处理前48小时,将每种类型的sk-br-3和bt-474细胞以5,000个细胞/孔接种在白色透明底部96孔板(corning)中。将该化合物在二甲基亚砜中稀释(sk-br-3:3倍稀释,共12个浓度,bt-474:5倍稀释,共12个浓度),并且以1μl注射以具有的最终浓度为0.2nm至5μm。关于活细胞的测量,在用该化合物处理后120小时,使用celltiter-glo发光法细胞活力试剂(promega)将细胞在室温下储存10分钟,然后使用读取器(synergyneo,biotek)测量发光。每个测试重复三次。
601、将结果值计算为与对照组相比的细胞生长率(%)。使用graphpad prism version8.3.0程序绘制图形,并计算gi50值。
602、下表2示出了评价对sk-br-3(其是erbb2-过表达的癌细胞)增殖的抑制活性的结果。
603、[表2]
604、
605、
606、a:gi50<50nm;b:50nm≤gi50<500nm;c:500nm≤gi50<5000nm;d:5000nm≤gi50;
607、下表3示出了评价对bt-474(其是erbb2-过表达的癌细胞)增殖的抑制活性的结果。
608、[表3]
609、
610、
611、a:gi5<50nm;b:50nm≤gi50<500nm;c:500nm≤gi50<5000nm;d:5000nm≤gi50;
612、如表2和表3所示,可以看出,本发明的实施例的化合物对erbb2-过表达的细胞系表现出高抑制活性。
613、如上,已经通过优选的制备实施例、实施例和实验实施例详细描述了本发明,但本发明的范围不限于特定实施例化合物,并且应当根据所附权利要求进行解释。此外,本领域普通技术人员应当理解,在不脱离本发明的范围的情况下,许多修改和变化是可能的。
技术实现思路
- 还没有人留言评论。精彩留言会获得点赞!