冻干制剂的重构方法与流程
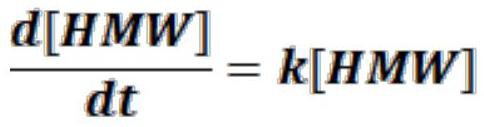
本披露属于蛋白质治疗剂和使用方法领域。相关申请的交叉引用和通过引用并入本申请要求2021年6月30日提交的美国临时申请号63/216,616的权益,该临时申请的全部内容通过引用完全并入本文。通过引用以其全文并入了与本文同时提交的计算机可读核苷酸/氨基酸序列表,其鉴定如下:名为“56395_seqlisting.txt”的ascii(文本)文件,362,780字节,创建于2022年6月29日。
背景技术:
1、由于商业规模纯化方法的进步,现在可以在首次制造时以高纯度获得基于蛋白质的药物,例如重组蛋白。然而,蛋白质仅略微稳定并且极易受到化学和物理降解二者的影响。化学降解是指涉及共价键的修饰,如脱酰胺化、氧化、裂解、剪切/片段化、形成新的二硫桥键、水解、异构化或去糖基化。物理降解包括蛋白质去折叠、对表面的不希望的吸附、和聚集。处理这些物理和化学不稳定性是蛋白质药物开发中最具挑战性的任务之一(chi等人,pharm res[药物研究],第20卷,第9期,2003年9月,第1325-1336页;roberts,trendsbiotechnol.[生物技术趋势]2014年7月;32(7):372-80)。
2、聚集是蛋白质制剂中观察到的显著的物理不稳定性类型。它是从初始的天然和折叠蛋白组装成高分子量物质(hmw)。半衰期延长的双特异性t细胞接合抗原结合多肽(例如包含半衰期延长模式的双特异性t细胞接合剂分子(例如fc分子))易于发生蛋白质聚集和/或其它降解事件。分子的蛋白质聚集是有问题的,因为它会损害治疗性蛋白质的生物活性。另外,还担忧聚集蛋白(甚至是人源化或全人源蛋白质)的存在可能增加患者对活性蛋白质单体产生免疫应答的风险,导致形成中和抗体和抗药性或其他不良副作用(mahler j pharm sci.[药物科学杂志]2009年9月;98(9):2909-34)。虽然蛋白质聚集体在例如下游加工的精制步骤中作为杂质被去除,但聚集体可能会在运送至临床地点并由临床医生处理后形成。
3、本领域需要制剂和方法来最小化制备用于向患者施用的制剂中的高分子量物质的量,以及在护理时使用蛋白质治疗剂时的相关不便。
技术实现思路
1、本披露提供了方法,该方法包括(a)用包含芳族醇、酚类化合物或具有芳族侧链的氨基酸的稀释剂重构包含多肽、糖、表面活性剂和缓冲液的冻干制剂,以及(b)在重构12小时内向有需要的受试者施用该重构制剂。在多个方面,多肽是双特异性抗体构建体。在多个方面,多肽结合人dll3和人cd3,例如包含seq id no:75和seq id no:9的氨基酸序列的多肽。可选地,稀释剂包含苯甲醇、苯酚、间甲酚或苯丙氨酸。还可选地,重构制剂的ph是约4至约7,并且/或者重构制剂包含约1mg/ml至约20mg/ml的多肽。在多个方面,缓冲液是谷氨酸盐缓冲液,糖是蔗糖,并且/或者表面活性剂是聚山梨醇酯80。例如,在示例性方面,在冻干之前,制剂包含15mm谷氨酸盐、9%(w/v)蔗糖和0.01%(w/v)聚山梨醇酯80,其中该制剂具有4.2的ph。在多个方面,受试者患有癌症,例如小细胞肺癌(sclc)、非小细胞肺癌(nsclc)、胶质瘤、胶质母细胞瘤、黑色素瘤、神经内分泌前列腺癌、神经内分泌胰腺癌、肝母细胞瘤或肝细胞癌。
2、应理解,虽然说明书中的多个实施例是使用“包含”语言呈现的,但在多种情况下,也可以使用“由……组成”或“基本上由……组成”语言来描述相关的实施例。本披露考虑了被描述为“包含”一种特征的实施例,以包括“由该特征组成”或“基本上由该特征组成”的实施例。术语“一种/一个(a或an)”是指一种或多种/一个或多个;例如,“一种/一个免疫球蛋白分子”应理解为代表一种或多种/一个或多个免疫球蛋白分子。同样地,术语“一种/一个”、“一种或多种/一个或多个”以及“至少一种/至少一个(at least one)”在本文中可互换地使用。
3、还应理解,当描述值范围时,所描述的特征可以是在该范围内找到的单个值。例如,“从约ph 4至约ph 6的ph”可以是但不限于,ph 4、4.2、4.6、5.1、5.5等,以及这些值之间的任何值。另外,“从约ph 4至约ph 6的ph”不应被解释为意指所考虑制剂的ph在储存期间在ph 4至ph 6的范围内变化2个ph单位,而是指溶液的ph可以在该范围内挑选值,并且ph在约该ph下保持缓冲。在本文所述的任何范围内,该范围的端点包括在该范围内。然而,该描述还考虑了排除较低和/或较高端点的相同范围。
4、当使用术语“约”时,其意指所列举数字加上或减去所列举数字的5%、10%、15%或更多。预期的实际变化可从上下文确定。
5、从本申请的整体,包括附图、具体实施方式和所附权利要求书,本发明的另外的特征和变化对于本领域技术人员而言将是显而易见的,并且所有这样的特征都旨在作为本披露的方面。同样,本文所述的本发明的特征可以重组成另外的实施例,这些实施例也旨在作为本发明的方面,无论这些特征的组合是否在上文作为本发明的一个方面或实施例特别提及。而且,只有本文所述的对本发明关键的限制才应被视为如此;本发明的缺少限制的变化(本文未描述为关键的那些)旨在作为本发明的方面。
6、本文引用的所有参考文献(包括专利、专利申请、文献出版物等)通过引用以其全文特此并入。
技术特征:
1.一种方法,该方法包括
2.如权利要求1所述的方法,其中该稀释剂包含苯甲醇、苯酚、间甲酚或苯丙氨酸。
3.如权利要求1或权利要求2所述的方法,其中该重构制剂的ph是约4至约7。
4.如权利要求1-3中任一项所述的方法,其中该制剂具有4.2的ph。
5.如权利要求1-4中任一项所述的方法,其中该重构制剂包含约1mg/ml至约20mg/ml的该多肽。
6.如权利要求1-5中任一项所述的方法,其中该重构制剂包含约15mg/ml的该多肽。
7.如权利要求1-6中任一项所述的方法,其中该缓冲液是乙酸盐缓冲液、谷氨酸盐缓冲液、柠檬酸盐缓冲液、乳酸缓冲液、琥珀酸盐缓冲液、酒石酸盐缓冲液、富马酸盐缓冲液、马来酸盐缓冲液、组氨酸缓冲液或磷酸盐缓冲液。
8.如权利要求7所述的方法,其中该缓冲液是谷氨酸盐缓冲液。
9.如权利要求1-8中任一项所述的方法,其中在冻干之前,该缓冲液以5至200mm范围的浓度存在。
10.如权利要求9所述的方法,其中在冻干之前,该缓冲液以10至50mm范围的浓度存在。
11.如权利要求1-10中任一项所述的方法,其中该糖是单糖或二糖。
12.如权利要求1-11中任一项所述的方法,其中该糖是葡萄糖、半乳糖、果糖、木糖、蔗糖、乳糖、麦芽糖、海藻糖、山梨糖醇、甘露糖醇或木糖醇。
13.如权利要求12所述的方法,其中该糖是蔗糖。
14.如权利要求1-13中任一项所述的方法,其中在冻干之前,该糖以1%至15%(w/v)范围的浓度存在。
15.如权利要求1-14中任一项所述的方法,其中该表面活性剂是聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯60、聚山梨醇酯80、泊洛沙姆188、泊洛沙姆407、x-100、聚氧乙烯、peg 3350、peg 4000或其组合。
16.如权利要求15所述的方法,其中该表面活性剂是聚山梨醇酯80。
17.如权利要求1-16中任一项所述的方法,其中在冻干之前,该表面活性剂以0.001%至0.5%(w/v)范围的浓度存在。
18.如权利要求1-17中任一项所述的方法,其中在冻干之前,该制剂包含15mm谷氨酸盐、9%(w/v)蔗糖和0.01%(w/v)聚山梨醇酯80,并且其中该制剂具有4.2的ph。
19.如权利要求1-18中任一项所述的方法,其中该稀释剂包含0.9%苯甲醇。
20.如权利要求1-18中任一项所述的方法,其中该稀释剂包含苯酚。
21.如权利要求1-18中任一项所述的方法,其中该稀释剂包含间甲酚。
22.如权利要求1-18中任一项所述的方法,其中该稀释剂包含苯丙氨酸。
23.如权利要求1-22中任一项所述的方法,其中步骤(b)包括在重构六小时内向有需要的受试者施用该重构制剂。
24.如权利要求1-22中任一项所述的方法,其中步骤(b)包括在重构四小时内向有需要的受试者施用该重构制剂。
25.如权利要求1-22中任一项所述的方法,其中步骤(b)包括在重构两小时内向有需要的受试者施用该重构制剂。
26.如权利要求1-22中任一项所述的方法,其中步骤(b)包括在重构一小时内向有需要的受试者施用该重构制剂。
27.如权利要求1-22中任一项所述的方法,其中该受试者患有癌症。
28.如权利要求1-27中任一项所述的方法,其中多肽结合dll3和cd3。
29.如权利要求1-28中任一项所述的方法,其中该多肽包含seq id no:75和seq idno:9的氨基酸序列。
30.如权利要求1-29中任一项所述的方法,其中该多肽包含seq id no:76或seq idno:77中列出的氨基酸序列。
31.如权利要求27-30中任一项所述的方法,其中该癌症是小细胞肺癌(sclc)、非小细胞肺癌(nsclc)、胶质瘤、胶质母细胞瘤、黑色素瘤、神经内分泌前列腺癌、神经内分泌胰腺癌、肝母细胞瘤或肝细胞癌。
32.如权利要求31所述的方法,其中该癌症是sclc、nsclc、胶质瘤、胶质母细胞瘤或神经内分泌前列腺癌。
33.如权利要求1-27中任一项所述的方法,其中该多肽包含seq id no:20、seq id no:21、seq id no:22、seq id no:23、seq id no:33、seq id no:43、seq id no:44、seq idno:45、seq id no:55、seq id no:65、seq id no:66、seq id no:76、seq id no:77、seq idno:87、seq id no:97、seq id no:98、seq id no:99、seq id no:109、seq id no:110、seqid no:111、seq id no:121、seq id no:122、seq id no:131、seq id no:141、seq id no:142、seq id no:146、seq id no:147、seq id no:156、seq id no:165、seq id no:174、seqid no:183、seq id no:184、seq id no:185、seq id no:186、seq id no:187或seq id no:188中列出的氨基酸序列。
34.如权利要求33所述的方法,其中该多肽包含seq id no:76、seq id no:77、seq idno:97、seq id no:98、seq id no:99、seq id no:156、seq id no:165、seq id no:174或seq id no:183中列出的氨基酸序列。
技术总结
本文描述了方法,该方法包括(a)用包含芳族醇、酚类化合物或具有芳族侧链的氨基酸的稀释剂重构包含多肽、糖、表面活性剂和缓冲液的冻干制剂,以及(b)在重构12小时内向有需要的受试者施用该重构制剂,其中该多肽是双特异性抗体构建体,例如结合人DLL3和人CD3并且可选地包含SEQ ID NO:75和SEQ ID NO:9的氨基酸序列的双特异性抗体构建体。
技术研发人员:W·齐,C·任
受保护的技术使用者:安进公司
技术研发日:
技术公布日:2024/1/15
- 还没有人留言评论。精彩留言会获得点赞!