3-苯氧基氮杂环丁烷-1-基-杂芳基吡咯烷衍生物及其作为药物的用途的制作方法
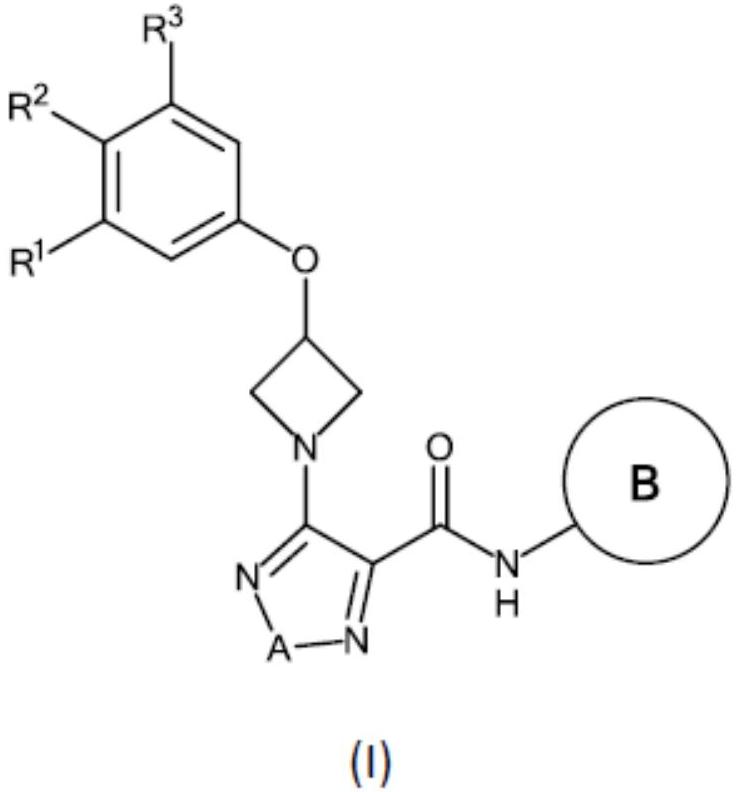
本发明涉及通式(i)的3-苯氧基氮杂环丁烷-1-基-杂芳基吡咯烷衍生物,其为gpr52的激动剂,可用于治疗中枢神经系统疾病及其他疾病。此外,本发明涉及通式(i)的3-苯氧基氮杂环丁烷-1-基-杂芳基吡咯烷衍生物,其用作药物,包含通式(i)的3-苯氧基氮杂环丁烷-1-基-杂芳基吡咯烷衍生物的药物组合物及制备药物组合物的方法以及制造根据本发明的化合物的方法。
背景技术:
1、人类gpr52是g蛋白偶联受体(gpcr)。于人类中枢神经系统(cns)内的最高表达程度见于纹状体中(wo2016/176571)。于cns的许多其他结构(包含皮层)中见到较低但是显著表达程度。gpr52几乎完全与人类及啮齿动物纹状体中的d2受体,及与人类及啮齿动物皮层中的d1受体共同局域化(wo2016/176571)。
2、d1受体一般经gs偶联,及因而刺激第二信使camp的产生及pka的活性。相比之下,d2受体一般经gi偶联,及因而负调节camp的产生及导致pka活性的减少。
3、因为gpr52与皮层中的d1受体共同局域化及因为gpr52及d1受体均经gs偶联,所以gpr52激动剂应与d1激动剂功能相似及因此展示对皮质功能及额叶功能低下的作用。已知若干化合物作为d1激动剂于皮层中起作用,于皮层中其增加皮质功能及解决额叶功能低下。
4、据报导,现有抗精神病药剂的功效通过纹状体中的中型多棘神经元(msn)上的d2拮抗剂活性介导。然而,d2拮抗剂产生副作用,诸如运动症状及高泌乳素血症。因为gpr52几乎完全与纹状体中的d2受体共同局域化及因为gpr52经gs偶联且d2经gi偶联,所以gpr52激动剂应与d2拮抗剂功能相似及因此展示抗精神病功效。此外,因为与d2拮抗剂相关联的副作用中的许多通过d2受体介导,所以gpr52激动剂可避免与现有d2拮抗剂相关联的副作用。
5、基于表达模式、共同局域化、细胞内信号传导及功能性质,表明gpr52为与治疗若干神经及精神障碍(包含以下所述那些)相关的脑功能的显著调节剂:
6、(1)额叶功能低下
7、前额叶皮质中的减少的血流(额叶功能低下)为若干神经病状的症状,所述神经病状包括与精神分裂症相关联的认知及阴性症状、注意力缺陷过动症(adhd)、双相障碍、重度抑郁症及与物质滥用相关联的额叶功能低下。前额叶皮质中的多巴胺能传递主要由d1受体介导,及d1功能障碍与精神分裂症的认知损害及阴性症状相关(goldman-rakic ps、castner sa、svensson th、siever lj、williams gv(2004)targeting the dopamine d1receptor in schizophrenia:insights for cognitivedysfunction.psychopharmacology 174,3-16)。因此,利用gpr52激动剂增加前额叶皮质的功能可用于治疗与额叶功能低下相关联的症状。
8、(2)运动障碍
9、纹状体涉及对运动的控制。纹状体的病理学与许多运动障碍相关联,包括通过过量异常不自主运动(称作过动症)表征的过动性运动障碍。过动性运动障碍的例子包括震颤、肌张力障碍、舞蹈病、颤搐、手足徐动症、抽搐症/妥瑞氏(tourette’s)综合征、亨廷顿氏病(huntington's disease)、肌阵挛及惊吓综合征、刻板症及静坐不能。
10、于纹状体中,gpr52几乎完全在间接纹状体路径的神经元上表达。过动症与此路径的抑制性d2表达神经元的功能障碍相关联。此功能障碍导致不能抑制运动,导致抽搐症、舞蹈病、发声、震颤及其他过动症状。例如,亨廷顿氏病的早期运动多度性运动症状为间接含d2路径的选择性损伤的结果(albin rl、reiner a、anderson kd、penney jb、young ab.(1990)striatal and nigral neuron subpopulations in rigid huntington'sdisease:implications for the functional anatomy of chorea and rigidity-akinesia.ann neurol.27,357-365)。此外,纹状体中的d2受体结合与妥瑞氏综合征症状的严重度相关联(wolf ss、jones dw、enable mb、gorey jg、lee ks、hyde tm、coppola r、weinberger dr(1996)tourette syndrome:prediction of phenotypic variation inmonozygotic twins by caudate nucleus d2 receptor binding.science 273,1225-1227)。
11、gpr52经激动剂的刺激会活化间接纹状体路径,导致对运动的更多抑制性控制及过动症状的解决。因此,本文中所公开的gpr52激动剂可用于治疗这些症状。
12、(3)精神病
13、精神分裂症的精神病症状自纹状体中的过度活跃突触前多巴胺活性产生(howesod,kapur s(2009)the dopamine hypothesis of schizophrenia:版本iii—the finalcommon pathway.schizophr bull.35,549-562)。用于治疗精神病症状的现有抗精神病药物的临床功效依赖于d2受体的阻断。具有治疗精神病的功效的所有已知抗精神病药物为多巴胺d2受体的拮抗剂或部分激动剂(remington g,kapur s(2010)antipsychotic dosing:how much but also how often?schizophr bull.36,900-903)。虽然这些抗精神病药物可治疗精神分裂症的阳性(或精神病性)症状,但是其不治疗精神分裂症的其他方面,诸如阴性症状或认知损害。基于gpr52及多巴胺d2受体的共同表达,gpr52激动剂应治疗与精神分裂症相关联的精神病症状。此外,因为gpr52激动剂的作用机制对已知d2受体相关联的抗精神病药物为独特的,应期望gpr52激动剂增强已知神经松弛剂的抗精神病功效。此可不仅导致改善的抗精神病功效,而且可用于降低抗精神病药物的剂量,从而降低其相关副作用。增加的血清催乳素含量为已知d2r拮抗剂抗精神病药物的突出副作用特性中之一者,然而已证实gpr52激动剂降低血清催乳素含量,因此gpr52激动剂与d2r拮抗剂抗精神病药物的共同应用可使血清催乳素含量正常,从而降低与d2r拮抗剂抗精神病药物相关联的副作用。此外,gpr52激动剂应治疗与各种精神病适应症相关联的精神病症状,包括精神分裂感情型障碍、分裂型障碍、类精神分裂症、难治性精神分裂症、药物诱导的精神病、双相障碍、自闭症谱系障碍及衰减精神病综合征。此外,gpr52激动剂应治疗与各种神经退化性适应症相关联的精神病及神经精神病学症状,包括帕金森氏病(parkinson’s disease)、阿尔茨海默氏病(alzheimer’s disease)、额颞叶痴呆、血管性认知损害及路易体(lewy bodies)痴呆。这些抗精神病药物亦与显著副作用特性相关联,包括体重增加、代谢综合征、糖尿病、高脂血症、高血糖症、胰岛素抗性、锥体束外症状、高泌乳素血症及迟发性运动障碍。因为gpr52激动剂应与d2拮抗剂功能相似,本文中所公开的gpr52激动剂可用于治疗精神病。
14、(4)其他d1相关病症
15、已知若干神经学及精神病学药物作为d1激动剂起作用,包括a-86929、地那索林(dinapsoline)、多沙唑嗪(doxanthrine)、skf-81297、skf-82958、skf-38393、非诺多泮(fenoldopam)、6-br-apb及斯替复里啶(stepholoidine)。因为gpr52激动剂应与d1激动剂功能相似(及共同局域化),所以本文中所公开的gpr52激动剂可用于治疗可通过d1激动剂治疗的病症,包括(但不限于)成瘾(例如,可卡因成瘾)、高血压、不宁腿综合征、帕金森氏病及抑郁。此外,基于其表达模式及功能性偶联,gpr52激动剂可用于治疗与精神分裂症、类精神分裂症、难治性精神分裂症、衰减精神病综合征及分裂型障碍、双相疾病、自闭症谱系障碍、阿尔茨海默氏病、帕金森氏病、额颞叶痴呆(匹克氏病(pick’s disease))、路易体痴呆、血管性痴呆、中风后痴呆及克雅二氏病(creutzfeldt-jakob disease)相关联的认知缺陷。
16、(5)其他d2相关病症
17、若干神经学病症(诸如强迫症及冲动控制障碍)与多巴胺受体信号传导的交替相关联,因此gpr52激动剂可用于治疗这些适应症(lopez am、weintraub d、claassen do(2017)impulse control disorders and related complications of parkinson’sdisease therapy.semin neurol.37,186-192)(koo ms、kim ej、roh d、kim ch(2014)roleof dopamine in the pathophysiology and treatment of obsessive-compulsivedisorder.exp.rev.neurotherap.10,275-290)。此外,已知若干神经学及精神病学药物作为d2拮抗剂起作用,包括非典型抗精神病药物(例如,阿立哌唑(aripiprazole)、氯氮平(clozapine)、奥氮平(olanzapine)及齐拉西酮(ziprasidone))、多潘立酮(domperidone)、依替必利(eticlopride)、法利普利特(fallypride)、脱甲氧基法利普利特、l-741,626、雷氯必利(raclopride)、羟嗪、伊托必利(itopride)、sv 293、典型抗精神病药物、育亨宾(yohimibine)、胺磺必利(amisulpride)及uh-232。因为gpr52激动剂应与d2拮抗剂功能上相似,本文中所公开的gpr52激动剂可用于治疗可通过d2拮抗剂治疗的病症,包括(但不限于)精神病、疏离感、焦虑、与精神神经病相关联的焦虑/紧张、急性躁狂症、精神激动、双相障碍中的躁狂、心境恶劣、恶心、呕吐、胃肠病状、消化不良及成瘾(例如,可卡因成瘾、安非他明(amphetamine)成瘾等)。
18、因此,据信gpr52激动剂为治疗中枢神经系统的疾病的有前景候选。
19、因此,对开发用于预防和/或治疗精神病的具有对gpr52的促效作用的化合物存在需求。
20、特别是,对开发用于预防和/或治疗精神病(诸如精神分裂症)的具有对gpr52的促效作用及可用作药物剂的优化药物性质的化合物存在需求。
21、wo2009/157196、wo2009/107391、wo2011/078360、wo2011/093352、wo2011/145735、wo2012/020738、wo2016/176571以及wo2021/090030、wo2021/198149及w02021/216705公开用于治疗中枢神经系统疾病及其他疾病的调节gpr52的化合物。
22、本发明的目标
23、现已发现根据通式(i)的本发明的化合物或其药学上可接受的盐为gpr52的有效激动剂。
24、除了针对gpr52的促效性质外,本发明的化合物提供另外有利性质以对人类疗法可行,诸如低血浆蛋白结合、于人类肝细胞中的高稳定性、延长至非cyp酶代谢(诸如水解酶介导的路径)的药物代谢、低herg通道抑制(或相互作用)、和/或待用作药物的化合物的适当水溶性。
25、根据通式(i)的本发明的化合物于人类肝细胞中是代谢稳定的。因此,期望本发明的化合物具有有利体内清除及因此于人类中的所需作用持续时间。许多药物的主要代谢位点为肝,因此,肝细胞代表用于研究体外药物代谢的模型体系。于人类肝细胞中的增强的稳定性与若干药物动力学优点相关联,包括增加的生物可利用率和/或更长半衰期,其可使患者能更低和/或更少频率给药。用于疾病治疗的化合物的更低和/或更少频率有效剂量最小化潜在副作用。因此,于人类肝细胞中的增强的代谢稳定性为待用作药物的化合物的有利特性。
26、此外,根据通式(i)的本发明的化合物显示低血浆蛋白结合及因此高的于血浆中的未结合分数,其翻译成用于疾病治疗的化合物的适当低有效剂量及因此另外潜在优点,诸如副作用的最小化。因此,本发明的化合物针对人类疗法可行,特别是具有高至中等代谢稳定性及低血浆蛋白结合二者的通式(i)的化合物。
27、根据通式(i)的本发明的化合物(限制条件为基团r6为c1-3-烷羰基部分)显示非cyp酶代谢,特别是水解酶介导的代谢,其促进多样化整体代谢及导致经由细胞色素p450酶的药物动力学药物-药物相互作用的降低的风险。
28、药物-药物相互作用是指一种药物对另一种的影响,若药物影响代谢酶或转运蛋白的功能或表达,则通常发生。最严重药物动力学相互作用为其中第二种药物改变第一种药物的清除率的那些。实施例为一种药物的代谢通过共同施用的药物的抑制:存在第一种药物的血浆浓度的增加,其可导致治疗反应的临床相关增加或增加的毒性。
29、药物代谢主要于肝及肠中发生。这些器官表达多种药物代谢酶及负责许多药物的生物转化。第i阶段氧化代谢主要透过位于肝内质网中的酶的细胞色素p450(cyp)家族发生,但是亦可通过非cyp酶(诸如水解酶)介导。接着这些功能化反应通常为结合反应(第ii阶段)以增加异型生物质的可排泄性。
30、认为细胞色素p450(cyp)酶为能催化大多数药物及其他亲脂性异型生物质的氧化生物转化(第1阶段代谢)的主要酶家族,而透过非cyp酶介导的路径介导的药物代谢为较不突出。若cyp独立路径涉及药物的氧化、水解或结合,则醛氧化酶、酯酶/水解酶及葡萄糖苷酸转移酶(ugt)各自为催化此代谢的主要酶。例如,负责导致药物的n-脱乙酰化的酰胺水解的主要酶为丝氨酸水解酶,诸如芳乙酰胺脱乙酰酶。
31、肝微粒体提供优异体外工具以识别这些非cyp代谢路径,包括主要代谢物的解析。
32、于临床精神病学中,组合药物疗法通常用于治疗患有精神或身体疾病共病的患者,以控制特定药物的副作用或增强药物效应。然而,所述复方用药方法涉及cyp介导的药物-药物相互作用的高风险。因此,具有药物-药物相互作用的低潜能的药物的使用为所需,尤其针对更可能同时服用多种药物的老年患者(spina e,de leon,j.(2007)metabolicdrug interactions with newer antipsychotics:a comparative review.basicclin.pharmacol.toxicol.100,4-22)。
33、因此,如由根据通式(i)的本发明化合物(其中基团r6为c1-3-烷羰基部分)所示,对透过非cyp酶依赖路径,例如经由水解酶介导的代谢的整体代谢清除的另外贡献(从而导致更多样化代谢及因此药物-药物相互作用的降低的风险)是高度所需的。因此,本发明的化合物针对人类疗法可行。
34、herg通道的抑制及随后延迟的心脏再极化为与特定多形性室性心动过速、尖端扭转型室性心动过速的增加的风险相关联,如由sanguinetti等人(1995,cell,81(2):299-307)及随后证据所确立。为最小化此风险,于使用herg通道的异源表达的体外系统中针对herg信道抑制的筛选为惯例及后期临床前分析的重要部分,如由ich指导方针s 7 b所建议(international conference on harmonization(2005):ich topic s 7 b;thenonclinical evaluation of the potential for delayed ventricularrepolarization(qt interval prolongation)by human pharmaceuticals)。因此,低至中等herg通道抑制或相互作用(诸如由本发明的化合物所示)为高度所需。因此,本发明的化合物针对人类疗法可行。
35、根据式(i)的本发明的化合物显示待用作药物的化合物的可接受的水溶性。化合物的增强的溶解度导致提高的药物产物的可开发性。此外,如本领域已知,溶解性差的化合物可遭受差的人类暴露。
36、因此,本发明的一个方面涉及根据通式(i)的化合物或其盐,优选地其药学上可接受的盐,作为gpr52的激动剂。
37、本发明的另一方面涉及根据通式(i)的化合物或其盐,优选地其药学上可接受的盐,作为gpr52的激动剂,具有高至中等人类肝细胞稳定性。
38、本发明的另一方面涉及根据通式(i)的化合物或其盐,优选地其药学上可接受的盐,作为gpr52的激动剂,具有低至中等人类血浆蛋白结合。
39、本发明的另一方面涉及根据通式(i)的化合物(其中基团r6为c1-3-烷羰基部分)或其盐,优选地其药学上可接受的盐,作为gpr52的激动剂,具有多样化代谢,包括非cyp酶依赖性代谢路径,诸如水解酶介导的代谢。
40、本发明的另一方面涉及根据通式(i)的化合物或其盐,优选地其药学上可接受的盐,作为gpr52的激动剂,具有低至中等herg通道抑制。
41、本发明的另一方面涉及根据通式(i)的化合物或其盐,优选地其药学上可接受的盐,作为gpr52的激动剂,具有待用作药物的化合物的适当水溶性。
42、本发明的另一方面涉及根据通式(i)的化合物或其盐,作为gpr52的激动剂,具有高至中等人类肝细胞稳定性及低至中等人类血浆蛋白结合。
43、本发明的另一方面涉及根据通式(i)的化合物或其盐,作为gpr52的激动剂,具有高至中等人类肝细胞稳定性,低至中等人类血浆蛋白结合,及多样化代谢,包括非cyp酶依赖性代谢路径,诸如水解酶介导的代谢。
44、本发明的另一方面涉及根据通式(i)的化合物或其盐,作为gpr52的激动剂,具有高至中等人类肝细胞稳定性,低至中等人类血浆蛋白结合,多样化代谢,包括非cyp酶依赖性代谢路径,诸如水解酶介导的代谢(仅针对其中基团r6为c1-3-烷羰基部分的化合物),低至中等herg通道抑制及任选待用作药物的化合物的适当水溶性。
45、于另一方面中,本发明涉及药物组合物,其含有至少一种根据通式(i)的化合物,或其药学上可接受的盐,任选连同一种或多种惰性佐剂、稀释剂和/或载剂。
46、本发明的另一方面涉及根据通式(i)的化合物或其药学上可接受的盐,或包含根据式(i)的化合物或其药学上可接受的盐的药物组合物,其用于预防和/或治疗与不足gpr52活性相关的病症。
47、本发明的另一方面涉及制造根据通式(i)的本发明的化合物或其盐,特别是药学上可接受的盐的方法。
48、本发明的其他目的对于本领域技术人员将从上述和后面的说明直接变得显而易见。
技术实现思路
- 还没有人留言评论。精彩留言会获得点赞!