缺乏I类和II类MHC的NSG小鼠
缺乏i类和ii类mhc的nsg小鼠
1.本技术是申请日2018年5月14日和发明名称“缺乏i类和ii类mhc的nsg小鼠”的201880045358.2号中国发明专利申请的分案申请。
2.相关申请的引用
3.本技术要求2017年5月12日提交的美国临时专利申请序列号62/505,264和2018年3月28日提交的美国临时专利申请序列号62/649,099的优先权,其全部内容通过引用并入本文。
4.拨款引用
5.本发明是在国立卫生研究院授予的拨款号1r24 od018259和拨款号od011190的政府支持下完成的。政府拥有本发明的某些权利。
技术领域
6.通常描述的是功能性人类细胞和组织的小鼠模型。根据特定的方面,提供了遗传修饰的免疫缺陷小鼠,其缺乏i类mhc和ii类mhc。根据进一步特定的方面,提供了遗传修饰的免疫缺陷小鼠,其缺乏i类mhc和ii类mhc并且其包含1)移植的功能性人t细胞和2)同种异体或异种细胞,如人患者来源的肿瘤细胞。
背景技术:
7.人源化小鼠(例如,移植了功能性人细胞和组织的免疫缺陷小鼠)已广泛用于在体内对人类免疫细胞的功能进行建模。在这样的小鼠模型中研究人类t细胞功能的主要限制是移植物抗宿主病(gvhd)的快速发展,这不仅缩短了实验时间窗,而且由于最终杀死小鼠的正在进行中的潜在gvhd,使得对人类t细胞功能的分析造成混淆。这些问题已经阻碍了人类t细胞功能的研究。
8.做出了一些尝试以产生缺乏i类或ii类主要组织相容性复合物(mhc)的人源化小鼠模型。例如,vugmeyster等公开了一种缺乏由h-2k和h-2d基因编码的mhc分子的小鼠模型(kbd
b-/-小鼠)(vugmeyster等,proc.natl.acad.sci.usa 95:12492-12497,1998)。ashizawa等描述了一种人源化免疫缺陷nog小鼠(nod/shi-scid-il2rγ
null
)[nod/shi-prkdc
scid-il2rγ
null
],其敲除了i/ii类mhc(ashizawa等,clin cancer res;23(1),149-158,2017)。
[0009]
对功能性人细胞和组织的小鼠模型存在持续需求。
技术实现要素:
[0010]
根据本发明的方面,提供了一种nod.cg-prkdc
scid
il2rg
tm1wjl
/szj(nod-scid-il2rγ
null
,nsg)小鼠,所述小鼠被遗传修饰使得所述nsg小鼠缺乏功能性主要组织相容性复合物i(mhc i)和缺乏功能性主要组织相容性复合物ii(mhc ii)。根据特定的方面,遗传修饰的nsg小鼠是nod.cg-prkdc
scid
h2-k1
tm1bpe
h2-ab1
em1mvw
h2-d1
tm1bpe
il2rg
tm1wjl
/szj(nsg-(kbdb)
null
(ia
null
))小鼠、nsg-rip-dtr(kbdb)
null
(ia
null
)小鼠或nod.cg-b2m
tm1unc
prkdc
scid
h2
dlab1-ea
il2rg
tm1wjl
/szj(nsg-b2m
null
(ia ie
null
))小鼠。
[0011]
根据本发明的方面,提供了一种nod.cg-prkdc
scid
il2rg
tm1wjl
/szj(nod-scid-il2rγ
null
,nsg)小鼠,所述小鼠被遗传修饰使得所述nsg小鼠缺乏功能性主要组织相容性复合物i(mhc i)和缺乏功能性主要组织相容性复合物ii(mhc ii),其包含人免疫细胞。根据特定的方面,所述遗传修饰的nsg小鼠是nod.cg-prkdc
scid
h2-k1
tm1bpe
h2-ab1
em1mvw
h2-d1
tm1bpe
il2rg
tm1wjl
/szj(nsg-(kbdb)
null
(ia
null
))小鼠,其包含人免疫细胞,nsg-rip-dtr(kbdb)
null
(ia
null
)小鼠,其包含人免疫细胞,或者nod.cg-b2m
tm1unc
prkdc
scid
h2
dlab1-ea
il2rg
tm1wjl
/szj(nsg-b2m
null
(ia ie
null
))小鼠,其包含人免疫细胞。
[0012]
根据本发明的方面,提供了一种nod.cg-prkdc
scid
il2rg
tm1wjl
/szj(nod-scid-il2rγ
null
,nsg)小鼠,所述小鼠被遗传修饰使得所述nsg小鼠缺乏功能性主要组织相容性复合物i(mhc i)和缺乏功能性主要组织相容性复合物ii(mhc ii),其包含人外周血单核细胞。根据特定的方面,所述遗传修饰的nsg小鼠是nod.cg-prkdc
scid
h2-k1
tm1bpe
h2-ab1
em1mvw
h2-d1
tm1bpe
il2rg
tm1wjl
/szj(nsg-(kbdb)
null
(ia
null
))小鼠,其包含人外周血单核细胞,nsg-rip-dtr(kbdb)
null
(ia
null
)小鼠,其包含人外周血单核细胞,或者nod.cg-b2m
tm1unc
prkdc
scid
h2
dlab1-ea
il2rg
tm1wjl
/szj(nsg-b2m
null
(ia ie
null
))小鼠,其包含人外周血单核细胞。
[0013]
根据本发明的方面,提供了一种nod.cg-prkdc
scid
il2rg
tm1wjl
/szj(nod-scid-il2rγ
null
,nsg)小鼠,所述小鼠被遗传修饰使得所述nsg小鼠缺乏功能性主要组织相容性复合物i(mhc i)和缺乏功能性主要组织相容性复合物ii(mhc ii),其包含人t细胞。根据特定的方面,所述遗传修饰的nsg小鼠是nod.cg-prkdc
scid
h2-k1
tm1bpe
h2-ab1
em1mvw
h2-d1
tm1bpe
il2rg
tm1wjl
/szj(nsg-(kbdb)
null
(ia
null
))小鼠,其包含人t细胞,nsg-rip-dtr(kbdb)
null
(ia
null
)小鼠,其包含人t细胞,或者nod.cg-b2m
tm1unc
prkdc
scid
h2
dlab1-ea
il2rg
tm1wjl
/szj(nsg-b2m
null
(ia ie
null
))小鼠,其包含人t细胞。
[0014]
根据本发明的方面,提供了一种nod.cg-prkdc
scid
il2rg
tm1wjl
/szj(nod-scid-il2rγ
null
,nsg)小鼠,所述小鼠被遗传修饰使得所述nsg小鼠缺乏功能性主要组织相容性复合物i(mhc i)和缺乏功能性主要组织相容性复合物ii(mhc ii),其包含人免疫细胞和人肿瘤细胞。根据特定的方面,所述遗传修饰的nsg小鼠是nod.cg-prkdc
scid
h2-k1
tm1bpe
h2-ab1
em1mvw
h2-d1
tm1bpe
il2rg
tm1wjl
/szj(nsg-(kbdb)
null
(ia
null
))小鼠,其包含人免疫细胞和人肿瘤细胞,nsg-rip-dtr(kbdb)
null
(ia
null
)小鼠,其包含人免疫细胞和人肿瘤细胞,或者nod.cg-b2m
tm1unc
prkdc
scid
h2
dlab1-ea
il2rg
tm1wjl
/szj(nsg-b2m
null
(ia ie
null
))小鼠,其包含人免疫细胞和人肿瘤细胞。
[0015]
根据本发明的方面,提供了一种nod.cg-prkdc
scid
il2rg
tm1wjl
/szj(nod-scid-il2rγ
null
,nsg)小鼠,所述小鼠被遗传修饰使得所述nsg小鼠缺乏功能性主要组织相容性复合物i(mhc i)和缺乏功能性主要组织相容性复合物ii(mhc ii),其包含人外周血单核细胞和人肿瘤细胞。根据特定的方面,所述遗传修饰的nsg小鼠是nod.cg-prkdc
scid
h2-k1
tm1bpe
h2-ab1
em1mvw
h2-d1
tm1bpe
il2rg
tm1wjl
/szj(nsg-(kbdb)
null
(ia
null
))小鼠,其包含人外周血单核细胞和人肿瘤细胞,nsg-rip-dtr(kbdb)
null
(ia
null
)小鼠,其包含人外周血单核细胞和人肿瘤细胞,或者nod.cg-b2m
tm1unc
prkdc
scid
h2
dlab1-ea
il2rg
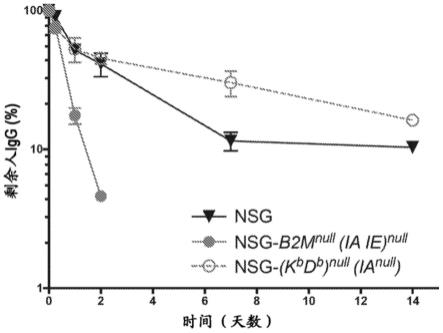
tm1wjl
/szj(nsg-b2m
null
(iaie
null
))小鼠,其包含人外周血单核细胞和人肿瘤细胞。
[0016]
根据本发明的方面,提供了一种nod.cg-prkdc
scid
il2rg
tm1wjl
/szj(nod-scid-il2rγ
null
,nsg)小鼠,所述小鼠被遗传修饰使得所述nsg小鼠缺乏功能性主要组织相容性复合
d1
tm1bpe
il2rg
tm1wjl
/szj(nsg-(kbdb)
null
(ia
null
))小鼠,nsg-rip-dtr(kbdb)
null
(ia
null
)小鼠,或者nod.cg-b2m
tm1unc
prkdc
scid
h2
dlab1-ea
il2rg
tm1wjl
/szj(nsg-b2m
null
(ia ie
null
))小鼠,其中所述方法包括向所述遗传修饰的免疫缺陷小鼠施用测试物质;和在所述遗传修饰的免疫缺陷小鼠中测定所述人白细胞的作用。测试物质可以是但不限于抗肿瘤抗体、免疫治疗剂、免疫检查点抑制剂,包括但不限于pd-1抑制剂、pd-l1抑制剂或ctla-4抑制剂。测试物质可以是选自下述的免疫检查点抑制剂:阿特珠单抗、阿维鲁单抗、德鲁单抗、伊匹单抗、纳武单抗或派姆单抗,或者前述任一种的抗原结合片段。测试物质可以是抗癌剂。
[0023]
提供了一种对遗传修饰的免疫缺陷小鼠中人pmbc的作用进行建模的方法,其中所述遗传修饰的免疫缺陷小鼠是nod.cg-prkdc
scid
h2-k1
tm1bpe
h2-ab1
em1mvw
h2-d1
tm1bpe
il2rg
tm1wjl
/szj(nsg-(kbdb)
null
(ia
null
))小鼠,nsg-rip-dtr(kbdb)
null
(ia
null
)小鼠,或者nod.cg-b2m
tm1unc
prkdc
scid
h2
dlab1-ea
il2rg
tm1wjl
/szj(nsg-b2m
null
(ia ie
null
))小鼠,其中所述方法包括向所述遗传修饰的免疫缺陷小鼠施用测试物质;和在所述遗传修饰的免疫缺陷小鼠中测定所述人pmbc的作用。测试物质可以是但不限于抗肿瘤抗体、免疫治疗剂、免疫检查点抑制剂,包括但不限于pd-1抑制剂、pd-l1抑制剂或ctla-4抑制剂。测试物质可以是选自下述的免疫检查点抑制剂:阿特珠单抗、阿维鲁单抗、德鲁单抗、伊匹单抗、纳武单抗或派姆单抗,或者前述任一种的抗原结合片段。测试物质可以是抗癌剂。
[0024]
提供了一种对遗传修饰的免疫缺陷小鼠中人t细胞的作用进行建模的方法,其中所述遗传修饰的免疫缺陷小鼠是nod.cg-prkdc
scid
h2-k1
tm1bpe
h2-ab1
em1mvw
h2-d1
tm1bpe
il2rg
tm1wjl
/szj(nsg-(kbdb)
null
(ia
null
))小鼠,nsg-rip-dtr(kbdb)
null
(ia
null
)小鼠,或者nod.cg-b2m
tm1unc
prkdc
scid
h2
dlab1-ea
il2rg
tm1wjl
/szj(nsg-b2m
null
(ia ie
null
))小鼠,其中所述方法包括向所述遗传修饰的免疫缺陷小鼠施用测试物质;和在所述遗传修饰的免疫缺陷小鼠中测定所述人t细胞的作用。测试物质可以是但不限于抗肿瘤抗体、免疫治疗剂、免疫检查点抑制剂,包括但不限于pd-1抑制剂、pd-l1抑制剂或ctla-4抑制剂。测试物质可以是选自下述的免疫检查点抑制剂:阿特珠单抗、阿维鲁单抗、德鲁单抗、伊匹单抗、纳武单抗或派姆单抗,或者前述任一种的抗原结合片段。测试物质可以是抗癌剂。
附图说明
[0025]
图1a-1c显示了在nsg-(kbdb)
null
(ia
null
)和nsg-b2m
null
(ia ie)
null
小鼠中i类和ii类mhc的表达的代表性流式细胞术图。通过酶促和机械消化分解nsg、nsg-(kbdb)
null
(ia
null
)和nsg-b2m
null
(ia ie)
null
敲除小鼠的脾脏。
[0026]
图1a是显示在活细胞中鉴定出单核细胞来源的树突状细胞为cd11b+、ly6gdim、cd11c+和ly6c-的图。
[0027]
图1b是显示从各个表达小鼠h2kd和h2kb的品系中回收的单核细胞来源的树突状细胞的评估结果的图。对于所有染色,显示了代表性染色(n=2)。
[0028]
图1c是显示从各个表达小鼠h2 ia
g7
和h2 iab的品系中回收的单核细胞来源的树突状细胞的评估结果的图。对于所有染色,显示了的代表性染色(n=2)。
[0029]
图2是显示在nsg-(kbdb)
null
(ia
null
)和nsg-b2m
null
(ia ie)
null
小鼠血清中人igg半衰期的图。向小鼠iv注射200μg人igg并在所示时间点取血以回收血清。将血清用于循环人igg的elisa分析。将在注射后2分钟的第一次取血认为是100%血清igg。每个点表示5只2-3
(kbdb)
null
(ia
null
)(n=8)小鼠用作pbmc的受体时人cd3+细胞(占cd45的%)的图。数据代表3次独立实验。将双因素anova用于确定在每个时间点组间的显著性差异。*表示p《0.05。
[0040]
图5b是显示当将nsg(n=7)、nsg-(ia
null
)(n=5)、nsg-(kbdb)
null
(n=7)和nsg-(kbdb)
null
(ia
null
)(n=8)小鼠用作pbmc的受体时人cd20+细胞(占cd45的%)的图。数据代表3次独立实验。将双因素anova用于确定在每个时间点组间的显著性差异。*表示p《0.05。
[0041]
图5c是显示当将nsg(n=6)、nsg-(ia ie)
null
(n=6)、nsg-b2m
null
(n=5)和nsg-b2m
null
(ia ie)
null
(n=7)小鼠用作pbmc的受体时人cd3+细胞(占cd45的%)的图。数据代表3次独立实验。将双因素anova用于确定在每个时间点组间的显著性差异。*表示p《0.05。
[0042]
图5d是显示当将nsg(n=6)、nsg-(ia ie)
null
(n=6)、nsg-b2m
null
(n=5)和nsg-b2m
null
(ia ie)
null
(n=7)小鼠用作pbmc的受体时人cd20+细胞(占cd45的%)的图。数据代表3次独立实验。将双因素anova用于确定在每个时间点组间的显著性差异。*表示p《0.05。
[0043]
图6a-6h显示了在注射了pbmc的nsg、nsg-(ia
null
)、nsg-(kbdb)
null
和nsg-(kbdb)
null
(ia
null
)小鼠中移植的人t细胞的表型分析。向受体小鼠iv注射10x106个pbmc,并在注射后4周监测外周血中人cd3+/cd4+和cd3/cd8+t细胞的水平(图6a和图6d)和t细胞表型(图6b、图6c和图6e-图6h)。数据代表2次独立实验。将单因素anova用于确定组间的显著性差异。*表示p《0.05,**表示p《0.01,***表示p《0.005和****表示p《0.001。
[0044]
图6a是显示通过流式细胞术确定并以cd4与cd8 t细胞的比率表示的cd4和cd8 t细胞的水平的图。
[0045]
图6b是显示对于注射了pbmc的nsg、nsg-(ia
null
)、nsg-(kbdb)
null
和nsg-(kbdb)
null
(ia
null
)小鼠通过流式细胞术确定的由cd4 t细胞表达的pd-1的图。
[0046]
图6c是显示对于注射了pbmc的nsg、nsg-(ia
null
)、nsg-(kbdb)
null
和nsg-(kbdb)
null
(ia
null
)小鼠通过流式细胞术确定的由cd8 t细胞表达的pd-1的图。
[0047]
图6d-6f是显示代表性cd4、cd8和pd1染色的图。
[0048]
图6g和6h是分别显示cd4和cd8 t细胞的图,其通过流式细胞术针对cd45ra和ccr7的表达进行评估。t细胞亚群的百分比显示为cd45ra+/ccr7+细胞标记为幼稚,cd45ra-/ccr7+细胞标记为中央记忆,cd45ra-/ccr7-细胞标记为效应/效应记忆和cd45ra+/ccr7-细胞标记为temra。
[0049]
图7a-7h显示了在注射了pbmc的nsg、nsg-(ia ie)
null
、nsg-b2m
null
和nsg-b2m
null
(ia ie)
null
小鼠中移植的人t细胞的表型分析。向受体小鼠iv注射10x106个pbmc,并在注射后4周监测外周血中人cd3+/cd4+和cd3/cd8+t细胞(图7a和图7d)的水平和t细胞表型(图7b、图7c和图7e-图7h)。数据代表2次独立实验。将单因素anova用于确定组间的显著性差异。*表示p《0.05,**表示p《0.01,***表示p《0.005和****表示p《0.001。
[0050]
图7a是显示通过流式细胞术确定并以cd4与cd8 t细胞的比率表示的cd4和cd8 t细胞水平的图。
[0051]
图7b是显示对于注射了pbmc的nsg、nsg-(ia ie)
null
、nsg-b2m
null
和nsg-b2m
null
(ia ie)
null
小鼠通过流式细胞术确定的由cd4细胞表达的pd-1的图。
[0052]
图7c是显示对于注射了pbmc的nsg、nsg-(ia ie)
null
、nsg-b2m
null
和nsg-b2m
null
(ia ie)
null
小鼠通过流式细胞术确定的由cd8细胞表达的pd-1的图。
[0053]
图7d-7f是显示代表性cd4、cd8和pd1染色的图。
[0054]
图7g和7h是分别显示cd4和cd8 t细胞的图,其通过流式细胞术针对cd45ra和ccr7的表达进行评估。t细胞亚群的百分比显示为cd45ra+/ccr7+细胞标记为幼稚,cd45ra-/ccr7+细胞标记为中央记忆,cd45ra-/ccr7-细胞标记为效应/效应记忆和cd45ra+/ccr7-细胞标记为temra。
[0055]
图8a-8f显示了在移植了pbmc的nsg-rip-dtr(kbdb)
null
(ia
null
)小鼠中人胰岛(islet)同种异体移植物的排斥情况。数据代表2次独立实验。将t-检验用于确定组间的显著性差异。*表示p《0.05,**表示p《0.01,***表示p《0.005。
[0056]
图8a是显示在pbmc注射前6天,用40ng白喉毒素(dt)处理nsg-rip-dtr(kbdb)
null
(ia
null
)小鼠,然后再通过脾内注射植入人胰岛(4000ieq)的结果的图。在第0天时,向一组小鼠ip注射50x106个人pbmc,未对另一组小鼠进行处理。监测血糖水平,将连续2次检测血糖水平高于300mg/dl的小鼠认为是糖尿病。
[0057]
图8b是显示通过确定外周血(6周)和脾脏(7周)中cd45+细胞比例监测小鼠中人细胞嵌合水平的结果的图。
[0058]
图8c和8d是分别显示在外周血和脾脏中cd3+/cd4+和cd3+/cd8+t细胞水平的图。
[0059]
图8e是显示在第6周时通过elisa确定的血浆中循环人c-肽水平的图。
[0060]
图8f是显示通过elisa在第7周时确定的胰岛移植小鼠的脾脏中总胰岛素含量的图。
[0061]
图9a-9h显示了在移植pbmc的nsg和nsg-(kbdb)
null
(ia
null
)小鼠中表达人il2增强人cd4+treg的存活。向受体nsg和nsg-(kbdb)
null
(ia
null
)小鼠ip注射2.5x10
11
个aav-il2颗粒或注射pbs。两周后,向小鼠腹腔(ip)注射1x106个pbmc。
[0062]
图9a-9c是显示通过流式细胞术确定的人cd45+细胞(图9a)、cd3+t细胞(图9b)和cd4+/cd25+/cd127-/foxp3+treg(图9c)水平的图。将双因素anova用于确定组间的显著性差异。***表示p《0.005,和****表示p《0.001。
[0063]
图9d显示了针对所示组的对cd25、cd127和foxp3的cd4+t细胞的代表性染色。
[0064]
图9e是显示监测受体小鼠存活%并使用对数秩统计检验所示组之间的存活分布的图。
[0065]
图9f是显示通过流式细胞术确定并以cd4与cd8 t细胞的比率表示的cd4和cd8 t细胞水平的图。实心黑色三角形表示nsg小鼠,空心黑色三角形表示注射了aav-il2的nsg小鼠,实心圆圈表示nsg-(kbdb)
null
(ia
null
)小鼠和空心圆圈表示注射了aav-il2的nsg-(kbdb)
null
(ia
null
)小鼠。
[0066]
图9g是显示通过流式细胞术评估cd8 t细胞中cd45ra和ccr7表达的结果的图。t细胞亚群的百分比显示为cd45ra+/ccr7+细胞标记为幼稚,cd45ra-/ccr7+细胞标记为中央记忆,cd45ra-/ccr7-细胞标记为效应/效应记忆和cd45ra+/ccr7-细胞标记为temra。实心黑色三角形表示nsg小鼠,空心黑色三角形表示注射了aav-il2的nsg小鼠,实心圆圈表示nsg-(kbdb)
null
(ia
null
)小鼠和空心圆圈表示注射了aav-il2的nsg-(kbdb)
null
(ia
null
)小鼠。
[0067]
图9h是显示通过流式细胞术确定的由cd8 t细胞表达的颗粒酶b并且显示了代表性染色的图。将t-检验用于确定用aav-il2处理的小鼠与对照之间的显著性差异。***表示p《0.005,****表示p《0.001。数据代表3次独立实验。
[0068]
图10a是显示共同注射了pbmc和人患者来源的肿瘤细胞的一组nsg小鼠和共同注
射了pbmc和人患者来源的肿瘤细胞的一组nsg-(kbdb)
null
(ia
null
)小鼠的存活百分比的图。
[0069]
图10b是显示1)在注射人患者来源的肿瘤细胞的nsg小鼠;2)在共同注射了pbmc和人患者来源的肿瘤细胞的nsg小鼠;注射了pbmc的nsg-(kbdb)
null
(ia
null
)小鼠;和共同注射了pbmc和人患者来源的肿瘤细胞的nsg-(kbdb)
null
(ia
null
)小鼠中的肿瘤生长的图。
具体实施方式
[0070]
本文使用的科学和技术术语旨在具有本领域普通技术人员通常理解的含义。这样的术语被发现在各种标准参考文献的上下文中定义和使用,说明性地包括:j.sambrook和d.w.russell,molecular cloning:a laboratory manual,cold spring harbor laboratory press;第3版,2001;f.m.ausubel,ed.,short protocols in molecular biology,current protocols;第5版,2002;b.alberts等,molecular biology of the cell,第4版,garland,2002;d.l.nelson和m.m.cox,lehninger principles of biochemistry,第4版,w.h.freeman&company,2004;a.nagy,m.gertsenstein,k.vintersten,r.behringer,manipulating the mouse embryo:a laboratory manual,第3版,cold spring harbor laboratory press;2002年12月15日,isbn-10:0879695919;kursad turksen(ed.),embryonic stem cells:methods and protocols in methods mol biol.2002;185,humana press;current protocols in stem cell biology,isbn:9780470151808;chu,e.和devita,v.t.,eds.,physicians’cancer chemotherapy drug manual,jones&bartlett publishers,2005;j.m.kirkwood等,eds.,current cancer therapeutics,第4版,current medicine group,2001;remington:the science and practice of pharmacy,lippincott williams&wilkins,第21版,2005;l.v.allen,jr.等,ansel’s pharmaceutical dosage forms and drug delivery systems,第8版,philadelphia,pa:lippincott,williams&wilkins,2004;和l.brunton等,goodman&gilman’s the pharmacological basis of therapeutics,mcgraw-hill professional,第12版,2011。
[0071]
单数的术语“一种/一个(a/an)”和“所述/该(the)”并无意局限,其包括复数形式,除非另行明确说明或者上下文另有明确指示。
[0072]
如本文通常使用的,术语“功能性”指保留了相应天然蛋白、复合物、细胞或其他物质的生物学功能的蛋白、复合物、细胞或其他物质。
[0073]
而相反的是,如本文通常使用的,术语“非功能性”指没有保留相应天然蛋白、复合物、细胞或其他物质的生物学功能的蛋白、复合物、细胞或其他物质。
[0074]
本发明提供了缺乏i类mhc和ii类mhc的遗传修饰的免疫缺陷小鼠。
[0075]
根据各个方面,提供了一种遗传修饰的免疫缺陷小鼠,其在其基因组中包含至少一个突变,所述突变有效地减少或消除功能性mhc iα蛋白的表达和/或减少或消除功能性β2-微球蛋白的表达,以使得在所述小鼠中不存在mhc i或其不是功能性的;并且其在其基因组中包含至少一个突变,所述突变有效地减少或消除功能性mhc iiα蛋白的表达和/或功能性mhc iiβ蛋白的表达,以使得在所述小鼠中不存在mhc ii或其不是功能性的。
[0076]
根据各个方面,遗传修饰的免疫缺陷小鼠是遗传修饰的nsg小鼠。根据本发明的方面,nsg mhc i/ii敲除小鼠可用于各种应用,包括在不存在gvhd情况下的人免疫力的研究
deursen,eds.,transgenic mouse methods and protocols,humana press,2002;a.l.joyner,gene targeting:apractical approach,oxford university press,2000;manipulating the mouse embryo:a laboratory manual,第3版,cold spring harbor laboratory press;2002年12月15日,isbn-10:0879695919;kursad turksen(ed.),embryonic stem cells:methods and protocols in methods mol biol.2002;185,humana press;current protocols in stem cell biology,isbn:978047015180;meyer等,pnas usa,vol.107(34),15022-15026。
[0091]
根据优选的方面,除了缺乏功能性内源性mhc i和mhc ii以外,在本发明的遗传修饰的免疫缺陷小鼠中不表达非内源性mhc i或mhc ii。特别地,根据优选的实施方式,在本发明的遗传修饰的免疫缺陷小鼠中不存在或不表达人淋巴细胞相容性基因。
[0092]
如本文中所使用的,与基因及其编码的蛋白相关的“内源性”指在小鼠基因组的其天然基因座中存在的基因。
[0093]
可以将基于同源性的重组基因修饰策略用于通过编码一种或多种内源性蛋白(例如,mhc iα蛋白和β2-微球蛋白的至少一种;以及mhc iiα蛋白和mhc iiβ蛋白的至少一种)的基因的“敲除”或其他突变来遗传修饰免疫缺陷小鼠。
[0094]
基于同源性的重组基因修饰策略包括基因编辑方法,如使用归巢核酸内切酶、整合酶、大范围核酸酶、转座子、使用锌指核酸酶(zfn)的核酸酶介导的过程、转录激活因子样(tal)、规律成簇的间隔短回文重复序列(crispr)-cas或者果蝇重组相关蛋白(drap)方法的那些。参见例如,cerbini等,plos one.2015;10(1):e0116032;shen等,plos one 8(10):e77696;和wang等,protein&cell,2016年2月,第7卷,第2期,pp 152
–
156。
[0095]
通过例如本文所述的和在下述中详述的方法进行基因组编辑:j.p.sundberg和t.ichiki,eds.,genetically engineered mice handbook,crc press;2006;m.h.hofker和j.van deursen,eds.,transgenic mouse methods and protocols,humana press,2002;a.l.joyner,gene targeting:a practical approach,oxford university press,2000;manipulating the mouse embryo:a laboratory manual,第3版,cold spring harbor laboratory press;2002年12月15日,isbn-10:0879695919;kursad turksen(ed.),embryonic stem cells:methods and protocols in methods mol.biol.2002;185,humana press;current protocols in stem cell biology,isbn:978047015180;meyer等,pnas usa,2010,vol.107(34),15022
–
15026;以及doudna,j.等,(eds.)crispr-cas:a laboratory manual,2016,cshp。本文描述了几种基因组编辑技术的简要描述。
[0096]
用于遗传修饰的核酸酶技术
[0097]
可以将遗传修饰方法(例如但不限于核酸酶基因编辑技术)用于将期望的dna序列在预定靶位点引入基因组中,如使用归巢核酸内切酶、整合酶、大范围核酸酶、转座子、使用锌指核酸酶(zfn)的核酸酶介导的过程、转录激活因子样(tal)、规律成簇间隔短回文重复序列(crispr)-cas或者果蝇重组相关蛋白(drap)的方法。简言之,可以使用的遗传修饰方法包括将编码靶向talen、zfn、crispr或drap的rna分子和至少一种寡核苷酸引入es细胞、ips细胞、体细胞、受精卵或胚胎中,然后选择具有期望的遗传修饰的es细胞、ips细胞、体细胞、受精卵或胚胎。
[0098]
例如,可以通过核酸酶技术(例如但不限于crispr方法、tal(转录激活因子样效应
物方法)、锌指介导的基因组编辑或drap)在预定的靶位点将期望的核酸序列引入小鼠的基因组中,以产生根据本发明的实施方式提供的遗传修饰的小鼠。
[0099]
如在本文中所使用的,在核酸酶基因编辑技术的背景下,术语“靶位点”和“靶序列”指定义了待编辑的染色体序列的一部分的核酸序列,并且只要存在充分的结合条件,核酸酶被工程化与之识别和结合。
[0100]
crispr-cas系统
[0101]
crispr(规律成簇的间隔短回文重复序列)是含有多个短直接重复序列的基因座,其见于约40%已测序的细菌和90%已测序的古细菌的基因组中,并且赋予了对外源dna元件的抗性,参见horvath,2010,science,327:167
–
170;barrangou等,2007,science,315:1709-1712;和makarova等,2011,nature reviews microbiology.9:467-477。
[0102]
crispr重复序列的大小范围为24至48个碱基对。其通常表现出一定的二重对称性,这意味着形成了例如发夹但并不是真正的回文的二级结构。crispr重复序列被相似长度的间隔子隔开。
[0103]
crispr-相关(cas)基因通常与crispr重复序列间隔子阵列相关。已经描述了超过40种不同的cas蛋白家族(haft等,2005,plos comput biol.1(6):e60)。已将cas基因与重复序列结构的特定组合用于定义8种crispr亚型,其中的一些与编码重复序列相关未知蛋白(ramp)的其他基因模块相关。
[0104]
在不同生物体中存在多样的crispr系统,最简单的一个是来自酿脓链球菌(streptococcus pyogenes)的ii型crispr系统:只有一个编码cas9蛋白的基因和两个rna,一个成熟crispr rna(crrna)和一个部分互补的反式作用rna(tracrrna),其对于rna指导的外源dna沉默是必需且充分的(gasiunas等,2012,pnas 109:e2579-e2586;jinek等,2012,science 337:816-821)。crrna的成熟需要tracrrna和rnase iii(deltcheva等,2011,nature 471:602-607)。然而,这种需求可以通过使用含有模拟tracrrna-crrna复合物的设计发夹的工程化的小指导rna(sgrna)而绕过(jinek等,2012,science 337:816-821)。由于cas9的核酸内切酶活性,sgrna与靶dna之间的碱基配对导致双链断裂(dsb)。结合特异性由sgrna-dna碱基配对和与dna互补区并列的短dna基序(原间隔子相邻基序[pam]序列:ngg)两者决定(marraffini&sontheimer,2010,nature reviews genetics,11:181-190)。例如,crispr系统需要含有两个分子即cas9蛋白和sgrna的最小组,因此可以用作独立于宿主的基因靶向平台。可以利用cas9/crispr进行位点选择性rna指导的基因组编辑,如靶向插入,参见例如,carroll,2012,molecular therapy 20:1658-1660;chang等,2013,cell research 23:465-472;cho等,2013,nature biotechnol 31:230-232;cong等,2013,science339:819-823;hwang等,2013,nature biotechnol 31:227-229;jiang等,2013,nature biotechnol 31:233-239;mali等,2013,science 339:823-826;qi等,2013,cell 152:1173-1183;shen等,2013,cell research23:720-723;和wang等,2013,cell 153:910-918。特别是,wang等,2013,cell 153:910-918描述了使用crispr/cas9系统联合寡核苷酸的靶向插入。
[0105]
产生根据本发明的遗传修饰的免疫缺陷小鼠可以包括将适当的核酸(例如用于在crispr中使用的编码cas9的表达构建体和编码对被靶向的基因具有特异性的指导rna的表达构建体)注射或转染至植入前的胚胎或干细胞,如胚胎干细胞(es)或诱导的多能干细胞
(ips)。任选地,cas9和指导rna在单个表达构建体中编码。
[0106]
tal(转录激活因子样)效应物
[0107]
转录激活因子样(tal)效应物或tale(转录激活因子样效应物)来源于植物病原菌黄单胞菌属,并且这些蛋白模拟植物转录激活因子和操纵植物转录,参见kay等,2007,science,318:648-651。
[0108]
tal效应物含有集中的串联重复序列结构域,每个重复序列含有约34个氨基酸,其对这些蛋白的dna结合特异性是关键的。此外,其含有核酸定位序列和酸性转录激活结构域,综述参见schornack等,2006,j.plant physiol.,163(3):256-272;scholze和boch,2011,curr opin microbiol,14:47
–
53。
[0109]
tal效应物的特异性取决于在串联重复序列中存在的序列。重复序列包含约102bp,重复序列彼此之间通常具有91-100%的同源性(bonas等,1989,mol gen genet 218:127-136)。重复序列的多态性通常位于第12和13位,并且第12和13位高变二残基的同一性与tal效应物靶序列中连续核苷酸的同一性之间似乎是一一对应的,参见moscou和bogdanove 2009,science 326:1501;和boch等,2009,science 326:1509-1512。将两个高变残基称为重复可变二残基(rvd),其中一个rvd识别dna序列的一个核苷酸并确保每个tal效应物的dna结合结构域能够以较高精度(15-30nt)靶向大的识别位点。在实验上,已确定了这些tal-效应物的dna识别代码,以使得在第12和13位的hd序列与胞嘧啶(c)结合,ng与t结合,ni与a、c、g或t结合,nn与a或g结合以及ig与t结合。这些dna结合重复序列已被组装成具有新的组合和重复序列的数量的蛋白,以形成能够在植物细胞中与新序列相互作用并激活报告基因的表达的人工转录因子(boch等,2009,science 326:1509-1512)。这些dna结合结构域已被证明在所有细胞类型中的靶向基因组编辑或靶向基因调控领域具有普遍适用性,参见gaj等,trends in biotechnol,2013,31(7):397-405。而且,工程化的tal效应物已显示出与外源功能性蛋白效应结构域(如核酸酶)结合的功能,所述外源功能性蛋白效应结构域在哺乳动物细胞的天然黄单胞菌tal-效应物或蛋白中不天然存在。可以通过组合tal与核酸酶(例如,在n-末端或c-末端的foki核酸酶结构域)构建tal核酸酶(taln或talen),kim等,1996,pnas 93:1156-1160;christian等,2010,genetics 186:757-761;li等,2011,nucleic acids res 39:6315-6325;和miller等,2011,nat biotechnol 29:143-148。已在大鼠、小鼠、斑马鱼、非洲爪蟾、青鳉、大鼠和人细胞中显示出talen通过nhej导致缺失的功能性,ansai等,2013,genetics,193:739-749;carlson等,2012,pnas,109:17382-17387;hockemeyer等,2011,nature biotechnol.,29:731-734;lei等,2012,pnas,109:17484-17489;moore等,2012,plos one,7:e37877;stroud等,2013,j.biol.chem.,288:1685-1690;sung等,2013,nature biotechnol 31:23-24;wefers等,2013,pnas 110:3782-3787。
[0110]
对于talen,进一步在美国专利号8,420,782;8,450,471;8,450,107;8,440,432;8,440,431和美国专利公开号us20130137161和us20130137174中描述了制备其的方法。
[0111]
其他有用的核酸内切酶可以包括例如hhai、hindiii、noti、bbvci、ecori、bg/i和alwi。可以利用一些核酸内切酶(例如,foki)仅作为二聚体的功能来增强tal效应物的靶特异性。例如,在一些情况下,每个foki单体均可以与识别不同dna靶序列的tal效应物序列融合,并且仅当两个识别位点非常接近时,无活性单体才能结合在一起形成功能性酶。通过要求dna结合以激活核酸酶,可以产生高度位点特异性限制酶。
[0112]
在一些实施方式中,talen还可以包含核定位信号或序列(nls)。nls是有助于将talen核酸酶蛋白靶向细胞核中以便在染色体中的靶序列处引入双链断裂的氨基酸序列。
[0113]
核定位信号是本领域所公知的,参见例如,makkerh等,1996,curr biol.6:1025-1027。nls包括来自sv40大t抗原的序列,kalderon 1984,cell,39:499
–
509;来自核蛋白的nls,在dingwall等,1988,j cell biol.,107,841
–
9中对其进行了详细描述。在mclane和corbett 2009,iubmb life,61,697
–
70;dopie等,2012,pnas,109,e544
–
e552中描述了进一步的实例。
[0114]
切割结构域可以从任何核酸内切酶或核酸外切酶获得。可以作为切割结构域来源的核酸内切酶的非限制性实例包括但不限于限制性核酸内切酶和归巢核酸内切酶。参见例如,2002-2003catalog,new england biolabs,beverly,mass.;和belfort等,(1997)nucleic acids res.25:3379-3388。切割dna的其他酶是已知的,例如si核酸酶;绿豆核酸酶;胰dnase i;微球菌核酸酶;酵母ho核酸内切酶。亦参见linn等,(eds.)nucleases,cold spring harbor laboratory press,1993。可以将一种或多种这些酶或者其功能性片段作为切割结构域的来源。
[0115]
锌指介导的基因组编辑
[0116]
已经很好地建立了使用锌指核酸酶(zfn)用于基因编辑,如通过同源定向修复过程进行靶向插入。例如,参见carbery等,2010,genetics,186:451-459;cui等,2011,nature biotechnol.,29:64-68;hauschild等,2011,pnas,108:12013-12017;orlando等,2010,nucleic acids res.,38:e152-e152;和porteus&carroll,2005,nature biotechnology,23:967-973。
[0117]
锌指介导过程的组分包括具有dna结合结构域和切割结构域的锌指核酸酶。例如,在下述中对其进行了描述:beerli等,(2002)nature biotechnol.,20:135-141;pabo等,(2001)ann.rev.biochem.,70:313-340;isalan等,(2001)nature biotechnol.19:656-660;segal等,(2001)curr opin.biotechnol.,12:632-637;和choo等,(2000)curr opin.struct.biol.,10:411-416;以及美国专利号6,453,242和6,534,261。设计和选择靶序列的锌指结合结构域的方法是本领域公知的,参见例如sera,等,biochemistry 2002,41,7074-7081;美国专利号6,607,882;6,534,261和6,453,242。
[0118]
在一些实施方式中,锌指核酸酶还可以包含核定位信号或序列(nls)。nls是有助于将锌指核酸酶蛋白靶向细胞核中以便在染色体中的靶序列处引入双链断裂的氨基酸序列。核定位信号是本领域公知的。参见例如,makkerh等,(1996)current biology 6:1025-1027以及本文所述的其他文献。
[0119]
切割结构域可以从任何核酸内切酶或核酸外切酶获得。可以作为切割结构域来源的核酸内切酶的非限制性实例包括但不限于限制性核酸内切酶和归巢核酸内切酶。参见例如,2002-2003catalog,new england biolabs,beverly,mass.;和belfort等,(1997)nucleic acids res.25:3379-3388。切割dna的其他酶是已知的(例如,si核酸酶;绿豆核酸酶;胰dnase i;微球菌核酸酶;酵母ho核酸内切酶)。亦参见linn等,(eds.)nucleases,cold spring harbor laboratory press,1993。可以将一种或多种这些酶(或者其功能性片段)作为切割结构域的来源。如上所述,切割结构域还可以来自需要二聚化以产生切割活性的酶或其部分。
[0120]
可能需要两个锌指核酸酶进行切割,因为每个核酸酶包括活性酶二聚体的一个单体。或者,单个锌指核酸酶可以包含全部两个单体以产生活性酶二聚体。限制性核酸内切酶(限制酶)存在于很多物种中,并且能够序列特异性地与dna结合(在识别位点)并在结合位点处或其附近切割dna。某些限制酶(例如,iis型)在从识别位点去除的位点切割dna,并且具有可分离的结合和切割结构域。例如,iis型酶foki催化dna的双链切割,其在一条链上是来自其识别位点的9个核苷酸,在另一条连上是来自其识别位点的13个核苷酸。参见例如,美国专利号5,356,802;5,436,150和5,487,994;以及li等,(1992)pnas 89:4275-4279;li等,(1993)pnas 90:2764-2768;kim等,(1994)pnas 91:883-887;kim等,(1994)j.biol.chem.269:31,978-31,982。因而,锌指核酸酶可以包含来自至少一种iis型限制酶的切割结构域和一种或多种锌指结合结构域,其可以是经过或未经工程化的。例如,在国际公开的wo 07/014275中描述了示例性的iis型限制酶,其全部公开内容通过引用并入本技术。其他限制酶还含有可分离的结合和切割结构域,并且这些也包含在本公开内容中。参见例如,roberts等,(2003)nucleic acids res.31:418-420。切割结构域与结合结构域相分离的示例性iis型限制酶是foki。这种特定的酶是作为二聚体具有活性的(bitinaite等,1998,pnas 95:10,570-10,575)。因此,出于本公开内容的目的,将在锌指核酸酶中使用的foki酶的部分认为是切割单体。因此,对于使用foki切割结构域靶向双链切割而言,可以使用两个锌指核酸酶(每个均包含foki切割单体)以重构核心酶二聚体。或者,也可以使用含有锌指结合结构域和两个foki切割单体的单一多肽分子。在某些实施方式中,切割结构域可以包含一个或多个工程化的切割单体,其最小化或阻止同源二聚化,如在例如美国专利公开号20050064474、20060188987和20080131962中所描述的,其全部内容均通过引用并入本技术。在非限制性实例中,在foki的位置446、447、479、483、484、486、487、490、491、496、498、499、500、531、534、537和538的氨基酸残基均是影响foki切割半结构域二聚化的靶点。形成专性异二聚体的foki的示例性工程化切割单体包含一对,其中第一切割单体包含在foki的氨基酸残基位置490和538处的突变以及第二切割单体包含在氨基酸残基位置486和499处的突变。因此,在一个实施方式中,在氨基酸位置490存在glu(e)替代lys(k)的突变;在氨基酸残基538处存在ile(e)替代lys(k)的突变;在氨基酸残基486处存在gln(q)替代glu(e)的突变;以及在位置499处存在ile(i)替代lys(k)的突变。特别地,可以通过以下方式来制备工程化的切割单体:在一个切割单体中通过将位置490由e突变为k并将位置538由i突变为k以产生命名为“e490k:i538k”的工程化的切割单体并且在另一个切割单体中通过将位置486由q突变为e并将位置499由q突变为e以产生命名为“q486e:i499l”的工程化的切割单体。上文所述的工程化的切割单体是专性异二聚体突变体,其中异常切割被最小化或消除。可以使用适宜的方法制备工程化的切割单体,例如通过野生型切割单体(foki)的位点定向诱变,如在美国专利公开号20050064474中所描述的。
[0121]
上文所述的锌指核酸酶可以被工程化,以在靶向整合位点处引入双链断裂。双链断裂可以位于靶向整合位点处,或者可以距离整合位点最多1、2、3、4、5、10、15、20、25、30、35、40、45、50、100或1000个核苷酸。在一些实施方式中,双链断裂可以距离整合位点最多1、2、3、4、5、10、15或20个核苷酸。在其他实施方式中,双链断裂可以距离整合位点最多10、15、20、25、30、35、40、45或50个核苷酸。在另外其他实施方式中,双链断裂可以距离整合位点最多50、100或1000个核苷酸。
[0122]
已在美国专利号6,534,643;6,858,716和6,830,910以及watt等,2006中描述了drap技术。
[0123]
可以通过将基因靶向载体引入植入前胚胎或干细胞(如胚胎干细胞(es)或诱导的多能干细胞(ips))中产生其基因组包含遗传修饰的遗传修饰的免疫缺陷小鼠,其中所述遗传修饰使得小鼠缺乏mhc i和mhc ii。
[0124]
术语“基因靶向载体”指例如通过插入或替代靶基因有效地与特定染色基因座重组并对其进行突变的双链重组dna分子。
[0125]
对于靶基因破坏(例如,突变)而言,基因靶向载体是使用重组dna技术制备的并且包含与干细胞内源性靶基因同源的5’和3’序列。基因靶向载体任选地和优选地还包含选择标记,如新霉素磷酸转移酶、潮霉素或嘌呤霉素。本领域普通技术人员能够选择包含在基因靶向载体中的序列,并仅使用常规实验就可以使用它们。可以使用公知的方法重组或合成产生基因靶向载体。
[0126]
对于将基因靶向载体dna注射进入植入前的胚胎中的方法而言,在注射进入非人植入前胚胎中以前将基因靶向载体线形化。优选地,将基因靶向载体注射进入受精卵。交配次日(0.5dpc)从超排卵雌性中收集受精卵,并注射表达构建体。将注射的卵母细胞培养过夜或直接转移至0.5-天p.c.假孕雌性的输卵管中。用于超排卵,收获卵母细胞,基因靶向注射以及胚胎转移的方法是本领域公知的,并且在manipulating the mouse embryo:a laboratory manual,第3版,cold spring harbor laboratory press;2002年12月15日,isbn-10:0879695919中进行了描述。可以通过dna分析(如pcr、southern印记或测序)针对靶基因破坏(例如,突变)的存在情况对后代进行检测。可以针对靶蛋白的表达(如通过使用elisa或western印记分析)和/或mrna的表达(如通过rt-pcr)对具有破坏的(例如,突变的)靶基因的小鼠进行检测。
[0127]
或者,可以使用熟知的方法(如电穿孔、磷酸钙沉淀和脂质转染)将基因靶向载体转染进入干细胞(es细胞或ips细胞)。
[0128]
在针对特定细胞系优化的培养基中培养小鼠es细胞。通常地,es培养基为含有15%胎牛血清(fbs)或者合成或半合成等价物、2nm谷氨酰胺、1mm丙酮酸钠、0.1mm非必需氨基酸、50u/ml青霉素和链霉素、0.1mm 2-巯基乙醇和1000u/ml lif(对于一些细胞系加入化学分化抑制剂)的dulbecco's modified eagle media(dmem)。详细说明是本领域所公知的(tremml等,2008,current protocols in stem cell biology,chapter 1:unit 1c.4)。es细胞分化抑制剂的综述参见buehr,m.等,(2003).genesis of embryonic stem cells.philosophical transactions of the royal society b:biological sciences358,1397-1402。
[0129]
通过dna分析(如pcr、southern印记或测序)针对靶基因的破坏(例如,突变)对细胞进行筛选。可以针对靶蛋白的表达(如通过使用elisa或western印记分析)和/或mrna的表达(如通过rt-pcr)对具有破坏靶基因的正确同源重组事件的细胞进行检测。如有需要,可以通过使用cre重组酶处理干细胞除去选择标记。在使用cre重组酶处理后,针对编码靶蛋白的核酸的存在情况对细胞进行分析。
[0130]
可以将所选择的具有破坏靶基因的正确基因组事件的干细胞注射进入植入前的胚胎中。对于显微注射,使用胰酶和edta的混合物将es或ips细胞制成单细胞,随后重悬于
es培养基中。使用拉出的细玻璃针(内径为20-25微米)选择单细胞群,并使用装有显微操作器的倒置显微镜将其通过胚胎的透明带引入胚泡腔(囊胚腔)。作为胚泡注射的替代方法,可以将干细胞注射到早期胚胎中(例如,2细胞、4细胞、8细胞、前桑葚胚或桑葚胚)。可以使用钻孔打开透明带的激光或压电脉冲辅助注射。每个胚泡或8细胞阶段胚胎注射约9-10个选定的干细胞(es或ips细胞),每个4细胞阶段胚胎注射6-9个干细胞以及每个2细胞阶段胚胎注射约6个干细胞。引入干细胞后,使胚胎在37℃下在含5% co2、5% o2的氮气中恢复数小时或培养过夜,随后转移进入假孕受体雌性中。在干细胞注射进一步的替代方法中,可以将桑葚胚期的胚胎与干细胞聚集在一起。所有这些方法均已很好的建立,并且可以用于生产干细胞嵌合体。更加详细的说明,参见manipulating the mouse embryo:a laboratory manual,第3版(a.nagy,m.gertsenstein,k.vintersten,r.behringer,cold spring harbor laboratory press;2002年12月15日,isbn-10:0879695919),nagy等,1990,development 110,815-821;us7576259:method for making genetic modifications,us7659442,us7,294,754,kraus等,010,genesis 48,394-399。
[0131]
使用本领域公知的方法制备假孕胚胎受体。简言之,将6-8周龄的可育雌性小鼠与已切除输精管或不育的雄性小鼠交配,以诱导有助于支持手术引入胚胎的激素状态。在交配后(dpc)2.5天,将多达15个含有胚泡的干细胞引入非常靠近子宫与输卵管交界处的子宫角。对于早期胚胎和桑葚胚而言,将这些胚胎在体外培养成胚泡或根据胚胎阶段将其植入0.5dpc或1.5dpc假孕雌性的输卵管中。来自移植胚胎的嵌合幼崽在转移后16-20天出生,具体取决于植入时的胚龄。选择嵌合雄性进行繁殖。可以通过皮毛颜色和核酸分析(如pcr、southern印记或测序)分析后代es细胞基因组的传递情况。此外,可以比如通过蛋白分析(例如,免疫测定)或功能性测定针对靶mrna或蛋白表达情况对靶基因表达情况进行分析,以确认靶基因破坏。将靶基因破坏(例如,突变)的后代互相交配,以产生靶基因破坏的非人动物纯合子。将转基因小鼠与免疫缺陷小鼠交配,以产生靶基因破坏的同基因免疫缺陷品系。
[0132]
对遗传修饰小鼠进行评估以确定靶基因是否被破坏以使得所述小鼠缺乏表达靶基因的能力的方法是众所周知的,并且包括标准技术,如核酸测定、光谱测定、免疫测定和功能性测定。
[0133]
可以使用一个或多个标准品,以便能够对样品中的靶蛋白进行定量检测。
[0134]
可以在推定靶基因破坏的动物中进行评估功能性靶蛋白的测定。本文描述了在推定靶基因破坏的动物中进行评估靶蛋白的功能的测定。
[0135]
任选地,通过选择性繁殖产生根据本发明的方面的遗传修饰的免疫缺陷小鼠。可以将具有第一期望基因型的小鼠的第一亲本品系与具有第二期望基因型的小鼠的第二亲本品系进行繁殖,以产生具有第一和第二期望基因型的遗传修饰小鼠的后代。例如,可以将免疫缺陷的第一小鼠与mhc i基因破坏的第二小鼠进行繁殖,以使得不表达mhc i或其表达减少,以产生免疫缺陷且mhc i基因破坏以使得不表达mhc i或其表达减少的后代。在进一步的实例中,可以将nsg小鼠与靶基因破坏以使得不表达靶基因或其表达减少的小鼠进行繁殖,以产生免疫缺陷且靶基因破坏以使得不表达靶蛋白或其表达减少的后代。
[0136]
本发明的方面提供了一种遗传修饰的免疫缺陷小鼠,其在基本上所有细胞中包含靶基因破坏,以及一种遗传修饰的小鼠,其在一些但不是所有细胞中包含靶基因破坏。
[0137]
免疫缺陷
[0138]
术语“免疫缺陷的非人动物”意指其特征在于以下中的一种或多种的非人动物:缺少功能性免疫细胞,如t细胞和b细胞;dna修复缺陷;编码淋巴细胞上抗原特异性受体的基因重排的缺陷;缺乏免疫功能分子,如igm、igg1、igg2a、igg2b、igg3和iga。
[0139]
根据本发明的方面,根据本发明的方面提供的其基因组包含遗传修饰的遗传修饰的免疫缺陷非人动物是小鼠,其中所述遗传修饰使得所述非人动物缺乏mhc i和mhc ii活性。尽管本文描述的主要指本发明的方面,其中遗传修饰的免疫缺陷非人动物是小鼠,但是遗传修饰的免疫缺陷非人动物也可以是哺乳动物,如大鼠、沙鼠、豚鼠、仓鼠、兔子、猪、绵羊或非人灵长类动物。
[0140]
术语“免疫缺陷小鼠”意指其特征在于以下中的一种或多种的小鼠:缺少功能性免疫细胞,如t细胞和b细胞;dna修复缺陷;编码淋巴细胞上抗原特异性受体的基因重排的缺陷;缺乏免疫功能分子,如igm、igg1、igg2a、igg2b、igg3和iga。免疫缺陷小鼠可通过参与免疫功能的基因中一种或多种缺陷来表征,如rag1和rag2(oettinger,m.a等,science,248:1517-1523,1990;和schatz,d.g.等,cell,59:1035-1048,1989)免疫缺陷小鼠可能具有导致小鼠免疫功能异常的这些或其他缺陷中的任一种。
[0141]
特别有用的免疫缺陷小鼠品系是nod.cg-prkdc
scid il2rg
tm1wjl
/szj,通常将其称为nod scidγ(nsg)小鼠,在shultz ld等,2005,j.immunol,174:6477-89中对其进行了详细描述。nsg是在jackson laboratory开发的具有代表性的小鼠亚品系。可以将其他类似的小鼠亚品系用于制备nsg,并且旨在包括在本发明中。其他有用的免疫缺陷小鼠品系包括nod.cg-rag1
tm1mom il2rg
tm1wjl
/szj,参见shultz ld等,2008,clin exp immunol 154(2):270-84,通常将其称为nrg小鼠;和nod.cg-prkdc
scid il2rg
tm1sug
/jictac或nod/shi-scid-il2rγ
null
,通常将其称为nog小鼠,如在ito,m.等,blood 100,3175
–
3182(2002)中详细描述的。
[0142]
术语“严重联合免疫缺陷(scid)”意指其特征在于缺乏t细胞和b细胞功能缺乏的病况。
[0143]
scid的常见形式包括:x-连锁scid,其特征在于il2rg基因中γ链基因突变和淋巴细胞表型t(-)b(+)nk(-);和常染色体隐性scid,其特征在于jak3基因突变和淋巴细胞表型t(-)b(+)nk(-),ada基因突变和淋巴细胞表型t(-)b(-)nk(-),il-7rα链突变和淋巴细胞表型t(-)b(+)nk(+),cd3δ或ε突变和淋巴细胞表型t(-)b(+)nk(+),rag1/rag2突变和淋巴细胞表型t(-)b(-)nk(+),artemis基因突变和淋巴细胞表型t(-)b(-)nk(+),cd45基因突变和淋巴细胞表型t(-)b(+)nk(+)。
[0144]
在进一步的方面,遗传修饰的免疫缺陷小鼠在其编码dna依赖性蛋白激酶催化亚基(prkdc)的内源性基因中有缺陷,其导致小鼠表达有缺陷的内源性dna依赖性蛋白激酶催化亚基和/或内源性dna依赖性蛋白激酶催化亚基的量减少,或者所述小鼠可能根本不表达内源性dna依赖性蛋白激酶催化亚基。免疫缺陷小鼠可以任选地是prkdc null的,以使得其缺乏功能性内源性prkdc基因。
[0145]
根据本发明的方面遗传修饰的小鼠具有具有严重联合免疫缺陷突变(prkdc
scid
),通常被称为scid突变。scid突变是公知的,并且如bosma等,immunogenetics 29:54-56,1989中所描述位于小鼠第16号染色体上。对于scid突变纯合的小鼠的特征在于缺乏功能性
t细胞和b细胞、淋巴细胞减少、低球蛋白血症和正常的造血微环境。可以检测scid突变,例如通过使用公知的方法(如pcr或流式细胞术)检测scid突变的标志物。
[0146]
根据本发明的方面,遗传修饰的小鼠具有il2受体γ链的缺乏。术语“il2受体γ链缺陷”意指il2受体γ链减少。il2受体γ链的减少可能是由于基因缺失或突变所致。可以检测降低的il2受体γ链,例如通过使用公知的方法检测il2受体γ链基因的缺失或突变和/或检测降低的il2受体γ链的表达。
[0147]
根据本发明的方面,提供了一种遗传修饰的免疫缺陷nsg小鼠,其基因组包含遗传修饰,其中所述遗传修饰使得免疫缺陷小鼠缺乏mhc i和mhc ii,以使得所述遗传修饰的免疫缺陷nsg小鼠缺乏功能性mhc i和缺乏功能性mhc ii。
[0148]
根据本发明的方面,提供了一种遗传修饰的免疫缺陷nrg小鼠,其基因组包含遗传修饰,其中所述遗传修饰使得免疫缺陷小鼠缺乏mhc i和mhc ii,以使得所述遗传修饰的免疫缺陷nrg小鼠缺乏功能性mhc i和缺乏功能性mhc ii。
[0149]
根据本发明的方面,提供了一种遗传修饰的免疫缺陷nog小鼠,其基因组包含遗传修饰,其中所述遗传修饰使得免疫缺陷小鼠缺乏mhc i和mhc ii,以使得所述遗传修饰的免疫缺陷nog小鼠缺乏功能性mhc i和缺乏功能性mhc ii,前体是所述免疫缺陷小鼠不是以β2m(mhc i的组分)敲除和iaβ(mhc ii的组分)敲除为特征的nod/shi-scid-il2rγ
null
小鼠。
[0150]
nsg-(kbdb)
null
(ia
null
)小鼠
[0151]
根据本发明的方面,一种缺乏i类mhc和ii类mhc的遗传修饰的免疫缺陷小鼠是nod.cg-prkdc
scid h2-k1
tm1bpe h2-ab1
em1mvw h2-d1
tm1bpe il2rg
tm1wjl
/szj(缩写为nsg-(k
b db)
null
(ia
null
))小鼠,其缺乏功能性mhc i和缺乏功能性mhc ii。由于h2-k和h2-d mhc iα蛋白亚类的纯合null突变(缩写为(k
b db)
null
),使得nsg-(k
b db)
null
(ia
null
)小鼠缺乏功能性mhc i。由于mhc ii的h-2a亚类的纯合null突变(缩写为ia
null
),使得nsg-(k
b db)
null
(ia
null
)小鼠缺乏功能性mhc ii。
[0152]
尽管nsg-(k
b db)
null
(ia
null
)和nsg-b2m
null
(ia ie)
null
小鼠均缺乏功能性mhc i和mhc ii,但是未预料到的是,人igg在nsg-(k
b db)
null
(ia
null
)小鼠中的清除与在nsg-b2m
null
(ia ie)
null
小鼠中存在显著差异。尽管nsg-(k
b db)
null
(ia
null
)小鼠显示出缓慢的人igg清除模式(与在nsg小鼠中观察到的类似;值得注意的是nsg小鼠具有功能性mhc i和mhc ii),但是nsg-b2m
null
(ia ie)
null
小鼠显示出迅速的igg清除(见图2),其使得这种小鼠模型不适于在抗体测试中使用。本发明的nsg-(k
b db)
null
(ia
null
)小鼠的特征在于在施用人igg后2天的时间段内清除不超过60%,例如清除不超过70%、80%或90%。在约2周后,在nsg-(k
b db)
null
(ia
null
)小鼠中约90%的人igg被清除。涉及向小鼠施用的人igg时,所使用的术语“清除”指从小鼠中除去功能性人igg的过程。
[0153]
nsg-b2m
null
(ia ie)
null
小鼠
[0154]
根据本发明的方面,缺乏功能性mhc i和缺乏功能性mhc ii的i类mhc和ii类mhc缺陷的遗传修饰的免疫缺陷小鼠是nod.cg-prkdc
scid h2-k1
tm1bpe h2-ab1
em1mvw h2-d1
tm1bpe il2rg
tm1wjl tg(ins2-hbegf)6832ugfm/sz(缩写为nsg-b2m
null
(ia ie)
null
)小鼠。由于β2微球蛋白的纯合null突变(缩写为b2m
null
)使得nsg-b2m
null
(ia ie)
null
小鼠缺乏功能型mhc i。由于mhc ii的h-2a和h-2e亚类的纯合null突变(缩写为(ia ie)
null
)使得nsg-b2m
null
(ia ie)
null
小鼠缺乏功能性mhc ii。
[0155]
在nsg-b2m
null
(ia ie
null
)小鼠中观察到人igg的迅速清除。在约2天后,在nsg-b2m
null
(ia ie
null
)小鼠中约90%的人igg被清除,见图2。
[0156]
nsg-rip-dtr(kbdb)
null
(ia
null
)小鼠
[0157]
根据本发明的方面,缺乏功能性mhc i和缺乏功能性mhc ii的i类mhc和ii类mhc缺陷的遗传修饰的免疫缺陷小鼠是nod.cg-prkdc
scid h2-k1
tm1bpe h2-ab1
em1mvw h2-d1
tm1bpe il2rg
tm1wjl tg(ins2-hbegf)6832ugfm/sz转基因小鼠,缩写为nsg-rip-dtr(k
b db)
null
(ia
null
),其在nsg背景下在大鼠胰岛素启动子的控制下表达白喉毒素受体。将白喉毒素(dt)注射至在大鼠胰岛素启动子的控制下表达白喉毒素受体的小鼠中导致小鼠胰岛β细胞死亡和高血糖。nsg-rip-dtr(k
b db)
null
(ia
null
)品系能够完全和特异性消除小鼠胰腺β细胞,从而避免了糖尿病性药物(如链脲佐菌素)的广泛毒性作用。
[0158]
包含同种异体和/或异种细胞的小鼠模型
[0159]
根据本发明的方面的遗传修饰的免疫缺陷小鼠还包含同种异体和/或异种细胞或组织。由于所述小鼠缺乏功能性mhc i和功能性mhc ii使得移植物抗宿主病(gvhd)减轻或消失,因而观察到已施用同种异体和/或异种细胞或组织的本发明的遗传修饰的免疫缺陷小鼠的存活增加。例如,与相同类型但不缺乏功能性mhc i和功能性mhc ii的免疫缺陷小鼠相比,向所述遗传修饰的免疫缺陷小鼠施用同种异体和/或异种细胞或组织后缺乏功能性mhc i和功能性mhc ii的遗传修饰的免疫缺陷小鼠的存活延长。
[0160]
向缺乏功能性mhc i和功能性mhc ii的遗传修饰的免疫缺陷小鼠施用的同种异体和/或异种细胞或组织的来源或类型不受限制。向缺乏功能性mhc i和功能性mhc ii的遗传修饰的免疫缺陷小鼠施用同种异体和/或异种细胞或组织,根据所施用的同种异体和/或异种细胞或组织的类型,可提供多种用途的小鼠模型。所施用的异种细胞或组织包括但不限于:人胰腺细胞;人胰岛;人胰腺β细胞;干细胞,例如但不限于人cd34+细胞;人患者来源的原代肿瘤细胞;人肿瘤细胞系细胞;人肝细胞;人造血细胞;分离的或混合的人分群血细胞群,如白细胞、红细胞、淋巴细胞、单核细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、血小板、nk细胞、人外周血单核细胞(pbmc)以及两种或多种类型的细胞或组织的组合。
[0161]
所施用的同种异体和/或异种细胞或组织包括但不限于:非人胰腺细胞;非人胰岛;非人胰腺β细胞;干细胞,例如但不限于非人cd34+细胞;非人原代肿瘤细胞;非人肿瘤细胞系细胞;非人干细胞;非人造血细胞;分离的或混合的非人分群血细胞群,如白细胞、红细胞、淋巴细胞、单核细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、血小板、nk细胞、非人外周血单核细胞以及两种或多种类型的细胞或组织的组合。
[0162]
任选地,向缺乏功能性mhc i和功能性mhc ii的遗传修饰的免疫缺陷小鼠施用的同种异体和/或异种细胞或组织是遗传修饰的。
[0163]
根据本发明特定的方面,向缺乏功能性mhc i和功能性mhc ii的免疫缺陷的遗传修饰小鼠施用人t细胞。人t细胞可以以分离的人t细胞群的形式,以在小鼠中将分化成人t细胞的人干细胞或人前体细胞群的形式,或者以人t细胞作为子集的混合细胞群的形式施用。
[0164]
根据本发明特定的方面,向缺乏功能性mhc i和功能性mhc ii的免疫缺陷的遗传修饰小鼠施用人肿瘤细胞。人肿瘤细胞可以以分离的人肿瘤细胞群的形式(例如但不限于,人患者来源的原代人肿瘤细胞或人肿瘤细胞系细胞),或者以人肿瘤细胞作为子集的混合
细胞群的形式施用。
[0165]
根据本发明特定的方面,向缺乏功能性mhc i和功能性mhc ii的免疫缺陷的遗传修饰小鼠施用人肿瘤细胞。人肿瘤细胞可以以分离的人肿瘤细胞群的形式(例如但不限于,人患者来源的原代人肿瘤细胞或人肿瘤细胞系细胞),或者以人肿瘤细胞作为子集的混合细胞群的形式施用。
[0166]
可以通过各种途径(例如但不限于静脉内或腹腔内施用)将同种异体和/或异种细胞或组织施用给本发明的遗传修饰的免疫缺陷小鼠。
[0167]
可以向遗传修饰的免疫缺陷小鼠施用一次或多次同种异体和/或异种细胞或组织。由于移植物抗宿主病(gvhd)减轻或消失,因而已施用同种异体和/或异种细胞或组织的本发明的缺乏功能性mhc i和功能性mhc ii的遗传修饰的免疫缺陷小鼠的存活增加。
[0168]
根据本发明的方面,通过施用一种或多种类型的干细胞将分化的同种异体和/或异种细胞引入缺乏功能性mhc i和功能性mhc ii的免疫缺陷的遗传修饰的小鼠,所述一种或多种类型的干细胞植入免疫缺陷的遗传修饰的小鼠并通过在小鼠中分化干细胞产生分化的细胞或组织。
[0169]
不认为同种异体和/或异种细胞的数量是限制性的。因而,尽管可以使用更多或更少的细胞,但是所施用的同种异体和/或异种细胞数通常在1x103至1x108个(1,000至100,000,000个)范围内。
[0170]
因而,根据本发明的方法的方法可以包括向免疫缺陷的遗传修饰的小鼠施用约1x103(1000)至约1x108(100,000,000)、约1x104(10,000)至约1x108(100,000,000)、约1x104(10,000)至约1x107(10,000,000)、约1x105(100,000)至约1x107(10,000,000)、约1x103(1,000)至约1x104(10,000)、约5x103(5,000)至约5x104(50,000)、约1x104(10,000)至约1x105(100,000)、约5x104(50,000)至约5x105(500,000)、约1x106(1,000,000)至约1x108(100,000,000)、约5x106(5,000,000)至约1x108(100,000,000)、约1x107(10,000,000)至约1x108(100,000,000)、约2x104(20,000)至约5x105(500,000)或者约5x104(50,000)至约2x105(200,000)个同种异体和/或异种细胞。所述方法可以包括向免疫缺陷的遗传修饰小鼠施用至少约1x102(100)、约2x102(200)、约3x102(300)、约4x102(400)、约5x102(500)、约6x102(600)、约7x102(700)、约8x102(800)、约9x102(900)、约1x103(1000)、约2x103(2000)、约3x103(3000)4x103(4000)、约5x103(5000)、约6x103(6000)、约7x103(7000)、约8x103(8000)、约9x103(9000)、约1x104(10,000)、约2x104(20,000)、约3x104(30,000)、约4x104(40,000)、约5x104(50,000)、约6x104(60,000)、约7x104(70,000)、约8x104(80,000)、约9x104(90,000)、约1x105(100,000)、约2x105(200,000)、约3x105(300,000)、约4x105(400,000)、约5x105(500,000)、约6x105(600,000)、约7x105(700,000)、约8x105(800,000)、约9x105(900,000)、约1x106(1,000,000)、约2x106(2,000,000)、约3x106(3,000,000)、约4x106(4,000,000)、约5x106(5,000,000)、约6x106(6,000,000)、约7x106(7,000,000)、约8x106(8,000,000)、约9x106(9,000,000)、约1x107(10,000,000)、约2x107(20,000,000)、约3x107(30,000,000)、约4x107(40,000,000)、约5x107(50,000,000)、约6x107(60,000,000)、约7x107(70,000,000)、约8x107(80,000,000)、约9x107(90,000,000)或者约1x108(100,000,000)个同种异体和/或异种细胞。本领域普通技术人员将能够通过有限的实验确定向特定小鼠施用的同种异体和/或异种细胞的数量。
[0171]
施用同种异体和/或异种细胞至小鼠可包括施用包含同种异体和/或异种细胞的组合物至小鼠。所述组合物可以还包括,例如,水、张力调节剂(例如,盐,比如氯化钠)、ph缓冲剂(例如,柠檬酸盐)和/或糖(例如,葡萄糖)。
[0172]
同种异体和/或异种造血干细胞在遗传修饰的免疫缺陷动物中植入的特征在于,在本发明的遗传修饰的免疫缺陷小鼠中存在分化的同种异体和/或异种细胞(如造血细胞)。同种异体和/或异种细胞的植入可以通过各种方法中的任一者来评估,例如但不限于:在施用细胞后的一个或多个时间点对施用同种异体和/或异种细胞的动物中的细胞进行流式细胞术分析。
[0173]
肿瘤异种移植
[0174]
本发明的各个方面涉及施用异种肿瘤细胞至本发明的遗传修饰的免疫缺陷小鼠。
[0175]
施用至本发明中的遗传修饰的免疫缺陷小鼠的异种肿瘤细胞可以是任何各种肿瘤细胞,包括但不限于肿瘤细胞系细胞和原发性肿瘤细胞。异种肿瘤细胞可以来源于任何各种生物,优选地是哺乳动物,包括人、非人灵长类、大鼠、豚鼠、兔、猫、狗、马、牛、山羊、猪和绵羊。
[0176]
根据本发明的具体方面,异种肿瘤细胞是人肿瘤细胞。根据本发明的具体方面,人肿瘤细胞存在于从人获得的样品,例如但不限于血液样品、组织样品或通过人肿瘤活组织检查获得的样品。
[0177]
从人获得的肿瘤细胞可直接施用至本发明的遗传修饰的免疫缺陷小鼠,或者可以在施用至遗传修饰的免疫缺陷小鼠之前进行体外培养。
[0178]
如本文使用的,术语“肿瘤”意指其特征在于不受调节地生长的细胞,包括但不限于肿瘤前过度增殖、原位癌、肿瘤、转移瘤和实体及非实体肿瘤。肿瘤的实例是由癌症导致的那些,包括但不限于淋巴瘤、白血病、鳞状细胞癌、小细胞肺癌、非小细胞肺癌、肺的腺癌、肺的鳞状细胞癌、腹膜癌、肾上腺癌、肛门癌、胆管癌、膀胱癌、脑癌、乳腺癌、三阴性乳腺癌、中枢或外周神经系统癌、宫颈癌、结肠癌、结直肠癌、子宫内膜癌、食道癌、胆膀胱癌、胃肠癌、胶质母细胞瘤、头颈癌、肾癌、肝癌、鼻咽癌、鼻腔癌、口咽癌、口腔癌、骨肉瘤、卵巢癌、胰腺癌、甲状旁腺癌、垂体癌、前列腺癌、视网膜母细胞瘤、肉瘤、唾液腺癌、皮肤癌、小肠癌、胃癌、睾丸癌、胸腺癌、甲状腺癌、子宫癌、阴道癌和外阴癌。
[0179]
施用肿瘤细胞至遗传修饰的免疫缺陷小鼠可以是如本领域中已知适用的任何方法。例如,施用可包括施用细胞至器官、体腔或血管中,例如通过注射或植入,例如皮下和/或腹膜内植入。所述肿瘤细胞可以肿瘤块、肿瘤细胞团块或解离细胞形式施用。
[0180]
肿瘤细胞可通过各种途径施用,例如但不限于,通过皮下注射、腹膜内注射或注射到尾静脉中。
[0181]
异种肿瘤细胞的植入可以通过各种方法中的任一种进行评估,例如,包括但不限于目视检查小鼠的肿瘤形成迹象。
[0182]
各种方法中的任一种可用于测量异种肿瘤的生长,包括但不限于,在活的小鼠中测量,测量从活的小鼠切除的肿瘤,或测量从死亡小鼠原位或切除的肿瘤。测量可以使用例如卡尺的测量仪器,使用例如超声波检查、计算机断层扫描、正电子发射断层扫描、荧光成像、生物发光成像、磁共振成像的一种或多种成像技术,以及这些或其他肿瘤测量方法中的任何两种或更多种的组合来测量。从携带异种肿瘤细胞的小鼠获得的样品中肿瘤细胞的数
量可用于测量肿瘤的生长,特别是对于非实体肿瘤。例如,可以评估血液样品中非实体肿瘤细胞的数量,以获得小鼠中非实体肿瘤生长的测量。
[0183]
施用的肿瘤细胞的数量不被认为有所限定。单个肿瘤细胞可以在本文所述的遗传修饰的免疫缺陷动物中扩增成可检测的肿瘤。施用的肿瘤细胞的数量通常在103(1,000)至1
×
108(100,000,000)个肿瘤细胞的范围内,尽管可以施用更多或更少。
[0184]
因而,根据本发明的方面的方法可以包括向遗传修饰的免疫缺陷小鼠施用约1x102(100)至约1x108(100,000,000)、约1x103(1,000)至约1x105(100,000)、约1x104(10,000)至约1x106(1,000,000)、约1x105(100,000)至约1x107(10,000,000)、约1x103(1000)至约1x104(10,000)、约5x103(5,000)至约5x104(50,000)、约1x104(10,000)至约1x105(100,000)、约5x104(50,000)至约5x105(500,000)、约1x105(100,000)至约1x106(1,000,000)、约5x105(500,000)至约5x106(5,000,000)、约1x106(1,000,000)至约1x107(10,000,000)、约2x104(20,000)至约5x105(500,000)或者约5x104(50,000)至约2x105(200,000)个异种肿瘤细胞(如人肿瘤细胞)。所述方法可以包括向免疫缺陷的quad小鼠施用至少约1x102(100)、约2x102(200)、约3x102(300)、约4x102(400)、约5x102(500)、约6x102(600)、约7x102(700)、约8x102(800)、约9x102(900)、约1x103(1,000)、约2x103(2,000)、约3x103(3,000)、约4x103(4000)、约5x103(5,000)、约6x103(6,000)、约7x103(7,000)、约8x103(8,000)、约9x103(9,000)、约1x104(10,000)、约2x104(20,000)、约3x104(30,000)、约4x104(40,000)、约5x104(50,000)、约6x104(60,000)、约7x104(70,000)、约8x104(80,000)、约9x104(90,000)、约1x105(100,000)、约2x105(200,000)、约3x105(300,000)、约4x105(400,000)、约5x105(500,000)、约6x105(600,000)、约7x105(700,000)、约8x105(800,000)、约9x105(900,000)、约1x106(1,000,000)、约2x106(2,000,000)、约3x106(3,000,000)、约4x106(4,000,000)、约5x106(5,000,000)、约6x106(6,000,000)、约7x106(7,000,000)、约8x106(8,000,000)、约9x106(9,000,000)或者约1x107(10,000,000)个异种肿瘤细胞(如人肿瘤细胞)。所述方法可以包括向遗传修饰的免疫缺陷小鼠施用约1x102(100)、约2x102(200)、约3x102(300)、约4x102(400)、约5x102(500)、约6x102(600)、约7x102(700)、约8x102(800)、约9x102(900)、约1x103(1,000)、约2x103(2,000)、约3x103(3,000)、约4x103(4,000)、约5x103(5,000)、约6x103(6,000)、约7x103(7,000)、约8x103(8,000)、约9x103(9,000)、约1x104(10,000)、约2x104(20,000)、约3x104(30,000)、约4x104(40,000)、约5x104(50,000)、约6x104(60,000)、约7x104(70,000)、约8x104(80,000)、约9x104(90,000)、约1x105(100,000)、约2x105(200,000)、约3x105(300,000)、约4x105(400,000)、约5x105(500,000)、约6x105(600,000)、约7x105(700,000)、约8x105(800,000)、约9x105(900,000)、约1x106(1,000,000)、约2x106(2,000,000)、约3x106(3,000,000)、约4x106(4,000,000)、约5x106(5,000,000)、约6x106(6,000,000)、约7x106(7,000,000)、约8x106(8,000,000)、约9x106(9,000,000)、约1x107(10,000,000)或者约1x108(100,000,000)个异种肿瘤细胞(如人肿瘤细胞)。本领域普通技术人员将能够通过有限的实验确定向特定小鼠施用的异种肿瘤细胞的数量。
[0185]
根据本发明的方面,向遗传修饰的免疫缺陷小鼠施用异种肿瘤细胞和异种白细胞。可以在同时或在不同时间施用异种肿瘤细胞和异种白细胞。
[0186]
根据本发明的方面,肿瘤细胞与所施用的白细胞来自同一物种。根据各个方面,向本发明的遗传修饰的免疫缺陷小鼠施用的肿瘤细胞和白细胞均是人细胞。
[0187]
根据本发明的方面,向遗传修饰的免疫缺陷小鼠施用异种肿瘤细胞和异种t细胞。可以在同时或在不同时间施用异种肿瘤细胞和异种t细胞。
[0188]
根据本发明的方面,肿瘤细胞与所施用的t细胞来自同一物种。根据各个方面,向本发明的遗传修饰的免疫缺陷小鼠施用的肿瘤细胞和t细胞均是人细胞。
[0189]
根据本发明的方面,向遗传修饰的免疫缺陷小鼠施用异种肿瘤细胞和异种pbmc。可以在同时或在不同时间施用异种肿瘤细胞和异种pbmc。
[0190]
根据本发明的方面,肿瘤细胞与所施用的pbmc来自同一物种。根据各个方面,向本发明的遗传修饰的免疫缺陷小鼠施用的肿瘤细胞和pbmc均是人细胞。
[0191]
预处理(conditioning)
[0192]
在根据本发明的方面的免疫缺陷的遗传修饰的小鼠中植入异种细胞包括在施用异种细胞之前例如通过用高频电磁辐射或伽马射线辐射对受体动物进行亚致死性辐照,或用辐射模拟药物如白消安或氮芥处理,对免疫缺陷的遗传修饰小鼠进行“预处理”。据信预处理减少了宿主免疫细胞(如造血细胞)的数量,并形成了异种免疫细胞(例如但不限于白细胞、t细胞、pbmc或其他细胞)植入的适宜微环境因素,和/或形成了适于植入异种免疫细胞的微环境。用于预处理的标准方法是本领域公知的,如在本文中和在j.hayakawa等,2009,stem cells,27(1):175-182中所描述的。
[0193]
根据本发明的方面提供的方法包括向免疫缺陷的遗传修饰的小鼠施用异种细胞(例如但不限于白细胞、t细胞、pbmc或其他细胞),而未在施用异种免疫细胞(例如但不限于白细胞、t细胞、pbmc或其他细胞)之前“预处理”免疫缺陷的遗传修饰的小鼠。根据本发明的方面提供的方法包括向免疫缺陷的遗传修饰的小鼠施用异种细胞(例如但不限于白细胞、t细胞、pbmc或其他细胞),而未在施用异种免疫细胞之前,通过辐射或辐射模拟药物“预处理”免疫缺陷的遗传修饰小鼠。
[0194]
测定
[0195]
根据本发明的方面提供了测定推定治疗剂的作用的方法,其包括向包含同种异体和/或异种细胞或组织的遗传修饰的免疫缺陷小鼠施用一定量的推定治疗剂;和测量推定治疗剂的作用。
[0196]
在本发明的方法中使用的推定治疗剂可以是任何化学实体,例如包括合成的或天然存在的化合物或者合成的或天然存在的化合物的组合、有机或无机小分子、蛋白、肽、核酸、碳水化合物、寡糖、脂质或者任何这些物质的组合。
[0197]
适于测定的标准品是本领域熟知的,并且所使用的标准品可以是任何适宜的标准品。
[0198]
可以使用统计分析通过各种方法中的任何一种来分析测定结果,示例为通过参数或非参数检验、方差分析、协方差分析、用于多变量分析的逻辑回归、fisher精确检验、卡方检验、student’st检验、mann-whitney检验、wilcoxon签名排名检验、mcnemar检验、friedman检验和page'sl趋势检验。这些和其他统计学检验在本领域中是公知的,详见hicks,cm,research methods for clinical therapists:applied project design and analysis,churchill livingstone(出版商);第5版,2009;和freund,rj等,statistical methods,academic press;第3版,2010。
[0199]
根据本发明的方面提供的方法和遗传修饰的免疫缺陷小鼠具有多种用途,如体内
测试针对人类癌症的物质。
[0200]
根据本发明的方面,用于鉴定测试物质的抗肿瘤活性的方法包括提供遗传修饰的免疫缺陷小鼠;向所述遗传修饰的免疫缺陷小鼠施用异种肿瘤细胞,其中所述异种肿瘤细胞在遗传修饰的免疫缺陷小鼠形成实体或非实体肿瘤;向所述遗传修饰的免疫缺陷小鼠施用测试物质;测定异种肿瘤和/或肿瘤细胞对所述测试物质的响应,其中所述测试物质对肿瘤和/或肿瘤细胞的抑制性作用将测试物质鉴定为具有抗肿瘤活性。
[0201]
根据本发明的方面,用于鉴定测试物质的抗肿瘤活性的方法包括提供遗传修饰的免疫缺陷小鼠;其中所述遗传修饰的免疫缺陷小鼠已植入异种pmbc;向所述遗传修饰的免疫缺陷小鼠施用异种肿瘤细胞,其中所述异种肿瘤细胞在所述遗传修饰的免疫缺陷小鼠中形成实体或非实体肿瘤;向所述遗传修饰的免疫缺陷小鼠施用测试物质;测定异种肿瘤和/或肿瘤细胞对所述测试物质的响应,其中所述测试物质对肿瘤和/或肿瘤细胞的抑制性作用将测试物质鉴定为具有抗肿瘤活性。
[0202]
根据本发明的方面,用于鉴定测试物质的抗肿瘤活性的方法包括提供遗传修饰的免疫缺陷小鼠;其中所述遗传修饰的免疫缺陷小鼠已植入人pmbc;向所述遗传修饰的免疫缺陷小鼠施用人肿瘤细胞,其中所述人肿瘤细胞在所述遗传修饰的免疫缺陷小鼠中形成实体或非实体肿瘤;向所述遗传修饰的免疫缺陷小鼠施用测试物质;测定人肿瘤和/或肿瘤细胞对所述测试物质的响应,其中所述测试物质对肿瘤和/或肿瘤细胞的抑制性作用将测试物质鉴定为具有抗肿瘤活性。
[0203]
根据本发明的方面,在用于鉴定测试物质的抗肿瘤活性的测定中使用的遗传修饰的免疫缺陷小鼠是nsg-(k
b db)
null
(ia
null
)小鼠;或nsg-b2m
null
(ia ie
null
)小鼠。
[0204]
如本文所用,术语“抑制效果”意指测试物质抑制肿瘤生长、肿瘤细胞代谢和肿瘤细胞分裂中一种或多种的效果。
[0205]
测定所述异种肿瘤和/或肿瘤细胞对测试物质的响应包括将所述响应与标准进行比较以根据本发明方法的方面确定所述测试物质对异种肿瘤细胞的效果,其中所述测试物质对所述异种肿瘤细胞的抑制效果将所述测试物质鉴定为抗肿瘤组合物。标准是本领域公知的,所用标准可以是任何合适的标准。在一个实例中,标准是已知具有抗肿瘤效果的化合物。在另一个实例中,对可比的异种肿瘤的无处理提供了无处理肿瘤生长的基础水平指示用于比较测试物质的效果。标准可以是先前在可比的小鼠个体或可比的小鼠群体中确定的预期肿瘤生长的参考水平,并以印刷品或电子基质保存以备回忆和与测定结果比较。
[0206]
测定结果可以通过各种方法中的任一种使用统计分析来确定测试物质是否对肿瘤具有抑制效果,示例为通过参数或非参数检验、方差分析、协方差分析、用于多变量分析的逻辑回归、fisher精确检验、卡方检验、student’s t检验、mann-whitney检验、wilcoxon签名排名检验、mcnemar检验、friedman检验和page's l趋势检验。这些和其他统计学检验在本领域中是公知的,详见hicks,cm,research methods for clinical therapists:applied project design and analysis,churchill livingstone(出版商);第5版,2009;和freund,rj等,statistical methods,academic press;第3版,2010。
[0207]
在本发明的方法中使用的测试物质可以是任何化学实体,例如包括合成的或天然存在的化合物或者合成的或天然存在的化合物的组合、有机或无机小分子、抗体(鼠源的、嵌合的或人源化的)、抗体片段(fab,f(ab)’2)、蛋白、肽、核酸、碳水化合物、寡糖、脂质或者
任何这些物质的组合。
[0208]
根据本发明的方面,测试物质是免疫治疗剂,如抗体(鼠源的、嵌合的或人源化的)、抗体片段(fab,f(ab)’2)或者任何这些物质的组合,或者非免疫治疗剂如合成的或天然存在的化合物、合成的或天然存在的化合物的组合、有机或无机小分子、不是抗体或抗原结合片段的蛋白或肽、核酸、碳水化合物、寡糖、脂质或者任何这些物质的组合。
[0209]
根据本发明的方面,测试物质是抗癌剂。根据本发明的方面,抗癌剂是抗癌免疫治疗剂,如抗癌抗体或其抗原结合片段。根据本发明的方面,抗癌剂是非免疫治疗剂,如合成的或天然存在的化合物、合成的或天然存在的化合物的组合、有机或无机小分子、不是抗体或抗原结合片段的蛋白或肽、核酸、碳水化合物、寡糖、脂质或者任何这些物质的组合。
[0210]
抗癌剂描述于例如brunton等,(eds.),goodman and gilman’s the pharmacological basis of therapeutics,第12版,macmillan publishing co.,2011。
[0211]
抗癌剂说明性地包括阿西维辛(acivicin)、阿柔比星(aclarubicin)、阿考达唑(acodazole)、阿克罗宁(acronine)、阿多来新(adozelesin)、阿地白介素(aldesleukin)、阿利维a酸(alitretinoin)、别嘌呤醇(allopurinol)、六甲蜜胺(altretamine)、安波毒素(ambomycin)、阿美蒽醌(ametantrone)、氨磷汀(amifostine)、氨鲁米特(aminoglutethimide)、安吖啶(amsacrine)、阿那曲唑(anastrozole)、氨茴霉素(anthramycin)、三氧化二砷(arsenic trioxide)、天冬酰胺酶(asparaginase)、曲林菌素(asperlin)、阿扎胞苷(azacitidine)、阿扎替哌(azetepa)、阿佐霉素(azotomycin)、巴马司他(batimastat)、苄替哌(benzodepa)、比卡鲁胺(bicalutamide)、比生群(bisantrene)、双萘法德(bisnafide dimesylate)、比折来新(bizelesin)、博来霉素(bleomycin)、布喹那(brequinar)、溴匹立明(bropirimine)、白消安(busulfan)、放线菌素(cactinomycin)、卡普睾酮(calusterone)、卡培他滨(capecitabine)、卡拉酰胺(caracemide)、卡贝替姆(carbetimer)、卡铂(carboplatin)、卡莫司汀(carmustine)、卡柔比星(carubicin)、卡折来新(carzelesin)、西地芬戈(cedefingol)、塞来昔布(celecoxib)、苯丁酸氮芥(chlorambucil)、西罗霉素(cirolemycin)、顺铂(cisplatin)、克拉屈滨(cladribine)、老比替尼(cobimetinib)、克雷斯托甲磺酸(crisnatol mesylate)、环磷酰胺(cyclophosphamide)、阿糖胞苷(cytarabine)、达卡巴嗪(dacarbazine)、更生霉素(dactinomycin)、柔红霉素(daunorubicin)、地西他滨(decitabine)、右奥马铂(dexormaplatin)、地扎胍宁(dezaguanine)、地扎胍宁甲磺酸(dezaguanine mesylate)、亚丝醌(diaziquone)、多西紫杉醇(doxorubicin)、多柔比星(droloxifene)、屈洛昔芬(droloxifene)、屈他雄酮(dromostanolone)、达佐霉素(duazomycin)、依达曲沙(edatrexate)、eflomithine、依沙芦星(elsamitrucin)、恩洛铂(enloplatin)、恩普氨酯(enpromate)、依匹哌啶(epipropidine)、表柔比星(epirubicin)、厄布洛唑(erbulozole)、依索比星(esorubicin)、雌氮芥(estramustine)、依他硝唑(etanidazole)、依托泊苷(etoposide)、艾托卜宁(etoprine)、法倔唑(fadrozole)、法扎拉滨(fazarabine)、芬维a胺(fenretinide)、氟尿嘧啶(floxuridine)、氟达拉滨(fludarabine)、氟二氧尿嘧啶(fluorouracil)、氟西他滨(flurocitabine)、磷喹酮(fosquidone)、福司曲星(fostriecin)、氟维司群(fulvestrant)、吉西他滨(gemcitabine)、羟基脲(hydroxyurea)、伊达比星(idarubicin)、异环磷酰胺(ifosfamide)、伊莫福新(ilmofosine)、白细胞介素ii
(il-2,包括重组白细胞介素ii或ril2)、干扰素α-2a、干扰素α-2b、干扰素α-n1、干扰素α-n3、干扰素β-1a、干扰素γ-1b、异丙铂(iproplatin)、伊立替康(irinotecan)、兰瑞肽(lanreotide)、来曲唑(letrozole)、亮丙瑞林(leuprolide)、利罗唑(liarozole)、洛美沙星(lometrexol)、洛莫司汀(lomustine)、洛沙昔醌(losoxantrone)、马索罗酚(masoprocol)、美登素(maytansine)、盐酸二氯甲基二乙胺(mechlorethamine hydrochlride)、甲地孕酮(megestrol)、醋酸美伦孕酮(melengestrol acetate)、美法仑(melphalan)、美诺立尔(menogaril)、巯基嘌呤(mercaptopurine)、甲氨蝶呤(methotrexate)、甲托嘌呤(metoprine)、美图雷替帕(meturedepa)、米替吲哚胺(mitindomide)、米托卡星(mitocarcin)、米托罗明(mitocromin)、米托霉素(mitogillin)、米托马星(mitomalcin)、丝裂霉素(mitomycin)、米托斯珀(mitosper)、米托坦(mitota)、米托蒽酮(mitoxantrone)、霉酚酸(mycophenolic acid)、奈拉滨(nelarabine)、诺科达唑(nocodazole)、诺加拉霉素(nogalamycin)、奥姆纳铂(ormnaplatin)、奥昔舒仑(oxisuran)、紫杉醇(paclitaxel)、培加帕加司(pegaspargase)、培利霉素(peliomycin)、戊氮芥(pentamustine)、培洛霉素(peplomycin)、培磷酰胺(perfosfamide)、哌泊溴烷(pipobroman)、哌泊舒凡(piposulfan)、盐酸吡罗昔酮(piroxantrone hydrochloride)、普列卡霉素(plicamycin)、普洛美坦(plomestane)、卟菲尔钠(porfimer)、波菲霉素(porfiromycin)、泼尼莫司汀(prednimustine)、丙卡嗪(procarbazine)、普霉素(purpycin)、吡唑夫林(pyrazofurin)、利博嘌呤(riboprine)、罗格列胺(rogletimide)、赛芬哥尔(safingol)、西莫司汀(semustine)、西曲嗪(simtrazene)、司帕膦(sparfosate)、司帕霉素(sparsomycin)、螺锗胺(spirogermanium)、螺莫司汀(spiromustine)、螺铂(spiroplatin)、链霉素(streptonigrin)、链球菌素(streptozocin)、亚氯芬(sulofenur)、他霉素(talisomycin)、他莫西芬(tamoxifen)、替考加兰(tecogalan)、替加福(tegafur)、替洛蒽酮(teloxantrone)、替波尔芬(temoporfin)、替硝普赛德(teniposide)、特罗西酮(teroxirone)、四斯托内酯(testolactone)、硫胺嘌呤(thiamiprine)、硫鸟嘌呤(thioguanine)、硫代替帕(thiotepa)、硫唑嘌呤(tiazofurin)、替拉帕嗪(tirapazamine)、托泊替康(topotecan)、托瑞米芬(toremifene)、曲托龙(trestolone)、三西利滨(triciribine)、三甲基蝶呤(trimetrexate)、雷公藤红素(triptorelin)、小管洛唑(tubulozole)、尿嘧啶芥末(uracil mustard)、尿得帕(uredepa)、伐普肽(vapreotide)、维莫拉非尼(vemurafenib)、维替泊芬(verteporfin)、长春花碱(vinblastine)、硫酸醛基长春碱(vincristine sulfate)、长春地辛(vindesine)、长春匹定(vinepidine)、长春苷酯(vinglycinate)、长春罗辛(vinleurosine)、长春瑞滨(vinorelbine)、长春罗定(vinrosidine)、长春利定(vinzolidine)、伏氯唑(vorozole)、折尼铂(zeniplatin)、净司他丁(zinostatin)、唑来膦酸(zoledronate)、佐柔比星(zorubicin)等。
[0212]
根据本发明的方面,抗癌剂是抗癌免疫治疗剂,也称为抗癌抗体。所使用的抗癌免疫治疗剂可以是任何抗体,或抗体的有效部分,其有效抑制至少一种类型的肿瘤,特别是人肿瘤。抗癌免疫治疗剂包括但不限于3f8、8h9、阿巴伏单抗(abagovomab)、abituzumab、阿达木单抗(adalimumab)、adecatumumab、aducanumab、阿夫土珠单抗(afutuzumab)、alacizumab pegol、阿仑单抗(alemtuzumab)、amatuximab、anatumomab mafenatox、anetumab ravtansine、apolizumab、arcitumomab、ascrinvacumab、阿特珠单抗
(atezolizumab)、bavituximab、贝利木单抗(belimumab)、贝伐单抗(bevacizumab)、bivatuzumab mertansine、brentuximab vedotin、brontictuzumab、cantuzumab mertansine、cantuzumab ravtansine、capromab pendetide、卡妥索单抗(catumaxomab)、西妥昔单抗(cetuximab)、citatuzumab bogatox、西妥木单抗(cixutumumab)、clivatuzumab tetraxetan、coltuximab ravtansine、conatumumab、达西珠单抗(dacetuzumab)、dalotuzumab、demcizumab、denintuzumab mafodotin、depatuxizumab mafodotin、德瓦鲁单抗(durvalumab)、dusigitumab、依决洛单抗(edrecolomab)、elotuzumab、emactuzumab、emibetuzumab、enoblituzumab、enfortumab vedotin、enavatuzumab、依帕珠单抗(epratuzumab)、ertumaxomab、伊瑞西珠(etaracizumab)、farletuzumab、ficlatuzumab、figitumumab、flanvotumab、futuximab、加利昔单抗(galiximab)、ganitumab、吉妥珠单抗(gemtuzumab)、girentuximab、glembatumumab vedotin、替伊莫单抗(ibritumomab tiuxetan)、伊戈伏单抗(igovomab)、imab362、imalumab、imgatuzumab、indatuximab ravtansine、indusatumab vedotin、inebilizumab、inotuzumab ozogamicin、intetumumab、伊匹木单抗、iratumumab、isatuximab、labetuzumab、来沙木单抗(lexatumumab)、lifastuzumab vedotin、林妥珠单抗(lintuzumab)、lirilumab、lorvotuzumab mertansine、lucatumumab、鲁昔单抗(lumiliximab)、lumretuzumab、马帕木单抗(mapatumumab)、margetuximab、马妥珠单抗(matuzumab)、milatuzumab、mirvetuximab soravtansine、米妥莫单抗(mitumomab)、莫加木珠单抗(mogamulizumab)、moxetumomab pasudotox、nacolomab tafenatox、naptumomab estafenatox、narnatumab、奈昔(necitumumab)、nesvacumab、尼妥珠单抗(nimotuzumab)、纳武单抗(nivolumab)、ocaratuzumab、奥法木单抗(ofatumumab)、olaratumab、onartuzumab、ontuxizumab、奥戈伏单抗(oregovomab)、oportuzumab monatox、otlertuzumab、帕尼单抗(panitumumab)、pankomab、parsatuzumab、patritumab、派姆单抗(pembrolizumab)、pemtumomab、帕妥珠单抗(pertuzumab)、pidilizumab、pinatuzumab vedotin、polatuzumab vedotin、pritumumab、racotumomab、radretumab、ramucirumab、利妥木单抗(rilotumumab)、利妥昔单抗(rituximab)、robatumumab、sacituzumab govitecan、samalizumab、seribantumab、sibrotuzumab、siltuximab、sofituzumab vedotin、tacatuzumab tetraxetan、tarextumab、tenatumomab、teprotumumab、tetulomab、tigatuzumab、tositumomab、tovetumab、曲妥珠单抗(trastuzumab)、tremelimumab、tucotuzumab celmoleukin、ublituximab、utomilumab、vandortuzumab vedotin、vantictumab、vanucizumab、varlilumab、vesencumab、volociximab、vorsetuzumab mafodotin、伏妥莫单抗(votumumab)、zalutumumab、zatuximab等。
[0213]
根据本发明的方面,测试物质是特异性结合下列的一种或多种的物质:1)细胞表面蛋白例如分化(cd)的细胞表面分子的簇;2)细胞内蛋白质例如激酶;和3)细胞外蛋白质,例如脱落细胞表面受体或细胞表面受体的可溶性配体。
[0214]
根据本发明的各方面,测试物质是特异性结合由白细胞(例如,淋巴细胞或骨髓系的白细胞)表达的蛋白的物质。在其他选择中,测试物质是特异性结合白细胞的配体的物质。在其他选择中,测试物质是特异性结合由癌细胞表达的分子的物质。
[0215]
根据本发明的方面,测试物质可以特异性地结合pd-1、pd-l1或ctla-4。根据本发
明的方面,测试物质可以是免疫检查点抑制剂,例如pd-1抑制剂、pd-l1抑制剂或ctla-4抑制剂。根据本发明的方面,免疫检查点抑制剂分别是与pd-1、pd-l1或ctla-4特异性结合的抗体,以及是pd-1抑制剂、pd-l1抑制剂或ctla-4抑制剂。根据本发明的方面,测试物质是选自阿特珠单抗、阿维鲁单抗、德瓦鲁单抗、伊匹木单抗、纳武单抗、派姆单抗和前述任一种中的抗原结合片段的免疫检查点抑制剂。
[0216]
测试物质可通过任何合适的施用途径施用,例如但不限于经口、直肠、经颊、经鼻、肌肉内、阴道、眼、耳、皮下、透皮、瘤内、静脉内和腹膜内。
[0217]
本发明的组合物和方法的实施方式在下面的实施例中说明。提供这些实施例是出于说明的目的,并不认为是对本发明组合物和方法的范围的限制。
[0218]
实施例
[0219]
小鼠
[0220]
在这些研究中使用的所有小鼠均是在jackson laboratory的繁殖克隆系(colonies)中养育(raised)的。此前已在shultz ld,等,2005,j immunol 174:6477-6489中对nod.cg-prkdc
scid
il2rg
tm1wjl
/szj(nod-scid il2rγ
null
,nsg)小鼠进行了描述。
[0221]
通过同胞交配维持nsg小鼠。使用talen开发nod.cg-prkdc
scid
h2-k1
tm1bpe
h2-ab1
em1mvw
h2-d1
tm1bpe
il2rg
tm1wjl
/szj(缩写为nsg-(kbdb)
null
(ia
null
))小鼠。在nod.cg-prkdc
scid
h2-k1
tm1bpe
h2-d1
tm1bpe
il2rg
tm1wjl
/szj(缩写为nsg-(kbdb)
null
,参见covassin l,等,2013,clin exp immunol 174:372-388)胚胎中靶向h2-ab1基因的外显子2。通过pcr鉴定携带null iab等位基因(h2-ab1
em1mvw
)的后代,并将null iab等位基因固定为纯合子。通过同源同胞交配维持nsg-(kbdb)
null
(ia
null
)小鼠。
[0222]
通过互相交配nod.cg-b2m
tm1unc
prkdc
scid
il2rg
tm1wjl
/szj(缩写为nsg-b2m
null
)小鼠(参见king ma,等,2009,clin exp immunol157:104-118)与nod.cg-prkdc
scid
h2
dlab1-ea1
il2rg
tm1wjl
/szj(参见madsen l,等,1999,proc natl acad sci u s a 96:10338-10343)产生nod.cg-b2m
tm1unc
prkdc
scid
h2
dlab1-ea
il2rg
tm1wjl
/szj(缩写为nsg-b2m
null
(ia ie)
null
),并将f1子代互相交配,随后选择b2m
tm1unc
和h2
dlab1-ea
等位基因双重纯合的nsg小鼠。通过同胞交配维持nsg-b2m
null
(ia ie
null
)小鼠。
[0223]
为了产生nod.cg-prkdc
scid
h2-k1
tm1bpe
h2-ab1
em1mvw
h2-d1
tm1bpe
il2rg
tm1wjl
tg(ins2-hbegf)6832ugfm/sz转基因(缩写为nsg-rip-dtr(kbdb)
null
(ia
null
))品系,将tg(ins2-hbegf)6832ugfm(缩写为rip-dtr转基因)与nsg品系回交(dai c,等,2016,j clin invest 126:1857-1870;和yang c,等,2015,.diabetes metab syndr obes8:387-398),然后将nsg-dtr品系与nsg-(kbdb)
null
(ia
null
)品系杂交以形成nsg-rip-dtr(kbdb)
null
(ia
null
)品系。通过针对等位基因破坏和转基因纯合的小鼠的同胞交配维持这些小鼠。
[0224]
将所有动物饲养在无特定病原体动物房的微型独立饲养笼中,提供高压灭菌食品,在jackson laboratory的酸化高压灭菌水下维持,或者在马萨诸塞大学医学院的酸化高压灭菌水和磺胺甲恶唑三甲氧苄啶药用水(goldline laboratories,ft.lauderdale,fl)之间每周交换下维持。
[0225]
抗体和流式细胞术
[0226]
如shultz ld,等,2005,j immunol 174:6477-6489中所详述的,确定nsg mhc敲除小鼠中鼠细胞的表型。为适应四色流式细胞仪分析购买了为fitc、pe、apc或percp缀合物的
抗鼠单克隆抗体(mab)。每次实验均配有免疫功能正常的nod/shiltj(nod)和c57bl/6(b6)小鼠,以确保正确的mhc染色。纳入b6小鼠,作为与经典敲除ea基因相邻的连锁mhc ii基因区域残留的对照,该基因在129个胚胎干细胞中制备并与nsg回交以产生nsg-b2m
null
(ia ie
null
)小鼠。将脾脏在冰上在1ml在不含血清的dmem中的200u/ml胶原酶d中中切成小块。再加入2ml胶原酶d溶液,并将脾脏涡旋。将其在37℃水浴中孵育30分钟,偶尔涡旋和混合。洗涤细胞并混悬在geys rbc裂解缓冲液中,混合并在冰上孵育1分钟。使用facs缓冲液洗涤细胞并在4℃下染色30分钟,使用facs缓冲液洗涤2次,将细胞混悬于250μl facs缓冲液中并使用碘化丙啶染色,然后在bd biosciences lsr ii流式细胞仪上分析100,000个事件。使用的抗小鼠抗体是抗-h2kb(克隆af6-885)、h2kd(sf1-1.1)、cd11b(m1/70)、cd11c(n418)、i-ab,d iek,d(m5/114)、ly6g(1a8)、ly6c(hk1.4)和i-ag7(10-2.16)。
[0227]
使用对下述人抗原具有特异性的mab,在植入pbmc的小鼠中监测人免疫细胞群:购自ebioscience,bd bioscience(san jose,ca)或biolegend(san diego,ca)的cd45(克隆hi30)、cd3(克隆ucht1)、cd4(克隆rpa-t4)、cd8(克隆rpa-t8)、cd20(克隆2h7)、cd45ra(克隆hi100)、ccr7(克隆g043h7)、pd1(克隆eh12.2h7)和颗粒酶b(克隆gb11)。通过使用对鼠cd45具有特异性的mab(克隆30-f11,bd biosciences)染色,鉴定小鼠细胞并将其从分析中排除。
[0228]
从植入小鼠制备脾脏的单细胞悬液,并在肝素中收集全血。使用facs缓冲液(补充了2%胎牛血清(fbs)和0.02%叠氮钠的pbs)洗涤1x106个细胞的单细胞悬液或100μl全血,然后使用大鼠抗小鼠fcr11b mab(克隆2.4g2,bd biosciences)预孵育以封闭与小鼠fc受体的结合。然后,将特异性mab加入样品中,并在4℃下孵育30min。洗涤染色的样品并使用2%多聚甲醛固定(针对细胞悬液)或者使用bd facs裂解溶液处理(针对全血)。在lsrii or facscalibur仪器(bd biosciences)上采集至少50,000个事件。为了进行人细胞的表型分型,通过使用对小鼠cd45具有特异性的mab(克隆30-f11,bd biosciences)染色,鉴定小鼠细胞并将其从分析中排除。使用flowjo(tree star,inc.,ashland,or)软件进行数据分析。
[0229]
收集人外周血单核细胞(pbmc)
[0230]
人pbmc来自健康志愿者。在肝素中收集pbmc,通过ficoll-hypaque密度离心纯化并混悬在rpmi中,用于以所示细胞剂量注射至小鼠中。在一些实验中,白细胞球(pheresis leukopaks)是作为匿名丢弃单元从马萨诸塞大学医学中心的血库获得的。
[0231]
gvhd方案
[0232]
对小鼠腹腔注射各种剂量的pbmc。对小鼠每周称重2至3次,将gvhd样症状的出现(包括体重减轻(》20%)、驼背的姿势、皮毛松弛、行动不便和呼吸急促)用于确定处死时间,并指示存活时间。
[0233]
人胰岛移植
[0234]
指定用于研究的人胰岛是从prodo laboratories,inc.(irvine,ca)获得的。将人ieq(4000)移植到nsg-rip-dtr(kbdb)
null
(ia
null
)小鼠脾脏中。在胰岛移植前,用40ng白喉毒素处理nsg-rip-dtr(kbdb)
null
(ia
null
)小鼠2-4天。使用accu-chek活性血糖仪(hoffmann-la roche,basel,switzerland)确认高血糖(》400mg/dl)。然后在移植后每周两次间隔测定血糖水平,以监测胰岛移植物功能。使用对人c-肽具有特异性的elisa试剂盒(alpco,salem,nh)检测c-肽水平。如此前所述(harlan dm,等,1995,diabetes,44:816-823)使用对人胰岛
素具有特异性的elisa试剂盒(alpco,salem,nh)确定移植的脾脏中的总胰岛素含量。
[0235]
dsaav载体
[0236]
如此前在he y,等,2013,hum.gene ther.,24:545-553中所述,将daaav载体工程化和包装。
[0237]
简言之,将编码人il2或egfp的全长cdna亚克隆至含有鼠前胰岛素原(preproinsulin)ii启动子(mip)的dsaav质粒(mccarty dm,等,2001,gene ther 8:1248-1254)中。dsaav载体包装如此前所述(grieger jc,等,2006,nat protoc 1:1412-1428;and johnson mc,等,2013,diabetes 62:3775-3784)进行,或者在马萨诸塞大学医学院horae gene therapy center(worcester,ma)由病viral vector core生产。向受体小鼠ip注射2.5x10
11
个纯化的aav8-huil2(aav-il2)颗粒。
[0238]
统计学分析
[0239]
为了对各个配对的分组进行比较,针对参数和非参数数据分别使用结合bonferroni后检验的单因素anova或双因素anova,或者结合dunns后检验的kruskal-wallis检验。假设p值《0.05有显著性差异。使用graphpad prism软件(4.0c版,graphpad,san diego,ca)进行统计学分析。
[0240]
结果
[0241]
nsg和两个nsg i/ii类mhc双敲除小鼠品系的表型特征
[0242]
建立i类和ii类mhc双重缺陷的两个nsg小鼠品系,nsg-(kbdb)
null
(ia
null
)和nsg-b2m
null
(ia ie)
null
敲除品系。通过流式细胞术证实在这两个品系中不存在i类和ii类mhc(图1)。由于缺乏表达易于检测到的小鼠mhc ii水平的免疫细胞,因此将脾脏进行酶促分解和门控以分析树突状细胞群。图1a显示了排除双峰和死细胞并对单核细胞来源的树突状细胞(cd11b+ly6c
dim
cd11c+)进行门控的门控策略。nsg小鼠显示了针对i类mhc的h2kd阳性h2kb阴性(图1b),以及针对ii类mhc的i-a
g7
阳性i-ab阴性(图1c)的预计染色模式。nsg-(kbdb)
null
(ia
null
)和nsg-b2m
null
(ia ie
null
)敲除小鼠两者缺乏正常由nod和c57bl/6小鼠表达的i类和ii类mhc分子。
[0243]
由于适当表达鼠fcrn(负责延长igg在循环中的半衰期的受体)需要b2m,因而比较了在这两种小鼠中人igg的清除。向小鼠iv注射200μg人igg并定期取血用于循环人igg的elisa分析。将注射后2分钟的第一次取血认为是100%血清igg。在nsg-b2m
null
(ia ie
null
)小鼠中观察到人igg的迅速清除,而在nsg-(kbdb)
null
(ia
null
)小鼠中igg的清除率与在nsg小鼠中观察到的结果相似(图2)。
[0244]
植入pbmc的nsg以及nsg-i类mhc敲除、nsg-ii类mhc敲除和nsg-mhc i/ii敲除小鼠的存活
[0245]
nsg-(kbdb)
null
(ia
null
):为了确定不存在小鼠i类和ii类mhc是否改变了在nsg mhc i/ii敲除小鼠中人pbmc植入后异种gvhd的发生率和动力学,向缺乏i类mhc、ii类mhc的nsg品系,或者两个nsg双敲除品系植入10x106个pbmc,并将其存活与nsg小鼠进行比较。如此前所报道的,nsg和nsg-(ia
null
)显示出相似的相对较短的存活期,这与在nsg小鼠中观察到的结果相似。而相反的是,正如所预期的那样,与nsg小鼠相比,nsg-(kbdb)
null
小鼠具有延长的存活期。然而,当在nsg-(kbdb)
null
(ia
null
)小鼠中将i类和ii类mhc均敲除后,其存活超过100天,在观察期结束时(125天)在15只这些mhc i/ii敲除小鼠中有13只仍存活且无gvhd症状,
(图3a)。
[0246]
nsg-b2m
null
(ia ie
null
):在植入pbmc的nsg-b2m
null
(ia ie
null
)小鼠中,观察到了类似的存活期延长的结果。针对这种mhc i/ii敲除品系,将nsg-b2m
null
品系而非nsg-(kbdb)
null
品系作为对照。同样地,nsg和nsg-(ia
null
)敲除小鼠具有相对较短的存活期。nsg-b2m
null
小鼠的存活期显著增加。如在nsg-(kbdb)
null
(ia
null
)小鼠中观察到的,nsg-b2m
null
(ia ie
null
)品系实现了长期存活,18只小鼠中有15只存活至实验结束时(125天)并且无gvhd症状(图3b)。
[0247]
在植入pbmc的nsg以及nsg-i类mhc敲除、nsg-ii类mhc敲除和nsg-mhc i/ii敲除小鼠中的人细胞嵌合
[0248]
植入pbmc的nsg i/ii敲除小鼠的长期存活可能是由于缺乏人细胞植入或由于缺乏i类和ii类mhc使得缺乏gvhd所致。为了区分这两种可能性,将10x106个pbmc ip注射至两个nsg mhc i/ii敲除品系,并且将随着时间推移的循环中cd45+细胞的水平与nsg、nsg-i类敲除和ii类mhc敲除小鼠进行比较。
[0249]
nsg-(kbdb)
null
(ia
null
)小鼠:在nsg和nsg-(ia
null
)小鼠中人cd45细胞植入迅速增加(图4a)。与nsg和nsg-(ia
null
)小鼠相比,随着时间的推移循环人cd45+细胞的百分比在nsg-(kbdb)
null
和nsg-(kbdb)
null
(ia
null
)小鼠中降低。在脾脏中,在nsg-(ia
null
)和nsg-(kbdb)
null
小鼠中人cd45+细胞的百分比与在nsg小鼠中观察到的结果相当,但是在nsg-(kbdb)
null
(ia
null
)小鼠脾脏中人cd45+细胞的百分比显著降低(图4b)。
[0250]
nsg-b2m
null
(ia ie)
null
小鼠:将nsg-b2m
null
品系作为nsg i类mhc敲除(ko)的对照。如在nsg、nsg-(ia
null
)小鼠、nsg-(kbdb)
null
和nsg-(kbdb)
null
(ia
null
)小鼠中所观察到的,与在nsg-b2m
null
和nsg-b2m
null
(ia ie
null
)小鼠中观察到的结果相比,在nsg和nsg-(ia
null
)小鼠中循环人cd45+细胞的百分比更高(图4c)。在nsg-b2m
null
(ia ie
null
)小鼠脾脏中人cd45+细胞的百分比与其他三个品系显著降低(图4d)。
[0251]
在植入pbmc的nsg以及nsg-i类mhc敲除、nsg-ii类mhc敲除和nsg-mhc i/ii敲除小鼠中的人t细胞和b细胞的植入
[0252]
nsg-(kbdb)
null
(ia
null
):在nsg、nsg-(ia
null
)和nsg-(kbdb)
null
小鼠中的循环人cd45+细胞主要是cd3+t细胞(图5a)。类似地,在nsg-(kbdb)
null
(ia
null
)中的大多数cd45+细胞也是cd3+t细胞。在nsg和nsg-(ia
null
)小鼠中,植入后2周存在易于检测数量的cd20+b细胞,但是在植入后4周基本上检测不到这些(图5b)。
[0253]
nsg-b2m
null
(ia ie)
null
:将nsg-b2m
null
小鼠作为进行比较的i类mhc敲除对照。与在nsg-b2m
null
(ia ie)
null
小鼠中观察到的结果一致,在nsg、nsg-(ia
null
)和nsg-b2m
null
小鼠中植入的pbmc主要由cd3+t细胞组成(图5c)。尽管在第一项实验中在两周时在nsg和nsg-ia
null
小鼠中易于出现人cd20+b细胞,但是在所考察的全部4个品系中其均以极低水平存在(图5d),这可能反映了供体的可变性,因为我们有时在植入pbmc的nsg小鼠中观察到了这种情况。
[0254]
在注射了pbmc的nsg、nsg-(ia
null
)、nsg-(kbdb)
null
和nsg-(kbdb)
null
(ia
null
)小鼠中植入的人t细胞的表型分析
[0255]
在pbmc植入后4周时,在nsg小鼠中的cd4:cd8的比率为约4:1(图6a)。而相反的是,在nsg-(ia
null
)小鼠中植入了非常少的cd4+t细胞,而在nsg-(kbdb)
null
小鼠中植入了高水平
(kbdb)
null
(ia
null
)小鼠中观察到的结果(图4b),尽管向nsg-rip-dtr(kbdb)
null
(ia
null
)小鼠中注射的人pbmc(50x106)的数量是向nsg-(kbdb)
null
(ia
null
)小鼠中注射的10x106个细胞的5倍。在实验过程中,血液中cd4:cd8细胞的比率发生了巨大变化,因为cd4+t细胞的百分比下降而在血液中cd8+t细胞的百分比显著增加(图8c)。在实验结束时,在脾脏中cd4:cd8 t细胞的比率也显示出cd8 t细胞显著增加(图8d)。在接受人pbmc的4只胰岛移植小鼠中,有3只在6周时血液中人c肽水平降低;未恢复为高血糖的一只小鼠的c-肽的水平类似于在未移植同种异体pbmc的胰岛受体中观察到的结果(图8e)。然而,在给予同种异体pbmc的全部4只小鼠中,在胰岛移植物中观察到的人胰岛素的量与未给予人pbmc的胰岛移植受体相比显著降低(图8f)。
[0262]
因而,在nsg-rip-dtr(kbdb)
null
(ia
null
)小鼠中植入的人pbmc易于植入高血糖nsg-rip-dtr(kbdb)
null
(ia
null
)小鼠中。高血糖的返回证实了人胰岛同种异体移植物的排斥,这在组织学上得到了证实。循环c肽的减少和移植物中剩余胰岛素绝对量的减少也证实了这一点。胰岛移植小鼠在血液和脾脏两者中cd8 t细胞群均增加。这表明存在胰岛同种异体移植物优先刺激和扩增细胞毒性cd8 t细胞群。这些数据表明,在不存在正在进行的gvhd应答的nsg mhc i/ii敲除小鼠中能够评估人pbmc的功能。
[0263]
通过用aav-il2处理移植pbmc的nsg和nsg-(kbdb)
null
(ia
null
)小鼠调节植入的人t细胞
[0264]
很多进入临床的药物都是免疫调节剂,进入临床试验的这些药物之一是施用重组il2。已将高剂量il2用于癌症治疗,而已将低剂量il2用于治疗自身免疫性疾病。
[0265]
已发现在nsg-(kbdb)
null
(ia
null
)小鼠中植入的人t细胞是功能性的(图8a),但不介导急性gvhd(图3),接下来确定施用人重组il2是否能够调节t细胞群。通过注射表达aav8-人il2的载体施用人il2增加了通过植入人胎肝和胸腺而人源化的nsg小鼠(即,blt模型)中人treg的比例。注射aav-huil2导致在已植入10x106个pbmc 2周的nsg和nsg-(kbdb)
null
(ia
null
)小鼠血液中人cd45+细胞的瞬时表达(图9a)。在实验的8周期间,aav-il2不改变是cd3+的人cd45+细胞的比例(图9b)。然而,在nsg小鼠中在pbmc注射后2、4和6周时和在nsg-(kbdb)
null
(ia
null
)小鼠中在pbmc注射后2和4周时表达调节性t(treg)表型的cd4+细胞(cd4+cd25+cd127-foxp3+)的比例显著增加(图9c)。上面一行显示了使用针对cd25和cd127的抗体对cd4+t细胞的代表型染色,下面一行显示了在施用或不施用aavil2的nsg和nsg-(kbdb)
null
(ia
null
)小鼠中在推定cd4+cd25+cd127-t细胞中foxp3的表达(图9d)。在两个品系中植入pbmc后,从2周至8周treg细胞的相对百分比平稳下降,且在8周前cd4+t细胞处于正常水平。使用给予nsg和nsg-(kbdb)
null
(ia
null
)小鼠的aav-il2载体,il2的水平从第2周(219
±
48和262
±
40pg/ml)至第4周(159
±
59和214
±
62pg/ml)至第6周(110
±
53和130
±
72pg/ml;针对nsg,在2、4和6周时n=8,针对nsg-(kbdb)
null
(ia
null
)小鼠在2周时n=5以及在4和6周时n=4)每周分别降低。循环il2的这种降低与在本实验中treg的丧失相关。
[0266]
然而,与在nsg和用aav-il2处理的nsg小鼠中观察到的结果相比,施用aav-il2还缩短了nsg-(kbdb)
null
(ia
null
)小鼠的存活期(图9e)。与未注射aav-il2的那些相比,在nsg和nsg-(kbdb)
null
(ia
null
)小鼠中注射aav-il2还将cd4:cd8的比率改变为主要是cd8 t细胞(图9f)。在进行或未进行aav-il2处理的nsg和nsg-(kbdb)
null
(ia
null
)小鼠的血液中,cd4+t细胞群中cd4和cd8幼稚、中央记忆、效应/效应记忆和temra子集的比例没有差异。在cd8 t细胞
群中t细胞子集比例的唯一差异在效应/效应记忆t细胞子集中,其在用aav-il2处理的小鼠中增加(图9g)。与aav-il2处理的nsg-(kbdb)
null
(ia
null
)小鼠中cd8+效应/效应记忆t细胞的增加相关的是表达颗粒酶b的cd8 t细胞的百分比增加(图9h)。
[0267]
pbmc和人患者来源的肿瘤细胞的共同施用
[0268]
向nsg和nsg-kbdb)
null
(ia
null
)小鼠sq植入pdx结肠肿瘤(2mm3),并于10天后ip注射来自非匹配供体的20x106个pbmc。监测小鼠的存活和肿瘤生长。
[0269]
图10a是显示共同注射了pbmc和人患者来源的肿瘤细胞的一组nsg小鼠和共同注射了pbmc和人患者来源的肿瘤细胞的一组nsg-(kbdb)
null
(ia
null
)小鼠的存活百分比的图。
[0270]
图10b是显示1)在注射给予人患者来源的肿瘤细胞的nsg小鼠;2)在共同注射了pbmc和人患者来源的肿瘤细胞的nsg小鼠;注射了pbmc的nsg-(kbdb)
null
(ia
null
)小鼠;和共同注射了pbmc和人患者来源的肿瘤细胞的nsg-(kbdb)
null
(ia
null
)小鼠中的肿瘤生长的图。因而,nsg-(kbdb)
null
(ia
null
)小鼠支持共同植入pdx肿瘤和pbmc。
[0271]
使用两个不同的nsg i/ii类mhc敲除小鼠模型nsg-(kbdb)
null
(ia
null
)品系和nsg-b2m
null
(ia ie
null
)品系,这些实施例表明人pbmc被植入但是小鼠在实验期结束时并未发展成急性gvhd样疾病,在一些情况下未发展成急性gvhd样疾病的时间超过pbmc植入后125天。如通过其排斥人胰岛同种异体移植物的能力所示,这些植入的人t细胞是功能性的。而且,如通过使用aav载体提供的重组人il2导致人t细胞扩增所证实的,人t细胞能够在体内被调节。在nsg-(kbdb)
null
(ia
null
)品系中,人igg的清除与在nsg小鼠中观察到的结果具有可比性,而在nsg-b2m
null
(ia ie
null
)品系中igg的清除相当迅速。
[0272]
本说明书提到的所有专利或出版物通过引用并入本文,其程度如同每个单独的出版物被具体地和单独地指示通过引用并入。
[0273]
本文描述的组合物和方法目前代表优选的实施方式,示例性的,并且不旨在作为对本发明的范围的限制。本领域技术人员将想到对其的改变和其他用途。在不偏离权利要求所述的本发明的范围的情况下,可以进行这样的改变和其他用途。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1