靶向CD19的全人源抗体及其应用的制作方法
本发明涉及靶向cd19的全人源抗体,还涉及包括该全人源抗体的单链抗体(scfv)的嵌合抗原受体(car)。该全人源抗体及其scfv和car可用于靶向cd19的car-t细胞的构建。
背景技术:
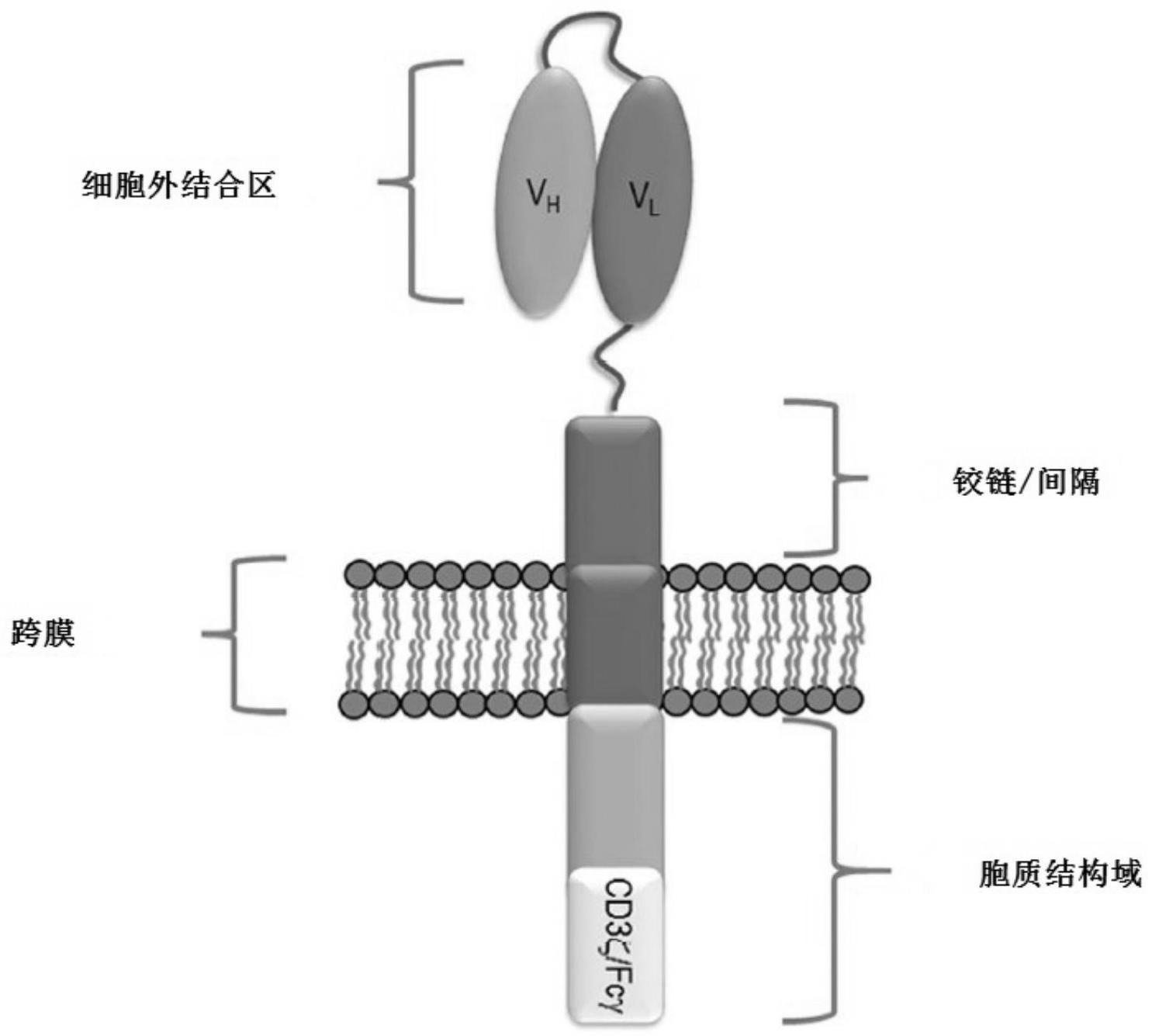
1、近年来,细胞免疫治疗技术、尤其是嵌合抗原受体t细胞(car-t)技术取得了突破性进展。2017年,诺华的kymriah(tisagenlecleucel)和kite pharma的yescarta先后经美国fda批准上市。kymriah是全球首个获批的car-t治疗产品,用于治疗3至25岁的急性淋巴细胞白血病患者和治疗复发或难治性弥漫性大b细胞淋巴瘤(dlbcl)的成人患者。yescarta是全球第二款获批上市的car-t产品,用于治疗成人复发或难治性b细胞淋巴瘤和非霍奇金淋巴瘤。图1显示了常用car的示意性分子结构。
2、由于car-t技术与手术、化疗、放疗等传统治疗方法完全不同的治疗原理以及对难治复发的血液肿瘤疾病有革命性的治疗效果,其开辟了肿瘤治疗的新时代。目前全世界已开展了大量car-t临床试验,其中中国和美国是相关临床试验最多的国家。
3、cd19作为car-t治疗的热门靶点之一,适应症是b淋巴细胞肿瘤。由于其疗效确定,副作用可控,在目前已上市和在研中的产品中是最多的。随着临床研究的深入,越来越多的证据表明,cd19 car-t治疗的短期效果很好,但随着时间的延长,大约50%的病人会复发。复发的原因很多,主要分为cd19抗原阴性的复发和阳性的复发。在cd19抗原阳性的复发中,car-t细胞在病人体内的存续时间短是主要的原因。根据对现有的car-t输注病人的研究,人体产生针对car-t使用的异源抗体的抗抗体(ada)或杀伤性t淋巴细胞(ctl),可能是导致部分病人体内car-t细胞迅速被清除的主要原因。
4、目前已经上市的2款产品及大多数临床实验中的产品,都是采用异源的抗体来识别cd19抗原。例如,kymriah和yescarta都采用了鼠源抗体,南京传奇的lcar-b38m采用了羊驼来源的抗体。全人源抗体由于具有比异源抗体更低的免疫原性,在抗体药物开发领域已经成为一个主流的方向。同样道理,全人源的抗体应用于car-t产品,也能降低car-t细胞的免疫原性,延长car-t细胞在人体内的存活时间,增强car-t产品的长期疗效。因此,开发全人源的cd19抗体,对于研发下一代体内存续时间更长、长期疗效更好的car-t产品,有非常重要的意义。
技术实现思路
1、在一方面,本文提供了靶向cd19的全人源抗体或其单链抗体或片段,其中所述全人源抗体的轻链可变区包括lcdr1、lcdr2和lcdr3,重链可变区包括hcdr1、hcdr2和hcdr3,其中所述lcdr1、lcdr2、lcdr3、hcdr1、hcdr2、和hcdr3选自如下组合之一:
2、(1)lcdr1的氨基酸序列为ssnigagyd;
3、lcdr2的氨基酸序列为ent;
4、lcdr3的氨基酸序列为qsydsslsgwrv;
5、hcdr1的氨基酸序列为gysftnsw;
6、hcdr2的氨基酸序列为iypddsdt;
7、hcdr3的氨基酸序列为arqstyiyggyydt;
8、(2)lcdr1的氨基酸序列为ssnignna;
9、lcdr2的氨基酸序列为ydd;
10、lcdr3的氨基酸序列为aawddslngwv;
11、hcdr1的氨基酸序列为gysftsyw;
12、hcdr2的氨基酸序列为iypgdsdt;
13、hcdr3的氨基酸序列为arlsyswsswywdf。
14、在一些实施方案中,所述轻链可变区包括seq id no:8所示的氨基酸序列,所述重链可变区包括seq id no:9所示的氨基酸序列;或者所述轻链可变区包括seq id no:11所示的氨基酸序列,所述重链可变区包括seq id no:12所示的氨基酸序列。
15、在一些实施方案中,所述单链抗体包括seq id no:7或10所示的氨基酸序列。
16、另一方面,本文提供了靶向cd19的嵌合抗原受体,其包括靶向cd19的单链抗体,所述单链抗体的轻链可变区包括lcdr1、lcdr2和lcdr3,重链可变区包括hcdr1、hcdr2和hcdr3,其中所述lcdr1、lcdr2、lcdr3、hcdr1、hcdr2、和hcdr3选自如下组合之一:
17、(1)lcdr1的氨基酸序列为ssnigagyd;
18、lcdr2的氨基酸序列为ent;
19、lcdr3的氨基酸序列为qsydsslsgwrv;
20、hcdr1的氨基酸序列为gysftnsw;
21、hcdr2的氨基酸序列为iypddsdt;
22、hcdr3的氨基酸序列为arqstyiyggyydt;
23、(2)lcdr1的氨基酸序列为ssnignna;
24、lcdr2的氨基酸序列为ydd;
25、lcdr3的氨基酸序列为aawddslngwv;
26、hcdr1的氨基酸序列为gysftsyw;
27、hcdr2的氨基酸序列为iypgdsdt;
28、hcdr3的氨基酸序列为arlsyswsswywdf。
29、在一些实施方案中,所述轻链可变区包括seq id no:8所示的氨基酸序列,所述重链可变区包括seq id no:9所示的氨基酸序列;或者所述轻链可变区包括seq id no:11所示的氨基酸序列,所述重链可变区包括seq id no:12所示的氨基酸序列。。
30、在一些实施方案中,所述单链抗体包括seq id no:7或10所示的氨基酸序列。
31、另一方面,本文提供了经修饰的t细胞,其表达前述嵌合抗原受体。
32、另一方面,本文提供了治疗细胞表面表达cd19的肿瘤的药物,其包括上述t细胞。
33、另一方面,本文提供了分离的核酸分子,其编码前述全人源抗体或其单链抗体或片段。
34、在一些实施方案中,编码所述全人源抗体的轻链可变区的序列包括seq id no:2所示的核苷酸序列,编码重链可变区的序列包括seq id no:3所示的核苷酸序列;或者编码所述人源抗体的轻链可变区的序列包括seq id no:5所示的核苷酸序列,编码重链可变区的序列包括seq id no:6所示的核苷酸序列。
35、在一些实施方案中,编码所述单链抗体的序列包括seq id no:1或4所示的核苷酸序列。
36、另一方面,本文提供了包括前述核酸分子的表达载体。
37、在一些实施方案中,所述表达载体还包括表皮生长因子受体(egfr)或截短形式的egfr(tegfr)的编码序列。
38、另一方面,本文提供了一种药物,其包括前述的全人源抗体或其单链抗体或片段或前述的t细胞。
39、另一方面,本文提供了前述的全人源抗体或其单链抗体或片段或前述的t细胞在制备治疗b细胞相关疾病的药物中的用途。
40、在一些实施方案中,所述b细胞相关疾病为b细胞相关肿瘤。
41、另一方面,本文提供了前述的全人源抗体或其单链抗体或片段或前述的t细胞在制备治疗肿瘤的药物中的用途。
42、在一些实施方案中,所述肿瘤为b细胞相关肿瘤。
43、在一些实施方案中,所述肿瘤为表达cd19的肿瘤。
44、本文提供的全人源抗体比鼠源抗体或经人源化的鼠源抗体具有更低的免疫原性,在抗体药物或car-t应用上有更好的潜力。与采用鼠源抗体的car-t细胞相比,利用本文提供的全人源抗体构建的car-t细胞与人体具有更好的相容性,有利于其在体内的长期增殖和存活。
- 还没有人留言评论。精彩留言会获得点赞!