一种光热-免疫联合治疗肿瘤的化合物及其应用
本发明属于化学制药领域,涉及一类含有“被动”靶向效应的超分子光热剂以及免疫检查点抑制剂通过刺激响应的二硫键键接,在水中可以进行超分子组装成纳米粒子,同时可对肿瘤微环境做出反应,并释放免疫检查点抑制剂,从而实现光热、免疫联合治疗。
背景技术:
1、癌症,作为全人类共同面对的医学难题,具有生长迅速、侵袭性强,可以从原发部位播散到身体其他的部位的特点。除手术,放、化疗等传统癌症治疗手段以外,研究者们不断开拓创新,
2、随着癌症的发病率逐年上升,对人们的生命健康有重大威胁,研究者们不断开创新的治疗手段,激光光热治疗逐渐走进人们的视野。光热疗法(ptt)用一束近红外光辐射肿瘤组织,荧光光热剂发光的同时会发热,升温可杀死癌细胞达到治疗效果;其对肿瘤的高度特异性、对周围正常组织的微创性以及时空选择性而受到了广泛的关注。
3、但是最近研究发现,单独的光热治疗仍然存在些许问题,其中最具代表性的比如热休克蛋白的生成,由于持续的热量使癌细胞产生热休克蛋白用以抵制突发的环境转变,同时持续的高温可能会对正常组织产生不良影响。此外,由于肿瘤驱动的免疫抑制,使肿瘤所在微环境整体传达免疫抑制的信号,使免疫系统瘫痪,导致肿瘤的复发和转移的可能性很高。
4、免疫疗法是一种革命性的癌症治疗方法,它依靠激活免疫系统来消除癌症,近年来凭借其临床疗效而收到越来越多的关注。免疫治疗主要分为免疫检查点阻断(icb)、过继t细胞疗法以及癌症疫苗。icb治疗通常利用拮抗剂阻断抑制通路,如程序性死亡蛋白1途径(pd-1/pd-l1)和细胞毒性t淋巴细胞相关抗原4。目前icb在临床中取得了很大的进展,已被应用于各种肿瘤的治疗,如黑色素瘤、非小细胞肺癌、肾细胞癌、尿路上皮癌、经典霍奇金淋巴瘤等。最突出的检查点受体是程序性细胞死亡蛋白1/程序性细胞死亡配体1(pd-1/pd-l1)和细胞毒性t淋巴细胞抗原4(ctla-4)通路anti-pd-l1 atezolizumab和avelumab已获美国食品和药物管理局(fda)批准。pd-l1在癌细胞上过表达,可向pd-1提供抑制信号,pd-1在活化的t细胞上表达,转导抑制信号拮抗活化的t细胞受体(tcr)和cd28轴。癌细胞利用pd-l1的免疫抑制功能来避免被杀死。
5、其中吲哚胺2,3-双加氧酶(ido)是一种重要的负反馈调节蛋白,能为肿瘤细胞生长制造免疫抑制微环境。ido在一些肿瘤细胞中过表达,能催化必需氨基酸色氨酸(trp)的降解,阻断细胞周期,使效应t细胞死亡,有研究发现可以通过抑制ido合成,能有效延缓色氨酸讲解为免疫抑制剂犬尿氨酸,从而促进调节性t细胞水平下降,效应t细胞水平上升,达到免疫杀伤的治疗效果。
6、事实证明,免疫治疗是临床上治疗不同类型癌症最有效的方法之一。但是在大多数情况下免疫治疗靶点缺乏特异性,可能在正常组织中表达,免疫治疗剂无针对性地释放到正常组织中有时会导致严重的副作用,如发热、低血压、皮肤反应以及一些超敏反应等,因此提高肿瘤特异性具有十分重要的意义。
技术实现思路
1、本发明的目的在于解决现有技术中存在的上述问题(主要针对单独使用光热治疗以及单独应用免疫治疗存在的不良反应),通过构筑超分子光热剂,并提出了一种光热、免疫联合治疗的化合物及其药物组合物的应用。
2、该类化合物能在水中自组装成微纳结构,并且通过epr效应的“被动靶向”,使光热剂富集在肿瘤组织内,在激光的照射下光热剂发光的同时放出热量,实现诊疗一体化,具有高光热转换效率、优异的光热稳定性和易降解安全性高的优势,同时由于肿瘤内本项目采用的免疫检查点抑制剂nlg919能抑制ido-1活性,逆转免疫抑制微环境,激活抗肿瘤级联免疫效应,引发癌细胞免疫原性细胞死亡(icd),而且通过nlg919介导的ido1抑制,有效地延缓色氨酸降解为免疫抑制剂犬尿氨酸,从而促使调节性t细胞水平下降,效应t细胞水平上升,达到免疫杀伤的治疗效果。
3、本发明的技术方案是:
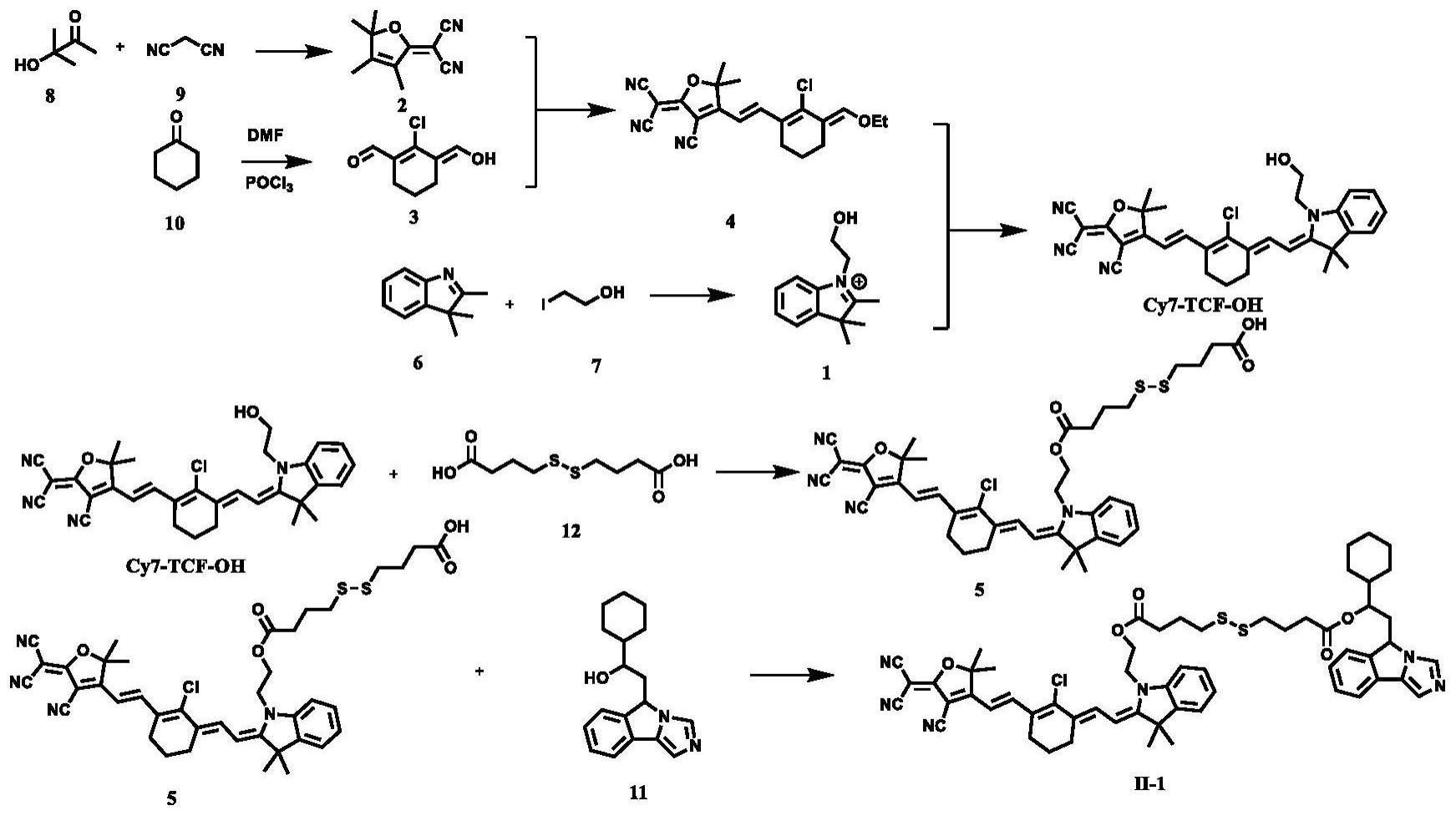
4、一种用于光热-免疫联合治疗的化合物,所述化合物具有式(ⅲ)所示结构或其异构体、药学上可接受的盐、水合物或溶剂化物在水溶液中自组装形成的微纳结构:
5、
6、或,具有式(ⅰ)所示结构或其异构体、药学上可接受的盐、水合物或溶剂化物在水溶液中自组装形成的微纳结构:
7、
8、
9、或,具有式(ⅱ)所示结构或其异构体、药学上可接受的盐、水合物或溶剂化物在水溶液中自组装形成的微纳结构:
10、
11、上述式(ⅰ)、式(ⅱ)、式(ⅲ)中:a为免疫调节基团,根据作用靶点不同,可分为细胞毒性t淋巴细胞抗原4(ctla-4)单抗、程序性死亡因子1(pd-1)单抗及程序性死亡因子配体1(pd-l1)单抗三大类,其他免疫检查点如lag-3,ido抑制剂、cd137、cd134等抑制药物。
12、所述式(ⅲ)中:
13、x2选自于o、s或-cr20r20’-;
14、y3、y4、y5各自独立地选自于h、羟基、卤素原子、取代或者非取代的氨基和烃氧基;
15、t1、t2、t3各自独立地选自0~5的整数;
16、r13、r13’、r14各自独立地选自于-cn,-cf3,f,-so2cf3,-no2,-cooet,-so2ph,
17、r15为-(ch2)m-、m为0~5的整数;
18、r16和r17共同形成如下之一的连接:或者r16、r17和x2共同形成如下连接其中,ra、rb、rc、rd、re、rf、rg各自独立地选自于h、卤素、取代或非取代的烃基、取代或非取代的羧基、取代或非取代的羟基和取代或非取代的氨基;
19、r18、r18’、r19、r20和r20’各自独立地选自于h、卤素原子、取代或非取代的烃基、取代或非取代的环烃基、取代或非取代的芳基、取代或非取代的杂芳基、取代或非取代的杂环基、取代或者非取代的醇基、取代或者非取代的醚基、取代或者非取代的醛基、取代或者非取代的羧基、取代或者非取代的酰胺基、取代或者非取代的酯基和取代或者非取代的氨基;
20、所述式(ⅰ)中:
21、b为取代或非取代的杂环,所述杂环不带电荷且包含n、o和s中的一个或多个杂原子;
22、l为取代或非取代的共轭碳链,所述共轭碳链中包含2~5个双键;
23、x1为o、n或-cr4r4’-;
24、n为0或1;
25、r1、r1’、r2各自独立地选自于具有吸电子能力的原子和基团;
26、r3和r3’、r4和r4’分别各自独立地选自于h、卤素原子、取代或非取代的烃基、取代或非取代的环烃基、取代或非取代的芳基、取代或非取代的杂芳基、取代或非取代的杂环基、取代或者非取代的醇基、取代或者非取代的醚基、取代或者非取代的醛基、取代或者非取代的羧基、取代或者非取代的酰氨基、取代或者非取代的酯基和取代或者非取代的氨基;
27、所述式(ⅱ)中:
28、y2为cl、br、其中,q、q’各自独立地选自0~12的整数;
29、r9为-cn或
30、r10为-(ch2)m-、m为0~5的整数,
31、r11为
32、r12为
33、所述q、q’各自独立地选自0~12的整数;
34、上述式(ⅰ)、式(ⅱ)、式(ⅲ)中,当所述基团为取代的时,取代基为单取代或多取代。
35、进一步的,所述a选自于
36、进一步的,式(ⅲ)中,所述t1和t2均为1,t3为0;所述m为3;
37、所述r13、r13’均为-cn,r14为-cn或
38、所述r18、r18’、r19各自独立地选自于h,-(ch2)qch3、-(ch2)qcf3、-(ch2)qchch2、-(ch2)qcch、-(ch2)qoh、-(ch2)qcooh、-(ch2)qnh2、-(ch2)qcho、-(ch2)qco(ch2)q’ch3、-(ch2)qo(ch2)r’ch3、其中q、q’各自独立地选自0-12的整数;优选的,所述r19为-ch2ch3;
39、所述y3和y5均为h;
40、y4为cl、br或-nr21r21’-,其中,r21、r21’各自独立地选自于h、取代或非取代的烃基、取代或非取代的环烃基、取代或非取代的芳基、取代或非取代的杂芳基、取代或非取代的杂环基、取代或者非取代的醇基、取代或者非取代的醚基、取代或者非取代的醛基、取代或者非取代的羧基、取代或者非取代的酰胺基、取代或者非取代的酯基和取代或者非取代的氨基;l1为酯基取代或非取代的碳链。
41、进一步的,式(ⅰ)中,所述共轭碳链中双键的个数为2、3、4或5个;x1为o;n为0;所述r1、r1’、r2各自独立地选自于-cn、-cf3、-f、-so2cf3、-no2、-cooet、-so2ph、所述r3、r3’各自独立地选自于h,-(ch2)qch3、-(ch2)qcf3、-(ch2)qch=ch2、-(ch2)qc≡ch、-(ch2)qoh、-(ch2)qcooh、-(ch2)qnh2、-(ch2)qcho、-(ch2)qco(ch2)q’ch3、-(ch2)qo(ch2)q’ch3、其中,q、q’各自独立地选自0~12的整数。
42、优选的,所述r1、r1’均为-cn;r2为-cn或
43、式(ⅰ)中,具体的,l可为其中,y1为卤素原子、取代或非取代的氨基或烃氧基;m为0-5的整数,优选地,m为3;r7各自独立地选自于h、卤素原子、取代或非取代的烃基、取代或非取代的环烃基、取代或非取代的芳基、取代或非取代的杂芳基、取代或非取代的杂环基、取代或者非取代的醇基、取代或者非取代的醚基、取代或者非取代的醛基、取代或者非取代的羧基、取代或者非取代的酰氨基、取代或者非取代的酯基和取代或者非取代的氨基。特别优选的,m为3,y1为cl、br、-nr8r8’或-or8;并且,r7为h、-ch3、r8和r8’各自独立地选自于h、取代或非取代的烃基、取代或非取代的环烃基、取代或非取代的芳基、取代或非取代的杂芳基、取代或非取代的杂环基、取代或者非取代的醇基、取代或者非取代的醚基、取代或者非取代的醛基、取代或者非取代的羧基、取代或者非取代的酰氨基、取代或者非取代的酯基和取代或者非取代的氨基。
44、由式(i)化合物在水溶液中自组装形成的所述微纳结构具有“光热”—“免疫”联合治疗效果,同时还具有高光热转换效率、优异的光热稳定性和易降解安全性高的优势。
45、优选的,b选自于取代或者非取代的吡咯或氢化吡咯环、取代或者非取代的呋喃或氢化呋喃环、取代或者非取代的噻吩或氢化噻吩环、取代或者非取代的吡唑或氢化吡唑环、取代或者非取代的咪唑或氢化咪唑环、取代或者非取代的噁唑或氢化噁唑环、取代或者非取代的异噁唑或氢化异噁唑环、取代或者非取代的噻唑或氢化噻唑环、取代或者非取代的吲哚或氢化吲哚环、取代或者非取代的苯并呋喃或氢化苯并呋喃环、取代或者非取代的苯并咪唑或氢化苯并咪唑环、取代或者非取代的咔唑或氢化咔唑环、取代或者非取代的吡啶或氢化吡啶环、取代或者非取代的吡喃或氢化吡喃环、取代或者非取代的噻喃或氢化噻喃环、取代或者非取代的苯并吡唑或氢化苯并吡唑环、取代或者非取代的哒嗪或氢化哒嗪环、取代或者非取代的嘧啶嗪或氢化嘧啶环、取代或者非取代的吡嗪或氢化吡嗪环、取代或者非取代的哌啶环、取代或者非取代的吗啉环、取代或者非取代的硫代吗啉环和取代或者非取代的三唑环;
46、更优的,所述b为其中,r5、r6、r6’各自独立地选自于h、卤素原子、取代或非取代的烃基、取代或非取代的环烃基、取代或非取代的芳基、取代或非取代的杂芳基、取代或非取代的杂环基、取代或者非取代的醇基、取代或者非取代的醚基、取代或者非取代的醛基、取代或者非取代的羧基、取代或者非取代的酰氨基、取代或者非取代的酯基和取代或者非取代的氨基。
47、进一步的,式(ⅱ)中,r10为-ch2-、-(ch2)2-、-(ch2)3-或-(ch2)4-,优选的,r10为-(ch2)3-。
48、化合物ⅱ的微纳结构由化合物ⅱ(包括表格1中的化合物ⅱ-1至化合物ⅱ-50)在水溶液中自组装形成。所述微纳结构的粒径为1nm~500nm,优选的,为10nm~200nm,更优选的,为30nm~150nm。
49、由于肿瘤(特别是实体瘤)组织的血管丰富,并缺失淋巴回流系统,会造成本发明所述的微纳结构在肿瘤位置被动高渗透性和滞留性,这种微纳结构在实体瘤组织的高通透效应和滞留效应被称为epr效应。这种被动靶向肿瘤的能力,使这类可以以超分子组装形成微纳结构的小分子化合物,相对于其他报道的小分子光热转换试剂,具有明显的优势。
50、进一步的,所述化合物为化合物ⅱ-1、ⅱ-2、ⅱ-3、ⅱ-4、ⅱ-5、ⅱ-6、ⅱ-7、ⅱ-8、ⅱ-9、ⅱ-10、ⅱ-11、ⅱ-12、ⅱ-13、ⅱ-14、ⅱ-15、ⅱ-16、ⅱ-17、ⅱ-18、ⅱ-19、ⅱ-20、ⅱ-21、ⅱ-22、ⅱ-23、ⅱ-24、ⅱ-25、ⅱ-26、ⅱ-27、ⅱ-28、ⅱ-29、ⅱ-30、ⅱ-31、ⅱ-32、ⅱ-33、ⅱ-34、ⅱ-35、ⅱ-36、ⅱ-37、ⅱ-38、ⅱ-39、ⅱ-40、ⅱ-41、ⅱ-42、ⅱ-43、ⅱ-44、ⅱ-45、ⅱ-46、ⅱ-47、ⅱ-48、ⅱ-49或ⅱ-50。
51、本发明还提供了一种药物组合物,包括:
52、1)治疗有效剂量的具有式(i)、式(ⅱ)或式(ⅲ)所示结构化合物或其异构体、药学上可接受的盐、水合物或溶剂化物
53、2)药学上可接受的载体。
54、优选地,所述药学上可接受的载体包括稀释剂、崩解剂、赋形剂、粘合剂、稳定剂或其组合。
55、本发明所提供化合物在制备用于光热-免疫联合治疗药物、制备诊断和/或治疗癌症的药物中的应用。所述联合治疗药物为光热治疗药物或光声治疗药物。
56、所述癌症包括食道癌、非小细胞肺癌、胆道癌、头颈癌、巴雷特食管炎、膀胱癌、结肠直肠癌、胰腺癌、卵巢癌、前列腺癌、脑肿瘤、乳腺癌或皮肤癌,所述皮肤癌包括黑色素瘤。
57、本发明所述的微纳结构是由具有式(i)、式(ⅱ)或式(ⅲ)所示结构的化合物、其异构体、药学上可接受的盐、水合物或溶剂化物在水溶液中自组装形成的纳米碟结构。
58、本发明还提供了所述微纳结构的制备方法,包括以下步骤:
59、1)将具有式(i)、式(ⅱ)或式(ⅲ)所示结构的化合物、其异构体、药学上可接受的盐、水合物或溶剂化物利用有机溶剂溶解;
60、所选用的有机溶剂为烷烃、烯烃、芳烃、醇、酮、醛、羧酸、酯或醚中的一种或者多种的混合;具体的,有机溶剂为二甲基亚砜、n,n-二甲基甲酰胺、甲醇、乙醇、乙二醇、正丙醇、异丙醇、丙二醇、丙三醇、正丁醇、异丁醇、丁二醇或聚乙二醇、丙酮、二氯甲烷或乙腈中的一种或者多种的混合;优选为乙醇。
61、2)将溶解得到的溶液加入水中,得到化合物的终浓度为1nm-1m的化合物溶液;
62、终浓度优选为100nm~500μm;最优选为0.46μm~300μm。
63、3)化合物在水溶液中自组装形成微纳结构。
64、上述制备方法简单、便捷,适宜规模化生产。
65、本发明还提供了微纳结构的药物组合物,包括:治疗有效剂量的所述微纳结构,和药学上可接受的载体。优选的,所述药学上可接受的载体包括稀释剂、崩解剂、赋形剂、粘合剂、稳定剂或其组合。
66、本发明所提供的药物组合物可以制成注射剂,注射剂包含治疗有效剂量的微纳结构和注射溶剂或附加剂或其组合;其中,注射溶剂为注射用水、乙醇、丙二醇、甘油、聚乙二醇中的一种、两种或两种以上的混合溶剂。优选的,所述药物组合物可以制为注射液。
67、本发明的微纳结构为纳米碟结构,其药物组合物还包括包封在微纳结构中的活性剂,活性剂为治疗剂或诊断剂,优选为化疗剂或放疗剂,包括小分子化疗药物、靶向治疗药物、化疗药物、抗体药物等。进一步的,微纳结构还包括靶向分子,优选抗体、肽、适体或叶酸等。
68、另一方面,本发明还提供微纳结构或其药物组合物在制备光治疗药物中的用途,以及作为光敏剂的用途。所述光敏剂用于制备光治疗药物。所述光治疗药物为光热治疗药物或光声治疗药物。
69、本发明还提供了微纳结构或其药物组合物在制备诊断和/或治疗癌症的药物中的用途。所述癌症包括食道癌、非小细胞肺癌、胆道癌、头颈癌、巴雷特食管炎、膀胱癌、结肠直肠癌、胰腺癌、卵巢癌、前列腺癌、脑肿瘤、乳腺癌或皮肤癌,所述皮肤癌包括黑色素瘤。
70、本发明还提供了一种在受试者的靶区域进行光治疗的方法,包括:
71、1)提供所述的微纳结构;
72、2)将所述微纳结构给予受试者;
73、3)等待所述微纳结构在靶区域富集;
74、3)使用所述微纳结构激发波段的光辐照受试者的靶区域,优选地,采用808nm的光波照射。
75、本发明的有益效果:
76、(1)本发明所提供的化合物,在水溶液中可以自组装形成微纳结构,可以同时实现epr效应的“被动”靶向,使光热剂更多的富集于肿瘤内,靶向肿瘤效果优异,进而具有高光热转换效率、光热稳定性好、光热效应好、易降解、安全性高的优势,在癌症诊断和治疗方面具有广阔前景。
77、(2)本发明所提供的式(ⅰ)、式(ⅱ)或式(ⅲ)所示的化合物具有制备联合光治疗药物,以及制备诊断和治疗癌症药物的用途,其靶向效果好、治疗效果好、创伤小,具备极大的市场价值和广阔的经济前景。
78、(3)本发明引入nlg919基团之后,整体的有机小分子仍然可以通过超分子组装构建微纳结构,微纳结构可通过epr效应被动靶向肿瘤,同时在肿瘤组织中高谷胱甘肽的刺激下实现免疫检查点抑制剂的精准释放,避免免疫不良反应,进一步提高免疫治疗的安全性。断键后cy7-tcf可实现荧光增强,进一步提高荧光成像强度和光热治疗效果,而且经光热治疗后免疫原性进一步提高,提高免疫疗效,从而实现“1+1>2”的治疗过程。
- 还没有人留言评论。精彩留言会获得点赞!