一种产丙酸的工程益生菌的构建与应用
本发明属于基因工程和微生物发酵,具体涉及一种产丙酸的工程益生菌、构建方法、发酵工艺及其在医药,畜牧业,食品,保健或化工领域中的应用。
背景技术:
1、丙酸(propanoic acid,pa)是肠道菌群代谢产生的短链脂肪酸(short-chainfatty acids,scfa)之一,主要以游离的形式存在。已有研究证实丙酸具有许多重要的生理功能,参与物质代谢、促进肠道组织发育、增强机体免疫等生理活动。已有研究表明丙酸对于炎症性肠病(inflammatory bowel disease,ibd)有良好的治疗效果,能够改善肠道屏障功能。
2、然而直接补充丙酸存在生物利用度低、持续作用效果差等弊端;使用一些产丙酸的天然细菌,例如丙酸梭菌,韦荣氏球菌,嗜黏蛋白阿克曼菌等等,也能改善肠道炎症,但是大多数天然产丙酸细菌都是非益生菌,可能存在一定的毒力因子,因而导致肠道菌群紊乱。
技术实现思路
1、本发明的目的是克服上述现有技术的不足,通过合成生物学手段对天然益生菌进行合理设计,添加丙酸合成、表达通路上的基因,使得天然益生菌从无到有产生丙酸,并实现机体肠道屏障功能的修复。具体地,
2、本发明第一方面,提供了一种产丙酸的工程益生菌,所述工程益生菌包括导入丙酸合成途径中的四种基因的修饰,所述四种基因包括:第一种包括编码乳酸脱氢酶(lactate dehydrogenase,ldh)的基因ldha,第二种包括编码丙酸辅酶a-转移酶(propionate coa-transferase,pct)的基因pct,第三种包括编码乳糖辅酶a脱水酶(lactoyl-coa dehydratase,lcd)的基因lcda,第四种包括编码丙烯酰辅酶a还原酶(acryloyl coareductase,acu)的基因acui。
3、所述工程益生菌经过四种基因的修饰,可以合成终产物丙酸。其中,
4、通过第一种基因,使得益生菌可以在丙酮酸基础上合成l-乳酸,这是丙酸合成的第一步;
5、通过第二种基因,使得益生菌能够合成乳酰辅酶a,这是丙酸合成的第二步;
6、通过第三种基因,使得益生菌进一步可以合成丙烯酰辅酶a,这是丙酸合成的第三步;
7、通过第四种基因,使得益生菌可以合成丙酰基辅酶a,同时在第二种基因作用下合成终产物丙酸。
8、优选的,所述第一种基因包括但不限于来源于肠道细菌粪肠球菌属enterococcusfaecalis的乳酸脱氢酶编码基因ldha。
9、更优选的,所述ldha的核苷酸序列如seq id no:1所示。
10、ldha的核苷酸序列也可以是上述序列的互补、或者简并序列,更适合工程益生菌中表达的密码子优化序列,或者seq id no:1的突变序列,上述核苷酸序列具有编码ldh蛋白的功能。
11、优选的,所述突变序列包括:1)与seq id no:1具有至少90%的同一性,优选的,与seq id no:1具有至少95%、96%、97%、98%、99%的同一性等等;2)相对于seq id no:1具有一个或多个核苷酸的缺失、插入或者替换;3)在严格杂交条件下与seq id no:1能够杂交,以上核苷酸序列均具有编码ldh蛋白的功能。
12、优选的,所述ldha的核苷酸序列编码的ldh蛋白的序列如seq id no:2所示。或者如seq id no:2的突变序列,更优选地,所述突变序列包括:1)与seq id no:2具有至少90%的同一性,优选的,具有例如,至少92%、93%、94%、95%、96%、97%、98%、99%的同一性等等;2)相对于seq id no:2具有一个或多个氨基酸的缺失、插入或者替换;以上氨基酸序列均具有ldh蛋白的功能。
13、所述第二种基因包括但不限于来源于肠道细菌嗜热产乙酸菌属moorellathermoacetica的丙酸辅酶a-转移酶编码基因pct。
14、更优选的,所述pct的核苷酸序列可以如seq id no:3所示。
15、pct的核苷酸序列也可以是上述序列的互补、或者简并序列,更适合工程益生菌中表达的密码子优化序列。或者seq id no:3的突变序列,上述核苷酸序列具有编码pct蛋白的功能。
16、优选的,所述突变序列包括:1)与seq id no:3具有至少90%的同一性,优选的,与seq id no:3具有至少95%、96%、97%、98%、99%的同一性等等;2)相对于seq id no:3具有一个或多个核苷酸的缺失、插入或者替换;3)在严格杂交条件下与seq id no:3能够杂交,以上核苷酸序列均具有编码pct蛋白的功能。
17、优选的,所述pct的核苷酸序列编码的pct蛋白的序列如seq id no:4所示。或者如seq id no:4的突变序列,更优选地,所述突变序列包括:1)与seq id no:4具有至少90%的同一性,优选的,具有例如,至少92%、93%、94%、95%、96%、97%、98%、99%的同一性等等;2)相对于seq id no:4具有一个或多个氨基酸的缺失、插入或者替换;以上氨基酸序列均具有pct蛋白的功能。
18、所述第三种基因来源于丙酸梭菌属clostridium propionicum的乳糖辅酶a脱水酶的编码基因lcda。
19、更优选的,lcda的核苷酸序列如seq id no:5所示。
20、lcda的核苷酸序列也可以是上述序列的互补、或者简并序列,更适合工程益生菌中表达的密码子优化序列。或者seq id no:5的突变序列,上述核苷酸序列具有编码lcd蛋白的功能。
21、优选的,所述突变序列包括:1)与seq id no:5具有至少90%的同一性,优选的,具有例如,至少92%、93%、94%、95%、96%、97%、98%、99%的同一性等等;2)相对于seq idno:5具有一个或多个核苷酸的缺失、插入或者替换;3)在严格杂交条件下与seq id no:5能够杂交;以上核苷酸序列均具有编码lcd蛋白的功能。
22、优选的,所述lcda的核苷酸序列编码的lcd蛋白的序列如seq id no:6所示。或者如seq id no:6的突变序列,更优选地,所述突变序列包括:1)与seq id no:6具有至少90%的同一性,优选的,具有例如,至少92%、93%、94%、95%、96%、97%、98%、99%的同一性等等;2)相对于seq id no:6具有一个或多个氨基酸的缺失、插入或者替换;以上氨基酸序列均具有lcd蛋白的功能。
23、所述第四种基因来源于丙酸梭菌属clostridium propionicum的丙烯酰辅酶a还原酶的编码基因acui。
24、更优选的,acui的核苷酸序列如seq id no:7。
25、acui的核苷酸序列也可以是上述序列的互补、或者简并序列,更适合工程益生菌中表达的密码子优化序列。或者seq id no:7的突变序列,上述核苷酸序列具有编码acu蛋白的功能。
26、优选的,所述突变序列包括:1)与seq id no:7具有至少90%的同一性,优选的,具有例如,至少92%、93%、94%、95%、96%、97%、98%、99%的同一性等等;2)相对于seq idno:7具有一个或多个核苷酸的缺失、插入或者替换;3)在严格杂交条件下与seq id no:7能够杂交;以上核苷酸序列均具有编码acu蛋白的功能。
27、优选的,所述acui的核苷酸序列编码的acu蛋白的序列如seq id no:8所示。或者如seq id no:8的突变序列,更优选地,所述突变序列包括:1)与seq id no:8具有至少90%的同一性,优选的,具有例如,至少92%、93%、94%、95%、96%、97%、98%、99%的同一性等等;2)相对于seq id no:8具有一个或多个氨基酸的缺失、插入或者替换;以上氨基酸序列均具有acu蛋白的功能。
28、优选的,经过上述丙酸合成酶的四种基因的修饰,改造后的工程益生菌相比于未经基因修饰的工程益生菌,获得生产丙酸的能力,丙酸初步产量48h可达至少25mg/l,例如28、30、33、35、38、40、45、50mg/l等等。
29、优选的,上述四种基因的修饰使得编码的酶的活性提高或过表达,更优选的,所述使得编码的酶的活性提高或过表达的基因修饰方式包括点突变,连接强启动子,连接增强子,提高拷贝数、外源导入或者融合共表达。等等。
30、优选的,基于工程益生菌内源基因的不同,上述四种基因可以部分或者全部外源导入,或以其他方式进行基因修饰,从而在工程益生菌中建立以丙酮酸为底物合成丙酸的途径。
31、例如,在工程益生菌中不存在上述第一、第二、第三、第四种基因时,外源导入上述四种基因;又如,在工程益生菌中内源存在第一种基因时,外源导入第二、第三、第四种基因,优选的,可进一步对第一种内源基因进行修饰使得编码的酶的活性提高或过表达。或者在工程益生菌中内源存在第二和第三种基因时,外源导入第一、第四种基因,优选的,可进一步对第二和第三种内源基因进行修饰使得编码的酶的活性提高或过表达,以此类推。
32、优选的,上述工程益生菌还包括第五种基因修饰,所述修饰包括基于丙酮酸合成乙酸途径中的酶的活性降低或者表达被抑制。
33、更优选的,所述第五种基因修饰后降低乙酸(acetic acid,aa)的合成。
34、更优选的,所述第五种基因包括编码丙酮酸甲酸裂解酶(pyruvate formatelyase,pfl)的基因pflb、编码丙酮酸脱氢酶(pyruvate dehydrogenase,pdh)的基因poxb和/或编码乙酸激酶(acetate kinase,ak)的基因acka。
35、更优选的,所述修饰包括但不限于点突变,缺失,插入,反义polynucleotides,sirna,microrna,crispr,更为优选的,所述修饰方式包括点突变,缺失或插入一个或者多个核苷酸,点突变如单核苷酸的转换(嘌呤到嘌呤或嘧啶到嘧啶)或者颠换(嘌呤到嘧啶或嘧啶到嘌呤)。核苷酸的突变可以导致在其表达的多肽中一个或者多个保守的或者非保守的氨基酸的置换,这种置换可能会导致多肽的构象发生变化,也可能失去部分或者全部功能,可能发生移码突变将导致整个多肽链从该点处开始编码一个完全不同的多肽,也可能提前形成一个终止密码子使得多肽链残缺,甚至使基因沉默。
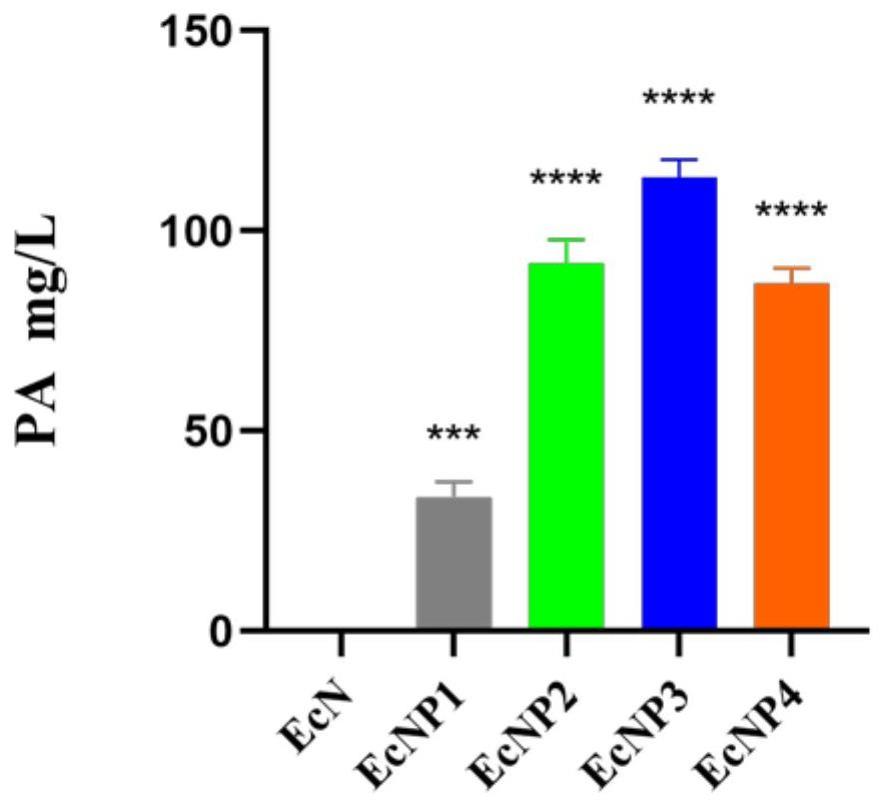
36、缺失或插入用核苷酸序列可以用pcr或者化学合成的方法得到,也可以利用细胞复制扩增得到。使基因酶活性或表达被完全抑制的基因修饰还可以通过提供或表达反义寡核苷酸antisense polynucleotides,sirna,microrna或其他可以阻止待修饰基因的mrna翻译为蛋白质的核苷酸的方法来实现。近年来发展的类转录激活因子效应物核酸酶(transcription activator-like effector nuclease,talen)和crispr技术——规律成簇的间隔短回文重复(clustered regularly interspaced short palindromic repeats)也可以用来失活基因。
37、本发明中提到的使基因酶活性降低或表达被抑制的基因修饰指的是能够使得这种酶/多肽的活性降低(与未经基因修饰的益生菌或野生型益生菌比较)至少95%(例如至少96%,97%,98%,99%,或者100%)。
38、在一个具体的实施方式中,所述编码丙酮酸甲酸裂解酶(pyruvate formatelyase,pfl)的基因pflb、丙酮酸脱氢酶(pyruvate dehydrogenase,pdh)的基因poxb和/或乙酸激酶(acetate kinase,ak)的基因acka的核苷酸序列部分或者全部缺失。
39、上述第五种基因修饰,改造后的工程益生菌相对于野生型或者上述四种基因修饰的工程益生菌,丙酸合成能力进一步得到增强,产率提高至少50%、例如50%、75%、100%、150%、200%、250%、300%、350%、400%、450%、500%,甚至更高。
40、进一步的,所述基因的修饰方式包含使用选择标记基因。优选的,所述选择标记基因包括但不限于ura3,leu2,his3,trp1。更优选使用ura3选择标记基因。更进一步优选的,所述基因的修饰方式是循环使用选择标记基因而不保留选择标记基因。
41、本发明所描述的工程益生菌,较未经基因修饰的大肠杆菌获得一定水平的丙酸合成能力,且合成水平得到了显著的增强。最优的方案中,本文描述的工程益生菌的丙酸产量可达113mg/l。
42、优选的,所述的工程益生菌包括益生大肠杆菌、酵母菌、益生芽孢菌、丙酸梭菌、乳杆菌、双歧杆菌、放线菌等等,更优选的,所述益生大肠杆菌包括escherichia coli nissle1917(ecn),酵母菌包括酿酒酵母(saccharomyces cerevisiae),巴斯德酵母(saccharomyces pastorianus),树干毕赤酵母(pichiastipitis),saccharomycesbayanus和休哈塔假丝酵母(candida shehatae)中的任意一种。
43、本发明的第二方面,提供一种上述工程益生菌的构建方法,所述构建方法包括:
44、1)在工程益生菌中导入丙酸合成的四种基因中的一种或者多种,使得工程益生菌以丙酮酸为底物的基础上合成丙酸。
45、优选的,所述构建方法中还包括2)对工程益生菌引入第五种基因修饰,所述修饰包括基于丙酮酸合成乙酸天然途径中的酶的活性降低或者表达被抑制。
46、更优选的,所述第五种基因修饰后降低乙酸(acetic acid,aa)的合成。
47、更优选的,第五种基因修饰使修饰后基因编码酶的活性降低或表达被抑制,上述第五种基因的修饰方式包括但不限于点突变,缺失,插入,反义polynucleotides,sirna,microrna,crispr,更为优选的,所述修饰方式包括点突变,缺失或插入一个或者多个核苷酸,点突变如单核苷酸的转换(嘌呤到嘌呤或嘧啶到嘧啶)或者颠换(嘌呤到嘧啶或嘧啶到嘌呤)。核苷酸的突变可以导致在其表达的多肽中一个或者多个保守的或者非保守的氨基酸的置换,这种置换可能会导致多肽的构象发生变化,也可能失去部分或者全部功能,可能发生移码突变将导致整个多肽链从该点处开始编码一个完全不同的多肽,也可能提前形成一个终止密码子使得多肽链残缺,甚至使基因沉默。
48、缺失或插入用核苷酸序列可以用pcr或者化学合成的方法得到,也可以利用细胞复制扩增得到。使基因酶活性或表达被完全抑制的基因修饰还可以通过提供或表达反义寡核苷酸antisense polynucleotides,sirna,microrna或其他可以阻止待修饰基因的mrna翻译为蛋白质的核苷酸的方法来实现。近年来发展的类转录激活因子效应物核酸酶(transcription activator-like effector nuclease,talen)和crispr技术--规律成簇的间隔短回文重复(clustered regularly interspaced short palindromic repeats)也可以用来失活基因。
49、在一个具体的实施方式中,所述编码丙酮酸甲酸裂解酶(pyruvate formatelyase,pfl)的基因pflb、丙酮酸脱氢酶(pyruvate dehydrogenase,pdh)的基因poxb和/或乙酸激酶(acetate kinase,ak)的基因acka的核苷酸序列部分或者全部缺失。
50、更优选的,所述第五种基因修饰方式包括利用crispr技术使得基因全部缺失。
51、进一步优选的,所述crispr技术包括使用sgrna缺失(敲除)第五种基因。
52、在一个具体的实施方式中,所述sgrna的pflb靶向序列包括seq id no:27。
53、在一个具体的实施方式中,所述sgrna的poxb靶向序列包括seq id no:28。
54、在一个具体的实施方式中,所述sgrna的acka靶向序列包括seq id no:29。
55、进一步优选的,所述步骤1)包括:(1-1)构建包含第一种和/或第二种基因的载体;(1-2)将步骤(1-1)的载体导入到工程益生菌,获得包含第一种和/或第二种基因的工程益生菌;(1-3)构建包含第三种和/或第四种的载体;(1-4)将步骤(1-3)的载体导入到步骤(1-2)的工程益生菌,获得包含第一种、第二种、第三种和第四种基因的工程益生菌。
56、所述步骤2)包括:(2-1)构建包含靶向第五种基因的载体;(2-2)将步骤(2-1)的载体导入到步骤1)获得的第五种基因缺失的工程益生菌。
57、优选的,所述载体包含调控元件,进一步优选的,所述调控元件包括启动子,终止子等等。
58、进一步的,所述载体还包括左同源臂序列和右同源臂序列。优选的,所述导入包括利用crispr/cas9进行基因编辑。更优选的,使用grna和上述载体一起进行导入。
59、在一个具体的实施方式中,
60、所述步骤1)包括:
61、(1-1)构建包含第一种和第二种基因的质粒载体pcdfduet-ldha-pct;
62、(1-2)将步骤(1-1)的载体导入到工程益生菌,获得包含第一种和第二种基因的工程益生菌;
63、(1-3)构建包含第三种和第四种基因的质粒载体petduet-lcda-acui;
64、(1-4)将步骤(1-3)的载体导入到步骤(1-2)的工程益生菌,获得包含第一种、第二种、第三种和第四种基因的工程益生菌。
65、所述步骤2)包括:
66、(2-1)构建包含靶向第五种基因的sgrna序列的载体;
67、(2-2)将步骤(2-1)的载体导入到步骤1)获得的工程益生菌以缺失(敲除)第五种基因,获得包含多种基因修饰的工程益生菌。
68、在工程益生菌中基因修饰的顺序可以不分先后,任一组合的被修饰。所述第一、二、三、四、五种基因仅仅是为了区分彼此而进行的基因命名,并不表明时间的先后顺序,例如,可以在第四种基因修饰后进行第一种基因修饰,也可以在第一种基因修饰后,进行第五种基因的修饰,然后进行第三种基因的修饰,又例如可以在第五种基因修饰后,进行第四种基因的修饰,然后进行第一种基因修饰,等等,修饰后,在工程益生菌中至少包括第一、二、三、四种基因的修饰。
69、进一步优选的,核苷酸序列(如表达载体)可以通过多种方法导入到益生菌细胞或者其他宿主细胞中。这些方法包括(不局限于此)电穿孔法,磷酸钙沉淀法,热激法,脂质转染法,显微注射法,氯化锂法,醋酸锂法和病毒介导基因转移法。
70、除了益生菌细胞,宿主细胞还可以是任何可以用于标准分子生物学操作并产生核苷酸和多肽的细胞。包括但不仅限于细菌细胞(如e.coli),昆虫细胞,植物细胞和哺乳动物细胞(如cho或cos细胞)。益生菌细胞包括本文中描述的工程益生菌细胞。本文所指的宿主细胞不仅包括对其进行核苷酸转导的母细胞,还包括其子细胞。
71、在本发明的基因修饰过程中,供转入益生菌细胞筛选使用的选择标记基因包括但不仅限于益生菌可用的任何营养缺陷型基因,如ura3、leu2、his3、trp1、lys2。为了能进行尽可能多的基因修饰,同时避免营养缺陷型基因表达本身带来的可能干扰,优选能方便地被反复、循环使用的ura3基因。更进一步优选的,ura3等选择标记基因被循环使用而不保留在被基因修饰的菌株中。
72、虽然本发明实施例所应用的策略针对益生大肠杆菌,例如escherichia colinissle 1917(ecn)菌株的基因和多肽,但是相同的策略同样适用于其他益生菌,例如酵母菌、益生芽孢菌、丙酸梭菌、乳杆菌、双歧杆菌、放线菌等,可以根据这些益生菌中内源基因的不同,而导入丙酸合成的其他外源基因,包括上述第一至第四基因的一种或者多种基因,并可根据益生菌的不同而对密码子进行优化。在这些菌株中通路或者基因名称或许稍有不同,但是可以应用同样的策略和技术来修饰相应的通路和同源基因。此处描述的基因工程工程益生菌是本领域的研究人员所熟知的。
73、本发明第三方面,提供一种利用上述的工程益生菌生产丙酸的方法,所述方法包括在培养基中培养上述工程益生菌。
74、优选的,所述方法中培养基包括碳源,氮源,微量元素。
75、更优选的,所述方法中,培养基包括葡萄糖浓度为16-25g/l,酵母提取物为8-12g/l,蛋白胨为15-25g/l。
76、本发明第四方面,提供一种利用上述的工程益生菌发酵生产的发酵产物。
77、优选的,所述发酵产物包括上述工程益生菌和分泌的丙酸。
78、更优选的,所述丙酸含量至少25mg/l,例如30、35、40、45、50、55、58、60、67、72、80、90、101、113、150mg/l以上,甚至更高。
79、本发明第五方面,提供上述任一的工程益生菌或者发酵产物在生产丙酸中的用途。
80、本发明第六方面,提供上述任一的工程益生菌或者发酵产物在医药,农药,食品,制酒等领域的应用。
81、优选的,所述应用包括:
82、作为医药领域中药物组合物,所述药物组合物促进肠道组织发育、增强机体免疫、改善肠道屏障功能、改善炎症细胞受损、治疗炎症性肠病(inflammatory bowel disease,ibd);
83、作为农药领域中的除草剂;
84、作为食品领域中的防腐剂、防霉剂和/或香料等等;
85、作为制酒领域中啤酒制备中黏性物质抑制剂。
86、本发明第七方面,提供一种制备医药,农药,食品,制酒等领域的产品的方法,所述方法包括利用上述任一的工程益生菌或者所述任一的发酵产物制备上述产品。
87、优选的,所述方法包括将所述工程益生菌或者发酵产物进一步加工成任何其他剂型,更优选的,所述剂型包括可食用的剂型,进一步优选的,所述剂型为粉剂,颗粒剂,片剂,胶囊,或液体形式。更优选的,为低温干燥或喷雾干燥方法制备粉剂。
88、本发明第八方面,提供一种制剂,所述制剂包含上述任意的工程益生菌或上述任意的发酵产物。
89、优选的,所述制剂包括任意的剂型,更优选的,所述剂型包括可食用的剂型,进一步优选的,所述剂型为粉剂,颗粒剂,片剂,胶囊,或液体形式。更优选的,为低温干燥或喷雾干燥方法制备粉剂。
90、本发明的第九方面,提供一种药物组合物,所述药物组合包含上述任一所述的工程益生菌或者发酵产物。
91、优选的,所述药物组合物促进肠道组织发育、增强机体免疫、改善肠道屏障功能、改善炎症细胞受损、治疗炎症性肠病(inflammatory bowel disease,ibd)。
92、若非特殊说明,本文涉及的所有专业术语、技术概念都是本领域技术人员所熟知的。尽管有多种类似或等效的方法可以用来构建和测定本发明中涉及的工程益生菌,下文中将描述一种合适的方法和材料。这些材料、方法和例子只是作为举证,它不在任何程度上限制本发明。本文中提到的所有文献、专利和其他参考资料均尊重其完整性。本发明涉及的方法和材料将在下文中与详细说明和图表一同给出。
93、本发明的优点和益处:
94、1.本发明首次将产丙酸途径引入到工程益生菌,所得重组工程益生菌具有低营养需求、容易培养、适合大规模发酵生产丙酸并易于实现产业化的性能;
95、2.通过基因工程手段进行相关基因修饰,在引入丙酮酸途径中4种关键丙酸合成基因时,赋予工程益生菌初步合成丙酸的能力,在减少乙酸合成旁路代谢分流通量的同时,提高丙酸前体物质的胞内外运输和积累,使所得重组工程益生菌能稳定,持续,高效生产丙酸,产量可达113mg/l。
96、3.优选的方案中,本发明利用sgrna对第五基因进行敲除,敲除效率高。
97、4.本发明克服了原非益生菌合成丙酸的缺陷,对机体无毒副作用,结合益生菌的作用,包括改善肠道屏障功能、促进营养物质的消化吸收、提高机体免疫力等功能,将推动高值医药和生化产品的绿色清洁生产,能广泛应用于医药、食品等领域,具有重要的经济价值和社会意义。
- 还没有人留言评论。精彩留言会获得点赞!