基于时珍法的中药鉴定方法及应用
本技术涉及中药鉴定,具体涉及一种基于时珍法(analysis of whole-genome,age,又称全基因组分析法或阿哥法)的中药鉴定方法及应用。
背景技术:
1、中医药是一个传承千年的伟大宝库,蕴含着无数先贤与疾病作斗争积累下来的宝贵经验与智慧。中药的传统鉴定方法(如眼观、手摸、口尝)现已无法满足高时效性发展的中药鉴定需求,而基于指标性成分检测的理化鉴定方法往往无法解决人为掺假等鉴定难题。dna分子鉴定方法通过识别物种固有的特异性dna序列进行鉴定,具有客观、灵敏、专属性强、简便易行、易于标准化等优点,正在中药鉴定领域发挥着越来越重要的作用。
2、核、叶绿体和线粒体基因组作为物种全部遗传信息的载体,能够提供大量的物种特异性dna序列,是中药鉴定的理想数据库,但由于技术方面的限制,目前尚无基于核、叶绿体和线粒体基因组的中药分子鉴定方法。
3、此前已有多种物种特异性dna序列的识别方法,包括crispr/cas系统、taqmanprobe-based real-time pcr系统、pcr系统和sanger测序系统等。crispr/cas系统是依赖cas蛋白(如cas12a和cas13a)的反式切割活性:crrna特异性识别靶标序列后cas蛋白反式切割活性被激活,可非特异性切割单链dna荧光信号分子,产生可检测的荧光。该反应在37℃下进行,操作简单,仅需要恒温与荧光检测仪器。taqman probe-based real-time pcr系统通过在pcr反应过程中添加特异性识别靶标序列的荧光探针,可通过检测荧光信号鉴定物种。该方法需要实时荧光定量pcr仪,结果较为准确。pcr系统通过设计特异性识别靶标序列的引物,pcr后通过电泳进行物种鉴别,最为简便,但特异性较弱。sanger测序系统的检测结果最为准确,但需要测序仪器,检测相对繁琐,时间较长。除了上述特异性dna序列检测方法,其他序列检测方法同样可用,适用于不同应用场景。但是目前已经筛选得到的物种特异性靶标序列往往具有特异性较低、脱靶风险高等缺点,如何构建得到适宜的物种特异性靶标序列的文库成为制约已有的dna序列识别方法在中药分子鉴定方面的广泛应用的关键因素。
技术实现思路
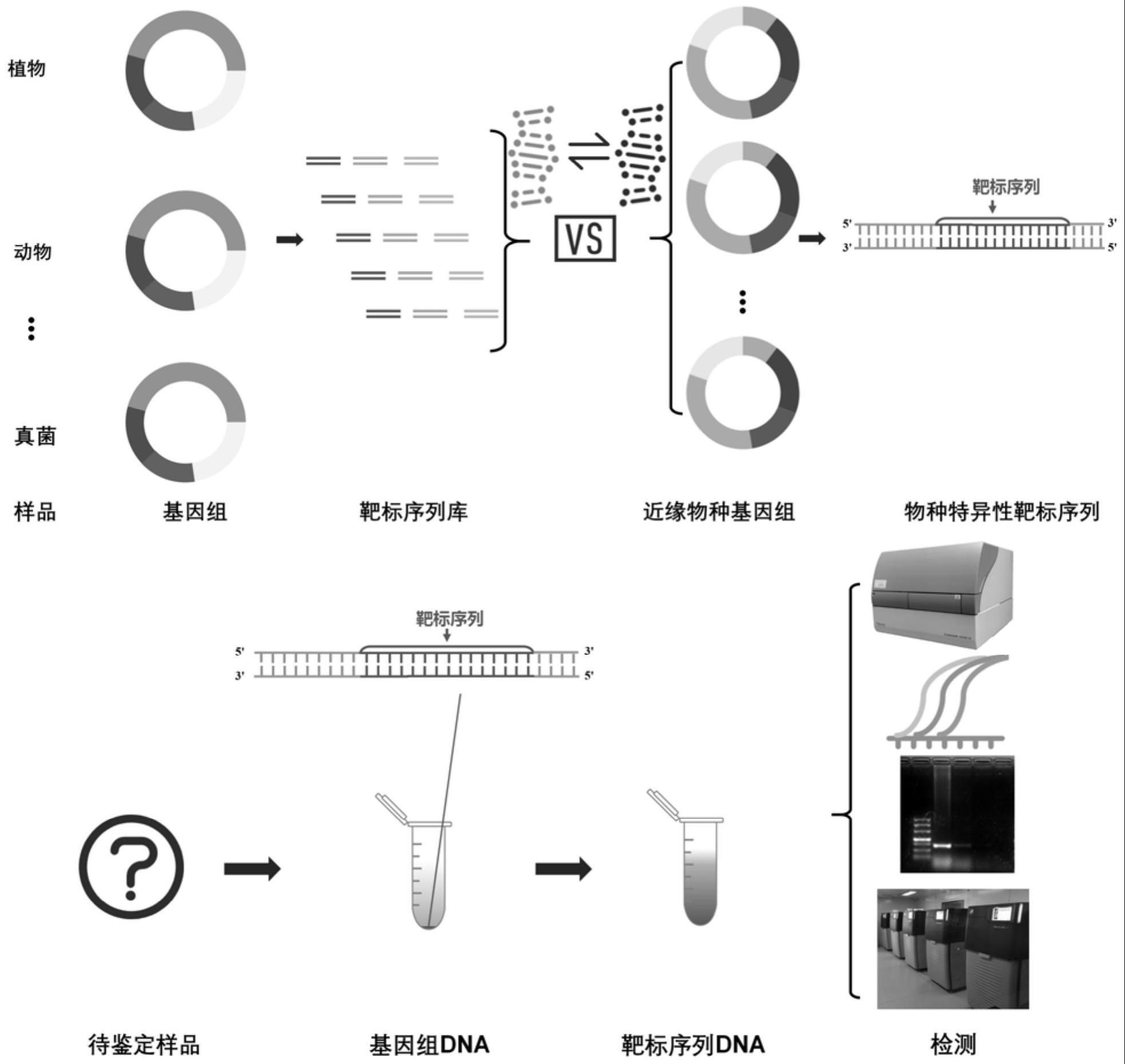
1、本发明的物种鉴定方法(以下称为时珍法)将核、叶绿体和线粒体基因组分析与不同的靶标序列检测方法相结合,实现了从核、叶绿体和线粒体基因组层面进行中药鉴定。与现有技术相比,时珍法通过从核、叶绿体和线粒体基因组中筛选用于鉴定的候选靶标序列,根据应用场景选择不同检测方法并筛选相应的物种标准特异性靶标序列,充分挖掘了核、叶绿体和线粒体基因组应用于物种鉴定的潜力。考虑到核、叶绿体和线粒体基因组蕴含的巨大信息以及不同的靶标序列检测方法提供的靶标序列选择多样性,理论上时珍法可通过多种相对简单且成本更低的方法确定待检测样品基因组是否存在特异性靶标序列,不需要对样品的全基因组进行测序即可判定任意待检测中药样品与指定中药基原物种的同一性,消除了脱靶等失误风险,由此,时珍法可准确判定任意待检测中药样品与指定中药基原物种的同一性。
2、在一个方面,本发明提出了一种基于时珍法的中药鉴定方法,包括:
3、(1)获得中药基原物种的核、叶绿体和线粒体基因组序列,构建小片段基因组文库;
4、(2)从所述小片段基因组文库中提取候选靶标序列并进行分析,从所述候选靶标序列中筛选符合选自筛选条件(a)至(d)中的至少一种的候选序列作为标准特异性靶标序列,所述筛选条件包括:
5、(a)候选序列gc含量为40%-60%;
6、候选序列不能含有四核苷酸及以上重复序列、连续的三核苷酸重复序列、不连续的3个及以上的三核苷酸重复序列;
7、候选序列不能与crrna重复序列互补;
8、候选序列5'端6个核苷酸中g+c含量为30%-80%;
9、候选序列与混伪品及近缘物种的核、叶绿体和线粒体基因组序列进行比对至少含有3个差异核苷酸;和/或
10、候选序列所在区域-50bp到+300bp或-300bp到+50bp内不存在连续4个以上a或gt重复;
11、(b)候选序列及扩增候选序列所在区域的引物中的g+c含量为30%-80%;
12、根据候选序列设计的荧光探针与上下游扩增候选序列所在区域的引物退火温度分别为55℃-60℃以及68℃-70℃,且引物对间退火温度相差不超过2℃;
13、候选序列及扩增候选序列所在区域的引物长度为15-30bp;
14、上下游扩增候选序列所在区域的引物间隔50-150bp且正向引物靠近根据候选序列设计的荧光探针;
15、根据候选序列设计的荧光探针与上下游扩增候选序列所在区域的引物不含发卡结构且引物对不能形成二聚体;
16、上下游扩增候选序列所在区域的引物3'端5bp内g/c碱基不超过两个;
17、根据候选序列设计的荧光探针中的c碱基多于g碱基;和/或
18、候选序列与混伪品及近缘物种的核、叶绿体和线粒体基因组进行比对
19、至少含有2个差异核苷酸;
20、(c)根据候选序列设计的扩增引物gc含量为40%-60%,且四种核苷酸均匀分布,不存在聚嘌呤及聚嘧啶,不含gc富含区;
21、根据候选序列设计的扩增引物长度为18-30bp,引物对间相差不超过3个碱基;
22、根据候选序列设计的扩增引物不含反向重复序列以及大于3bp的自互补序列,引物间不能形成二聚体;
23、根据候选序列设计的扩增引物退火温度为55-60℃,引物对之间的退火温度相差不超过2℃;
24、根据候选序列设计的扩增引物3'端5个碱基中的g/c碱基多于一个但不超过三个;和/或
25、候选序列与混伪品及近缘物种的核、叶绿体和线粒体基因组进行比对至少含有2个差异核苷酸;
26、或者,(d)候选序列所在区域为纯合的;
27、候选序列所在区域的gc含量在30%-80%;
28、候选序列所在区域不能含有四个以上连续的重复核苷酸;
29、候选序列所在区域不能含有甲基化序列;
30、候选序列所在区域不能存在发卡结构;和/或
31、候选序列与混伪品及近缘物种的核、叶绿体和线粒体基因组进行比对至少含有2个差异核苷酸;
32、(3)提取待检测中药样品的基因组dna,任选地对其进行扩增,将所述基因组dna或其扩增产物作为dna底物,利用靶标序列检测系统来检测所述dna底物中是否存在所述标准特异性靶标序列,其中,所述靶标序列检测系统包括crispr/cas12a系统、taqman probe-based real-time pcr系统、pcr系统或者sanger测序系统,其中,对于所述crispr/cas12a系统,通过所述检测若产生明显荧光信号,则所述待检测中药样品与指定的中药基原物种具有同一性,反之则没有;对于所述taqman probe-based real-time pcr系统,通过所述检测若ct值大于37,则所述待检测中药样品与指定的中药基原物种具有同一性,反之则没有;对于所述pcr系统中,通过所述检测若电泳结果产生明显条带,则所述待检测中药样品与指定的中药基原物种具有同一性,反之则没有;对于所述sanger测序系统,若测序结果与所述标准特异性靶标序列相同,则所述待检测中药样品与指定的中药基原物种具有同一性,反之则没有。
33、在一些实施方式中,通过构建基因组图谱或浅层测序获得所述中药基原物种的核、叶绿体和线粒体基因组序列。
34、在一些实施方式中,将所述中药基原物种的核、叶绿体和线粒体基因组序列分成l-k+1个长度为k的片段,以构成所述小片段基因组文库,并计算每个片段的拷贝数,再通过与基因组比对确定每个片段的基因组位置,其中l表示基因组序列长度,k表示文库片段长度。在一些实施方式中,k为15-750bp,例如18-30bp、20-750bp、25-28bp。
35、在一些实施方式中,针对上述方法指定的中药基原物种为掌叶大黄(rheumpalmatum)、唐古特大黄(rheum tanguticum)或药用大黄(rheum officinale),但不限于此。在本文中,中药基原物种是指待检测的样品可能所属的物种,例如,对于疑似来自大黄的待检测样品,可以选择掌叶大黄、唐古特大黄、药用大黄等作为基原物种;进一步地,如果想要确定该待检测样品是否与药用大黄具有同一性,则药用大黄为指定的中药基原物种。
36、在一些实施方式中,在步骤(2)中,根据步骤(4)中采用的对所述标准特异性靶标序列进行检测的检测系统来提取所述候选靶标序列。本领域技术人员熟知各种序列检测系统对于待测序列的要求,例如,针对crispr/cas12a系统,可选择5'端带有tttv或3'段带有vaaa(pam)的基序(优选地,对小片段基因组文库中的每一个片段检测pam基序,并提取带有pam的候选靶标序列构建候选靶标序列库);针对taqman probe-based real-time pcr系统,可选择不含超过3个连续重复碱基以及3个连续g碱基的基序;针对pcr系统,可选择不含富含gc区的基序;或者例如,针对sanger测序系统,可以选择适合测序的基序,但是本发明的保护范围不限于此。
37、在一些实施方式中,可通过增加候选序列与混伪品及近缘物种的核、叶绿体和线粒体基因组序列的差异核苷酸数,以进一步提高标准特异性靶标序列的特异性;或者可以通过调节候选序列与混伪品及近缘物种的核、叶绿体和线粒体基因组序列的差异核苷酸数,筛选得到预定数量范围内的标准特异性靶标序列。
38、在优选的实施方式中,所述指定的中药基原物种为药用大黄,所述靶标序列检测系统为crispr/cas12a系统,并且所述标准特异性靶标序列包括以seq id no:1和4示出的靶标核苷酸序列。在优选的实施方式中,所述指定的中药基原物种为掌叶大黄,所述靶标序列检测系统为crispr/cas12a系统,并且所述标准特异性靶标序列包括以seq id no:2示出的靶标核苷酸序列。在优选的实施方式中,所述指定的中药基原物种为唐古特大黄,所述靶标序列检测系统为crispr/cas12a系统,并且所述标准特异性靶标序列包括以seq id no:3示出的靶标核苷酸序列。
39、在优选的实施方式中,所述指定的中药基原物种为药用大黄,并且所述靶标序列检测系统为taqman probe-based real-time pcr系统,并且所述标准特异性靶标序列包括以seq id no:17示出的靶标核苷酸序列。
40、在优选的实施方式中,所述指定的中药基原物种为药用大黄,并且所述靶标序列检测系统为pcr系统,并且所述标准特异性靶标序列包括以seq id no:19示出的靶标核苷酸序列。
41、在优选的实施方式中,所述指定的中药基原物种为药用大黄,并且所述靶标序列检测系统为sanger测序系统,并且所述标准特异性靶标序列包括以seq id no:20示出的靶标核苷酸序列。
42、在步骤(3)中,本领域技术人员熟知各种序列检测系统对于检测序列的要求,并在基于本发明得到的标准特异性靶标序列的前提下,可以利用已知的分子生物学网站或者工具常规地设计并合成相应的检测序列。在一些实施方式中,例如对于crispr/cas12a系统,可以根据标准特异性靶标序列设计并合成crispr rna(crrna);优选地,可以通过构建指定的中药基原物种相对于其混伪品及近缘物种的标准特异性靶标序列库,从而构建与该标准特异性靶标序列库相匹配的crrna序列库。例如,对于taqman probe-based real-time pcr系统,可以根据标准特异性靶标序列及标准特异性靶标序列所在区域设计并合成引物与荧光探针;例如,对于pcr系统,可以根据标准特异性靶标序列设计并合成扩增引物;例如,对于sanger测序系统,可以根据选定的标准特异性靶标序列合成测序引物。本领域技术人员可以理解的是,靶标序列检测系统并不仅限于上述示例的这些,而是可以基于本领域已知的任意检测系统,并由此设计得到相应的检测序列。
43、在优选的实施方式中,采用crispr/cas12a系统以seq id nos:5、6、7或8示出的crrna来检测所述dna底物中是否存在所述标准特异性靶标序列。
44、在优选的实施方式中,采用taqman probe-based real-time pcr以seq id nos:18和16示出的引物对、以及以fam-gcttgaatgaaagt caggcactccgcca-bhq示出的taqman探针来检测所述dna底物中是否存在所述标准特异性靶标序列。
45、在优选的实施方式中,采用pcr系统以seq id nos:19和16示出的引物对来检测所述dna底物中是否存在所述标准特异性靶标序列。
46、在优选的实施方式中,采用sanger测序系统以seq id nos:19和21示出的测序引物对来检测所述dna底物中是否存在所述标准特异性靶标序列。
47、在一些实施方式中,在步骤(4)中,例如,可利用特异性扩增标准特异性靶标序列的引物对来扩增待检测中药的基因组dna并回收扩增的标准特异性靶标序列作为dna底物;或利用特异性扩增包含标准特异性靶标序列的dna序列的引物来扩增待检测基因组dna并回收扩增得到的包含标准特异性靶标序列的dna序列作为dna底物。
48、例如,在选择crispr/cas12a系统作为靶标序列检测系统时,可利用以seq idnos:9-10、seq id nos:11-12、seq id nos:13-14或seq id nos:15-16示出的引物对扩增待检测中药的基因组dna并回收扩增的标准特异性靶标序列作为dna底物。
49、在一些优选的实施方式中,所述crispr/cas12a系统包括:基因编辑缓冲液、cas12a、crrna、无核酸酶水、dna底物和荧光信号分子(例如ssdna报告基因)。
50、作为示例,就所述crispr/cas12a系统而言,可选择nebuffer 2.1和lba cas12a(cpf1),荧光信号分子可选择poly_c_fq(5’-fam-cccccccccc-bhq-3’),按如下进行反应:
51、(1)配制以下反应体系(括号内为终浓度)
52、
53、(2)在室温孵育10分钟。
54、(3)以扩增后回收的标准特异性靶标序列作为dna底物,加入10μl扩增后回收的标准特异性靶标序列(1ng/μl)和4μl poly_c_fq(400nm)后在37℃孵育并在0、3、6、9、12、15、25、35、45分钟时用酶标仪在λex 483nm/λem 535nm(根据所选荧光信号分子确定)分别检测荧光值。如检测结果与空白对照存在显著性差异(p<0.01),则可判定待检测样品与指定物种具有同一性,反之则不具有同一性。
55、在一些优选的实施方式中,所述taqman probe-based real-time pcr系统包括:缓冲液、引物、无核酸酶水、dna底物和taqman探针。
56、作为示例,就taqman probe-based real-time pcr系统而言,可选择probe qpcrmix,taqman探针荧光基团选择fam,淬灭基团选择bhq。按如下进行反应:
57、(1)配制以下反应体系(括号内为终浓度)
58、
59、(2)反应条件为95℃30sec;40个循环:95℃5sec;60℃30sec。
60、(3)如检测结果ct值大于37,则可判定待检测样品与指定物种具有同一性,反之则不具有同一性。
61、在一些优选的实施方式中,所述pcr系统包括:缓冲液、正向/反向引物、无核酸酶水和dna底物。
62、作为示例,就所述pcr系统而言,可选择taq pcr mastermix,按如下进行反应:
63、(1)配制以下反应体系(括号内为终浓度)
64、
65、
66、(2)反应条件为95℃30sec;30个循环:95℃5sec;tm 30sec;72℃30sec;72℃10min。
67、(3)pcr产物用2%琼脂糖凝胶电泳,电泳条件为120v 30min。如电泳结果有特异性条带,则可判定待检测物种与指定物种具有同一性,反之则不具有同一性。
68、在一些优选的实施方式中,所述sanger测序系统包括:缓冲液、测序引物、无核酸酶水和dna底物。
69、作为示例,就所述sanger测序系统而言,可选择taq pcr mastermix,按如下进行反应:
70、(1)配制以下反应体系(括号内为终浓度)
71、
72、(2)反应条件为95℃30sec;30个循环:95℃5sec;tm 30sec;72℃30sec;72℃10min。
73、(3)使用测序引物将pcr产物进行sanger测序。
74、(4)分析测序结果,如测序结果中含有标准特异性靶标序列可判定待检测物种与指定物种具有同一性,反之则不具有同一性。
75、在一个方面,本发明提供了大黄的标准特异性靶标核苷酸,所述靶标核苷酸为选自如下的至少一种:(1)以seq id no:1示出的靶标核苷酸(aatatggttatgttatattaataaa);(2)以seq id no:2示出的靶标核苷酸(tttatattgattgttttatattgat);(3)以seq id no:3示出的靶标核苷酸(tttcgccagtatcattattatttaattt);(4)以seq id no:4示出的靶标核苷酸(tttcttgtggcggagtgcctgactt);(5)以seq id no:17示出的靶标核苷酸(gcttgaatgaaagtcaggcactccgcca);(6)以seq id no:19示出的靶标核苷酸(aagctggctgtcattcagct);或(7)以seq id no:20示出的靶标核苷酸(ataacctgcattctatggtttggtt)。
76、另一方面,本发明提供了上述的标准特异性靶标核苷酸在对大黄或源自大黄的材料进行物种鉴定、或者区分大黄与其近缘物种中的应用。
77、本发明首次发现了在大黄中存在上文示出的物种特异性的标准特异性靶标核苷酸序列。其中,以seq id no:1、4、17、19和20示出的靶标核苷酸序列见于药用大黄,以seqid no:2示出的靶标核苷酸序列见于掌叶大黄;并且以seq id no:3示出的靶标核苷酸序列见于唐古特大黄。在一些实施方式中,所述大黄可选自掌叶大黄、唐古特大黄或药用大黄。
78、在一个方面,本发明提供了用于对大黄或源自大黄的材料进行物种鉴定的引物对,包括:
79、(1)ro_cp_1f:ccaaattgcccgaagcctatg(seq id no:9),和ro_cp_1r:atcgctttccgacccacaat(seq id no:10);
80、(2)rp_cp_1f:gtttaggcggtacgtacataga(seq id no:11),和rp_cp_1r:gatctcagtaagaagggtttacga(seq id no:12);
81、(3)rt_cp_1f:cgctttcgccagtatcattat(seq id no:13);和rt_cp_1r:ccattccacaaagggatcc(seq id no:14);
82、(4)ro_wg_1f:atggcgagagaggtgttcctaaa(seq id no:15);和ro_wg_1r:gttgtgaatccgacacgaccaatat(seq id no:16);
83、(5)ro_wg_2f:gctgtcattcagctgttctctgt(seq id no:18);和ro_wg_2r:gttgtgaatccgacacgaccaatat(seq id no:16);
84、(6)ro_wg_3f:aagctggctgtcattcagct(seq id no:19);和ro_wg_3r:gttgtgaatccgacacgaccaatat(seq id no:16);或者
85、(7)ro_wg_4f:aagctggctgtcattcagct(seq id no:19);和ro_wg_4r:atattggtcgtgtcggattcacaac(seq id no:21)。
86、本发明的上述的引物对能够用于对大黄的物种标准特异性靶标序列进行扩增,从而实现对大黄的物种鉴定。例如,以seq id nos:9-10、15-16、18和16、19和16、以及19和21示出的引物对可优选用于对源自药用大黄的材料进行物种鉴定;以seq id nos:11-12示出的引物对可优选用于对源自掌叶大黄的材料进行物种鉴定;并且以seq id nos:13-14示出的引物对可优选用于对源自唐古特大黄的材料进行物种鉴定。在一些实施方式中,所述大黄可选自掌叶大黄、唐古特大黄或药用大黄。
87、在另一方面,本发明涉及一种用于大黄或源自大黄的材料的物种鉴定的试剂盒,其中,所述试剂盒包含上述的引物对。
88、在一些实施方式中,所述试剂盒还包含pcr反应试剂。在一些优选的实施方式中,所述pcr反应试剂包含:pcr扩增缓冲液、dntps、taq dna聚合酶、mgcl2以及无菌超纯水。
89、在一些实施方式中,所述试剂盒还包含选自如下中的至少一种:taqman探针系统的反应试剂、crispr/cas12a体系反应试剂。
90、在一些优选的实施方式中,所述taqman探针系统的反应试剂包括:dna聚合酶、dntps、缓冲液、mgcl2、无核酸酶水(nuclease-free water)和taqman探针。在具体实施方式中,所述taqman探针的荧光基团包括fam,淬灭基团包括bhq。在具体实施方式中,所述taqman探针以fam-gcttgaatgaaagtcaggcactccgcca-bhq示出。
91、在一些优选的实施方式中,所述crispr/cas12a体系反应试剂包含:基因编辑缓冲液、cas蛋白、crrna、无核酸酶水和荧光信号分子(例如ssdna荧光报告基因)。在具体实施方式中,所述cas12a为lba cas12a(cpf1);所述荧光信号分子包括poly_c_fq(5’-fam-cccccccccc-bhq-3’)。在具体实施方式中,所述crrna可为以seq id nos:5、6、7或8示出的crrna中的任一者。
92、在另一方面,本发明提供了上述引物对或试剂盒在如下方面的应用:鉴定待检测样品中的大黄成分,对大黄或者源自大黄的材料进行物种鉴定,区分源自大黄的中药材与其混伪品,或者用于食品、药品或保健品的安全检测。
93、在一些实施方式中,所述待检测样品可以是大黄、大黄的组织或器官(例如大黄的根或茎)、含有大黄的中药材、或者大黄混伪品。
94、在本发明中,通过获取待检测的样品(例如,大黄、大黄的组织或器官、混伪品、中药材、饮片、中成药、食品、保健品)的基因组dna,并检测所述基因组dna中是否含有指定物种(例如药用大黄)的所述标准特异性靶标序列,从而确定所述待检测的样品与所述指定物种的同一性。
95、在本文中,所述待检测样品可以是来自大黄的样品。在一些示例性的实施方式中,所述待检测的大黄样品可以是来自药用大黄、掌叶大黄或唐古特大黄的样品。在一些实施方式中,所述待检测的大黄样品是单一物种来源的样品或者是多个物种来源的样品的混合物。
96、在本文中,本发明的示例性的实施方案可通过如下的编号段落中的内容进行说明:
97、1.一种基于时珍法的中药鉴定方法,包括:
98、(1)获得中药基原物种的核、叶绿体和线粒体基因组序列,构建小片段基因组文库;
99、(2)从所述小片段基因组文库中提取候选靶标序列并进行分析,从所述候选靶标序列中筛选符合选自筛选条件(a)至(d)中的至少一种的候选序列作为标准特异性靶标序列,所述筛选条件包括:
100、(a)候选序列gc含量为40%-60%;
101、候选序列不能含有四核苷酸及以上重复序列、连续的三核苷酸重复序列、不连续的3个及以上的三核苷酸重复序列;
102、候选序列不能与crrna重复序列互补;
103、候选序列5'端6个核苷酸中g+c含量为30%-80%;
104、候选序列与混伪品及近缘物种的核、叶绿体和线粒体基因组序列进行比对至少含有3个差异核苷酸;和/或
105、候选序列所在区域-50bp到+300bp或-300bp到+50bp内不存在连续4个以上a或gt重复;
106、(b)候选序列及扩增候选序列所在区域的引物中的g+c含量为30%-80%;
107、根据候选序列设计的荧光探针与上下游扩增候选序列所在区域的引物退火温度分别为55℃-60℃以及68℃-70℃,且引物对间退火温度相差不超过2℃;
108、候选序列及扩增候选序列所在区域的引物长度为15-30bp;
109、上下游扩增候选序列所在区域的引物间隔50-150bp且正向引物靠近根据候选序列设计的荧光探针;
110、根据候选序列设计的荧光探针与上下游扩增候选序列所在区域的引物不含发卡结构且引物对不能形成二聚体;
111、上下游扩增候选序列所在区域的引物3'端5bp内g/c碱基不超过两个;
112、根据候选序列设计的荧光探针中的c碱基多于g碱基;和/或
113、候选序列与混伪品及近缘物种的核、叶绿体和线粒体基因组进行比对
114、至少含有2个差异核苷酸;
115、(c)根据候选序列设计的扩增引物gc含量为40%-60%,且四种核苷酸均匀分布,不存在聚嘌呤及聚嘧啶,不含gc富含区;
116、根据候选序列设计的扩增引物长度为18-30bp,引物对间相差不超过3个碱基;
117、根据候选序列设计的扩增引物不含反向重复序列以及大于3bp的自互补序列,引物间不能形成二聚体;
118、根据候选序列设计的扩增引物退火温度为55-60℃,引物对之间的退火温度相差不超过2℃;
119、根据候选序列设计的扩增引物3'端5个碱基中的g/c碱基多于一个但不超过三个;和/或
120、候选序列与混伪品及近缘物种的核、叶绿体和线粒体基因组进行比对至少含有2个差异核苷酸;
121、或者,(d)候选序列所在区域为纯合的;
122、候选序列所在区域的gc含量在30%-80%;
123、候选序列所在区域不能含有四个以上连续的重复核苷酸;
124、候选序列所在区域不能含有甲基化序列;
125、候选序列所在区域不能存在发卡结构;和/或
126、候选序列与混伪品及近缘物种的核、叶绿体和线粒体基因组进行比对至少含有2个差异核苷酸;
127、(3)提取待检测中药样品的基因组dna,任选地对其进行扩增,将所述基因组dna或其扩增产物作为dna底物,利用靶标序列检测系统来检测所述dna底物中是否存在所述标准特异性靶标序列,其中,所述靶标序列检测系统包括crispr/cas12a系统、taqman probe-based real-time pcr系统、pcr系统或者sanger测序系统,其中,对于所述crispr/cas12a系统,通过所述检测若产生明显荧光信号,则所述待检测中药样品与指定的中药基原物种具有同一性,反之则没有;对于所述taqman probe-based real-time pcr系统,通过所述检测若ct值大于37,则所述待检测中药样品与指定的中药基原物种具有同一性,反之则没有;对于所述pcr系统中,通过所述检测若电泳结果产生明显条带,则所述待检测中药样品与指定的中药基原物种具有同一性,反之则没有;对于所述sanger测序系统,若测序结果与所述标准特异性靶标序列相同,则所述待检测中药样品与指定的中药基原物种具有同一性,反之则没有。
128、2.如段落1所述的方法,其中,通过构建基因组图谱或浅层测序获得所述中药基原物种的核、叶绿体和线粒体基因组序列。
129、3.如段落1或2所述的方法,其中,将所述中药基原物种的核、叶绿体和线粒体基因组序列分成l-k+1个长度为k的片段,以构成所述小片段基因组文库,并计算每个片段的拷贝数,再通过与基因组比对确定每个片段的基因组位置,其中l表示基因组序列长度,k表示文库片段长度,其中,k为15-750bp。
130、4.如段落1-3中任一段所述的方法,其中,所述中药基原物种为掌叶大黄、唐古特大黄或药用大黄。
131、5.如段落1-4中任一段所述的方法,其中,所述中药基原物种为药用大黄,所述靶标序列检测系统为crispr/cas12a系统,并且所述标准特异性靶标序列包括以seq id no:1和4示出的靶标核苷酸序列;
132、所述中药基原物种为药用大黄,并且所述靶标序列检测系统为taqman probe-based real-time pcr系统,并且所述标准特异性靶标序列包括以seq id no:17示出的靶标核苷酸序列;
133、所述中药基原物种为药用大黄,并且所述靶标序列检测系统为pcr系统,并且所述标准特异性靶标序列包括以seq id no:19示出的靶标核苷酸序列;或者
134、所述中药基原物种为药用大黄,并且所述靶标序列检测系统为sanger测序系统,并且所述标准特异性靶标序列包括以seq id no:20示出的靶标核苷酸序列。
135、6.如段落1-4中任一段所述的方法,其中,所述中药基原物种为掌叶大黄,所述靶标序列检测系统为crispr/cas12a系统,并且所述标准特异性靶标序列包括以seq id no:2示出的靶标核苷酸序列。
136、7.如段落1-4中任一段所述的方法,其中,所述中药基原物种为唐古特大黄,所述靶标序列检测系统为crispr/cas12a系统,并且所述标准特异性靶标序列包括以seq idno:3示出的靶标核苷酸序列。
137、8.如段落1-7中任一段所述的方法,其中,采用crispr/cas12a系统以seq id nos:5、6、7或8示出的crrna来检测所述dna底物中是否存在所述标准特异性靶标序列。
138、9.如段落1-5中任一段所述的方法,其中,采用taqman probe-based real-timepcr系统以seq id nos:18和16示出的引物对、以及以fam-gcttgaatgaaagtcaggcactccgcca-bhq示出的taqman探针来检测所述dna底物中是否存在所述标准特异性靶标序列。
139、10.如段落1-5中任一段所述的方法,其中,采用pcr系统以seq id nos:19和16示出的引物对来检测所述dna底物中是否存在所述标准特异性靶标序列。
140、11.如段落1-5中任一段所述的方法,其中,采用sanger测序系统为以seq id nos:19和21示出的测序引物对来检测所述dna底物中是否存在所述标准特异性靶标序列。
141、12.如段落1-11中任一段所述的方法,其中,在步骤(4)中,利用特异性扩增标准特异性靶标序列的引物对来扩增待检测中药的基因组dna并回收扩增的标准特异性靶标序列作为dna底物;或者利用特异性扩增包含标准特异性靶标序列的dna序列的引物来扩增待检测基因组dna并回收扩增得到的包含标准特异性靶标序列的dna序列作为dna底物。
142、13.如段落1-8中任一项所述的方法,其中,所述crispr/cas12a系统包括:基因编辑缓冲液、cas12a、crrna、无核酸酶水、dna底物和荧光信号分子。
143、14.如段落1-5和9中任一项所述的方法,其中,所述taqman probe-based real-time pcr系统包括:缓冲液、引物、无核酸酶水、dna底物和taqman探针。
144、15.如段落1-5和10中任一项所述的方法,其中,所述pcr系统包括:缓冲液、正向引物、反向引物、无核酸酶水和dna底物。
145、16.如段落1-5和11中任一项所述的方法,其中,所述sanger测序系统包括:缓冲液、测序引物、无核酸酶水和dna底物。
146、17.大黄的标准特异性靶标核苷酸,其中,所述靶标核苷酸为选自如下的至少一种:(1)以seq id no:1示出的靶标核苷酸;(2)以seq idno:2示出的靶标核苷酸;(3)以seqid no:3示出的靶标核苷酸;(4)以seq id no:4示出的靶标核苷酸;(5)以seq id no:17示出的靶标核苷酸;(6)以seq id no:19示出的靶标核苷酸;或(7)以seq id no:20示出的靶标核苷酸。
147、18.段落17所述的标准特异性靶标核苷酸在对大黄或源自大黄的材料进行物种鉴定、或者区分大黄与其近缘物种中的应用。
148、19.如段落18所述的应用,其中,所述大黄选自掌叶大黄、唐古特大黄或药用大黄。
149、20.一种用于对大黄或源自大黄的材料进行物种鉴定的引物对,包括:
150、(1)seq id no:9和seq id no:10;
151、(2)seq id no:11和seq id no:12;
152、(3)seq id no:13和seq id no:14;
153、(4)seq id no:15和seq id no:16;
154、(5)seq id no:18和seq id no:16;
155、(6)seq id no:19和seq id no:16;或者
156、(7)seq id no:19和seq id no:21。
157、21.如段落20所述的引物对,其中,所述大黄选自掌叶大黄、唐古特大黄或药用大黄。
158、22.一种用于大黄或源自大黄的材料的物种鉴定的试剂盒,其中,所述试剂盒包含段落20或21所述的引物对。
159、23.如段落22所述的试剂盒,其中,所述试剂盒还包含pcr反应试剂。
160、24.如段落23所述的试剂盒,其中,所述pcr反应试剂包含:pcr扩增缓冲液、dntps、taq dna聚合酶、mgcl2以及无菌超纯水。
161、25.如段落22-24中任一段所述的试剂盒,其中,所述试剂盒还包含选自如下中的至少一种:taqman探针系统的反应试剂、crispr/cas12a体系反应试剂。
162、26.如段落25所述的试剂盒,其中,所述taqman探针系统的反应试剂包括:dna聚合酶、dntps、缓冲液、mgcl2、无核酸酶水和taqman探针。
163、27.如段落26所述的试剂盒,其中,所述taqman探针以fam-gcttgaatgaaagtcaggcactccgcca-bhq示出。
164、28.如段落25所述的试剂盒,其中,所述crispr/cas12a体系反应试剂包含:基因编辑缓冲液、cas蛋白、crrna、无核酸酶水和荧光信号分子。
165、29.如段落28所述的试剂盒,其中,所述crrna为以seq id nos:5、6、7或8示出的crrna中的任一者。
166、30.段落20或21所述的引物对或段落22-29中任一段所述的试剂盒在如下方面的应用:鉴定待检测样品中的大黄成分,对大黄或者源自大黄的材料进行物种鉴定,区分源自大黄的中药材与其混伪品,或者用于食品、药品或保健品的安全检测。
167、31.如段落30所述的应用,其中,所述待检测样品是大黄、大黄的组织或器官、含有大黄的中药材、或者大黄混伪品。
168、32.如段落30或31所述的应用,其中,所述待检测的大黄样品是来自药用大黄、掌叶大黄或唐古特大黄的样品。
169、33.如段落30-32中任一段所述的应用,其中,所述待检测的大黄样品是单一物种来源的样品或者是多个物种来源的样品的混合物。
170、以下将结合附图对本发明的示例性方案作进一步说明,以充分说明本发明的目的、技术特征和技术效果。以下附图仅仅是本公开的示例,本发明的保护范围不限于此。
- 还没有人留言评论。精彩留言会获得点赞!