一种无动物源性规模化制备口服五价轮状病毒减毒活疫苗的方法及其应用与流程
本发明属于生物制品,具体涉及一种无动物源性规模化制备口服五价轮状病毒减毒活疫苗的方法及其应用。
背景技术:
1、轮状病毒(rotavirus,简称rv)是一种双链核糖核酸病毒,属于呼肠孤病毒科,轮状病毒是造成婴幼儿急性严重脱水腹泻的主要原因,主要传播途径为粪口传播,同时也存在呼吸道传播。轮状病毒会感染与小肠连结的肠黏膜细胞并且产生肠毒素,肠毒素会引起肠胃炎,导致严重的腹泻,有时候甚至会因为脱水而导致死亡。针对轮状病毒的口服减毒活疫苗在2006年在全球获批使用,虽然疫苗的引入减少了轮状病毒相关死亡人数,但疫苗的有效性并不理想,目前针对轮状病毒感染引起的腹泻还没有特效药物治疗,仅能通过接种疫苗来预防轮状病毒,从而降低新生儿及婴幼儿因轮状病毒感染导致的死亡率。
2、目前,生物反应器运用于大规模培养动物细胞生产包括蛋白质药物、单克隆抗体、病毒疫苗等生物制品。反应器通常具有探针或传感器自动检测活细胞的生长环境。通过通气量、搅拌速度、悬浮均匀程度、ph稳定性、温度变化、罐压、培养体积及溶氧供应等参数控制,对ph、温度、溶解氧、营养素消耗、代谢物积累、血清、生长因子、细胞外基质、剪应力和细胞凋亡等实行计算机自动控制。微载体培养是融合悬浮培养优点的一种特殊的细胞贴壁培养模式。细胞微载体培养的基本特征是细胞贴附于微载体的表面并随微载体悬浮于细胞培养液中。随着生产需求的增长,微载体培养细胞很容易放大。
3、传统轮状病毒疫苗生产过程中,在细胞培养阶段中会使用到血清,血清组分的复杂性和不确定性,以及其中可能存在的病毒等病原微生物,都影响着病毒疫苗的生产工艺和疫苗质量。从病毒疫苗生产工艺角度考虑,血清组分的复杂性和批次间的质量差异增加了病毒疫苗生产的不稳定性和产品质量控制的难度。
4、在细胞消化阶段要用到胰酶消化,目前消化胰酶已有基因胰酶替代动物胰酶,但在病毒激活的时候和病毒培养的时候,也需要用到胰酶去激活和维持培养,而病毒激活和维持培养的胰酶需要一种特别的能切割病毒酶切位点的胰酶,轮状病毒才能感染细胞,获得较高的病毒滴度。传统过程这一步都是猪胰酶才能达到要求。本发明在病毒激活和维持培养阶段,筛选到一种可以替代猪胰酶的基因工程胰酶。
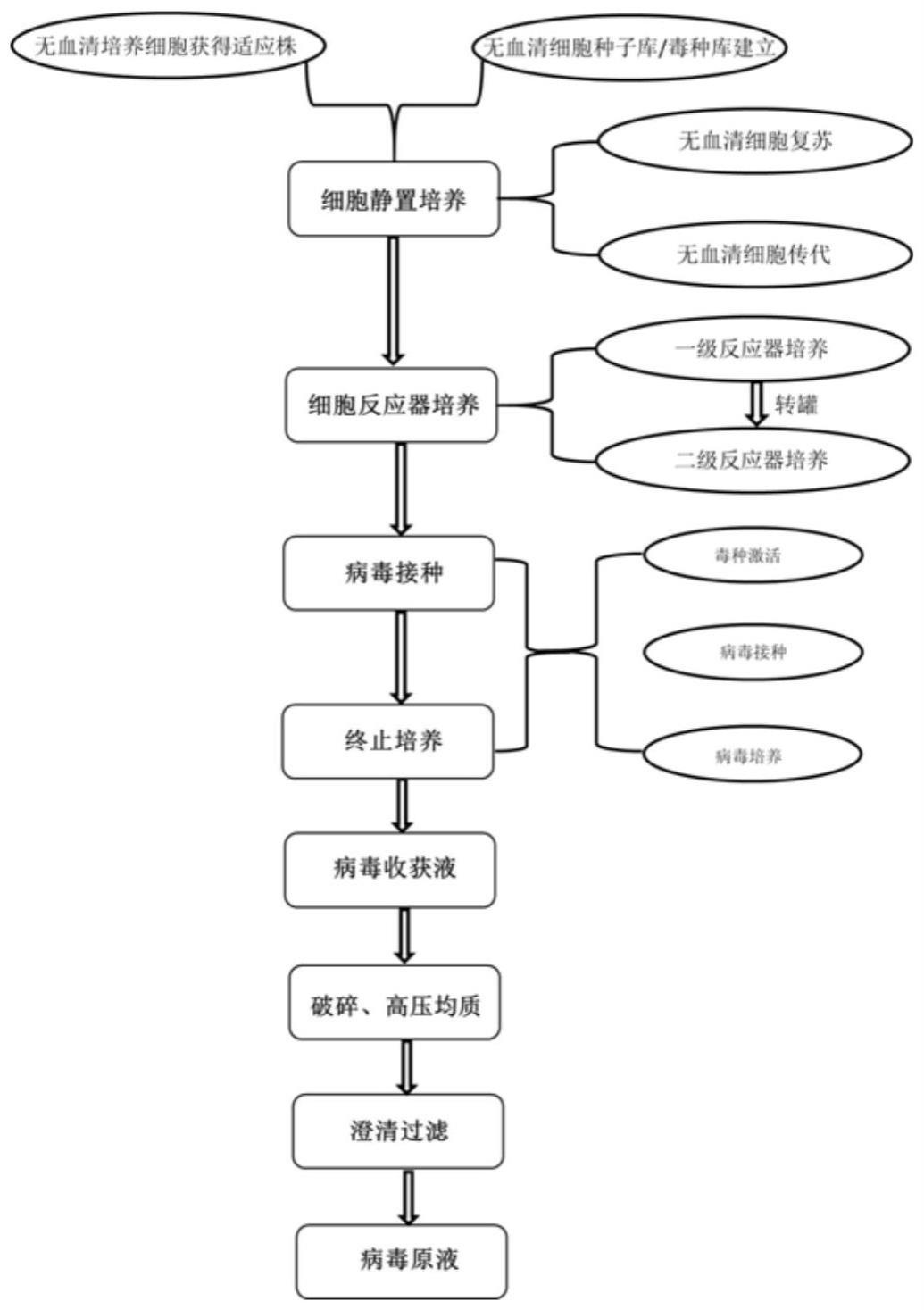
5、因此,提供一种无动物源性成分、安全性高、成本低的轮状病毒减毒活疫苗的制备方法,在预防轮状病毒感染中具有重要的意义。
技术实现思路
1、针对现有技术存在的不足,本发明的目的在于提供一种无动物源性规模化制备口服五价轮状病毒减毒活疫苗的方法及其应用。本发明建立了一种50l转200l微载体生物反应器无动物源性规模化制备口服五价轮状病毒减毒活疫苗的方法,利用无血清微载体反应器工艺去除了传统细胞工厂培养中的冻融工艺,从而使制备的轮状病毒均一性好、病毒滴度高并且无动物源性成分,安全性高,还能降低成本,为轮状疫苗无动物源性规模化生产奠定基础。
2、为达到此发明目的,本发明采用以下技术方案:
3、第一方面,本发明提供了一种无动物源性规模化制备口服五价轮状病毒减毒活疫苗的方法,所述方法包括:
4、分别建立无动物源性轮状病毒毒株种子库和无血清vero细胞种子库;采用无血清微载体悬浮培养vero细胞种子,并进行转罐放大规模培养;采用基因重组胰酶激活轮状病毒工作种子,将激活后的轮状病毒接种到vero细胞中,于生物反应器内用含有基因重组胰酶的病毒维持液培养五价轮状病毒;收获后的轮状病毒收获液经破碎、澄清,加保护剂制成口服五价减毒活疫苗。
5、本发明中,采用的基因重组胰酶为无动物源性基因工程胰酶(hbp000218),在整个工艺中不含动物源性杂质,避免引入外源杂质安全性更高。所述基因重组胰酶能很好地将轮状病毒vp4基因酶切成vp5和vp8基因,有利于病毒感染,从而提高病毒滴度,减少超滤浓缩工艺步骤,降低成本。
6、优选地,所述方法包括如下具体步骤:
7、(1)无血清细胞株的适应:通过无血清培养基进行vero细胞的复苏与适应培养;
8、(2)无血清细胞种子库建立:细胞株适应无血清培养基后进行传代扩增,用基因重组胰酶消化,冻存,建立无血清细胞种子库;
9、(3)无动物源性轮状病毒种子库建立:用基因重组胰酶激活轮状病毒,接种在步骤(2)复苏与传代后的vero细胞上,建立无动物源性轮状病毒毒株种子库;
10、(4)细胞复苏与传代:将种子库的vero细胞用无血清培养基进行复苏培养,用基因重组胰酶消化细胞,进行细胞传代培养;
11、(5)细胞的生物反应器培养:将步骤(4)复苏与传代后的vero细胞在t瓶上培养传代至10层细胞工厂,转接至第一级生物反应器中进行第一级无血清微载体悬浮培养;采用基因重组胰酶进行消化,转罐至第二级生物反应器进行第二级无血清微载体悬浮培养;
12、(6)轮状病毒激活、接种与培养:采用基因重组胰酶激活轮状病毒工作种子,将激活后的轮状病毒接种到vero细胞中,于生物反应器内用含有基因重组胰酶的病毒维持液培养五价轮状病毒;
13、(7)轮状病毒液的收获:待微载体上细胞病变cpe≥75%进行收获,过滤收集培养液上清,加入蔗糖保护剂制成病毒收获液;
14、(8)轮状病毒纯化:病毒收获液经破碎、澄清过滤后制成轮状病毒原液。
15、优选地,步骤(1)中,所述无血清培养基为cellin vero无血清培养基。
16、优选地,步骤(1)中,所述复苏与适应培养的条件为:38-40℃(例如可以是38℃、39℃或40℃等)、水浴1-4min(例如可以是1min、2min、3min或4min等)复苏,37-39℃(例如可以是37℃、38℃或39℃等)进行适应性培养。
17、优选地,步骤(2)中,所述无血清细胞种子库采用包括如下步骤的方法建立:
18、vero细胞株适应无血清培养基后,使用无血清培养液进行细胞传代,取p145-p146代细胞接种至t225培养瓶中,待细胞生长至致密单层用基因重组胰酶消化,用无血清冻存液重悬分装冻存,建立无血清细胞种子库。
19、优选地,步骤(4)中,所述细胞复苏与传代采用包括如下步骤的方法进行:
20、将无血清细胞种子库细胞水浴化冻,加入到装有细胞复苏液的培养容器中复苏培养,进行换液再培养,培养至vero细胞长成致密单层;细胞长至致密单层后经pbs清洗、胰蛋白酶消化、重悬后进行传代培养。
21、优选地,所述水浴化冻的温度为:38-40℃,例如可以是38℃、39℃或40℃等。
22、优选地,所述复苏培养的条件为:36-38℃(例如可以是36℃、37℃或38℃等)环境中培养4-24h(例如可以是4h、8h、12h、16h、20h或24h等)。
23、优选地,所述换液再培养的条件为:37-39℃(例如可以是37℃、38℃或39℃等)环境中培养4-6天(例如可以是4天、5天或6天等)。
24、优选地,所述传代培养的传代比例为1:3-1:8,例如可以是1:3、1:4、1:5、1:6、1:7或1:8等。
25、优选地,步骤(5)中,所述细胞的生物反应器培养采用包括如下步骤的方法进行:
26、将步骤(4)复苏与传代后的vero细胞在t瓶上培养传代至10层细胞工厂,将经过t瓶上培养传代后的vero细胞接种到第一级生物反应器中并进行第一级无血清微载体悬浮培养,采用换液的方式进行培养,直至细胞长满致密单层,将第一级培养后的vero细胞用基因重组胰酶进行消化,转罐至第二级生物反应器进行第二级无血清微载体悬浮培养。
27、优选地,所述微载体的类型为cytiva公司的codexⅰ;所述微载体的使用量为10-16g/l,例如可以是10g/l、11g/l、12g/l、13g/l、14g/l、15g/l或16g/l等。
28、优选地,所述第一级生物反应器的容量为50l。
29、优选地,所述第一级无血清微载体悬浮培养中接种量为5-7×105个/ml,例如可以是5×105个/ml、6×105个/ml或7×105个/ml等,接种后5-25min(例如可以是5min、10min、15min、20min或25min等)取样计数,细胞密度不低于5×105个/ml。
30、优选地,所述第一级无血清微载体悬浮培养的条件为:培养温度为36-38℃(例如可以是36℃、37℃或38℃等),do为10-110%(例如可以是10%、20%、50%、80%、100%或110%等),搅拌转速为30-60rpm(例如可以是30rpm、40rpm、50rpm或60rpm等),ph为7.0-7.8(例如可以是7.0、7.2、7.4、7.6或7.8等)。
31、优选地,所述重组胰酶的消化条件为:在温度为36-38℃(例如可以是36℃、37℃或38℃等),搅拌转速为20-40rpm(例如可以是20rpm、30rpm或40rpm等)的条件下消化20-40min(例如可以是20min、30min或40min等)。
32、优选地,所述第二级生物反应器的容量为200l。
33、优选地,所述第二级无血清微载体悬浮培养的条件为:培养温度为36-38℃(例如可以是36℃、37℃或38℃等),do为10-110%(例如可以是10%、20%、50%、80%、100%或110%等),搅拌转速为30-60rpm(例如可以是30rpm、40rpm、50rpm或60rpm等),ph为7.0-7.8(例如可以是7.0、7.2、7.4、7.6或7.8等)。
34、优选地,所述第一级无血清微载体悬浮培养和第二级无血清微载体悬浮培养采用的培养基为cellin vero无血清培养基。
35、本技术中,在发酵培养过程中采用了两级无血清微载体悬浮培养,通过反应器放大,与细胞工厂工艺放大对比,反应器放大不仅操作简单、细胞大量培养同时降低了人工操作污染的风险。
36、优选地,步骤(6)中,所述细胞接种病毒时细胞密度为7-9×106个/ml(例如可以是7×106个/ml、8×106个/ml或9×106个/ml等)。
37、优选地,步骤(6)中,所述病毒维持液中基因重组胰酶的终浓度为0.5-1.5μg/ml(例如可以是0.5μg/ml、0.6μg/ml、0.8μg/ml、1.0μg/ml、1.2μg/ml或1.5μg/ml等)。
38、优选地,步骤(6)中,所述接种的moi为0.1-0.8(例如可以是0.1、0.3、0.5或0.8等)。
39、优选地,步骤(6)中,所述培养基为cellin vero无血清培养基。
40、优选地,步骤(6)中,所述培养的时间为2-4天(例如可以是2天、3天或4天等)。
41、优选地,步骤(8)中,所述破碎采用高压均质破碎进行,所述高压均质破碎的功率为400-500w(例如可以是400w、450w或500w等)。
42、优选地,步骤(8)中,所述澄清过滤采用0.2-20μm滤器进行(例如可以是0.2μm、10μm或20μm等)。
43、第二方面,本发明提供了第一方面所述的无动物源性规模化制备口服五价轮状病毒减毒活疫苗的方法在制备减毒活疫苗中的应用。
44、本发明所述的数值范围不仅包括上述列举的点值,还包括没有列举出的上述数值范围之间的任意的点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
45、相对于现有技术,本发明具有以下有益效果:
46、(1)运用生物反应器进行轮状病毒制备相比传统细胞工厂工艺来说,使用生物反应器进行细胞培养可以进行细胞悬浮培养,从而可以使病毒产量得到大幅度提高。
47、(2)生物反应器培养vero细胞操作更加简单,在操作的过程中污染更小,便于实现自动化控制,能对细胞培养过程实现实时监控,使整个生产条件稳定可控;
48、(3)使用生物反应器进行细胞培养的培养环境较为均一,可以稳定提高产品的质量,降低产品的批间差异,使产品的稳定性及效力明显优于使用细胞工厂培养获得的产品。
49、(4)生物反应器在病毒收获时,细胞均从微载体上脱落,只进行细胞上清液的收获;去除传统冻融工艺降低疫苗生产成本,减少人员操作。
50、(5)去除了动物源性血清(牛血清)以及动物源性胰酶,减少了潜在的病毒外源因子污染;降低了批次间的质量差异,降低了病毒疫苗生产的不稳定性和产品质量控制的难度。
51、(6)病毒激活和病毒培养用基因重组胰酶是一种特殊的基因工程胰酶,能很好地将轮状病毒vp4基因酶切成vp5和vp8基因,有利于病毒感染,从而提高病毒滴度,减少超滤浓缩工艺步骤,降低成本。
- 还没有人留言评论。精彩留言会获得点赞!