孔板和包括所述孔板的3D细胞培养板的制作方法
本发明涉及一种孔板和包括所述孔板的3d细胞培养板。更具体地,本发明涉及用于生产尺寸均匀的类器官的孔板和包括所述孔板的3d细胞培养板。
背景技术:
1、将已分化的体细胞恢复为未分化状态的细胞(例如干细胞)的过程称为重编程。诱导性多能干细胞(ipsc)也称为逆向分化的干细胞和逆向分化的多能干细胞,重编程是使用重编程因子(oct4、klf4、sox2、c-myc等)将体细胞转化为干细胞(非专利文献1和2)。
2、诱导性多能干细胞在诸如细胞治疗剂、生物组织工程、新药开发、毒理学和精准医学等领域具有广泛的应用。这些应用需要培养大量高效、高质量的诱导性多能干细胞和胚胎干细胞,并且要求在相同效率的情况下,干细胞大小均一,但事实上,对这种大量生产技术的研究还不够充分。此外,迄今为止,重编程诱导性多能干细胞的效率也相当低。近来对临床应用的方法进行了很多研究,即不整合外源基因的方法,也即不实现dna整合的方法,其中尝试通过例如游离型载体等方法来生产诱导性多能干细胞,但是这一系列生产方法存在3d培养方法的效率和体细胞的重编程效率也较低的问题。
3、此外,对于诱导性多能干细胞重编程,将2d细胞培养板底部涂覆水凝胶并使用,但很少形成集落,即使在细胞重编程后形成集落,集落也不易分离,这不仅对研究目的来说是障碍,而且对商业化来说也是障碍。此外,由于在现有方法的情况下几乎不可能生产大量克隆,因此难以稳定地确保在通过现有方法重编程为诱导性多能干细胞的状态下的克隆。此外,还需要一种能够轻松筛选诱导性多能干细胞的平台。
4、同时,韩国专利第10-1756901号(专利文献1)公开了一种能够培养3d组织细胞的细胞培养芯片。在专利文献1的细胞培养芯片中,第1培养部、第2培养部和第3培养部在各层中形成,并且能够在各层确认细胞增殖的进展程度。但是,专利文献1的细胞培养芯片存在不能以高收率获得球状体和/或类器官的问题。
5、此外,存在在进行细胞培养的过程中更换培养液的移液作业的情况,在能够进行3d细胞培养的corning球状体微孔板的情况下,细胞培养中的球状体或类器官会受到影响,使得因为存在在移液作业的过程中球状体或类器官会被吸起或位置发生变化的情况,而存在不利于细胞培养环境的问题。
6、基底胶(matrigel)(bd bioscience的产品名)是从engelbreth-holm-swarm(ehs)小鼠的肉瘤细胞中提取的蛋白质复合物,含有诸如层粘连蛋白、胶原蛋白和硫酸乙酰肝素蛋白多糖的胞外基质(ecm),以及诸如成纤维细胞生长因子(fgf)、表皮生长因子(efg)、胰岛素样生长因子(igf)、转化生长因子-β(tgf-β)和血小板衍生生长因子(pdgf)的生长因子。形成基底胶的复合物通过提供在许多组织中发现的复杂的胞外环境而被用作细胞培养的基质。
7、由于基底胶来源于小鼠肉瘤,因此存在转移免疫原和病原体的高风险。此外,虽然基底胶用于细胞生长和组织形成,但也有批评认为,由于基底胶是一种复杂的材料,因此细胞再现性存在很大问题。目前还不清楚基底胶是否只是充当被动3d支架,为生长中的球状体提供物理支持,或者基底胶是否通过提供生物学必需要素而主动影响球状体的形成。此外,基底胶也很昂贵。因此,虽然基底胶是对细胞培养技术领域的发展做出贡献的材料,但也存在基底胶阻碍该技术领域发展的事实。
8、因此,本发明人在不使用水凝胶的情况下对通过提高干细胞的重编程效率以大量培养干细胞的技术进行了持续研究,从而完成了本发明。
9、[相关技术文献]
10、[专利文献]
11、1.韩国专利第10-1756901号
12、[非专利文献]
13、1.takahashi k,yamanaka s.通过确定因子由小鼠胚胎和成体成纤维细胞培养物诱导多能干细胞(induction of pluripotent stem cells from mouse embryonic andadult fibroblast cultures by defined factors).cell.2006;126:663-676。
14、2.takahashi k,tanabe k,ohnuki m,narita m,ichisaka t,tomoda k,yamanakas.通过确定因子由成人成纤维细胞诱导多能干细胞(induction of pluripotent stemcells from adult human fibroblasts by defined factors).cell.2007;131:861-872。
技术实现思路
1、技术问题
2、本发明的目的是提供一种干细胞增殖方法。
3、然而,本发明要解决的技术问题不限于上述问题,本领域技术人员可以通过以下描述清楚地理解未提及的其他问题。
4、技术方案
5、为实现所述目的,本发明提供了一种干细胞增殖方法,该方法包括:
6、i)培养细胞;
7、ii)制备用于生产干细胞的无水凝胶的3d细胞培养板;
8、iii)在所述无水凝胶的3d细胞培养板中将培养的细胞重编程为干细胞;
9、iv)形成重编程的干细胞的球状体;
10、v)制备用于继代培养的无水凝胶的3d细胞培养板;和
11、vi)通过分离球状体在所述无水凝胶的3d细胞培养板中继代培养球状体一次或多次,
12、其中,3d细胞培养板包括:
13、孔板,所述孔板包括多个主孔和多个子孔(sub well),所述多个子孔形成在主孔的下部以注入细胞培养液并且包括在其底表面上的凹入部;和支持所述孔板的用于大容量和高速高内涵筛选(hcs)的连接件,并且
14、用于高内涵筛选(hcs)的连接件包括配备有固定装置以与所述孔板的下端连接并且从所述孔板的下端分离的底座以及位于所述孔板的上部以连接到所述底座的盖,所述主孔具有形成为在预定位置逐渐变细的台阶,所述台阶相对于主孔的壁具有10°至60°的倾斜角(θ)。
15、细胞可以是体细胞或干细胞。
16、体细胞可以是成纤维细胞,但不限于此,可以使用本领域已知的任何体细胞。
17、干细胞可以是选自由成体干细胞、胚胎干细胞、间充质干细胞、脂肪源性干细胞、造血干细胞、脐带血干细胞和诱导性多能干细胞组成的组中的一种或多种,并且不是限于此,并且只要是本领域已知的干细胞都可以使用。
18、细胞可以在一般的2d孔板、3d细胞培养板或根据本发明的3d板中培养。
19、水凝胶可以是基于胞外基质的水凝胶。
20、基于胞外基质的水凝胶可以是基底胶(matrigel)(产品名)。
21、继代培养可以是继代培养1至20代,但不限于此。
22、在步骤vi)中,可以将球状体分离成单细胞并且将单细胞继代培养一次或多次。
23、3d细胞培养板的子孔可以具有形成为朝向凹入部逐渐变细的倾斜表面,子孔的上端直径可以为3.0mm至4.5mm,凹入部的上端直径可以为0.45mm到1.5mm,子孔和凹入部之间的倾斜表面(θ2)可以在40°到50°的范围内,并且子孔的直径与凹入部的直径的长度比可以为1:0.1至1:0.5。
24、3d细胞培养板的主孔的个体体积可以为100μl至300μl,凹入部的个体体积可以为20μl至50μl,主孔与凹入部的个体体积比可以平均为1:0.1至1:0.5。
25、主孔包括台阶和子孔之间的空间部,空间部的高度(ah)可以平均为2.0mm至3.0mm,子孔的高度(bh)可以平均为1.0mm到2.0mm,空间部与子孔的高度比(ah:bh)可以为1:0.3至1:1。
26、体细胞可以以100至1000个细胞/孔接种在细胞培养板的子孔中。
27、在下文中,将详细描述本发明。
28、由于本发明可以以各种形式进行修改并且包括各种示例性实施方式,因此将在附图中示出具体的示例性实施方式并且在具体实施方式中进行详细描述。
29、但是,该描述并不旨在将本发明限制于具体的实施方式,并且应当理解,本发明的构思和技术范围所包含的所有变化、等同物和替代物均包含在本发明中。当确定在描述本发明时对相关公知技术的详细描述可能使本发明的主旨模糊不清时,将省略其详细描述。
30、本技术中使用的术语仅用于描述具体实施方式,并不旨在限制本发明。除非上下文另有明确说明,否则单数表达包括复数表达。
31、在本发明中,术语“包括”或“具有”意在表示说明书中描述的特征、数量、步骤、操作、构成要素、部分或其任意组合的存在,并且应理解为不排除存在或添加一种或多种其他特征或数量、步骤、操作、构成要素、部件或其任意组合的可能性。
32、通常,当培养细胞、球状体、类器官等时,使用水凝胶来提供胞外基质的作用。通常,当使用2d板或3d细胞培养板对诱导性多能干细胞进行重编程时,将细胞培养板涂覆基于胞外基质的水凝胶(例如,基底胶)并使用。
33、然而,本发明提供了一种使用不包括水凝胶的3d细胞培养板生产诱导性多能干细胞的方法。下面对本发明的3d细胞培养板进行具体说明。
34、在示例性实施方式中,本发明使用3d细胞培养板,所述3d细胞培养板包括:
35、孔板,所述孔板包括多个主孔和多个子孔,所述多个子孔形成在主孔的下部以注入细胞培养液并且包括在其底表面上的凹入部;和
36、支持所述孔板的用于大容量和高速高内涵筛选(hcs)的连接件,
37、其中,用于高内涵筛选(hcs)的连接件包括配备有固定装置以与所述孔板的下端连接并且从所述孔板的下端分离的底座以及位于所述孔板的上部以连接到所述底座的盖,
38、所述主孔具有形成为在预定位置逐渐变细的台阶,所述台阶相对于主孔的壁具有10°至60°的倾斜角(θ)。
39、相关技术中的96孔板的问题在于,为了评价高收率药物的功效,需要进行数次或更多的实验和分析,因此花费大量时间和成本。此外,在通常进行的细胞培养过程中更换培养液的移液作业的情况是存在的,在相关技术的corning球状体微孔板的情况下,细胞培养中的球状体或类器官会受到影响,使得因为存在在移液作业的过程中球状体或类器官被吸起或位置发生变化的情况,而存在不利于细胞培养环境的问题。
40、因此,本发明致力于解决上述问题,并提供一种细胞培养板,该细胞培养板通过在孔板的多个主孔中包括多个子孔,从而能够以高收率制造球状体/类器官,并且该细胞培养板通过包含支持孔板的用于大容量和高速高内涵筛选(hcs)的连接件,以减少捕获大容量和高速图像时的容差,从而能够均匀地捕获孔板中的图像。此外,本发明提供一种细胞培养板,该细胞培养板能够将更换培养基期间的移液作业对通过主孔的台阶培养的细胞的影响降至最低。
41、在下文中,将参照附图详细描述本发明的优选示例性实施方式。在描述之前,说明书和权利要求书中使用的术语或词语不应被解释为限于一般或字典含义,而应根据发明人可以适当地定义术语的概念以便以最佳方法描述他/她自己的发明的原则,而解释为符合本发明的技术精神的含义和构思。
42、因此,由于本说明书中描述的示例性实施方式和附图中所示的构造仅是本发明的最优选的示例性实施方式并且不代表本发明的全部技术精神,因此应当理解,在提交本技术时,可以替换示例性实施方式和构造的各种等效物和修改示例是可能的。
43、图1中的(a)是根据本发明的示例性实施方式的细胞培养板的正视图;图1中的(b)是根据本发明的示例性实施方式的细胞培养板的截面视图;图2是示出在根据本发明的示例性实施方式的细胞培养板中形成的主孔的视图;图3是示出根据本发明的示例性实施方式的细胞培养板的孔板、底座和盖的视图((a)盖,(b)底座,和(c)微孔板和底座的固定装置)。
44、在下文中,将参照图1至图3详细描述根据本发明的示例性实施方式的细胞培养板。
45、如图1至图3所示,根据本发明的示例性实施方式的细胞培养板10包括:孔板100,孔板100包括多个主孔110和多个子孔120,多个子孔120形成在主孔110的下部以注入细胞培养液并且包括在其底表面上的凹入部121;和支持孔板100的用于大容量和高速高内涵筛选(hcs)的连接件200。
46、首先,将详细描述根据本发明的示例性实施方式的孔板100。
47、孔板100通过模具注塑成型制成板状。为了制造如上所述的用于注塑的模具,主孔110具有作为孔结构的重复图案,从而可以降低生产的单位成本并且可以通过精细加工来容易地增加尺寸。因此,细胞容易量产,并且可以根据用户的要求将细胞转化成各种尺寸并使用。
48、孔板100中形成有多个主孔110,每个主孔110包括台阶101。台阶101在主孔110的预定位置处形成,更具体地,台阶101可以在主孔110总长度的1/3至1/2的位置处形成,台阶101可以在距主孔110下端的总长度的1/3至1/2的位置处形成。
49、在相关技术中,存在在进行的细胞培养过程中更换培养液的移液作业的情况,在这种情况下,细胞培养中的球状体或类器官会受到影响,使得因为存在在移液作业的过程中球状体或类器官被吸起或位置发生变化的情况,而存在不利于细胞培养的问题,但设置台阶101以防止该问题。
50、台阶101可以是放置移液器的空间,具体地,可以相对于主孔110的壁具有10°至60°的倾斜角(θ)。可替代地,台阶101的倾斜角可以在20°至50°的范围内,优选地在30°至45°的范围内。当台阶101的倾斜角小于10°时,主孔110内的倾斜角太小,以至于可放置移液器的空间不足,结果,当主孔110中的培养液被吸起时,移液器可能在子孔120内滑动,导致球状体或类器官被吸起,或者其位置等发生变化。此外,在倾斜角(θ)超过60°的情况下,虽然设置了可放置移液器的空间,但台阶101的倾斜角过大,以至于可能难以充分吸取培养液,并且在子孔120上接种细胞时,可能会出现细胞接种在台阶101上而没有进入所有子孔120的问题。因此,期望具有上述范围内的倾斜角。
51、同时,根据本发明的示例性实施方式的主孔可以包括下文将描述的在台阶101和子孔120之间的空间部130。具体而言,空间部130是注入培养液的空间,并且是子孔120内的细胞能够共享同一培养液的空间。
52、更具体地,空间部130的高度(ah)可以平均为2.0mm至3.0mm,或2.2mm至2.8mm,或者2.3mm至2.7mm。此外,子孔120的高度(bh)可以平均为1.0mm到2.0mm,或者平均为1.2mm到1.8mm。
53、例如,空间部130的高度(ah)可以平均为2.5mm,并且子孔的高度(ah)可以平均为1.5mm。
54、在这种情况下,空间部与子孔的高度比(ah:bh)可以为1:0.3到1:1,更具体地,空间部与子孔120的高度比(ah:bh)可以为1:0.4至0.9或1:0.5至0.8。当子孔120的高度与空间部的高度比小于1:0.3时,在更换子孔120的培养基的过程中,即使用很小的力,培养中的细胞也可能从内部逸出,当子孔120的高度与空间部的高度比超过1:1时,细胞所需的培养液不能得到充分更换,从而可能导致细胞死亡。因此,空间部130和子孔120优选具有上述范围的高度和高度比。
55、接下来,子孔120在每个主孔110的下部形成并且包括在其底表面上的凹入部121。作为特定方面,子孔120可以包括在主孔110的下部的多个凹入部。
56、被包括在主孔110下部的子孔120具有相同的尺寸和形状,从而能够在均匀的条件下产生球状体和类器官。
57、子孔120可以具有形成为朝向凹入部121逐渐变细的倾斜表面。具体地,子孔120的上部的水平面积可以随着其沿垂直方向下降而变小。例如,子孔120的上部可以形成为倒金字塔形。在图示的示例性实施方式中,子孔120的上部可以形成为诸如金字塔形或漏斗形的形状,其中子孔120的上部的水平面积随着其沿垂直方向下降而变小。
58、特别地,细胞培养板可以通过包括具有相同的尺寸和形状的多个子孔120,在均匀的条件下产生大量的球状体或类器官。
59、作为特定方面,一个主孔110可以包括4至25个相同尺寸的子孔120,整个微孔板100可以包括96至1,728个子孔120。因此,可以以相同的精确方式控制尺寸。
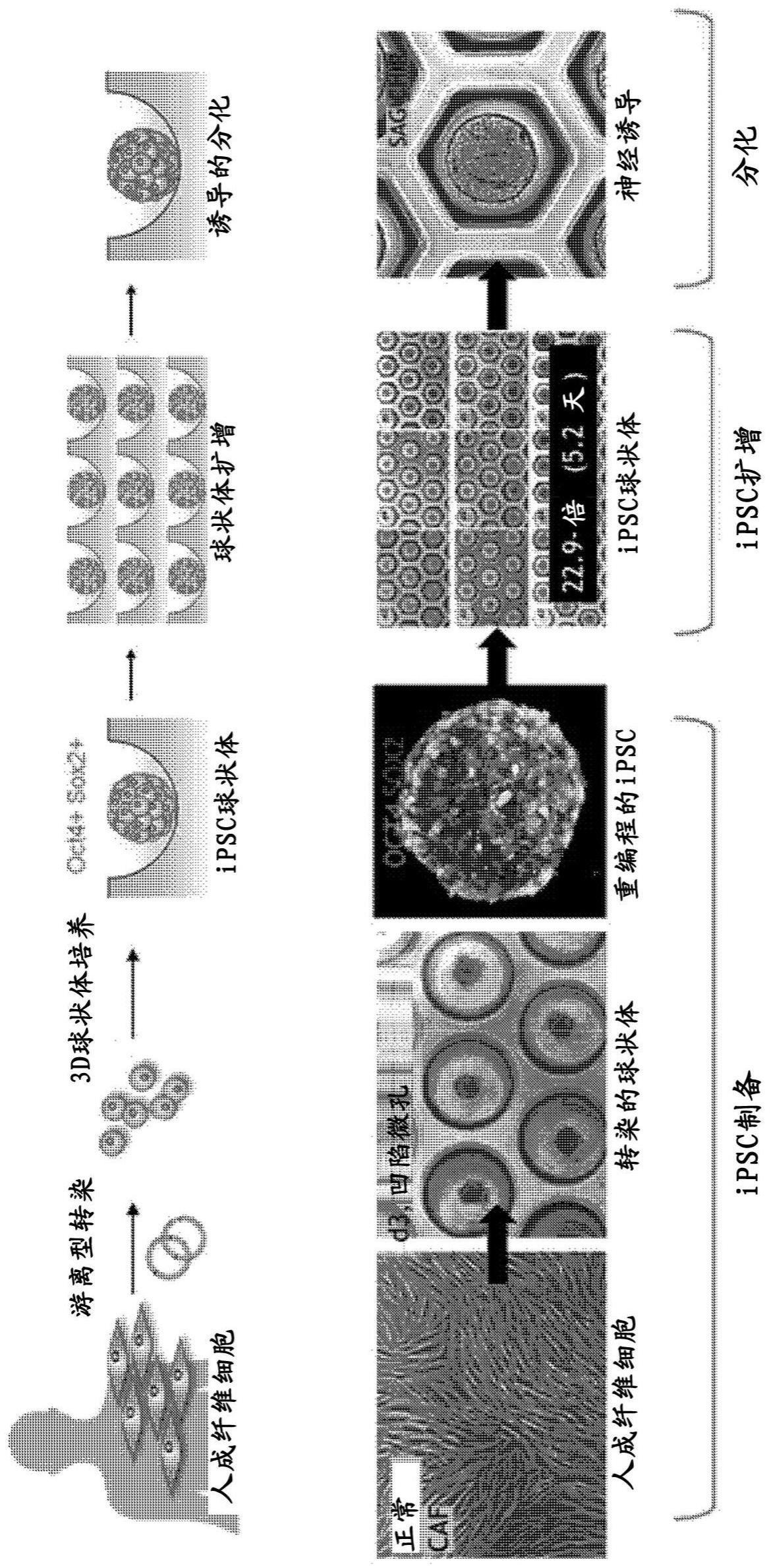
60、此外,子孔120包括凹入部121,并且在凹入部的下部形成空间,使得可以在凹入部121中培养3d球状体或类器官。具体地,凹入部121可以是字母“u”、“v”或“ц”的形式,例如,凹入部121可以是字母“u”的形式。
61、子孔120的上端直径可以为3.0mm至4.5mm,或3.5mm至4.3mm,或平均为4mm。此外,凹入部121的上端直径可以为0.45mm至1.5mm,或0.5mm至1.0mm,或平均为0.5mm。
62、此外,子孔120的直径与凹入部121的直径的长度比可以为1:0.1至0.5,优选地,子孔120的直径与凹入部121的直径的长度比可以为1:0.12。
63、当凹入部121的上端直径与子孔120的上端直径1相比小于0.1时,不能充分提供凹入部121的细胞培养空间,这可能引起在更换培养液的过程中,即使用很小的力细胞也会逸出的问题,而当凹入部121的上端直径与子孔120的上端直径1相比超过0.5时,无法更换细胞所需的足量培养液,这可能引起难以稳定培养细胞的问题。
64、同时,子孔120和凹入部121之间的倾斜表面相对于主孔的壁的倾斜角(θ2)可以为40°至50°、42°至48°、43°至47°,或者倾斜角(θ2)平均为45°。
65、上述子孔120具有能够以100~1000个细胞/孔以下培养细胞和能够稳定地控制球状体尺寸的优点。
66、此外,根据本发明的示例性实施方式的主孔110的个体体积可以为100μl至300μl,凹入部121的个体体积可以为20μl至50μl,以及主孔110与凹入部121的个体体积比可以被表征为平均为1:0.07至0.5。优选地,根据示例性实施方式的主孔的个体体积可以为250μl至300μl,凹入部的个体体积可以为25μl至35μl,以及主孔110与凹入部121的个体体积比可以平均为1:0.11。
67、具体而言,当主孔110的个体体积小于100μl时,会出现在细胞培养过程中不能容纳足够的培养液的问题,当个体体积超过300μl时,培养效率可能会降低。
68、另外,凹入部121是实质上培养细胞的空间,当体积小于20μl时,细胞培养空间不足,这可能会导致细胞逸出的问题,当体积超过50μl时,可能会出现难以稳定培养细胞等问题。因此,主孔110和凹入部121优选具有在上述范围内的体积。
69、由于本发明的细胞培养板的上述构造,在不包括水凝胶的情况下,重编程为诱导性多能干细胞的效率很高,即,不使用水凝胶涂覆细胞培养板,球状体在重编程后也形成良好。
70、此外,当在本发明的细胞培养板中分离和继代培养球状体时,球状体形成得非常好。具体而言,可以通过将球状体分离成单细胞并继代培养单细胞来产生数百至数千个单克隆诱导性多能干细胞。
71、根据本发明的示例性实施方式的细胞培养板10包括支持所述孔板100的用于大容量和高速高内涵筛选(hcs)的连接件200。在此,用于大容量和高速高内涵筛选(hcs)的连接件200是指连接到高内涵筛选(hcs)系统的连接件200,具体地,在本发明中,连接件可以指底座210和盖220。
72、更具体地,用于大容量和高速高内涵筛选(hcs)的连接件包括配备有固定装置140和240以与孔板100的下端连接并且从孔板100的下端分离的底座210以及位于孔板100上部以连接到底座210的盖220。另外,底座210的上端和孔板100的下端被表征为,包括可以固定的固定装置140和240以使彼此连接并且分离。
73、在这种情况下,底座包括用于支持孔板100的凸起部240,孔板100可以包括面对底座210的凸起部240的凹陷部140。孔板100可以通过固定装置被固定以在筛选期间均匀地捕获图像。
74、底座可由聚乙烯、聚丙烯、聚苯乙烯、聚对苯二甲酸乙二醇酯、聚酰胺、聚酯、聚氯乙烯、聚氨酯、聚碳酸酯、聚偏二氯乙烯、聚四氟乙烯、聚醚醚酮或聚醚酰亚胺材料形成,但不限于此。
75、孔板可以由聚二甲基硅酮、高脂改性硅酮、甲基氯苯基硅酮、烷基改性硅酮、甲基苯基硅酮、硅酮聚酯或氨基改性硅酮材料形成,但不限于此。
76、同时,当在本发明的细胞培养板10中形成诱导性多能干细胞时,不需要使用基底胶(matrigel)。
77、图4示出了用使用基底胶的2d细胞培养板生产诱导性多能干细胞的方法与用根据本发明的不需要基底胶的3d细胞培养板生产诱导性多能干细胞的方法的比较。培养体细胞(成纤维细胞)后,通过电穿孔用游离型载体转染成纤维细胞以诱导重编程,从而生产诱导性多能干细胞。在2d基底胶培养的情况下,诱导性多能干细胞的集落的收集过程复杂,并且收率低。然而,当使用本发明的3d培养板时,没有基底胶,因此许多重编程为诱导性多能干细胞的单细胞聚集形成球状体,即3d球状细胞聚集体。该球状体可以很容易地从3d细胞培养板中分离出来,并且可以进行继代培养(图7中的(d))。即,重编程效率非常高。
78、此外,如先前所述,对于本发明中使用的3d细胞培养板,一个主孔110可以包括4至25个相同尺寸的子孔120,整个微孔板100可以包括96至1,728个子孔120。因此,可以大量生产可以以相同的精确方式控制尺寸的诱导性多能干细胞及其球状体。
79、图10示意性地示出了大量增殖在诱导性多能干细胞重编程步骤中获得的诱导性多能干细胞球状体的方法。可以看出,与2d细胞培养板(涂有基底胶)相比,本发明的诱导性多能干细胞的增殖率非常高。此外,当将球状体分离成单细胞,再将单细胞铺板,继而继代培养时,可产生成百上千个大小均匀的单克隆球状体,从而也可产生诱导性多能干细胞球状体库。
80、[有益效果]
81、根据本发明的生产方法,无需水凝胶即可大量增殖重编程效率提高的干细胞。进一步地,可以生产单克隆干细胞球状体库。
- 还没有人留言评论。精彩留言会获得点赞!