一种快速检测单增李斯特菌的引物组、试剂盒及检测方法与流程
本发明涉及微生物快速检测,具体涉及一种快速检测单增李斯特菌的引物组、试剂盒及检测方法。
背景技术:
1、单增李斯特菌属于李斯特菌属,是唯一可使人类致病的李斯特氏菌,其生存环境可塑性很大,能在2~42℃温度范围下生存,不易被冻融,可在冰箱冷藏室内较长时间生长繁殖,同时能耐受较高的渗透压,在酸性、碱性条件下均都能适应。单增李斯特菌广泛存在于土壤、地面水、冰箱内、牛奶及奶制品、蔬菜、水产品和肉制品中。感染后,健康成人可能出现轻微类似流感症状,易感者突然发热、剧烈头痛、恶心、呕吐、腹泻,还可引起胃肠炎、败血症、脑膜炎等,可造成孕妇流产、死胎,死亡率可达20%~30%,严重影响人们的生命安全,2000年,世界卫生组织(who)将其列为需要重点监测的食源性致病菌之一。因此,需要加强食品中对单增李斯特菌的检测。
2、传统的单增李斯特菌检测方法为微生物培养法,我国制定了其检验国家标准gb4789.30-2016《食品安全国家标准食品微生物学检验单增李斯特菌检验》,规范了单增李斯特菌的检测方法,但该传统检测方法需要5天以上才能获得结果,且操作繁琐,费时费力,灵敏度和特异性均较低,尤其对于来源相近的李斯特氏菌菌株,较难区分,已不能满足我国公共卫生突发事件应急检测的需要。因此近年来众多研究者对各个微生物快速检测技术进行了探索研究,以期建立高效的检测方法。
3、与微生物培养法相比,分子生物学方法可以有效的缩短检测时间,且具有较高的特异性和灵敏度,目前针对单增李斯特菌的分子检测技术主要有pcr、实时荧光pcr、环介导核酸等温扩增(loop-mediated isothermal amplification,lamp)和滚环扩增(rollingcircle amplification,rca)等,各个方法均有其优点,但也存在其相应的不足之处:pcr扩增需要借助温度设备进行反复的升温降温操作,过度的依赖于精密的温度控制仪器,很难适用于现场检测场景;lamp等温核酸扩增虽应用较多,但需设计6条引物完成扩增,引物设计难度大,且容易形成气溶胶污染;rca等温核酸扩增则需要人为的环化dna模板4h,费时费力,无法实现真正的等温核酸扩增。因此,仍需研发更快速、高效、便捷的核酸扩增方法用于微生物的日常检测。
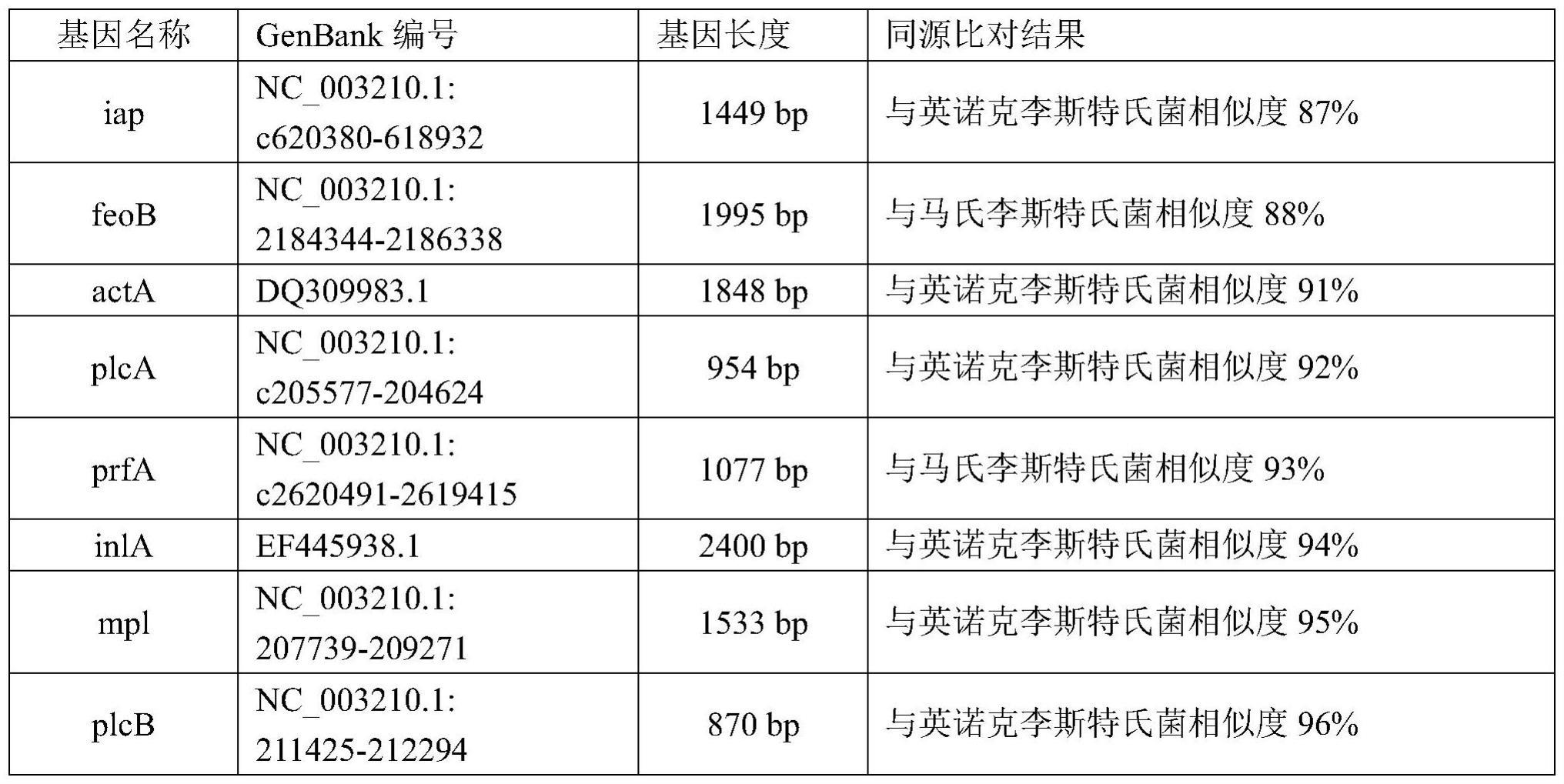
4、核酸扩增的特异性完全取决于物种特异性基因的筛选和引物设计工作,目前,利用分子生物学方法进行单增李斯特菌的特异性检测时,往往使用hlya进行引物设计和核酸扩增,较为单一,随着微生物基因组、转录组等大量测序数据的更新完善,分析其序列可知,基于上述靶基因序列获得的引物在实际应用中很难确保其特异性:hlya基因总长1590bp,在单增李斯特菌与伊氏李斯特菌中只存在43bp的差异,序列一致性高达97%,与英诺克李斯特菌的序列一致性也高达94%,若想通过该基因区分两种菌株,则可选择的用于引物设计的区域较少,考虑到引物gc含量,退火温度等因素后,很难设计出优质的引物用于后期实验。
技术实现思路
1、针对现有技术存在的上述不足,本发明的目的在于提供一种快速检测单增李斯特菌的引物组、试剂盒及检测方法,以解决现有技术中以hlya基因获得的引物组特异性不高的问题。
2、为了解决上述技术问题,本发明采用如下技术方案:
3、一种快速检测单增李斯特菌的引物组,所述引物组包括上游引物和下游引物,所述上游引物序列为:
4、seq id no.2:5’-ctagcactacaagaatctctgaatctcaagca-3’;
5、所述下游引物序列为:
6、seq id no.3:5’-cgtggatgttatcgtatttaacgccattgtct-3’。
7、本发明提供一种快速检测单增李斯特菌的试剂盒,所述试剂盒包括上述引物组。其中,还包括用于dna扩增的缓冲液、乙酸镁、dd h2o以及用于扩增产物纯化的溶剂。
8、本发明提供一种快速检测单增李斯特菌的检测方法,具体步骤如下:
9、步骤1:提取待测样品的基因组dna;
10、步骤2:步骤1以提取的基因组dna为模板,以seq id no.2和seq id no.3为引物,采用权利要求2所述试剂盒进行raa等温扩增;
11、步骤3:采用溶剂对扩增产物进行提取;
12、步骤4:对步骤3提取的扩增产物进行琼脂糖凝胶电泳分析,判断待测样品中是否含有单增李斯特菌。
13、优选地,在步骤2中,所述raa等温扩增的反应体系中,上游引物和下游引物的终浓度为400nmol/l。
14、优选地,所述raa等温扩增的反应体系为缓冲液25μl,上游引物和下游引物各2μl,乙酸镁2.5μl,单增李斯特菌基因组dna模板2μl,ddh2o为16.5μl。
15、优选地,在步骤2中,所述raa等温扩增的反应条件为:反应温度为37℃~42℃,反应时间为10min~40min。
16、优选地,在步骤3中,所述溶剂为苯酚、氯仿和异戊醇的混合物,其中,苯酚、氯仿和异戊醇的质量比为25:24:1。
17、与现有技术相比,本发明具有如下有益效果:
18、1、本发明通过对生物信息学分析,筛选出更为优异的单增李斯特菌的特异性基因iap,该基因与英诺克李斯特菌序列相似度仅有87%,与其他李斯特氏菌相似度极低,明显优于hlya基因,同时,对候选引物进行了筛选和优化,得到了特异性较强的引物组,与其它李斯特氏菌及其它常见食源性致病菌之间均无特异性扩增条带。
19、2、本发明所述方法与常规pcr和lamp等借助高温进行核酸扩增的技术相比,本发明对单增李斯特菌的快速检测无需借助大型的精密控温设备,无需通过高温打开dna双链结构,只需提供简单温度加热的水浴锅或金属浴(温度37℃)即可,条件温和,操作简单,不仅适用于实验室检测,也适用于资源匮乏的现场检测。
20、3、本发明通过对引物组、反应时间和反应温度等条件的不断优化,提高了对单增李斯特菌的检测灵敏度,采用本发明试剂盒和方法在基因组dna水平进行检测,其检测灵敏度可达2pg/μl;而且,反应迅速,在等温37℃条件下反应10min即可出现特异性扩增结果,反应40min则效果最优,明显短于传统培养法的5d,以及pcr扩增所需的2h。
21、4、本发明所述引物组、试剂盒以及检测方法,在使用的仪器、检测时间以及人力成本方面,与国标中的传统培养方法相比,都有显著降低,在食品中对单增李斯特菌进行快速检测的技术领域具有良好的应用前景。
技术特征:
1.一种快速检测单增李斯特菌的引物组,其特征在于,所述引物组包括上游引物和下游引物,所述上游引物序列为:
2.一种快速检测单增李斯特菌的试剂盒,其特征在于,所述试剂盒包括权利要求1所述引物组。
3.根据权利要求2所述快速检测单增李斯特菌的试剂盒,其特征在于,还包括用于dna扩增的缓冲液、乙酸镁、dd h2o以及用于扩增产物纯化的溶剂。
4.一种快速检测单增李斯特菌的检测方法,其特征在于,具体步骤如下:
5.根据权利要求4所述快速检测单增李斯特菌的检测方法,其特征在于,在步骤2中,所述raa等温扩增的反应体系中,上游引物和下游引物的终浓度为400nmol/l。
6.根据权利要求5所述快速检测单增李斯特菌的检测方法,其特征在于,所述raa等温扩增的反应体系为缓冲液25μl,上游引物和下游引物各2μl,乙酸镁2.5μl,单增李斯特菌基因组dna模板2μl,ddh2o为16.5μl。
7.根据权利要求4所述快速检测单增李斯特菌的检测方法,其特征在于,在步骤2中,所述raa等温扩增的反应条件为:反应温度为37℃~42℃,反应时间为10min~40min。
8.根据权利要求4所述快速检测单增李斯特菌的检测方法,其特征在于,在步骤3中,所述溶剂为苯酚、氯仿和异戊醇的混合物,其中,苯酚、氯仿和异戊醇的质量比为25:24:1。
技术总结
本发明公开了一种快速检测单增李斯特菌的引物组、试剂盒及检测方法,所述引物组包括上游引物和下游引物,所述上游引物序列为:SEQ ID No.2:5’‑CTAGCACTACAAGAATCTCTGAATCTCAAGCA‑3’;所述下游引物序列为:SEQ ID No.3:5’‑CGTGGATGTTATCGTATTTAACGCCATTGTCT‑3’。本发明在收集整理单增李斯特菌的候选特异性基因后,筛选出最优的特异性基因用于引物组设计,并对反应体系进行优化,从反应温度和反应时间等方面优化RAA等温扩增体系,使扩增效果最优,在使用的仪器、检测时间以及人力成本方面,与国标中的传统培养方法相比,都有显著降低,在食品中对单增李斯特菌进行快速检测的技术领域具有良好的应用前景。
技术研发人员:秦爱,王娟,袁磊,余秋地,刘明明,张明娟,周朝旭
受保护的技术使用者:重庆市计量质量检测研究院
技术研发日:
技术公布日:2024/1/12
- 还没有人留言评论。精彩留言会获得点赞!