叶酸-聚乙二醇-ss-聚赖氨酸-二氢卟吩Ce6多嵌段聚合物及其制备方法和应用
本发明涉及一种纳米聚合物载体材料的合成,具体涉及叶酸-聚乙二醇-ss-聚赖氨酸-二氢卟吩ce6多嵌段聚合物及其制备方法和应用,属于生物医用材料和纳米药物制剂领域。
背景技术:
1、癌症已经成为人类健康的主要威胁之一。近年来,肿瘤的发生率和死亡率明显呈上升趋势。在过去的几十年里,人们为战胜癌症付出了巨大的努力,使得我们在癌症治疗领域取得了巨大进展。然而,癌症的一线治疗方法,如手术、化疗和放疗等,依然受到明显的副作用和系统毒性所限制。所以,为了对癌症进行更安全、有效的治疗,发展新兴的治疗方式是必不可少的。
2、光热疗法、光动力疗法和化学动力疗法因其可忽略的侵袭性、低毒性、高选择性以及微创性而成为潜在的抗癌方式。其中,光动力疗法(photodynamic therapy,pdt)是通过光动力作用处理癌症的一种新的治疗模式。pdt是使用光敏剂(pi),通过产生活性氧(ros),如单线态氧(1o2)在光照条件下杀死肿瘤细胞。二氢卟吩因其在红光区的高消光系数和高单线态氧量子产率而被频繁用作光敏剂,其中二氢卟吩e6(chlorin e6,ce6)是最常用的光敏剂,它可在650纳米激光照射条件下产生ros,从而被近红外光激活并迅速从体内消除,它可以将光能转化为热能用于肿瘤的消融。然而,张静等人研究虽然发现叶酸修饰光敏剂ce6可以主动靶向作用聚集靶组织,而不会对周围正常组织造成损伤,但是这也会使光敏剂聚集,造成一定的毒性作用(张静,李园,何婷.化学修饰光敏剂的研究进展[j].化学试剂,2014,36(11):983-987+1020.)。李东红等人采用peg作为桥连连接叶酸和ce6,虽然解决了光敏剂聚集的问题,但是peg修饰纳米载体,到达靶点后,存在不容易释放出来的缺陷(李东红,刁俊林,刘建仓,臧家涛.光敏剂叶酸-卟啉对宫颈癌hela细胞的靶向性和光动力活性[j].中国激光医学杂志,2010,19(05):273-277+336.)。
3、peg是最常用的聚合物之一,也是为数不多获得fda批准用于药物和制药应用的聚合物之一。其分子具有亲水性,当与疏水性聚合物结合时,会自组装成两亲性分子。同时聚赖氨酸(poly-l-lysine,pll)也是一种常见的聚合物,它是由几十个赖氨酸连接而成具有氨基官能团的生物大分子,是一种可生物降解的阳离子多肽,它能与细胞相互作用并粘附在细胞上。
4、由于peg和pll属于生物大分子,为了防止大聚集体的形成,传统的方法是通过插入桥基(例如,可旋转的含σ键的苯环)或柔性接头(例如,硫化物键),使分子结构不那么刚性,从而防止长程有序的分子堆积。其中,最常用的柔性接头之一是二硫键(s-s),具有几乎垂直的双键角和单二面角,在分子自组装过程中提高结构柔性和平衡分子间力方面起着重要作用。
5、由于传统的药物治疗在运输方式上存在系统性障碍和细胞障碍,容易导致高毒性,低靶向性等缺点,所以需要制备一种多功能载体材料进行优化。功能性嵌段共聚物因其具有较高的稳定性,低临界胶束浓度,大小可控以及可功能化修饰等优点,常被应用于构建新型的纳米药物载体,赵顺新等人所制备的叶酸修饰星型端氨基peg-plga的纳米胶束,虽然有着主动靶向肿瘤组织,对肿瘤细胞具有较好的杀伤作用的优势,但是在制备以peg-plga为载体的纳米粒时,所使用的溶剂容易被plga所溶解,对机体可能有免疫抑制或者免疫刺激作用,从而诱导机体产生不同程度的免疫反应(马桂蕾,赵顺新,金旭,陈旼旼,张政朴,宋存先.叶酸修饰星型端氨基peg-plga纳米胶束的制备及肿瘤细胞靶向作用[j].高等学校化学学报,2012,33(08):1854-1859.)。魏露露公开了叶酸修饰一种刺激响应的两亲性嵌段共聚物的制备,所制备的纳米载体材料较为复杂,成本较高(魏路路.叶酸修饰的肿瘤细胞响应性嵌段共聚物的制备及其对dox的控释行为研究[d].石河子大学,2018.)。
6、叶酸(folic acid,fa)是一种小分子维生素。很多肿瘤细胞的细胞膜上都有一种过表达的特异性的蛋白质(叶酸受体),在正常组织中低表达,而在肿瘤细胞中高表达。与其他肿瘤细胞的靶向受体相比,它具有低免疫原性,易于改造,存储稳定性,与各种有机和水溶性试剂兼容以及成本低等优点。因此,叶酸修饰的纳米载体材料表面具有靶向癌细胞递送的特性。
7、查阅相关的文献和专利发现,本发明制备工艺简单可控、条件温和,所用原材料简单,并且目前还未发现使用光敏剂标记叶酸修饰二硫键连接的两嵌段共聚物作为载体材料将光能转化为热能用于肿瘤的消融以及肿瘤细胞的靶向的报道。
技术实现思路
1、本发明所要解决的技术问题在于:针对现有的技术条件下,提供一种肿瘤靶向性的还原响应型载体材料。
2、本发明解决其技术问题所采用的技术方案是:
3、叶酸-聚乙二醇-ss-聚赖氨酸-二氢卟吩ce6多嵌段聚合物,所述聚合物的分子式为:
4、
5、其中n≥2,x≥2。
6、一种肿瘤靶向性的还原响应型载体材料,由多嵌段聚合物在水中自组装形成的胶束组成,所述多段聚合物为叶酸-聚乙二醇-ss-聚赖氨酸-二氢卟吩ce6(fa-peg-ss-pll(-g-ce6)),其亲水端为peg,疏水端为pll,通过二硫键进行连接,叶酸靶向肿瘤细胞上的叶酸受体。
7、其结构如下式所示:
8、
9、其中n≥2,x≥2;
10、式中所示聚合物叶酸-聚乙二醇-ss-聚赖氨酸-二氢卟吩ce6(fa-peg-ss-pll(-g-ce6)),其亲水端为peg,疏水端为pll,通过二硫键进行连接;所述叶酸靶向受体为一种锚定在细胞膜中甘油磷脂酰肌醇上的单链糖蛋白,在正常组织中低表达,而在肿瘤细胞表面高表达。
11、所述载体材料自组装形成的胶束是一种壳核结构,两亲性嵌段共聚物含有亲水端peg和疏水端pll,疏水端的“核”用以包裹疏水性药物和ce6,亲水端的“壳”由于其亲水性所以可以使整个聚合物胶束更好的溶解在水中。由于在肿瘤环境中,gsh还原酶含量较高,胶束中的二硫键将会还原成巯基,穿透细胞膜,二硫键的断裂,使得药物的光敏剂释放。
12、叶酸-聚乙二醇-ss-聚赖氨酸-二氢卟吩ce6多嵌段聚合物的制备方法,具体实验步骤包括:
13、(1)制备叶酸的无水dmso溶液,用dcc和nhs溶液活化2~5h,边搅拌边逐滴滴加聚氧乙烯双胺的无水dmso溶液,反应24~48h后,将反应物透析,最后冷冻干燥得到叶酸修饰的聚氧乙烯双胺固体产物fa-peg-nh2;
14、
15、(2)将fa-peg-nh2和丁二酸酐溶解,逐滴滴加1.5~10倍三乙胺溶液,反应24~48h后,旋蒸除去大部分溶剂,浓缩液再用冰乙醚中沉淀,抽滤后真空常温干燥,得到fa-peg-cooh;
16、
17、(3)将fa-peg-cooh用dmf溶解,并加入dcc和nhs溶液活化5~6h,将摩尔比为1:5~20的胱胺溶解后,胱胺溶液逐滴滴加到fa-peg-cooh溶液中,室温下反应24~48h,将反应物用冰乙醚沉淀,抽滤后烘干,得到fa-peg-ss-nh2;
18、
19、(4)将步骤(3)所得固体与zll-nca以一定比例溶解于无水dmf中,30~35℃下,反应48~72h,将反应物透析,冷冻干燥后得到fa-peg-ss-pzll;
20、
21、(5)将步骤(4)所得产物用三氟乙酸溶解,并加入冰溴酸溶液,冰水浴,反应1~4h后,将反应物用冰乙醚沉淀,抽滤后冻干,得到fa-peg-ss-pll-nh2;
22、
23、(6)将ce6溶解于无水dmf中,加入edc·nhs进行活化2~5h,缓慢加入到fa-peg-ss-pll溶液中,反应24~48h,将反应物透析,冷冻干燥后得到fa-peg-ss-pll(-g-ce6)。
24、
25、步骤(1)中所述的叶酸与nh2-peg-nh2的摩尔比为2~6:1;所述的反应需要在n2保护下进行,目的是隔绝空气;所述的透析具体为用透析袋在纯水中透析24h后,将溶液透过微孔滤膜;所述透析袋的分子量截留为500~1500。
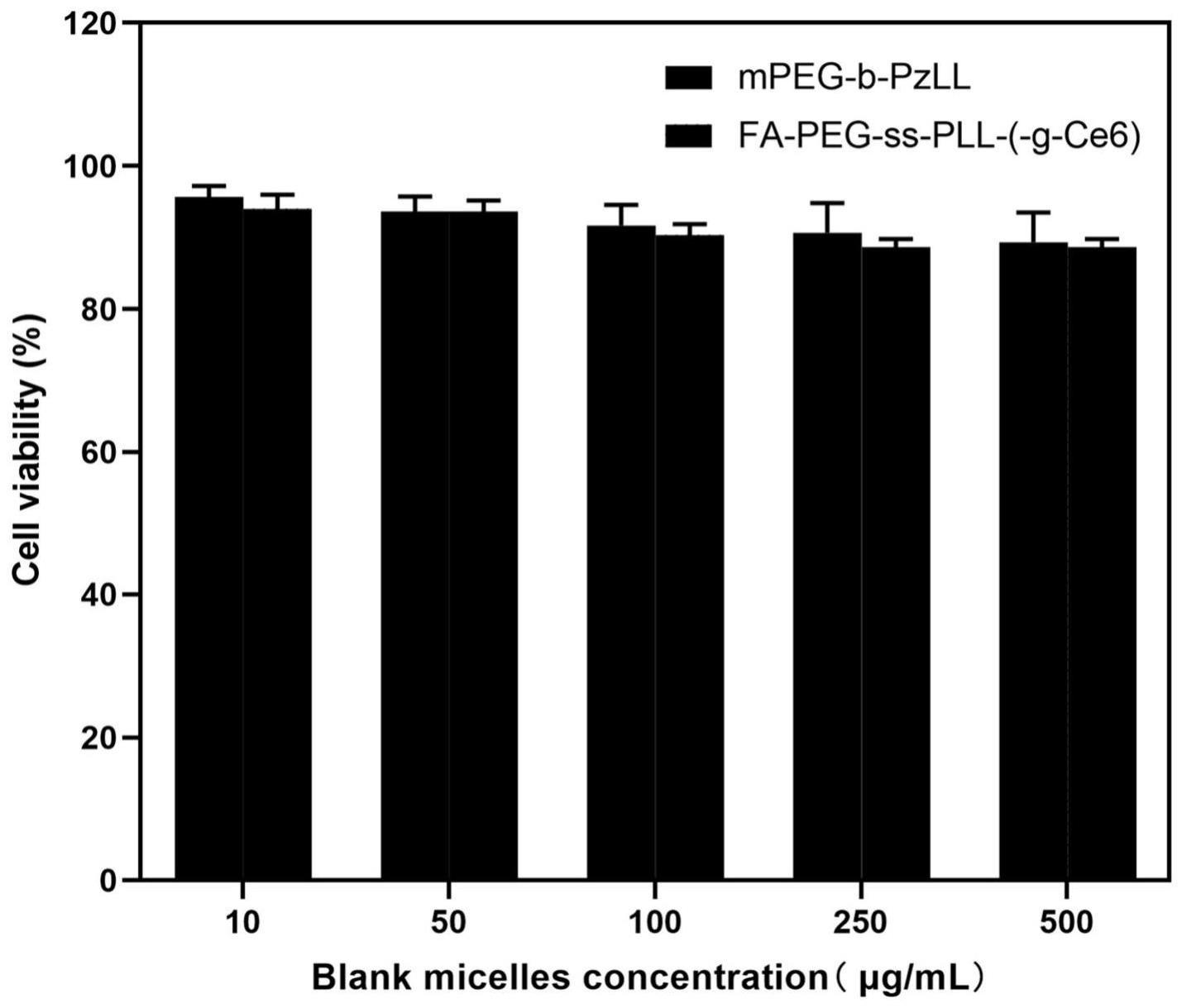
26、步骤(2)中所述需要加入三乙胺溶液,三乙胺与fa-peg-nh2摩尔比为1.5~10:1,目的是作为缚酸剂;所述fa-peg-nh2与丁二酸酐的摩尔比为0.5~2:1。
27、步骤(3)中所述加入nhs和dcc溶液,目的是为了活化fa-peg-cooh的羧基端;所述fa-peg-nh2与胱胺的摩尔比为1:5~20。
28、步骤(4)中所述fa-peg-ss-nh2与zll-nca摩尔比为1:15~20;所述的透析袋的分子量截留为3500~5000。
29、步骤(5)中所述加入冰溴酸溶液,目的是为了断裂酰胺键;所述冰溴酸体积约为0.5~5ml。
30、步骤(6)中所述加入nhs和dcc溶液,目的是为了活化光敏剂ce6的羧基端;所述fa-peg-ss-pll与ce6摩尔比为0.5~2:1。
31、所述载体材料用于制备肿瘤靶向性药物,能广泛应用于靶向化疗或靶向光疗体内各种肿瘤部位。
32、本发明制备的一种肿瘤靶向性的还原响应型载体作为一种具有创新性的载体材料,具有以下优点:
33、1.本发明制备的肿瘤靶向性的还原响应型载体材料,原材料叶酸和聚氧乙烯双胺简单易得,制备条件温和,是一种优良抗癌药物靶向载体。
34、2.本发明制备的载体材料由叶酸修饰二硫键连接的两嵌段聚合物,有利于叶酸主动靶向靶组织,并且用还原响应型二硫键连接嵌段共聚物的还原响应有利于载体材料根据肿瘤环境中gsh浓度断裂二硫键,释放药物而不会对周围组织造成损伤。
35、3.本发明制备的肿瘤靶向性的还原响应型载体材料,有利于载体材料上聚赖氨酸的多个氨基接枝多个光敏剂ce6,从而提高胶束的载药量和包封率。
36、4.本发明制备的肿瘤靶向性的还原响应型载体材料具有良好的生物相容性,并不会造成细胞毒性。
37、5.本发明制备的肿瘤靶向性的还原响应型载体材料自组装形成的载药胶束,具有化疗和光动力疗法双重响应的效果。
- 还没有人留言评论。精彩留言会获得点赞!