茶树芦丁:尿苷二磷酸葡萄糖基转移酶基因及其应用
本发明属于茶树基因工程领域;具体而言,本发明涉及茶树芦丁:尿苷二磷酸葡萄糖基转移酶(rutin:uridine diphosphate-glucosyltransferase,rug)基因的分离和分析,还涉及利用该基因进行槲皮素3-o-葡萄糖基鼠李糖基葡萄糖苷(q-glu-rha-glu)的体外合成。
背景技术:
1、黄酮醇苷是茶叶重要次生代谢产物,对茶树生长发育和逆境抵御有重要贡献;同时黄酮醇苷常为黄色或黄绿色粉末,具有柔和苦涩味,可增强咖啡因的苦味,对茶汤色泽和口感均有显著影响。黄酮醇苷活性羟基多、抗氧化能力强,具有抗炎、抗癌、抗突变和预防心血管疾病等诸多生理功效。
2、黄酮醇苷是由黄酮醇苷元和配糖体结合形成的糖苷类酚性化合物,其苷元具有2-苯基色原酮(c6-c3-c6)基本骨架,其a环来自乙酰coa代谢、并具有5-和7-位羟基,b环来自莽草酸途径、通常具有4′-或3′,4′-或3′,4′,5′-位羟基,c环是由3个碳原子和一个氧原子组成的杂环、并具有3-位羟基;黄酮醇的3-、5-、7-位羟基均可与配糖体结合形成糖苷,但主要以3-位糖苷为主。茶叶中常见的黄酮醇苷元主要有杨梅素、槲皮素和山奈酚等,常见的配糖体主要为葡萄糖、半乳糖和鼠李糖等,因苷元、糖基数量及其结合顺序不同,黄酮醇苷物质种类较多。茶叶黄酮醇苷可根据苷元分为杨梅素糖苷、槲皮素糖苷和山奈酚糖苷等;根据结合糖基的数目分为黄酮醇单糖苷、双糖苷和三糖苷。茶叶中黄酮醇三糖苷和黄酮醇双糖苷含量高于黄酮醇单糖苷和黄酮醇苷元,但每种黄酮醇苷单体丰度均低于2%,使得从茶叶中制备黄酮醇苷难度大、成本高。
3、糖苷化可以提高黄酮醇的稳定性和溶解度、并有助于其在体内的转运和贮存,对黄酮醇类物质生物功能的发挥有重要作用。植物黄酮醇苷元可经过一次、二次和三次转糖基反应生成相应的黄酮醇单糖苷、双糖苷和三糖苷,比如槲皮素经3-o位转葡萄糖基反应、生成槲皮素-3-o-葡萄糖苷,该单糖苷再经转鼠李糖基反应、可生成芦丁(即槲皮素3-o-鼠李糖基葡萄糖苷),该双糖苷再经转葡萄糖基反应、生成槲皮素3-o-葡萄糖基鼠李糖基葡萄糖苷。研究显示,黄酮醇和黄酮醇苷转糖基反应主要由糖基转移酶家族1催化,在催化转糖基反应时,主要以尿苷二磷酸(uridine diphosphate,udp)活化的糖基,如udp-葡萄糖、udp-鼠李糖和udp-半乳糖等为糖供体,因此该类酶也被称为尿苷二磷酸-糖基转移酶(uridine diphosphate-glycosyltransferases,ugts)。虽然科学家很早就开始了ugts特性的研究,但进展缓慢,其主要原因是ugts家族成员多、分离纯化困难。近年来随着分子生物学技术的不断进步,植物ugts研究有了较大进步。截止目前,茶树中ugt75e1、ugt75e2、ugt75e3、ugt73a17、ugt84a22、ugt78a14、ugt78a15、ugt73a20、ugt72am1、ugt75l12、ugt79b28以及f3galt等基因获得了分离和功能分析,在所有已完成功能鉴定的基因中,大部分基因编码的蛋白可催化黄酮醇转糖基反应生成黄酮醇单糖苷,少部分(如ugt79b28)基因编码的蛋白可催化黄酮醇单糖苷转糖基反应生成黄酮醇双糖苷。而茶树中的黄酮醇糖苷主要为黄酮醇二糖苷(如芦丁、山奈酚-3-o鼠李糖-葡萄糖苷)和黄酮醇三糖苷(如q-glu-rha-glu),迄今,茶树中尚未有催化黄酮醇双糖苷转糖基反应生成黄酮醇三糖苷的基因分离、功能鉴定以及应用的相关报道。
技术实现思路
1、本发明要解决的技术问题是提供一种茶树芦丁:尿苷二磷酸-葡萄糖基转移酶(rutin:uridine diphosphate-glucosyltransferase,rug)的基因序列及其编码的蛋白质,通过该基因的原核表达可以实现槲皮素3-o-葡萄糖基鼠李糖基葡萄糖苷(q-glu-rha-glu)体外受控合成。
2、为了解决上述技术问题,本发明提供一种茶树rug基因,其具有seq id no:1所示的核苷酸序列。
3、本发明还提供了上述rug基因编码的蛋白质,其具有seq id no:2所示的氨基酸序列(终止子未列)。
4、本发明还提供了上述rug基因用途:通过茶树rug基因的原核表达实现槲皮素3-o-葡萄糖基鼠李糖基葡萄糖苷(q-glu-rha-glu)体外受控合成。
5、作为本发明的茶树rug基因的用途的进一步改进:利用外源表达的rug基因编码产物催化芦丁与udp-葡萄糖发生糖基转移反应,通过体外合成制备槲皮素3-o-葡萄糖基鼠李糖基葡萄糖苷q-glu-rha-glu。
6、即,本发明的基因表达产物可以催化芦丁和udp-葡萄糖发生转葡萄糖基反应,实现q-glu-rha-glu体外受控合成。
7、本发明还同时提供了一种利用原核工程菌表达rug合成q-glu-rha-glu的方法,包括用茶树rug基因(seq id no:1)转化大肠杆菌,将诱导表达的rug催化芦丁和upd-葡萄糖反应,实现q-glu-rha-glu的合成。
8、作为本发明的体外合成制备q-glu-rha-glu的方法的改进:茶树rug基因(seq idno:1)在大肠杆菌原核表达系统中表达并纯化后,在30℃、磷酸缓冲系统、ph8.0条件下催化芦丁与udp-葡萄糖合成q-glu-rha-glu,并经乙酸乙酯萃取和冷冻干燥,制备纯度≥80%的q-glu-rha-glu。
9、本发明主要针对目前黄酮醇三糖苷制备困难和催化黄酮醇三糖苷合成相关基因报道缺乏等实际问题,通过对黄酮醇三糖苷含量差异明显的不同茶树叶片转录组差异基因筛选和克隆,以及外源基因原核表达酶活性分析,明确本发明rug基因编码产物在催化合成q-glu-rha-glu的作用,开发了利用转基因工程菌表达外源蛋白催化合成q-glu-rha-glu的方法。
10、本发明是采用了以下技术方案来实现:采用黄酮醇三糖苷丰度较高的茶树品种不同叶位样品的转录组差异基因筛选和黄酮醇苷代谢物关联分析,获得与q-glu-rha-glu合成相关的候选基因rug,经逆转录-聚合酶链反应(rt-pcr)和测序分析克隆了rug基因,其具有seq id no:1所示的核苷酸序列,可编码rug蛋白质,其具有如seq id no:2所示序列。
11、本发明还提供了茶树rug基因原核表达产物催化特性,证明本发明rug基因编码产物可以催化芦丁和udp-葡萄糖合成q-glu-rha-glu,并提供了利用工程菌原核表达的rug进行体外合成q-glu-rha-glu的优化方法。
12、实现本发明的具体技术步骤如下:
13、一、茶树rug基因克隆和序列分析
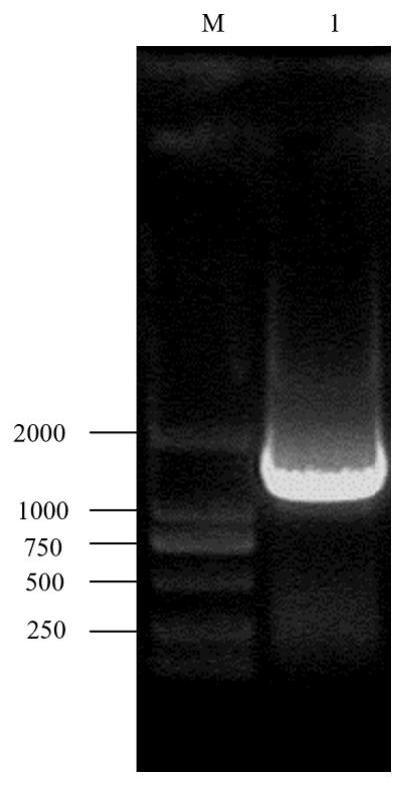
14、在春季采集黄酮醇三糖苷丰度较高的中小叶类茶树品种芽下第1叶、第2叶、第3叶和第4叶,并将各叶位样品分成2份。一份采用100℃蒸汽杀青2min、80℃烘至样品含水量为≤5%的方式制备固定样,通过uplc-dad-ms/ms分析黄酮醇苷组成和含量,获得不同样品表型数据;另一份置于液氮中充分研磨后,采用trizol法提取总rna/采用多糖多酚植物rna提取试剂盒(杭州易思得生物科技有限公司)提取总rna(操作参照试剂盒说明书),分别获得各叶位样品的总rna,经电泳和紫外分析明确rna质量和浓度符合后续实验。以各叶位总rna为起始物,采用ultratmdirectional rna library prep kit for试剂盒(new england biolabs,inc.)分离mrna并片段化、经双链cdna合成、cdna末端修补加a、nebnext adaptor接头连接、选择特异长度片段回收、pcr扩增富集等过程构建转录组文库,具体操作参照试剂盒相关说明。将构建的转录组文库委托测序公司通过illuminahiseq 2500平台进行序列测定、组装和基因差异表达分析。
15、以加权相关网络分析(weighted correlation network analysis,wgcna)对差异表达基因进行聚类分析,并与各样品中黄酮醇三糖苷含量等表型数据进行关联,筛选获得了参与q-glu-rha-glu合成的rug候选基因。根据转录组测序获得的rug候选基因序列设计克隆该基因全长开放阅读框(orf)的引物(表1中的no1,预计产物长度1410bp);采用rt-pcr对候选基因orf进行序列扩增(图1),扩增产物插入18-t载体构建包含rug基因的重组载体18-t-rug,并转化jm109感受态大肠杆菌,经蓝白斑筛选,挑取白斑扩增,以m13通用引物(表1中的no2)进行菌落pcr,将满足在氨苄青霉素抗性培养基上生长条件的阳性克隆委托上海生工生物工程公司以桑格测序法进行测序。采用dnastar软件包中的editseq推演orf编码的rug氨基酸序列,并以blast(www.blast.ncbi.nlm.nih.gov/blast.cgi)与美国生物技术信息中心genbank数据库进行核苷酸序列和氨基酸序列比对,发现本发明克隆的rug基因编码产物为糖基转移酶家族成员,与数据库中一个功能未知的茶树udp-糖基转移酶91q1基因(camellia sinensis udp-glycosyltransferase 91q1,csugt91q1)的同源性最高,即:本发明与csugt91q1核苷酸序列(编号kp682355.1)和氨基酸序列(编号alo19883.1)同源性分别为98.37%和98.51%。
16、二、rug基因功能分析
17、根据rug基因序列设计包含完整orf的原核表达引物(表1中的no3,预计产物长度1410bp),以包含rug基因的重组载体18-t-rug为模板,通过pcr反应扩增rug完整orf,购买pcold-tf载体(其中tf是指激发因子,即trigger factor,是一种原核的核糖体结合伴侣蛋白质,能够促进新生肽链的共翻译折叠),将pcold-tf载体用单切点内切酶eco53ki进行酶切线性化,将rug完整orf扩增产物与线性化pcold-tf载体在同源重组连接酶作用下进行交换重组形成环状pcold-tf-rug,并转化感受态大肠杆菌dh5α,经氨苄青霉素抗性筛选后,挑取阳性克隆以pcold-tf通用引物(表1中的no4)进行菌落pcr,将阳性克隆委托上海生工生物工程公司测序验证;提取测序验证后的重组质粒pcold-tf-rug,转化感受态大肠杆菌origami(de3),经测序验证后的阳性克隆扩繁,并在低温条件下通过异丙基-β-d-硫代半乳糖苷(iptg)诱导重组蛋白表达,经sds-page分析目标基因rug得到高表达、且可溶性强(图2)。采用his标签蛋白纯化试剂盒将融合重组蛋白经镍柱吸附纯化,以hrv 3c蛋白酶消化去除tf,获得纯化rug蛋白,具体操作参照相关质粒和试剂盒说明。以槲皮素、槲皮素3-o-葡萄糖苷、芦丁、山奈酚、山奈酚-3-o葡萄糖苷、山奈酚-3-o鼠李糖-葡萄糖苷等为受体,以udp-葡萄糖、udp-鼠李糖、udp-半乳糖等为供体,开展rug蛋白催化特异性分析,发现rug只能催化芦丁和udp-葡萄糖发生糖基转移反应,并生成q-glu-rha-glu(图3)。同时,研究还发现,原核表达的rug重组蛋白不管是否经过hrv 3c蛋白酶消化去除tf因子,均能有效催化芦丁和udp-葡萄糖合成q-glu-rha-glu。
18、进一步的,通过反义寡核苷酸基因沉默试验证明rug基因编码产物催化茶树q-glu-rha-glu合成,具体为,采用primerselection软件设计用于rug基因表达分析的引物rug.expf和rug.expr(表1中的no5)以及肌动蛋白act参比基因引物act.expf和act.expr(表1中的no6),并使用rnafold软件(https://sfold.wadsworth.org/cgi-bin/index.pl)设计rug基因特异性反义寡核苷酸asodn以及对照正义寡核苷酸sodn(表1中的no7)。采收嫩度相同的‘福鼎大白茶’芽下第二叶,将asodn和对照sodn分别用无菌水配成溶液,使用无菌注射器对每份叶片分别注射asodn或对照sodn溶液,之后分别浸泡在含相应寡核苷酸(表1中的no5)及芦丁和udp-葡萄糖的溶液中,光照、25℃培养24-36h。培养结束后,经荧光定量pcr检测rug表达情况、及利用uplc-dad-ms/ms检测黄酮醇苷组成分析,发现,与注射对照sodn相比,茶树rug基因被asodn沉默后叶片中rug基因表达显著下调,q-glu-rha-glu合成受到显著抑制(图4)。证明分离的茶树rug编码产物在茶树体内可催化芦丁和udp-葡萄糖合成相应的槲皮素三糖苷。
19、由此可见,rug基因是茶树合成q-glu-rha-glu黄酮醇三糖苷的关键功能基因,对茶叶黄酮醇苷滋味物质合成有重要影响。
20、上文中涉及的引物具体如下表1:
21、表1
22、
23、
24、三、rug基因应用
25、将包含重组质粒pcold-tf-rug的origami(de3)工程菌扩繁后,在低温下用iptg诱导重组蛋白表达,将工程菌用溶菌酶超声辅助破碎后,以镍柱纯化获得rug、并与芦丁和udp-葡萄糖混合后,比较不同温度、缓冲体系及其酸度条件下产物生成情况,发现温度30℃、磷酸缓冲体系、ph8.0条件下催化效率最高(图5)。在该条件下反应4-8h后,以90℃加热处理终止反应,并在混合物中加入等体积的乙酸乙酯萃取2次,合并乙酸乙酯层,在45℃下减压蒸馏去除乙酸乙酯,将糊状物转移至培养皿中,经冷冻干燥可获得干粉,其中q-glu-rha-glu含量超过80%。同时,将数据库中的茶树csugt91q1基因采用等同载体和工程菌、并在一致的低温诱导条件诱导表达,经等同的蛋白纯化和优化条件下的酶促反应,再经等同的萃取、蒸馏和干燥操作,获得的干粉中q-glu-rha-glu含量低于38%。
26、需要说明的是:
27、与本发明的rug基因同源性高的基因csugt91q1,其用途没有明确报道,本发明经实验证明:csugt91q1虽可催化生成q-glu-rha-glu,但催化效率远远低于本发明中的茶树rug基因,且csugt91q1对其他物质的特异性高效催化功能未有报道,芦丁和udp-葡萄糖并非是其最佳反应底物。
28、基因pgugt94q4,其用途为催化山奈酚和udp-葡萄糖发生糖基化反应生成山奈酚-3-o葡萄糖苷;与本发明的催化底物完全不同。
- 还没有人留言评论。精彩留言会获得点赞!