一种基于肿瘤类器官耐药克隆指导临床耐药后治疗系统的制作方法
本发明涉及一种生物医药,尤其涉及一种基于肿瘤类器官耐药克隆指导临床耐药后治疗系统。
背景技术:
1、目前晚期恶性肿瘤的治疗方式多样,主要包括全身化疗、靶向治疗、免疫治疗等多种模式。对于一般状态较好的患者,联合治疗如联合化疗、化疗联合靶向以及化疗联合免疫的治疗策略能够有效的控制肿瘤的生长进而取得较大的临床获益。然而,不管药物治疗方式如何发展,癌症患者在治疗过程中发生肿瘤耐药性几乎是难以避免的现象,此刻肿瘤往往控制不佳,医生只能根据临床经验和指南决定耐药后的后续治疗方案,缺乏可信赖的个体化用药证据。
2、进入21世纪,肿瘤治疗理念从经验医学和循证医学逐步发展至精准医学和个体化治疗。近些年,类器官逐渐发展成肿瘤个体化治疗的新兴技术。类器官是体内的干细胞在体外特殊培养条件下形成的具有三维组织结构的微器官,它们在许多方面重现了体内对应器官的结构和功能。目前类器官模型在常见肿瘤中均可稳定构建,包括肺癌、结直肠癌、乳腺癌、胃癌、胰腺癌、肝癌、前列腺癌、膀胱癌等。肿瘤类器官的构建成功率高(部分类型可达90%以上)、样本来源丰富(手术、穿刺、内镜活检或恶性积液)、时间周期较短(约2周)、成本较低、临床疗效预测一致性高。基于以上优势,肿瘤类器官药物敏感性检测指导临床个性化用药的技术短时间内发展十分迅速,尤其为晚期复发难治患者提供了更为精准的治疗方案,避免无效治疗。
3、然而,目前的肿瘤类器官药敏检测技术只能解决在组织样本可及情况下的药物筛选和评价,无法满足肿瘤患者发生耐药后但组织样本不可及情况下的个体化治疗临床需求。例如,对于晚期一般状态较差无法耐受联合治疗的患者,现阶段的类器官药敏检测技术可以协助临床医生制定个性化的单药治疗方案;但是个性化的单药治疗后仍有耐药的概率,晚期肿瘤患者后续的样本获取难度较大(如无法获得理想样本或者患者无再次取样的意愿),因此耐药后的用药方案往往缺乏个体化的用药指导。
4、为此,我们提出一种基于肿瘤类器官耐药克隆指导临床耐药后治疗系统。
技术实现思路
1、本发明的目的在于提供一种基于肿瘤类器官耐药克隆指导临床耐药后治疗系统,该系统补充完善了当前类器官药敏检测后筛选耐药克隆的技术体系;除了推荐临床个体化治疗的初始方案,更补充推荐了耐药后的治疗方案,从而为肿瘤患者在初始治疗耐药后提供更为精准的后续用药依据。
2、本发明采用的技术方案如下:
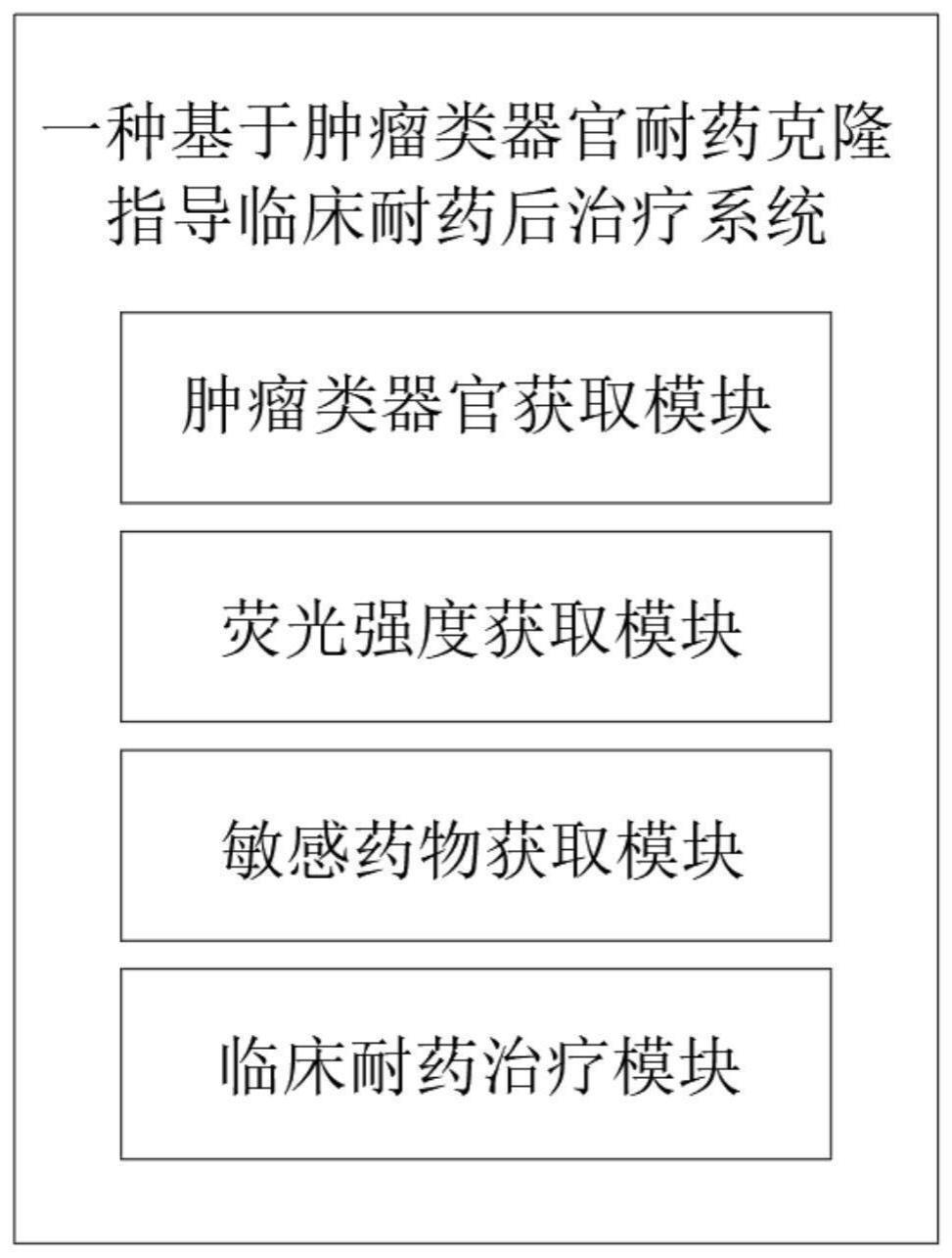
3、一种基于肿瘤类器官耐药克隆指导临床耐药后治疗系统,至少包括:
4、肿瘤类器官获取模块:用于将临床样本中获取的肿瘤细胞进行铺板培养,获取肿瘤类器官;
5、荧光强度获取模块:用于对肿瘤类器官设置给药组和对照组,对给药组进行给药孵育培养,并利用荧光显微镜对肿瘤类器官进行层扫,通过图像算法计算每孔肿瘤类器官的荧光强度;
6、敏感药物获取模块:用于利用荧光强度计算相对细胞活率,并根据相对细胞活率分析得到敏感药物;
7、临床耐药治疗模块:用于基于筛选出的敏感药物执行治疗,同时进入耐药克隆筛选、扩增培养,并迭代荧光强度获取模块和敏感药物获取模块获取敏感药物,根据实体瘤疗效评价recist1.1标准进行疗效评价,当疾病控制评估结果为pd,临床综合决策执行耐药克隆的敏感药物治疗。
8、作为优选,所述肿瘤类器官获取模块具体包括:
9、肿瘤细胞铺板单元:用于将临床样本中获取的肿瘤细胞在微孔板上进行铺板培养;
10、肿瘤类器官培养单元:用于微孔板内肿瘤类器官初始孵育,获取平均直径为100±20μm的肿瘤类器官。
11、作为优选,所述荧光强度获取模块的功能流程至少包括:
12、步骤s1:给药前去除每孔培养基,加入含有体积分数为0.01%-0.1%的calcein-am培养基,置于37℃,5%的co2中孵育培养1h;
13、步骤s2:对肿瘤类器官设置给药组和对照组,获得待测药物包括a1、a2……an,1≤n;对照组和每个待测药物对应的给药组分配3-10个复孔,利用荧光显微镜对肿瘤类器官进行层扫,并通过图像算法计算每孔肿瘤类器官的给药组初始荧光强度和对照组初始荧光强度;其中,初始荧光强度cv值≤15%-30%;
14、步骤s3:将含有ec浓度的待测药物a1加入到给药组1中,置于37℃,5%的co2中孵育培养3-7天后,加入含有体积分数为0.01%-0.1%体积比的calcein-am培养基,置于37℃,5%的co2中孵育培养1h,得到给药组1给药后的肿瘤类器官1;
15、步骤s4:重复步骤s3,直到得到n种待测药物的给药组给药后的肿瘤类器官;
16、步骤s5:对照组中加入含有体积分数为0.1%的dmso类器官培养基,置于37℃,5%的co2中孵育培养3-7天后,加入含有体积分数为0.01%-0.1%体积比的calcein-am培养基,置于37℃,5%的co2中孵育培养1h,得到对照组的肿瘤类器官;
17、步骤s6:利用荧光显微镜分别对给药组给药后的肿瘤类器官和对照组的肿瘤类器官进行层扫,并通过图像算法计算每孔肿瘤类器官的给药组终点荧光强度和对照组终点荧光强度。
18、作为优选,所述敏感药物获取模块具体包括:
19、相对细胞活率计算单元:用于根据给药组初始荧光强度和对照组初始荧光强度,给药组终点荧光强度和对照组终点荧光强度,计算肿瘤类器官的相对细胞活率;
20、敏感药物分析单元:用于对肿瘤类器官的相对细胞活率进行排序,筛选出相对细胞活率最小的作为敏感药物。
21、作为优选,所述相对细胞活率=(给药组终点荧光强度复孔均值/给药组初始荧光强度复孔均值)/(对照组终点荧光强度复孔均值/对照组初始荧光强度复孔均值)。
22、作为优选,所述临床耐药治疗模块中耐药克隆筛选、扩增培养包括:筛选出给药前后单个类器官活细胞信号衰减<50%的类器官为耐药类器官;针对筛选出的耐药类器官,用含有1%ec浓度的当前敏感药物的培养基,置于37℃,5%的co2中扩增培养,每3天换液一次,同时每3天进行一次明场成像,直至肿瘤类器官平均直径为100±20μm后进行敏感药物获取。
23、作为优选,对耐药克隆筛选、扩增培养所得到的肿瘤类器官执行荧光强度获取模块和敏感药物获取模块的标准操作,获取针对耐药克隆的敏感药物排序。
24、本发明的有益效果至少包括:
25、1、本发明构建的基于肿瘤类器官耐药克隆指导临床耐药后系统,能够为初始治疗方案耐药后的后续治疗提供更多个性化的用药指导,而常规atp类器官药敏检测方法由于对肿瘤类器官的破坏,无法在样本不可及情况下实施二次检测,减少了耐药患者从二次检测中获益的机会。
26、2、本发明中的图像识别类器官耐药克隆的技术是常规类器官药敏无法实现的。常规的类器官药敏检测方法,采用基于atp定量的生物发光检测原理,会破坏类器官和细胞结构,仅能通过酶标仪等设备读取微孔板单孔中活细胞的综合荧光读数值,并不能用于保持和提取反映患者肿瘤异质性的耐药克隆。
27、3、本发明通过显微成像技术提取单孔内所有类器官图像信息,结合活细胞荧光染色技术(超低细胞毒性,且不破坏细胞结构),可以精准识别和提取加药后单孔里面的耐药克隆,用于后续的扩增和药敏实验。
- 还没有人留言评论。精彩留言会获得点赞!