基于流式分选的鸡原代T细胞的体外分离及培养方法
本发明属于细胞分离培养领域,是一种t细胞体外分离及培养方法,是一种保证细胞纯度的单种类细胞的体外培养方法。
背景技术:
1、免疫细胞是指参与免疫应答或与免疫应答相关的细胞。包括淋巴细胞、树突状细胞、单核/巨噬细胞、粒细胞、肥大细胞等。免疫细胞可以分为多种,在人体中各种免疫细胞担任着重要的角色。t淋巴细胞是具有细胞免疫功能的细胞,对b细胞起促进作用,以及对免疫细胞起抑制、调整作用的细胞,所组成细胞群总称,又称胸腺依赖性淋巴细胞,是淋巴细胞主要组分。它具有多种生物学功能,比如直接杀伤靶细胞,辅助或抑制b细胞产生抗体。对于特异性抗原和促有丝分裂原应答反应,以及产生细胞因子等,使免疫效应扩大和增强。
2、流式分选技术是一种细胞分离技术,其原理是当经荧光染色或标记的单细胞悬液放入样品管中,被高压压入流动室内。流动室内充满鞘液,在鞘液的包裹和推动下,细胞被排成单列,以一定速度从流动室喷口喷出。在流动室的喷口上配有一个超高频的压电晶体,充电后振动,使喷出的液流断裂为均匀的液滴,待测细胞就分散在这些液滴之中。将这些液滴充以正、负不同的电荷,当液滴流经过带有几千伏的偏转板时,在高压电场的作用下偏转,落入各自的收集容器中,没有充电的液滴落入中间的废液容器,从而实现细胞的分离。
3、免疫磁珠细胞分选法是把细胞用超级顺磁性的(macs微型磁珠)特异性地标记,磁性标记完后,把这些细胞通过一个放在强而稳定磁场中的分选柱。分选柱里的基质造成一个高梯度磁场。被磁性标记的细胞滞留在柱里而未被标记的细胞则流出。当分选柱移出磁场后,滞留柱内的磁性标记细胞就可以被洗脱出来,这样就完全可以获得标记和未标记的两个细胞组份。小磁珠的优点:(1)对细胞温和,不影响分离细胞的后续培养;(2)可直接上流式检测,不影响散射光。小磁珠的缺点:(1)需要很强的磁场来分离细胞;(2)分离速度很慢,得率不高;(3)一次性的分离柱,不能在普通试管进行;(4)成本昂贵。大磁珠的优点:(1)技术简单,分离可在试管中完成;(2)易于增减细胞用量;(3)速度快,得率高;(4)成本低。缺点:(1)对细胞造成机械压力,影响其生物学活性,不利于分离后培养;(2)纯度低;(3)容易阻塞fcm的喷嘴。
4、鸡的t淋巴细胞对于抗沙门菌感染起着至关重要的作用,但是各种t细胞与抗原递呈细胞间的相互作用并不清楚,因此,我们迫切的需要一种能够放大单种细胞间相互作用的培养方法。流式分选能够分选出更高纯度的细胞,因此,建立一种基于流式分选下的细胞培养条件的确定显得尤为重要。
技术实现思路
1、鉴于以上所述的需求,本发明的目的在于建立一种基于流式分选下的t细胞体外培养技术,以满足高纯度细胞放大细胞间相互作用的需求。
2、本发明的一个目的在于通过流式分选得到高纯度的t细胞。
3、本发明的另一个目的在于确定流式分选后的t淋巴细胞的培养方法。
4、本发明提供的技术方案如下:
5、基于流式分选的鸡原代t细胞的体外分离及培养方法,包括以下步骤:从鸡外周血中分离出免疫细胞,并进行分选前样品处理;流式分选仪分选经过样品处理后的细胞;对经过流式分选仪分选后的cd3抗体阳性的t淋巴细胞进行纯度检测,并将经过流式分选仪分选后的cd3抗体阳性的t淋巴细胞与感染沙门菌后的巨噬细胞共培养,检测共培养后t细胞的il-6和il-1β产生情况,得到鸡原代t细胞。
6、进一步的,经过流式分选仪分选后的cd3抗体阳性的t淋巴细胞的培养温度为37℃。
7、进一步的,经过流式分选仪分选后的cd3抗体阳性的培养基中含有10%胎牛血清。
8、进一步的,对经过培养的cd3抗体阳性的t淋巴细胞提取rna,采用qrt-pcr方法对il-6和il-1β产生情况进行检测。
9、进一步的,qrt-pcr方法采用的引物序列如下:
10、
11、
12、进一步的,qrt-pcr反应体系如下:
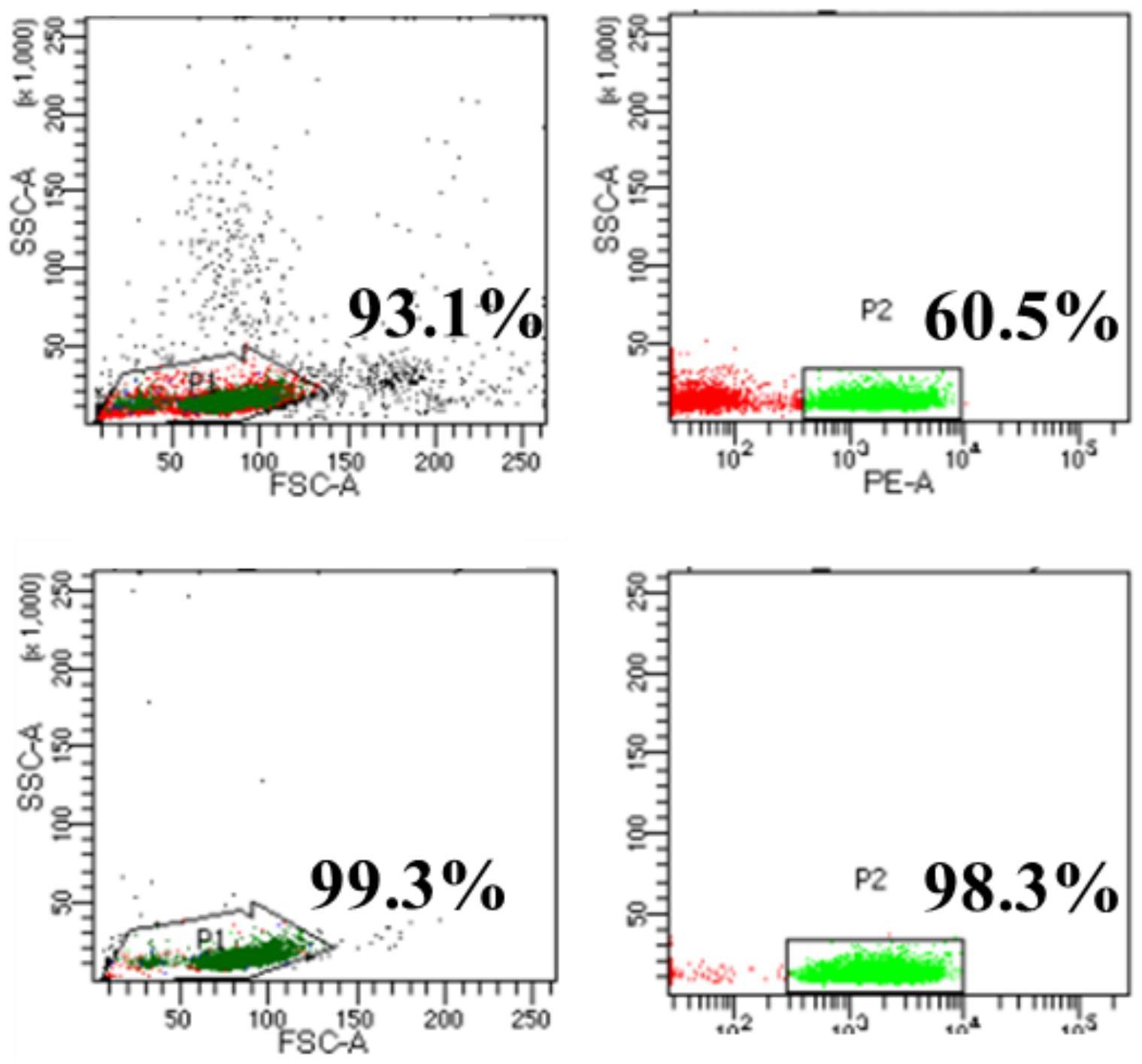
13、
14、进一步的,对鸡外周血中分离出免疫细胞采用表面抗体mouse anti-chickencd3-pe标记。
15、进一步的,所述分选前样品处理包括以下步骤:
16、采用翅静脉采血法用肝素锂抗凝管收集鸡抗凝血;在离心管中贴壁加入分离液和新鲜抗凝血,离心后液体分层,用吸管缓慢吸出白膜层,将收集到的白膜层细胞用清洗液稀释洗涤并离心;用pbs重悬细胞,并加入mouse anti-chicken cd3-pe,吹打混匀,避光孵育,离心pbs重悬细胞。
17、进一步的,所述流式分选仪分选细胞包括以下步骤:
18、将经过处理后的免疫细胞悬液压入流式细胞以流动室进行检测,液流系统将样本悬液定位在光源的中心处,激发光学系统,当一个细胞流经过流式细胞仪器的激光束时,对散射和荧光检测器产生光脉冲,光脉冲随后被转化为电压脉冲;流式检测仪内的检测分析系统将脉冲信号转化为数字信号,计算出每个脉冲峰的高度、宽度和面积;进行facs法细胞分选,分选cd3抗体阳性的t淋巴细胞。
19、进一步的,所述纯度检测包括以下步骤:
20、通过流式细胞术测定cd3+t细胞的纯度;用直方图或散点图显示流式细胞仪得到的数据;使用fsc-ssc物理图圈定目标细胞群,排除多细胞团块的影响;通过h和a参数,取出粘连细胞,fsc-w/ssc-a通道圈定fsc-w坐标50-100所有细胞;通过圈出细胞所占总细胞的比例分析分选所得细胞的纯度。
21、本发明技术方案的进一步改进在于,所述分选细胞包括以下步骤:
22、1.采用翅静脉采血法用肝素锂抗凝管收集5ml鸡抗凝血并使用密度梯度离心法分离pbmcs。
23、将上述所得细胞用200μl含有1% bsa的pbs重悬细胞,并加入2.5μl的mouseanti-chicken cd3-pe,吹打混匀。4℃,避光孵育30min。
24、4℃,1000r/min,离心5min。弃上清,用2ml含pbs重悬细胞,上述条件离心,弃上清,洗涤三遍。用含2.5%bsa的pbs重悬细胞,将细胞转移至流式管中。并利用流式分选仪进行分选。
25、2.所述确定流式分选后的t淋巴细胞的培养方法
26、①将细胞于不同温度下培养并比较死亡率;
27、②将细胞于含不同种类血清培养基中培养并比较死亡率;
28、③将细胞于含不同浓度胎牛血清培养基中培养并比较死亡率;
29、④将细胞于含与不含hepes浓度培养基中培养并比较死亡率;
30、①分选出的cd3+t细胞于含有10%fbs和2%青、链霉素的rpmi1640中培养,分别置于37℃和42℃细胞培养箱中培养。每天检测细胞死亡率。
31、②分选出的cd3+t细胞分别于含有10%fbs、10%鸡血清和5%fbs+5%鸡血清和2%青、链霉素的rpmi1640中,置于37℃,5%co2培养。每天检测细胞死亡率。
32、③分选出的cd3+t细胞分别于含有10%fbs、20%fbs、30%fbs、40%fbs和50%fbs,2%青、链霉素的rpmi1640中,置于37℃,5%co2培养。每天检测细胞死亡率。
33、④分选出的cd3+t细胞分别于含和不含有20mm的hepes的rpmi1640(含有10%fbs和2%青、链霉素)中,置于37℃,5%co2培养。每天检测细胞死亡率。
34、3.一种检测细胞死亡的方法
35、取培养基1/10体积的10-50μm的pi溶液,在37℃培养细胞10-20min。用pbs洗涤细胞两次。然后用流式细胞仪检测。
36、分选后的cd3+t细胞适宜使用rpmi1640(含10%fbs+2%青、链霉素)作为培养基,在37℃,5%co2下培养。
37、4.将分选后的t细胞与事先使用肠炎沙门菌(c50041)及鸡白痢沙门菌(c79/13)感染过的巨噬细胞进行共培养,72h后检测t细胞的细胞因子情况。
38、有益效果
39、本专利通过流式分选获得高纯度细胞,并在保证高纯度t细胞的前提下优化了单独培养鸡t淋巴细胞的条件,使其死亡率显著降低并节约培养成本;并成功将其应用于沙门菌感染后的细胞共培养,采用本发明方法可以得到更高纯度的细胞,且细胞死亡率更低。目前鲜有报道关于流式分选后鸡原代细胞培养条件的建立,本发明能为培养分选后鸡原代细胞的方法提供依据。
- 还没有人留言评论。精彩留言会获得点赞!