一种野黄芩苷元类化合物及其制备方法和应用
本发明属于医药化学领域,具体涉及一种野黄芩苷元类化合物及其制备方法和应用。
背景技术:
1、阿尔茨海默病(alzheimer’s disease,ad)已成为一个全球性的人类健康问题。随着人类寿命的延长,阿尔茨海默病的发病率也在不断上升,预计到2050年,全球阿尔茨海默病患者将达到1.52亿人。ad是一种进展缓慢、最终致命的退行性脑疾病,给患者及其家属带来巨大的经济和情感压力。不幸的是,目前基于药物的治疗只能适度改善学习和记忆,并且没有有效的治疗方法来减少或阻止ad的进展。因此,开发ad的新疗法成为现代医学的一大挑战。尽管ad的发病机制尚不完全清楚,但与ad的病理发展密切有关的,包括淀粉样蛋白-β(aβ)、tau蛋白、活性氧(reactive oxygen species,ros)、金属离子的异常积累以及神经炎症等。
2、aβ是由淀粉样前体蛋白(app)的蛋白水解产生的,β-分泌酶(β-site appcleavage enzyme,bace)切割该蛋白的n端,然后γ-分泌酶切割该蛋白的羧基端片段(ctfβ),形成aβ肽。淀粉样蛋白假说认为,在ad的发展过程中,aβ-肽以α-螺旋结构的形式,依次转化为β-片结构、单体、寡聚体,最后形成纤维。aβ聚集物的积累通过刺激细胞凋亡、炎症、突触和神经元损伤等一系列神经毒性途径,从而加速ad的进程。aβ作为ad的主要病理标志物,抑制aβ沉积被认为是ad潜在的治疗策略。
3、由于大脑对氧气的高需求和抗氧化防御系统的缺乏,大脑非常容易受到氧化应激(oxidative stress,os)的伤害。大量证据表明,ros过度生成导致os,os在ad的发病机制和病理生理学中起着关键作用。ad早期的os可能是启动ad其他病理机制所必需的,如aβ和tau诱导的神经毒性。因此,清除或阻止ros的形成可能有助于阻止ad的进展。ad作为一种神经炎症疾病,神经炎症在其发病过程中起着重要的作用。
4、2019年11月,我国中科院上海药物研究所及上海绿谷制药联合研发原创的抗ad新药甘露特钠胶囊(gv-971)获批上市。gv-971(甘露寡糖二酸),通过重塑肠道菌群的平衡,抑制肠道菌群特定代谢产物的异常增多,减少外周及中枢的炎症作用来治疗ad。又如2021年fda批准的渤健(biogen)公司研发的阿尔茨海默症新药阿杜那单抗(aducanumab,商品名aduhelm),经临床研究显示可以选择性结合β-淀粉样蛋白,从而清除阿尔茨海默病患者大脑中的β-淀粉样蛋白堆积。从近期批复的药物可以看出,靶向抗炎和抑制aβ沉积的药物具有较大的潜能。
5、另一方面,鉴于ad复杂的发病机制和病理表现,多靶点导向配体(multi-target-directedligands,mtdls)通过将两个或多个相关药效团片段组合,同时作用于ad多种致病途径,比单一靶点药物发挥更好的疗效,可能为ad的治疗开辟了全新的治疗途径。
6、我国中医药在ad防治中具有一定的功用。早在1436年《滇南本草》一书中,就收录了民间治疗脑瘫的药用植物──灯盏花。灯盏花,又名灯盏细辛,为菊科植物短葶飞蓬(erigeronbreviscapus(vant.)hand-mazz),以根或全草入药,主要分布在我省西南地区,具有祛风散寒,活血通络止痛等功效。野黄芩苷,又名灯盏花乙素(scutellarin,scu),是中药灯盏花最重要的活性成分,占灯盏花素含量90%以上,其化学名为4,5,6-三羟基黄酮-7-葡糖醛酸苷(结构式如式(a)所示)。
7、现有技术中证实,野黄芩苷具有抗氧化、抗炎、血管舒张、抗血小板、抗凝血、心肌保护等多种药理活性。研究发现,野黄芩苷可缓解aβ25-35诱导ad大鼠学习和记忆能力的损伤,使ad大鼠脑组织中的超氧化物歧化酶(superoxide dismutase,sod)活性、单胺氧化酶(monoamine oxidase,mao)活性、il-1β、il-6及tnf-α水平明显降低,并能抑制神经元的凋亡,具有改善认知的作用。野黄芩苷通过与aβ42结合,有效地抑制寡聚化和纤维形成,并降低aβ寡聚物诱导的sh-sy5y细胞毒性,对干预ad样神经病理学的发展或进展具有有益作用。然而,野黄芩苷药代动力学性质不佳,其在水中的溶解度仅为0.16mg/ml,在体内消除很快,生物半衰期仅为(2.27±0.58)min。野黄芩苷因其溶解性差和生物利用度低大大限制了其临床应用。对野黄芩苷的体内代谢研究发现,野黄芩苷在肠道水解为野黄芩苷元(scutellarein),其口服生物利用度是野黄芩苷的3倍,与野黄芩苷相比,具有更优的生物活性。
8、
9、本研究通过对野黄芩苷元进行改造,设计合成系列化合物,期望设计出具有抗氧化、抗炎和抑制aβ沉积多靶点抗ad的药物分子。
技术实现思路
1、第一方面,本发明提供一种式(i)所示的化合物、其立体异构体、互变异构体、同位素标记物、氮氧化物、溶剂化物、多晶型物、代谢产物、酯、药学上可接受的盐或前药,
2、
3、式(i)中,
4、r1选自-c1-6烷基、-c1-6烷基-c6-20芳基、-c6-20芳基、-c6-20芳基-3至10元杂环基;其中c6-20芳基、c3-10杂环基任选的被一个、两个或多个ra取代;
5、r2选自h、羟基、卤素、c1-6烷基、c1-6烷氧基;
6、r3选自h、羟基、卤素、c1-6烷基、c1-6烷氧基;
7、r4选自h、羟基、卤素;
8、r5选自h、羟基、卤素;
9、ra选自h、羟基、卤素、c1-6烷基、c1-6烷氧基。
10、在一些实施方案中,r1选自-c1-6烷基、-c1-6烷基-c6-10芳基、-c6-10芳基、-c6-10芳基-3至6元杂环基;其中c6-10芳基、3至6元杂环基任选的被一个、两个或多个ra取代;
11、优选地,r1选自-c1-3烷基、-c1-3烷基-c6-10芳基、-c6-10芳基、-c6-10芳基-3至6元杂环基;其中c6-10芳基、3至6元杂环基任选的被一个、两个或多个ra取代;
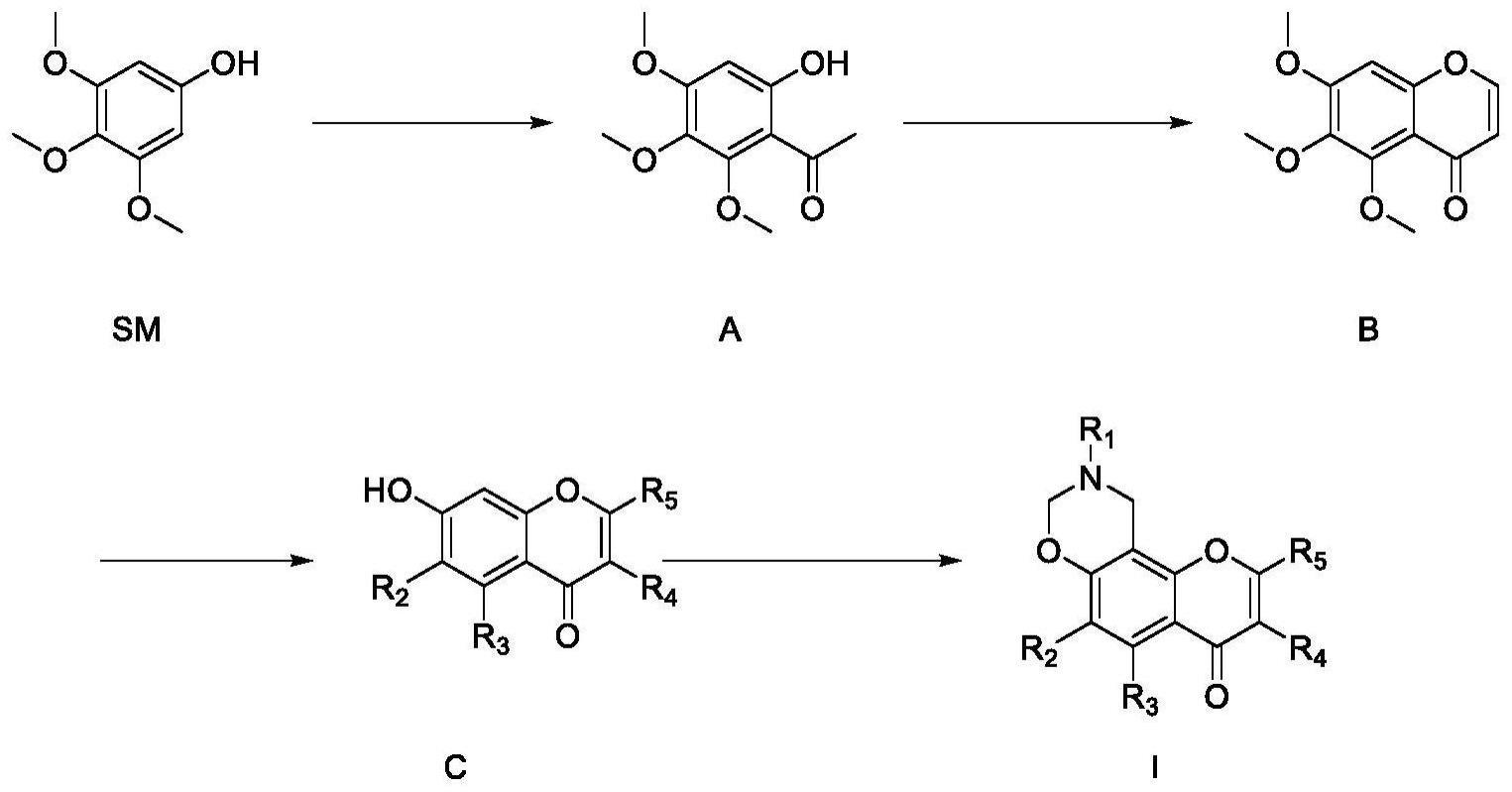
12、进一步优选地,r1选自-c1-3烷基、-c1-3烷基-c6芳基、-c6芳基、-c6芳基-6元杂环基;其中c6芳基、6元杂环基任选的被一个、两个或多个ra取代。
13、在一些实施方案中,6元杂环基包含1-3个杂原子,例如哌嗪基、哌啶基。
14、在一些实施方案中,r1选自甲基、乙基、丙基、-亚甲基-苯基、-亚甲基-联苯基、苯基、联苯基、-苯基-哌嗪基、-联苯基-哌嗪基;其中苯基、联苯基、哌嗪基任选的被一个、两个或多个ra取代。
15、在一些实施方案中,ra选自h、羟基、卤素、c1-3烷基、c1-3烷氧基。
16、在一些实施方案中,r1选自甲基、乙基、苯基、苄基、卤素取代的苯基、羟基取代的苯基、甲氧基取代的苯基、乙基哌嗪基取代的苯基。
17、在一些实施方案中,r2选自羟基。
18、在一些实施方案中,r3选自羟基。
19、在一些实施方案中,r4选自h。
20、在一些实施方案中,r5选自h。
21、在一些实施方案中,式(i)所示的化合物选自如下化合物:
22、
23、第二方面,本发明提供上述式(i)所示的化合物、其立体异构体、互变异构体、同位素标记物、氮氧化物、溶剂化物、多晶型物、代谢产物、酯、药学上可接受的盐或前药的制备方法,所述制备方法包括以下步骤:
24、(1)式sm化合物和bf3·et2o反应生成式a化合物;
25、(2)式a化合物经反应生成式b化合物;
26、(3)式b化合物经反应生成式c化合物;
27、(4)式c化合物和化合物r1-nh2反应制得式i化合物;
28、
29、其中,r1、r2、r3、r4具有上述定义。
30、在一些实施方案中,步骤(1)中,溶剂为acoh。
31、在一些实施方案中,步骤(2)中,反应在n,n-二甲基甲酰胺二甲基缩醛(dmf-dma)条件下进行;
32、和/或,反应溶剂为丙酮。
33、在一些实施方案中,步骤(3)中,反应在bbr3条件下进行;
34、和/或,反应溶剂为二氯甲烷。
35、在一些实施方案中,步骤(4)中,反应在hcho条件下进行;
36、和/或,反应溶剂为甲醇。
37、其中式sm化合物、三氟化硼乙醚配合物bf3·et2o、dmf-dmac、bbr3、hcho、4-(4-乙基-1-哌嗪基)苯胺为市售化合物或者本领域技术人员采用常规技术手段获取得到。
38、第三方面,本发明提供一种药物组合物,所述药物组合物包括上述式(i)所示的化合物、其立体异构体、互变异构体、同位素标记物、氮氧化物、溶剂化物、多晶型物、代谢产物、酯、药学上可接受的盐或前药。
39、在一些实施方案中,所述药物组合物任选地包含至少一种另外的活性成分。
40、在一些实施方案中,另外的活性成分包括胆碱酯酶抑制剂(例如多奈哌齐、利凡斯的明、加兰他敏、石杉碱甲)、n-甲基-d-天冬氨酸受体拮抗剂(例如美金刚)、甘露特钠胶囊(gv-971)和阿杜那单aduhelm。
41、在一些实施方案中,所述药物组合物任选地包含至少一种药学上可接受的辅料。
42、在一些实施方案中,药学上可接受的辅料包括可药用载体,溶剂、抛射剂、增溶剂、助溶剂、乳化剂、着色剂、黏合剂、崩解剂、填充剂、润滑剂、润湿剂、渗透压调节剂、稳定剂、助流剂、矫味剂、防腐剂、助悬剂、包衣材料、芳香剂、抗黏合剂、整合剂、渗透促进剂、ph值调节剂、缓冲剂、增塑剂、表面活性剂、发泡剂、消泡剂、增稠剂、包合剂、保湿剂、吸收剂、稀释剂、赋形剂、絮凝剂与反絮凝剂、助滤剂、释放阻滞剂等药学辅料。
43、在一些实施方案中,上述式(i)所示的化合物、其立体异构体、互变异构体、同位素标记物、氮氧化物、溶剂化物、多晶型物、代谢产物、酯、药学上可接受的盐或前药与可药用载体、稀释剂或赋形剂等药学辅料制成片剂、胶囊剂、散剂、颗粒剂、溶液剂、乳剂、混悬剂等,适用于经口、胃肠外给药。
44、在一些实施方案中,给药方法包括、但不限于口服、皮内、肌内、腹膜内、静脉内、皮下、鼻内和经口途径。
45、在一些实施方案中,所述制剂可以,但不限于,通过输注、推注、经皮吸收等途径施用。所述制剂可以通过本领域已知的制备方法制备。
46、第四方面,本发明提供上述式(i)所示的化合物、其立体异构体、互变异构体、同位素标记物、氮氧化物、溶剂化物、多晶型物、代谢产物、酯、药学上可接受的盐或前药以及上述药物组合物在制备治疗和/或治疗阿尔茨海默病的药物中的用途。
47、有益效果
48、本发明提供一种新的式(i)所示的化合物,所述化合物具有抗氧化和抑制aβ蛋白沉积等活性,能够实现阿尔茨海默病的多靶向治疗。
49、术语定义与说明除非另有说明,本技术说明书和权利要求书中记载的基团和术语定义,包括其作为实例的定义、示例性的定义、优选的定义、表格中记载的定义、实施例中具体化合物的定义等,可以彼此之间任意组合和结合。这样的组合和结合后的基团定义及化合物结构,应当被理解为本技术说明书和/或权利要求书记载的范围内。
50、除非另有说明,本说明书和权利要求书记载的数值范围相当于至少记载了其中每一个具体的整数数值。例如,数值范围“1-40”相当于记载了数值范围“1-10”中的每一个整数数值即1、2、3、4、5、6、7、8、9、10,以及数值范围“11-40”中的每一个整数数值即11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40。应当理解,本文在描述取代基时使用的一个、两个或更多个中,“更多个”应当是指≥3的整数,例如3、4、5、6、7、8、9或10。
51、一般而言,术语“取代的”表示所给结构中的一个或多个氢原子被具体取代基所取代。进一步地,当该基团被1个以上所述取代基取代时,所述取代基之间是相互独立,即,所述的1个以上的取代基可以是互不相同的,也可以是相同的。除非其他方面表明,一个取代基团可以在被取代基团的各个可取代的位置进行取代。当所给出的结构式中不只一个位置能被选自具体基团的一个或多个取代基所取代,那么取代基可以相同或不同地在各个位置取代。其中所述的取代基可以是,但并不限于,=o、氢、氘、氰基、硝基、卤素、烷基、卤代烷基、烷氧基、羧基、环烷基、环烷基氧基、杂环基、杂环基烷基、芳基、芳基烷基、芳基氧基、杂芳基、杂芳基烷基、杂芳基氧基等。
52、另外,需要说明的是,除非以其他方式明确指出,在本发明中所采用的描述方式“…独立地选自”应做广义理解,是指所描述的各个个体之间是相互独立的,可以独立地选自相同或不同的具体基团。更详细地,描述方式“…独立地选自”既可以是指在不同基团中,相同符号之间所表达的具体选项之间互相不影响;也可以表示在相同的基团中,相同符号之间所表达的具体选项之间互相不影响。
53、在本说明书的各部分,本发明公开化合物的取代基按照基团种类或范围公开。特别指出,本发明包括这些基团种类和范围的各个成员的每一个独立的次级组合。例如,术语“c1-6烷基”特别指独立公开的c1烷基、c2烷基、c3烷基、c4烷基、c5烷基或c6烷基。
54、在本发明的各部分,描述了连接取代基。当该结构清楚地需要连接基团时,针对该基团所列举的马库什变量应理解为连接基团。例如,如果该结构需要连接基团并且针对该变量的马库什基团定义列举了“烷基”或“芳基”,则应该理解,该“烷基”或“芳基”分别代表连接的亚烷基基团或亚芳基基团。
55、本发明化合物中的“氢”、“碳”、氧”包括其所有同位素。同位素应理解为包括具有相同原子数但具有不同质量数的那些原子。举例来说,氢的同位素包括氕、氚和氘,碳的同位素包括12c、13c和14c,氧的同位素包括16o和18o等。
56、本发明的“卤素”是指氟、氯、溴、碘。本发明的“卤代”是指被氟、氯、溴或碘取代。
57、本发明的“c1-6烷基”指含1至6个碳原子的直链或支链基团,进一步优选含有1至3个碳原子的直链或支链基团,非限制性实例包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、仲丁基、正戊基、1,1-二甲基丙基、1,2-二甲基丙基、2,2-二甲基丙基、1-乙基丙基、2-甲基丁基、3-甲基丁基、正己基等。烷基可以是取代的或未取代的,当被取代时,取代基可以在任何可使用的连接点上。
58、本发明的“c1-6烷氧基”是指-o-c1-6烷基。c1-6烷基具有上述定义。
59、本发明的“3至10元杂环基”是指具有1至4个环杂原子(其中每个杂原子独立地选自氮、氧、硫、硼、磷以及硅)的3至10元非芳香族环系统的基团。在包含一个或多个氮原子的杂环基基团中,连接点可以是碳或氮原子,只要化合价许可。杂环基基团可以是饱和的或可以是部分不饱和的。杂环基的每个实例可以是任选取代的或未取代的,当被取代时,取代基可以在任何可使用的连接点上。
60、本发明的“c6-20芳基”是指可以包含单环或稠合多环的含有6个至20个碳原子的芳香体系,优选包含单环或稠合双环的芳香体系,优选含有6至12个碳原子。合适的芳基包括但不限于苯基、萘基、蒽基、四氢萘基、芴基、茚满基。芳基可以是任选取代的或未取代的,当被取代时,取代基可以在任何可使用的连接点上。
61、“立体异构体”是指具有相同化学构造,但原子或基团在空间上排列方式不同的化合物。立体异构体包括对映异构体、非对映异构体、构象异构体(旋转异构体)、几何异构体(顺/反)异构体、阻转异构体,等等。
62、“互变异构体”是指具有不同能量的可通过低能垒(low energy barrier)互相转化的结构异构体。若互变异构是可能的(如在溶液中),则可以达到互变异构体的化学平衡。例如,质子互变异构体(proton tautomer)(也称为质子转移互变异构体(prototropictautomer))包括通过质子迁移来进行的互相转化,如酮-烯醇异构化和亚胺-烯胺异构化。价键互变异构体(valen cetautomer)包括通过一些成键电子的重组来进行的互相转化。酮-烯醇互变异构的具体实例是戊烷-2,4-二酮和4-羟基戊-3-烯-2-酮互变异构体的互变。互变异构的另一个实例是酚-酮互变异构。酚-酮互变异构的一个具体实例是吡啶-4-醇和吡啶-4(1h)-酮互变异构体的互变。除非另外指出,本发明化合物的所有互变异构体形式都在本发明的范围之内。
63、本发明的“氮氧化物”是指当化合物含几个胺官能团时,可将1个或大于1个的氮原子氧化形成n-氧化物。n-氧化物的特殊实例是叔胺的n-氧化物或含氮杂环氮原子的n-氧化物。可用氧化剂例如过氧化氢或过酸(例如过氧羧酸)处理相应的胺形成n-氧化物(参见advanced organic chemistry,wiley interscience,第4版,jerry march,pages)。尤其是,n-氧化物可用l.w.deady的方法制备(syn.comm.1977,7,509-514),其中例如在惰性溶剂例如二氯甲烷中,使胺化合物与间-氯过氧苯甲酸(mcpba)反应。
64、“前药”,代表一个化合物在体内转化为式(i)所示的化合物。这样的转化受前体药物在血液中水解或在血液或组织中经酶转化为母体结构的影响。本发明前体药物类化合物可以是酯,在现有的发明中酯可以作为前体药物的有苯酯类,脂肪族(c1-24)酯类,酰氧基甲基酯类,碳酸酯,氨基甲酸酯类和氨基酸酯类。例如本发明里的一个化合物包含羟基,即可以将其酰化得到前体药物形式的化合物。其他的前体药物形式包括磷酸酯,如这些磷酸酯类化合物是经母体上的羟基磷酸化得到的。关于前体药物完整的讨论可以参考以下文献:t.higuchiand v.stella,pro-drugsas novel delivery systems,vol.14of thea.c.s.symposium series,edward b.roche,ed.,bioreversible carriersin drugdesign,american pharmaceutical associationandpergamon press,1987,j.rautioetal.,prodrugs:designand clinical applications,nature reviewdrugdiscovery,2008,7,255-270,and s.j.heckeretal.,prodrugs of phosphatesandphosphonates,journal of medicinal chemistry,2008,51,2328-2345。
65、本发明所使用的术语“代谢产物”是指具体的化合物或其盐在体内通过代谢作用所得到的产物。一个化合物的代谢产物可以通过所属领域公知的技术来进行鉴定,其活性可以通过如本发明所描述的那样采用试验的方法进行表征。这样的产物可以是通过给药化合物经过氧化,还原,水解,酰氨化,脱酰氨作用,酯化,脱脂作用,酶裂解等等方法得到。相应地,本发明包括化合物的代谢产物,包括将本发明的化合物与哺乳动物充分接触一段时间所产生的代谢产物。
66、药学上可接受的盐可以是例如在链或环中具有氮原子的具有足够碱性的本发明的化合物的酸加成盐,例如与如下无机酸形成的酸加成盐:例如盐酸、氢氟酸、氢溴酸、氢碘酸、硫酸、焦硫酸、磷酸或硝酸,或硫酸氢盐、或者与如下有机酸形成的酸加成盐:例如甲酸、乙酸、乙酰乙酸、丙酮酸、三氟乙酸、丙酸、丁酸、己酸、庚酸、十一烷酸、月桂酸、苯甲酸、水杨酸、2-(4-羟基苯甲酰基)苯甲酸、樟脑酸、肉桂酸、环戊烷丙酸、二葡糖酸、3-羟基-2-萘甲酸、烟酸、扑酸、果胶酯酸、过硫酸、3-苯基丙酸、苦味酸、特戊酸、2-羟基乙磺酸、衣康酸、氨基磺酸、三氟甲磺酸、十二烷基硫酸、乙磺酸、苯磺酸、对甲苯磺酸、甲磺酸、2-萘磺酸、萘二磺酸、樟脑磺酸、柠檬酸、酒石酸、硬脂酸、乳酸、草酸、丙二酸、琥珀酸、苹果酸、己二酸、藻酸、马来酸、富马酸、d-葡糖酸、扁桃酸、抗坏血酸、葡庚酸、甘油磷酸、天冬氨酸、磺基水杨酸、半硫酸或硫氰酸。
67、另外,具有足够酸性的本发明的化合物的另一种适合的药学上可接受的盐是碱金属盐(例如钠盐或钾盐)、碱土金属盐(例如钙盐或镁盐)、铵盐,或与提供生理学可接受的阳离子的有机碱形成的盐,例如与如下物质形成的盐:钠离子、钾离子、n-甲基葡糖胺、二甲基葡糖胺、乙基葡糖胺、赖氨酸、二环己基胺、1,6-己二胺、乙醇胺、葡糖胺、葡甲胺、肌氨酸、丝氨醇、三羟基甲基氨基甲烷、氨基丙二醇、1-氨基-2,3,4-丁三醇。作为实例,所述药学上可接受的盐包括基团-cooh与如下物质形成的盐:钠离子、钾离子、钙离子、镁离子、n-甲基葡糖胺、二甲基葡糖胺、乙基葡糖胺、赖氨酸、二环己基胺、1,6-己二胺、乙醇胺、葡糖胺、葡甲胺、肌氨酸、丝氨醇、三羟基甲基氨基甲烷、氨基丙二醇、1-氨基-2,3,4-丁三醇。
68、另外,碱性含氮基团可用如下试剂季铵化:低级烷基卤化物,例如甲基、乙基、丙基和丁基氯化物、溴化物和碘化物;硫酸二烷基酯,例如硫酸二甲酯、硫酸二乙酯、硫酸二丁酯和硫酸二戊酯;长链卤化物,例如癸基、月桂基、肉豆蔻基和硬脂基氯化物、溴化物和碘化物;芳烷基卤化物如苄基和苯乙基溴化物等。作为实例,药学上可接受的盐包括盐酸盐、硫酸盐、硝酸盐、硫酸氢盐、氢溴酸盐、醋酸盐、草酸盐、柠檬酸盐、甲磺酸盐、甲酸盐或葡甲胺盐等。由于本发明的化合物可存在多个成盐位点,所述药学上可接受的盐不仅包括本发明化合物其中1个成盐位点上形成的盐,而且还包括其中2、3或全部成盐位点上形成的盐。为此,所述药学上可接受的盐中式(i)化合物与成盐所需的酸的根离子(阴离子)或碱的阳离子摩尔比可以在较大的范围内变化,例如可以是4:1~1:4,如3:1、2:1、1:1、1:2、1:3等。
69、本发明的“溶剂化物”在常规意义上是指溶质(如活性化合物、活性化合物的盐)和溶剂(如水)组合形成的复合物。溶剂是指本领域的技术人员所知的或容易确定的溶剂。如果是水,则溶剂化物通常被称作水合物,例如半水合物、一水合物、二水合物、三水合物或其替代量等。
70、本发明的“酯”是指含有羟基或羧基的化合物形成的体内可水解的酯。这样的酯是,例如在人或动物体内水解产生母体醇或酸的药学上可接受的酯。本发明式(i)化合物含有羧基,可以与适当的基团形成体内可水解的酯,这样的基团包括,但不限于,烷基、芳基烷基等。
71、本发明的“药物组合物”是指包含任何一种本发明所述的化合物,包括对应的异构体、前药、溶剂化物、药学上可接受的盐或其化学的保护形式,和一种或多种可药用载体和/或另一种或多种药物的混合物。药用组合物的目的是促进化合物对生物体的给药。所述组合物通常用于制备治疗和/或预防由一种或多种激酶介导的疾病的药物。
72、本发明的“可药用载体”是指对有机体不引起明显刺激性和不干扰所给予化合物的生物活性和性质的载体,包含所有的溶剂、稀释剂或其它赋形剂、分散剂、表面活性剂等渗剂、增稠剂或乳化剂、防腐剂、固体粘合剂、润滑剂等。除非任何常规载体介质与本发明化合物不相容。可以作为药学上可接受的载体的一些实例包括,但不限于糖类,如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和马铃薯淀粉;纤维素及其衍生物,如羧甲基纤维素钠、以及纤维素和乙酸纤维素;麦芽、明胶等。
73、本发明的“赋形剂”指加入到药用组合物中以进一步促进给予化合物的惰性物质。赋形剂可以包括碳酸钙、磷酸钙、多种糖类和多种类型的淀粉、纤维素衍生物、明胶、植物油、聚乙二醇。
74、本文所用的术语“治疗”,是指改善所述疾病或障碍(即,减慢或阻止或减少所述疾病或其至少一种临床症状的发展);或者是指减轻或改善至少一种机体参数,包括可能无法被患者辨别的那些机体参数;或者在身体上(例如症状)、生理学(例如身体参数)上或者这两方面调节所述疾病或障碍;或者预防或延迟所述疾病或障碍的发作、发生和进展。
- 还没有人留言评论。精彩留言会获得点赞!