一种具有直肠癌抑制作用的外泌体及其应用的制作方法
本发明涉及外泌体,尤其涉及一种具有直肠癌抑制作用的外泌体及其应用。
背景技术:
1、结直肠癌是常见的恶性肿瘤之一,在全球范围内,其发病率居恶性肿瘤第3位,死亡率居恶性肿瘤第2位,研究发现,8%-12%的crc患者携带braf突变基因,与braf野生型crc患者相比,这种类型的crc患者易发生腹膜种植转移和淋巴结转移,中位生存期一般不超过12个月,肿瘤微环境在肿瘤的发展和转移中发挥着重要作用,研究发现,与野生型相比,rafv600e突变型恶性肿瘤的微环境免疫状态更差,程序性死亡因子配体1(programmeddeathligand1,pd-l1)是重要的免疫负调节因子,据文献报道,在brafv600e突变型crc中,braf突变可以上调肿瘤表面pd-l1的表达,促进肿瘤侵袭、转移、化疗耐药和免疫逃逸,brafv600e突变型甲状腺癌中,肿瘤细胞常表达高水平的pd-l1和人白细胞抗原g的免疫抑制配体,且肿瘤组织中抑制性t细胞增加,显示出广泛的免疫抑制特征,braf抑制剂可以抑制黑色素瘤中t细胞及树突状细胞浸润,调节肿瘤的免疫微环境,从而抑制肿瘤增殖、促进细胞凋亡,在肿瘤微环境中,外泌体扮演着重要的角色,肿瘤相关巨噬细胞(tumor-associatedmacrophages,tams)及肿瘤相关成纤维细胞(cancer-associatedfibroblasts,cafs)是肿瘤微环境中的主要的组成成分,在其中发挥免疫抑制作用,促进肿瘤的发展、转移及血管形成,wang等人研究发现,crc分泌的外泌体将irna(mir-25-3p,mir-130b-3p,mir-425-5p)转移至巨噬细胞,激活pi3k/akt信号通路从而诱导巨噬细胞的m2极化,m2极化的巨噬细胞反过来通过增强上皮-间质转化(emt)和分泌血管内皮生长因子(vegf)促进了肿瘤肝转移;
2、现有的肝癌分泌的外泌体促进巨噬细胞分泌il-6,而褪黑素处理的肝细胞癌分泌的外泌体抑制了巨噬细胞il-6的分泌,从而改变了免疫抑制状态,不能有效的抑制肿瘤的侵袭及转移,为此我们提出一种具有直肠癌抑制作用的外泌体及其应用来解决上述问题。
技术实现思路
1、本发明的目的是为了解决现有技术中存在的问题,而提出的一种具有直肠癌抑制作用的外泌体及其应用。
2、为了实现上述目的,本发明采用了如下技术方案:
3、一种具有直肠癌抑制作用的外泌体,所述外泌体的制备准备包括以下步骤:
4、步骤1.实验材料:人结肠癌细胞株ht29-brafv600e突变型,简称ht29细胞,人结肠癌细胞株1627-braf基因沉默型,简称1627细胞,人单核细胞白血病细胞,简称thp-1细胞、人胚肺成纤维细胞,简称mrc-5细胞;
5、步骤2.实验试剂:mccoy’s5a培养基、rpmi1640培养基、mem培养液、胎牛血清、青链霉素、pbs缓冲液、0.25%胰蛋白酶、tris、sds、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、甘氨酸、甲醇、temed、tween-20、ecl发光试剂盒、pvdf膜、蛋白酶裂解液ripa、蛋白酶抑制剂、bca蛋白定量试剂盒、pma、dmso、兔抗人braf单克隆抗体、兔抗人cd63单克隆抗体、兔抗人cd9单克隆抗体、兔抗人fap单克隆抗体、兔抗人a-sma单克隆抗体、β-actin、辣根酶标记山羊抗兔igg、fitc鼠抗人cd68抗体、pe鼠抗人cd163抗体;
6、步骤3.实验仪器:生物安全柜、恒温水浴箱、倒置显微镜、生物显微镜、co2细胞培养箱、低速离心机、低温高速离心机、低温超速离心机、4℃/-20℃冰箱、-80℃低温冰箱、-130℃冰箱、透射电子显微镜、微量移液器、200目碳支持膜铜网、离心浓缩机、蛋白浓度定量仪、半干转膜仪系统、超纯水仪、凝胶玻璃板、固定夹、垂直电泳槽、转移电泳槽、电泳仪、电子天平、转移脱色摇床、旋涡混匀器、制冰机、酶标仪、流式细胞仪;
7、步骤4.溶液配制;
8、步骤4.1.1.5mtris-hcl(ph8.8,100ml),称取18.16gtris碱,加入50ml蒸馏水,充分溶解后向溶液中缓慢加浓盐酸至ph8.8,冷却至室温,加蒸馏水至100ml;
9、步骤4.2.1mtris-hcl(ph6.8,100ml),称取12.1gtris碱,加入50ml蒸馏水,充分溶解后溶液中缓慢加浓盐酸至ph6.8,冷却至室温,加蒸馏水至100ml;
10、步骤4.3.10%(w/v)sds(100ml),称取10g的sds,加蒸馏水至100ml,充分溶解;
11、步骤4.4.30%丙烯酰胺(100ml),29g丙烯酰胺、1g甲叉双丙烯酰胺,加蒸馏水至100ml,充分溶解;
12、步骤4.5.10%过硫酸铵(5ml),0.5g过硫酸铵加入5ml蒸馏水中,充分溶解;
13、步骤4.6.电泳缓冲液(1l),3gtris、14.4g甘氨酸、1gsds,加蒸馏水至1l,充分溶解;
14、步骤4.7.电转液(1l),3gtris、14.4g甘氨酸,添加200ml甲醇,加蒸馏水至1l;
15、步骤4.8.10xtbs缓冲液(1l),6.057gtris、8.775gnacl,加入100ml蒸馏水,充分溶解,再加入浓盐酸至ph7.4,最后加蒸馏水至1l;
16、步骤4.9.tbst缓冲液(1l),量取100ml配置好的10xtbs缓冲液,再取0.5mltween-20,最后加入蒸馏水至1l;
17、步骤4.10.封闭液(50ml),2.5g脱脂奶粉,加入到pbs中,充分溶解;
18、步骤4.11.10%分离胶的配制,取2.5ml的1.5mtris-hcl(ph8.8),3.94ml的蒸馏水,3.33ml的30%丙烯酰胺,100μl的10%sds,100μl的10%过硫酸铵,轻轻混匀后加入5μltemed;
19、步骤4.12.5%浓缩胶的配制,取0.75ml的1mtris-hcl(ph6.8),4.13ml的蒸馏水,1ml的30%丙烯酰胺,60μl的10%sds,60μl的10%过硫酸铵,轻轻混匀后加入5μltemed。
20、优选地,一种具有直肠癌抑制作用的外泌体,所述外泌体的培养包括以下步骤:
21、步骤1.细胞培养:ht29细胞、1627细胞采用含10%胎牛血清的mccoy's5a培养液培养,thp-1细胞采用含10%胎牛血清的rpmi1640培养液培养,mrc-5细胞采用含10%胎牛血清的mem培养液培养,细胞均置于37℃、含5%co2的恒温培养箱中,根据细胞生长状况,每1-2d传一次代,每次一传二,上述培养液均含有1%双抗,100μg/ml链霉素及100u/ml青霉素;
22、步骤2.细胞传代:倒置显微镜下观察ht29细胞、1627细胞的密度,当细胞长至约70%-80%的时候,弃去原有培养液,pbs冲洗细胞3遍,向培养瓶中加入1ml胰蛋白酶,倒置显微镜下观察细胞形态,待细胞变圆、细胞间隙增大时,加入3ml含10%胎牛血清的mccoy's5a培养液终止消化,一次性吸管轻轻吹打细胞,待细胞从培养瓶脱落后均匀分于2个培养瓶中,每个培养瓶中再加入4ml含有10%胎牛血清的mccoy's5a培养液,晃动培养瓶使细胞均匀平铺于瓶底,置于恒温培养箱中培养;
23、倒置显微镜下观察thp-1细胞的密度,当细胞长至约70%-80%的时候,收集细胞于15ml离心管中,1000r/min离心5min,弃上清,加入2ml含10%胎牛血清的rpmi1640培养液重悬细胞,均匀分于2个培养瓶中,每个培养瓶中再加入4ml含有10%胎牛血清的rpmi1640培养液,晃动培养瓶使细胞均匀平铺于瓶底,置于恒温培养箱中培养;
24、步骤3.样本蛋白提取:收集ht29、1627细胞,含抑制酶的ripa裂解液冰上裂解20min,12000r/min离心20min(4℃),取上清备用;
25、步骤3.1.灌胶:将10%的分离胶灌入玻璃槽中,直至距样品梳子底部约1.0cm,去离子水缓慢覆盖胶面,室温静置40min至分离胶凝固,倒掉去离子水覆盖液,并用吸水纸吸掉残留的液体,加入5%浓缩胶,插入样品梳,室温凝胶40min,轻轻拔去梳子,将玻璃夹板用夹子固定在电泳槽上;
26、步骤.3.2.样品变性:蛋白样品测定浓度后,加入相应体积的4×蛋白质上样缓冲液,轻轻混匀,95℃变性10min,冰上备用;
27、步骤3.3.电泳:将样品轻轻加至凝胶孔中,电泳仪设置成稳压状态,接通电源,将电压调至100v,使样品通过浓缩胶与分离胶,待marker分开后,调整电压为120v,直至溴酚蓝跑至底部时,结束电泳;
28、步骤4.转膜:电泳结束后取下电泳板,去掉上层玻璃板,取出夹板中的垫片,据目的蛋白大小切除多余凝胶,电转液中漂洗一次,根据切胶的大小,剪裁合适的pvdf膜,置于100%甲醇中浸泡1min,水、电转液依次浸泡5min,置于电转液中备用,剪裁与切胶大小相同的6层滤纸,由正极侧开始,依次为6层滤纸→pvdf膜→样品胶→6层滤纸,扣紧转膜夹后放入电泳槽中,接通电源,恒流250ma转膜47min;
29、步骤5.1.细胞上清液的收集:倒置显微镜下观察ht29细胞、1627细胞生长情况,待细胞生长覆盖至培养瓶底部约70%-80%时,弃去原有培养液,pbs冲洗3遍后向培养瓶加入15ml不含胎牛血清的mccoy’s5a培养液(含1%双抗),恒温培养箱中培养48h,最后收集培养液于50ml离心管中,用于外泌体的提取;
30、5.2外泌体提取:将收集到的培养液480×g离心5min(4℃),去除细胞,取上清2000×g离心10min(4℃),去除较大的细胞碎片,取上清10000×g离心30min(4℃),去除较小的细胞碎片及其他亚结构,取上清以超速100000×g离心2h(4℃),弃去上清,0.5mlpbs重悬外泌体,充分混匀,分装标记后-80℃保存备用。
31、优选地,一种具有直肠癌抑制作用的外泌体及其应用,所述外泌体应用为巨噬细胞的诱导及鉴定,包括以下步骤:
32、步骤1.巨噬细胞诱导:收集对数生长期的thp-1细胞于15ml离心管中,1000r/min离心5min,弃上清,加入新鲜的rpmi1640培养液重悬外泌体,接种于12孔板中,每孔接种5×105个细胞,最后向培养液中加入终浓度为100ng/ml的pma溶液(溶解于dmso),恒温培养箱中培养48h;
33、步骤2.巨噬细胞鉴定:流式细胞术检测巨噬细胞cd68的表达水平,thp-1细胞经pma诱导48h后弃去培养液,pbs冲洗3次,每孔加入0.5ml胰酶,恒温培养箱中消化5min,然后加入1.5ml含10%胎牛血清的培养液终止消化,细胞收集于15ml离心管中,1000r/min离心5min,弃上清,pbs重悬后再次离心,留取沉淀,然后加入5μlcd68流式抗体,4℃避光孵育30min,pbs冲洗2遍,1000r/min离心5min,300μlpbs重悬后上机进行检测;
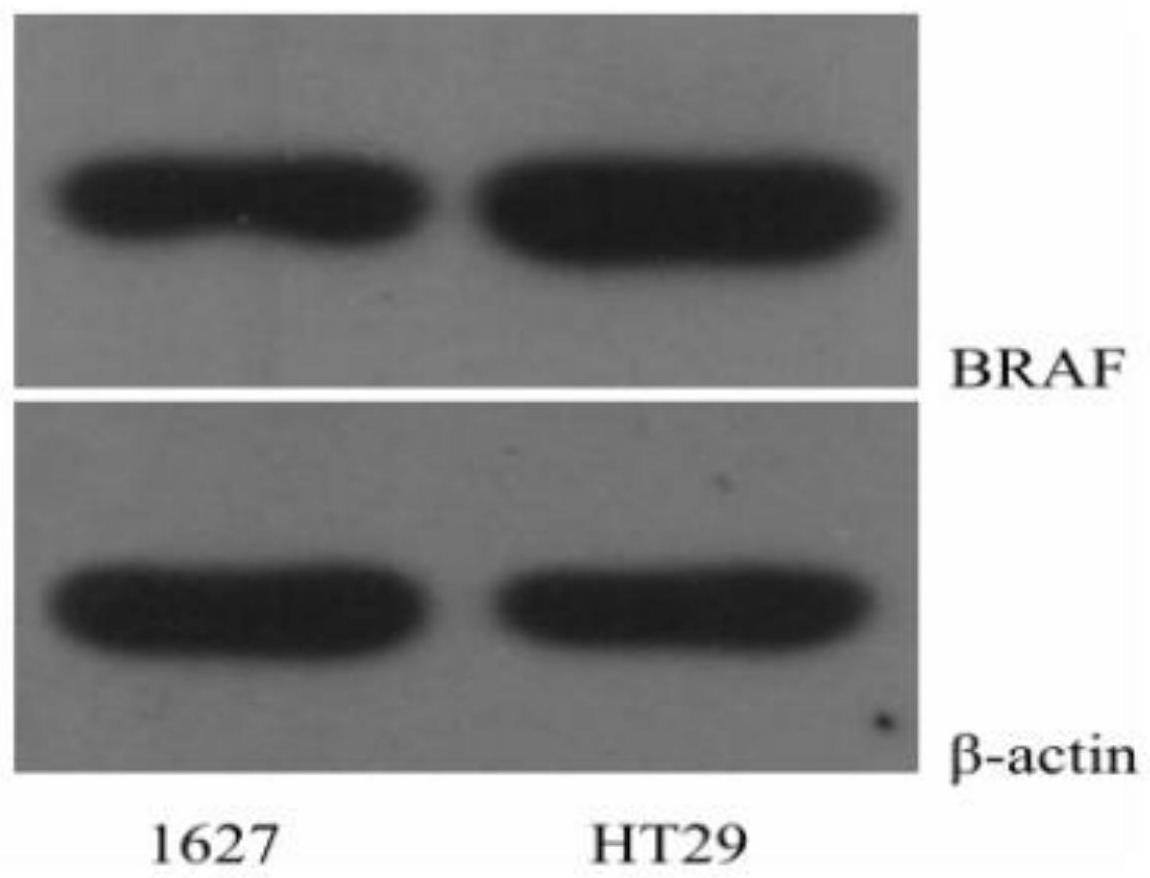
34、步骤3.westernblot法检测ht29、1627细胞braf蛋白表达水平:应用spss21.0进行数据分析,计量资料采用mean±sd表示,组内前后比较应用配对样本t检验,两组间计量资料采用独立样本t检验,两组以上比较采用单因素方差分析,westernblot结果显示,与ht29细胞相比,1627细胞的braf蛋白表达明显减少(p<0.05),提示1627细胞中braf基因沉默仍存在。
35、本发明中有益效果如下:外泌体沉默braf基因后,brafv600e突变型crc细胞来源的外泌体抑制巨噬细胞向m2型极化,从而有效的抑制肿瘤侵袭、远处转移和血管形成。
- 还没有人留言评论。精彩留言会获得点赞!