用于递送核酸的新型羰基脂质和脂质纳米颗粒制剂的制作方法
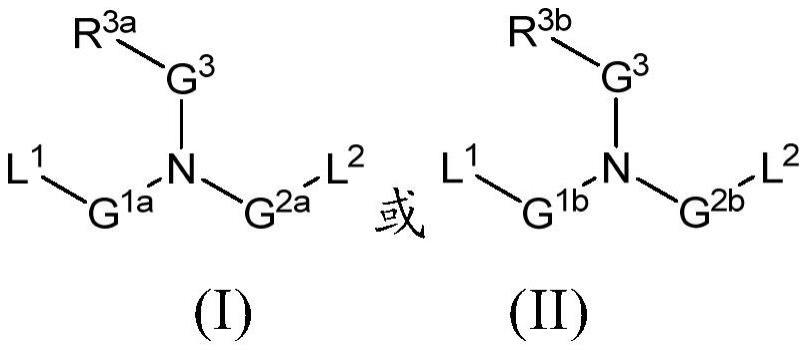
本发明的实施方案总体上涉及新型脂质,其可以与其他脂质组分(如中性脂质、胆固醇和聚合物缀合的脂质)组合使用,以形成脂质纳米颗粒以用于在体外和体内递送治疗剂,如核酸(例如寡核苷酸、信使rna)。相关技术描述与核酸递送相关的许多挑战影响生物系统中的期望响应。基于核酸的治疗具有巨大的潜力,但是仍然需要将核酸更有效地递送至细胞或有机体内的适当位点,以实现这种潜力。治疗性核酸包括如信使rna(mrna)、反义寡核苷酸、核酶、dna酶、质粒、免疫刺激性核酸、antagomir、antimir、模拟物、supermir和适配体。一些核酸,如mrna或质粒,可用于实现特定细胞产物的表达,这在治疗例如与蛋白质或酶缺乏有关的疾病中将是有用的。可翻译核苷酸递送的治疗应用极为广泛,因为可以合成构建体以产生任何选择的蛋白质序列,无论该序列是否是系统固有的。核酸的表达产物可以增加蛋白质的现有水平,替代蛋白质的缺失或无功能形式,或在细胞或有机体中引入新的蛋白质及相关功能。一些核酸如mirna抑制剂可用于实现受mirna调节的特定细胞产物的表达,这在治疗例如与蛋白质或酶缺乏相关的疾病中将是有用的。mirna抑制的治疗应用极为广泛,因为可以合成构建体来抑制一种或多种mirna,而所述一种或多种mirna继而会调节mrna产物的表达。抑制内源性mirna可以增加其下游靶标内源性蛋白表达,并恢复细胞或有机体中适当的功能,作为治疗与特定mirna或一组mirna相关的疾病的手段。其他核酸可以下调特定mrna的细胞内水平,因此可以通过诸如rna干扰(rnai)或反义rna的互补结合的过程下调相应蛋白质的合成。反义寡核苷酸和rnai的治疗应用也非常广泛,因为可以合成具有针对靶mrna的任何核苷酸序列的寡核苷酸构建体。靶标可以包括来自正常细胞的mrna,与疾病状态(如癌症)相关的mrna,以及感染原(如病毒)的mrna。迄今为止,在体外和体内模型中,反义寡核苷酸构建体均显示通过降解同源mrna特异性下调靶蛋白的能力。另外,目前正在临床研究中评价反义寡核苷酸构建体。然而,目前在治疗环境中使用寡核苷酸面临两个问题。首先,游离rna对血浆中的核酸酶消化敏感。其次,游离rna进入相关翻译机构所在的细胞内区室的能力有限。由与其他脂质组分(如中性脂质、胆固醇、peg、聚乙二醇化脂质)一起配制的脂质和寡核苷酸形成的脂质纳米颗粒已用于阻断血浆中rna的降解并促进细胞对寡核苷酸的摄取。仍然需要用于递送寡核苷酸的改良的脂质和脂质纳米颗粒。优选地,这些脂质纳米颗粒将提供最佳的药物:脂质比率,保护核酸免于血清中的降解和清除,适合全身或局部递送,并提供核酸的细胞内递送。此外,这些脂质-核酸颗粒应良好耐受,并提供足够的治疗指数,以便以有效剂量的核酸进行患者治疗与患者的不可接受的毒性和/或风险无关。本发明提供了这些以及相关的优点。简述简而言之,本发明的实施方案提供了脂质化合物(包括其立体异构体、药学上可接受的盐、前药或互变异构体),其可以单独使用或者与其他脂质组分(如中性脂质、带电脂质、类固醇(包括例如所有固醇)和/或其类似物、和/或聚合物缀合的脂质组合使用以形成脂质纳米颗粒以用于递送治疗剂。在一些情况下,脂质纳米颗粒用于递送诸如反义和/或信使rna的核酸。还提供了使用此类脂质纳米颗粒治疗各种疾病或病况(如由传染性实体和/或蛋白质不足引起的那些)的方法。在一个实施方案中,提供了具有以下结构(i)的化合物:或者其药学上可接受的盐、互变异构体、前药或立体异构体,其中r3a、l1、l2、g1a、g2a和g3如本文所定义。在其他实施方案中,提供了具有以下结构(ii)的化合物:或者其药学上可接受的盐、互变异构体、前药或立体异构体,其中r3b、l1、l2、g1b、g2b和g3如本文所定义。还提供了包含一种或多种上述结构(i)或(ii)的化合物和治疗剂的药物组合物。还提供了包含一种或多种结构(i)或(ii)的化合物的脂质纳米颗粒(lnp)。在一些实施方案中,药物组合物和/或lnp还包含一种或多种选自中性脂质、带电脂质、类固醇和聚合物缀合的脂质的组分。所公开的组合物可用于形成脂质纳米颗粒以用于递送治疗剂。在其他实施方案中,本发明提供了用于向有需要的患者施用治疗剂的方法,所述方法包括制备包含结构(i)或(ii)的化合物和治疗剂的脂质纳米颗粒的组合物,和将组合物递送至患者。例如,所述组合物可以包含含有一种或多种结构(i)或(ii)的化合物的lnp。参考以下详述后,本发明的这些和其他方面将变得显而易见。详述在以下描述中,阐述了某些特定细节以便提供对本发明的各种实施方案的透彻理解。然而,本领域技术人员将理解,可以在没有这些细节的情况下实践本发明。本发明的实施方案部分基于这样的新型脂质的发现:当用于脂质纳米颗粒中以将活性剂或治疗剂如核酸体内递送至哺乳动物细胞中时提供优势。特别地,本发明的实施方案提供了包含本文所述的一种或多种新型脂质的核酸-脂质纳米颗粒组合物,与先前所述的核酸-脂质纳米颗粒组合物相比,其提供了在体内增加的核酸活性和改良的组合物耐受性,从而导致治疗指数的显著增加提高。例如,实施方案提供了包含一种或多种结构(i)或(ii)的化合物的脂质纳米颗粒。在特定的实施方案中,本发明提供了新型脂质,其使得能够配制用于在体外和体内递送mrna和/或其他寡核苷酸的改良的组合物。在一些实施方案中,这些改良的脂质纳米颗粒组合物可用于表达由mrna编码的蛋白质。在其他实施方案中,这些改良的脂质纳米颗粒组合物可用于通过递送靶向一种特定mirna的mirna抑制剂或者调节一种靶mrna或几种mrna的一组mirna来上调内源性蛋白表达。在其他实施方案中,这些改良的脂质纳米颗粒组合物可用于下调(如沉默)靶基因的蛋白质水平和/或mrna水平。在一些其他实施方案中,脂质纳米颗粒也可用于递送mrna和质粒以表达转基因。在其他实施方案中,脂质纳米颗粒组合物可用于诱导由蛋白质表达产生的药理学效应,如通过递送适合的促红细胞生成素mrna增加红细胞的产生,或者通过递送编码适合抗原或抗体的mrna来保护免于感染。本发明的实施方案的脂质纳米颗粒和组合物可以用于多种目的,包括将封装的或缔合的(如,复合的)治疗剂如核酸在体外和体内递送至细胞。因此,本发明的实施方案提供了通过使有需要的对象与封装适合的治疗剂或与适合的治疗剂缔合的脂质纳米颗粒接触来治疗或预防所述对象中的疾病或病症的方法,其中所述脂质纳米颗粒包含本文所述的一种或多种新型脂质。如本文所述,本发明的脂质纳米颗粒的实施方案特别可用于核酸的递送,所述核酸包括如mrna、反义寡核苷酸、质粒dna、微rna(mirna)、mirna抑制剂(antagomir/antimir)、干扰信使rna的互补rna(micrna)、dna、多价rna、dicer底物rna、互补dna(cdna)等。因此,本发明的实施方案的脂质纳米颗粒和组合物可用于通过使细胞与包含本文所述的一种或多种新型脂质的脂质纳米颗粒接触来在体内和体外诱导期望蛋白质的表达,其中脂质纳米颗粒封装核酸或与核酸缔合,所述核酸经表达以产生期望蛋白质(如,编码期望蛋白质的信使rna或质粒)或抑制终止mrna(如,mirna抑制剂)表达的过程。可选地,本发明的实施方案的脂质纳米颗粒和组合物可用于通过使细胞与包含本文所述的一种或多种新型脂质(如结构(i)或(ii)的化合物)的脂质纳米颗粒接触来减少在体内和体外表达靶基因和蛋白质,其中脂质纳米颗粒封装核酸或与核酸缔合,所述核酸减少靶基因表达(如,反义寡核苷酸或小干扰rna(sirna))。本发明的实施方案的脂质纳米颗粒和组合物还可用于分别或组合共递送不同的核酸(如mrna和质粒dna),如可用于提供需要不同核酸(如,编码适合的基因修饰酶的mrna和用于掺入宿主基因组的dna区段)的共定位的作用。可以根据任何可用技术来制备与本发明的实施方案一起使用的核酸。对于mrna,主要的制备方法是但不限于酶促合成(也称为体外转录),这代表了目前最有效的产生长序列特异性mrna的方法。体外转录描述了从工程化的dna模板进行模板指导的rna分子合成的过程,该工程化的模板包含与编码目标基因的下游序列连接的上游噬菌体启动子序列(如,包括但不限于来自t7、t3和sp6大肠杆菌噬菌体的启动子序列)。可以使用本领域中众所周知的适当技术(包括但不限于质粒dna和聚合酶链式反应扩增)从多种来源制备用于在体外转录的模板dna(参见linpinsel,j.l和conn,g.l.,general protocols for preparationof plasmid dna template,以及bowman,j.c.,azizi,b.,lenz,t.k.,ray,p.,和williams,l.d.in rna in vitro transcription and rna purification by denaturing page inrecombinant and in vitro rna syntheses methods第941卷conn g.l.(编辑),newyork,n.y.humana press,2012)。在支持聚合酶活性同时使所得的mrna转录物的潜在降解最小化的条件下,在相应的rna聚合酶和腺苷、鸟苷、尿苷和胞苷核糖核苷三磷酸(rntp)的存在下,使用线性化的dna模板在体外进行rna转录。可以使用多种可商购获得的试剂盒以及可商购获得的试剂(包括rna聚合酶和rntp)进行体外转录,所述试剂盒包括但不限于ribomax大规模rna产生系统(promega)、megascript转录试剂盒(life technologies)。用于mrna的体外转录的方法是本领域众所周知的。(参见,如,losick,r.,1972,in vitro transcription,ann revbiochem第41卷409-46;kamakaka,r.t.和kraus,w.l.2001.in vitrotranscription.current protocols in cell biology.2:11.6:11.6.1–11.6.17;beckert,b.和masquida,b.,(2010)synthesis of rna by in vitro transcription inrna in methods in molecular biology第703卷(neilson,h.编辑),new york,n.y.humana press,2010;brunelle,j.l.和green,r.,2013,chapter five–in vitrotranscription from plasmid or pcr-amplified dna,methods in enzymology第530卷,101-114;所有均通过引用并入本文)。然后,从转录或相关反应的不期望组分(包括未掺入的rntp、蛋白酶、盐、短rna寡聚物等)中纯化出期望的在体外转录的mrna。用于分离mrna转录物的技术是本领域众所周知的。众所周知的程序包括苯酚/氯仿萃取或用醇(乙醇、异丙醇)沉淀(在单价阳离子或氯化锂的存在下)。可以使用的纯化程序的其他非限制性实例包括尺寸排阻色谱(lukavsky,p.j.和puglisi,j.d.,2004,large-scale preparation and purification ofpolyacrylamide-free rna oligonucleotides,rna v.10,889-893)、基于二氧化硅的亲和色谱和聚丙烯酰胺凝胶电泳(bowman,j.c.,azizi,b.,lenz,t.k.,ray,p.,和williams,l.d.in rna in vitro transcription and rna purification by denaturing page inrecombinant and in vitro rna syntheses methods v.941conn g.l.(编辑),new york,n.y.humana press,2012)。可以使用多种可商购获得的试剂盒进行纯化,所述试剂盒包括但不限于sv总分离系统(sv total isolation system)(promega)和体外转录清理和浓缩试剂盒(in vitro transcription cleanup and concentration kit)(norgen biotek)。此外,尽管逆转录可以产生大量的mrna,但产物可含有许多与不期望的聚合酶活性相关的异常rna杂质,可能需要从全长mrna制备物中去除所述杂质。这些包括由流产转录起始产生的短rna,以及由rna依赖性rna聚合酶活性、rna引发的从rna模板转录和自我互补的3’延伸而产生的双链rna(dsrna)。已经证实,具有dsrna结构的这些污染物可通过与真核细胞中的发挥识别特异性核酸结构并诱导有效免疫应答的功能的各种先天免疫传感器相互作用而导致不期望的免疫刺激活性。这继而可显著减少mrna翻译,因为先天细胞免疫应答期间蛋白质合成减少。因此,已经开发了去除这些dsrna污染物的另外的技术,并且其是本领域已知的,包括但不限于可缩放的hplc纯化(参见如kariko,k.,muramatsu,h.,ludwig,j.和weissman,d.,2011,generating the optimal mrna for therapy:hplcpurification eliminates immune activation and improves translation ofnucleoside-modified,protein-encoding mrna,nucl acid res,v.39e142;weissman,d.,pardi,n.,muramatsu,h.和kariko,k.,hplc purification of in vitro transcribedlong rna in synthetic messenger rna and cell metabolism modulation in methodsin molecular biology v.969(rabinovich,p.h.编辑),2013)。据报道,hplc纯化的mrna以高得多的水平翻译,特别是在原代细胞和体内。本领域中已经描述了各种各样的修饰,所述修饰用于改变体外转录的mrna的特异性能并提高其实用性。这些包括但不限于对mrna的5’和3’末端的修饰。内源性真核mrna通常在成熟分子的5′-末端含有帽结构,其在介导mrna帽结合蛋白(cbp)的结合中起着重要作用,所述mrna帽结合蛋白(cbp)继而负责增强细胞中mrna的稳定性和mrna翻译的效率。因此,用加帽的mrna转录物达到最高水平的蛋白质表达。5′-帽在5'-大多数核苷酸(5’-mostnucleotide)和鸟嘌呤核苷酸之间含有5′-5′-三磷酸连键。缀合的鸟嘌呤核苷酸在n7位是甲基化的。另外的修饰包括2'-羟基基团上倒数第一和倒数第二个大多数5'-核苷酸的甲基化。多种不同的帽结构可用于生成体外转录的合成mrna的5′-帽。合成mrna的5’-加帽可以用化学帽类似物共转录进行(即体外转录期间加帽)。例如,抗-反向帽类似物(arca)帽含有5′-5′-三磷酸鸟嘌呤-鸟嘌呤连键,其中一个鸟嘌呤含有n7甲基基团以及3'-o-甲基基团。然而,在该共转录过程中,多达20%的转录物保持未加帽,并且合成的帽类似物与真实细胞mrna的5′-帽结构不同,从而可能降低可翻译性和细胞稳定性。可选地,合成的mrna分子也可以在转录后被酶促加帽。这些可生成在结构上或功能上更紧密地模拟内源性5’-帽的更真实的5′-帽结构,其具有增强的帽结合蛋白的结合、延长的半衰期、降低的对5′核酸内切酶的敏感性和/或减少的5′脱帽。已经开发了许多合成的5’-帽类似物,并且在本领域中已知所述合成的5’-帽类似物增强mrna稳定性和可翻译性(参见,如,grudzien-nogalska,e.,kowalska,j.,su,w.,kuhn,a.n.,slepenkov,s.v.,darynkiewicz,e.,sahin,u.,jemielity,j.和rhoads,r.e.,synthetic mrnas with superior translation andstability properties in synthetic messenger rna and cell metabolismmodulation in methods in molecular biology v.969(rabinovich,p.h.编辑),2013)。在3’-末端,通常在rna加工过程中将长链腺嘌呤核苷酸(聚-a尾)添加至mrna分子中。转录后立即切割转录物的3′末端以释放3′羟基,在称为聚腺苷酸化的过程中,聚-a聚合酶会在该3′羟基上将腺嘌呤核苷酸链添加至rna中。已广泛显示聚-a尾增强了mrna的翻译效率和稳定性(参见bernstein,p.和ross,j.,1989,poly(a),poly(a)binding proteinand the regulation of mrna stability,trends bio sci v.14373-377;guhaniyogi,j.和brewer,g.,2001,regulation of mrna stability in mammalian cells,gene,v.265,11-23;dreyfus,m.和regnier,p.,2002,the poly(a)tail of mrnas:bodyguard ineukaryotes,scavenger in bacteria,cell,v.111,611-613)。可以使用多种方法实现体外转录的mrna的聚(a)加尾,所述方法包括但不限于将聚(t)簇(poly(t)tract)克隆至dna模板中,或使用聚(a)聚合酶通过转录后添加。第一种情况允许根据聚(t)簇的大小在体外转录具有限定长度的聚(a)尾的mrna,但需要对模板进行另外操作。后一种情况涉及使用将催化腺嘌呤残基掺入rna的3’末端的聚(a)聚合酶将聚(a)尾酶促添加到体外转录的mrna,这不需要另外操作dna模板,但会产生具有不均一长度的聚(a)尾的mrna。可以使用多种可商购获得的试剂盒以及可商购获得的试剂、各种arca帽、聚(a)聚合酶等进行5’-加帽和3’-聚(a)加尾,所述试剂盒包括但不限于聚(a)聚合酶加尾试剂盒(poly(a)polymerase tailing kit)(epicenter)、mmessage mmachine t7 ultra试剂盒和聚(a)加尾试剂盒(poly(a)tailing kit)(life technologies)。据报道,除了5’帽和3’聚腺苷酸化外,体外转录物的其他修饰还提供了与翻译效率和稳定性有关的益处。在本领域中众所周知,致病性dna和rna可以被真核生物内的多种传感器识别并触发有效的先天免疫应答。已显示区分致病性与自身dna和rna的能力至少部分基于结构和核苷修饰,因为天然来源的大多数核酸都含有修饰的核苷。相比之下,体外合成的rna缺少这些修饰,因此使得它具有免疫刺激性,继而可以抑制上文概述的有效的mrna翻译。将修饰的核苷引入体外转录的mrna可用于防止rna传感器的识别和激活,从而减轻这种不期望的免疫刺激活性并增强翻译能力(参见如kariko,k.和weissman,d.2007,naturally occurring nucleoside modifications suppress the immunostimulatoryactivity of rna:implication for therapeutic rna development,curr opin drugdiscov devel,v.10 523-532;pardi,n.,muramatsu,h.,weissman,d.,kariko,k.,invitro transcription of long rna containing modified nucleosides in syntheticmessenger rna and cell metabolism modulation in methods in molecular biologyv.969(rabinovich,p.h.编辑),2013);kariko,k.,muramatsu,h.,welsh,f.a.,ludwig,j.,kato,h.,akira,s.,weissman,d.,2008,incorporation of pseudouridine into mrnayields superior nonimmunogenic vector with increased translational capacityand biological stability,mol ther v.16,1833-1840。可以使用本领域已知的一般方法和程序来制备、监测和利用修饰的rna合成中使用的修饰的核苷和核苷酸。可获得各种各样的核苷修饰,其可以单独地或与其他修饰的核苷组合在一定程度上掺入至体外转录的mrna中(参见如us2012/0251618)。据报道,核苷修饰的mrna的体外合成降低了激活免疫传感器的能力,同时伴随着增强的翻译能力。可以进行修饰以提供可翻译性和稳定性方面益处的mrna的其他组分包括5'和3’非翻译区(utr)。已显示对utr的优化(可以从细胞或病毒rna中获得有利的5’和3’utr),无论是同时进行还是单独进行,均提高了体外转录的mrna的mrna稳定性和翻译效率(参见如pardi,n.,muramatsu,h.,weissman,d.,kariko,k.,in vitro transcription of longrna containing modified nucleosides in synthetic messenger rna and cellmetabolism modulation in methods in molecular biology v.969(rabinovich,p.h.编辑),2013)。除了mrna外,其他核酸有效载荷也可以用于本发明的实施方案。对于寡核苷酸,制备方法包括但不限于化学合成和酶促、化学切割较长的前体、如上所述的体外转录等。合成dna和rna核苷酸的方法被广泛使用并且是本领域众所周知的(参见,如gait,m.j.(编辑)oligonucleotide synthesis:a practical approach,oxford[oxfordshire],washington,d.c.:irl press,1984;和herdewijn,p.(编辑)oligonucleotide synthesis:methods and applications,methods in molecular biology,v.288(clifton,n.j.)totowa,n.j.:humana press,2005;这两者通过引用并入本文)。对于质粒dna,与本发明的实施方案一起使用的制备通常利用但不限于在含有目标质粒的细菌的液体培养物中体外扩增和分离质粒dna。目标质粒中编码对特定抗生素(青霉素、卡那霉素等)有抗性的基因的存在允许那些含有目标质粒的细菌能够在含有抗生素的培养物中选择性生长。分离质粒dna的方法被广泛使用并且在本领域中是众所周知的(参见,如heilig,j.,elbing,k.l.和brent,r(2001)large-scale preparation of plasmiddna.current protocols in molecular biology.41:ii:1.7:1.7.1–1.7.16;rozkov,a.,larsson,b.,s.,r.和schmidt,s.r.(2008),large-scaleproduction of endotoxin-free plasmids for transient expression in mammaliancell culture.biotechnol.bioeng.,99:557–566;和us6197553b1)。可以使用多种可商购获得的试剂盒以及可商购获得的试剂进行质粒分离,所述试剂盒包括但不限于plasmidplus(qiagen)、genjet plasmid maxiprep(thermo)和pureyield maxiprep(promega)试剂盒。下文进一步详细描述了本发明的脂质、脂质纳米颗粒和包含其的组合物的各种示例性实施方案,以及它们递送活性剂(例如治疗剂)如核酸以调节基因和蛋白质表达的用途。如本文所用,除非另有说明,否则以下术语具有赋予它们的含义。除非上下文另外要求,否则在整个说明书和权利要求书中,词语“包括/包含(comprise)”及其变型(如“包括/包含(comprises)”和“包括/包含(comprising)”)应以开放和包括性含义来解释,即“包括但不限于”。在整个本说明书的全文中,对提及“一个实施方案”或“一实施方案”的引用意指结合该实施方案描述的特定特征、结构或特性被包括在本发明的至少一个实施方案中。因此,在整个本说明书的全文中的不同地方各处出现的短语“在一个实施方案中”或“在一实施方案中”不一定都指的是是指同一实施方案。此外,可以在一个或多个实施方案中以任何适合的方式组合特定的特征、结构或特性。除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的技术人员通常所理解的相同含义。如说明书和权利要求书中所使用的,单数形式“一个/一种(a)”、“一个/一种(an)”和“该/所述(the)”包括复数指代物,除非上下文另外明确指出。短语“诱导期望蛋白质的表达”是指核酸能够增加期望蛋白质的表达。为了检查蛋白质表达的程度,可以使测试样品(如,表达期望蛋白质的培养细胞样品)或测试哺乳动物(如,哺乳动物,诸如人类或动物模型,诸如啮齿动物(如,小鼠)或非人灵长类(如,猴)模型)与核酸(如,与本发明的脂质组合的核酸)接触。将测试样品或测试动物中期望蛋白质的表达与不与核酸接触或未施用核酸的对照样品(如,表达期望蛋白质的培养细胞样品)或对照哺乳动物(如,哺乳动物诸如人类或动物模型,诸如啮齿动物(如,小鼠)或非人灵长类(如,猴)模型)中期望蛋白质的表达进行比较。当期望蛋白质存在于对照样品或对照哺乳动物中时,可以将对照样品或对照哺乳动物中期望蛋白质的表达赋值为1.0。在特定的实施方案中,当测试样品或测试哺乳动物中期望蛋白质的表达与对照样品或对照哺乳动物中期望蛋白质的表达水平的比率大于1例如约1.1、1.5、2.0、5.0或10.0时,就可以实现诱导期望蛋白质的表达。当对照样品或对照哺乳动物中不存在期望蛋白质时,当在测试样品或测试哺乳动物中检测到任何可测量水平的期望蛋白质时,实现了诱导期望蛋白质的表达。本领域普通技术人员将理解确定样品中蛋白质表达水平的适当测定,例如斑点印迹、northern印迹、原位杂交、elisa、免疫沉淀、酶功能和表型测定,或基于可在适当条件下产生荧光或发光的报告蛋白的测定。短语“抑制靶基因的表达”是指核酸能够沉默、减少或抑制靶基因的表达。为了检查基因沉默的程度,使测试样品(如,表达靶基因的培养细胞样品)或测试哺乳动物(如,哺乳动物诸如人类或动物模型诸如啮齿动物(如,小鼠)或非人灵长类动物(如猴)模型)与沉默、减少或抑制靶基因表达的核酸接触。将测试样品或测试动物中靶基因的表达与未接触或未施用核酸的对照样品(如,表达靶基因的培养细胞样品)或对照哺乳动物(如,哺乳动物诸如人类或动物模型诸如啮齿动物(如,小鼠)或非人灵长类动物(如猴)模型)中的靶基因的表达进行比较。可以将对照样品或对照哺乳动物中靶基因的表达赋值为100%。在特定的实施方案中,相对于对照样品或对照哺乳动物中靶基因表达水平,当测试样品或测试哺乳动物中靶基因表达水平为约95%、90%、85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%、10%、5%或0%时,实现沉默、抑制或减少靶基因的表达。换句话说,相对于未接触或未施用核酸的对照样品或对照哺乳动物中的靶基因表达水平,核酸能够将测试样品或测试哺乳动物中的靶基因表达沉默、减少或抑制至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%,或100%。用于确定靶基因表达水平的适合测定包括但不限于使用本领域技术人员已知的技术检查蛋白质或mrna水平,诸如如斑点印迹、northern印迹、原位杂交、elisa、免疫沉淀、酶功能以及本领域技术人员已知的表型测定。活性剂或治疗剂如治疗性核酸的“有效量”或“治疗有效量”是足以产生期望效果(如与在不存在核酸的情况下检测到的正常表达水平相比靶序列表达的增加或抑制)的量。当在没有核酸的情况下不存在的表达产物的情况下检测到任何可测量的水平时,实现了靶序列表达的增加。在与核酸接触之前,表达产物以某种水平存在的情况下,当用核酸如mrna获得的值相对于对照的增加倍数为约1.05、1.1、1.2、1.3、1.4、1.5、1.75、2、2.5、3、4、5、6、7、8、9、10、15、20、25、30、40、50、75、100、250、500、750、1000、5000、10000或更大时,实现了表达增加。当相对于对照,用核酸如反义寡核苷酸获得的值为约95%、90%、85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%、10%、5%或0%时,实现了靶基因或靶序列表达的抑制。用于测量靶基因或靶序列表达的适合测定包括如使用本领域技术人员已知的技术检查蛋白质或rna水平,如斑点印迹、northern印迹、原位杂交、elisa、免疫沉淀、酶功能、适合的报道蛋白的荧光或发光以及本领域技术人员已知的表型测定。如本文所用的术语“核酸”是指呈单链或双链形式的含有至少两种脱氧核糖核苷酸或核糖核苷酸的聚合物,并且包括dna、rna及其杂交物。dna可以呈反义分子、质粒dna、cdna、pcr产物或载体的形式。rna可以呈小发夹rna(shrna)、信使rna(mrna)、反义rna、mirna、micrna、多价rna、dicer底物rna或病毒rna(vrna)及其组合的形式。核酸包括含有已知核苷酸类似物或者修饰的主链残基或连键的核酸,其是合成的、天然存在的和非天然存在的并且具有与参考核酸相似的结合特性。此类类似物的实例包括但不限于硫代磷酸酯、氨基磷酸酯、甲基膦酸酯、手性-甲基膦酸酯,2'-o-甲基核糖核苷酸和肽-核酸(pna)。除非特别限定,否则该术语涵盖与参考核酸具有相似结合特性的含有天然核苷酸的已知类似物的核酸。除非另有说明,否则特定的核酸序列还隐含地涵盖其保守修饰的变体(如,简并密码子取代)、等位基因、直向同源物、单核苷酸多态性和互补序列以及明确指出的序列。具体而言,简并密码子取代可以通过生成其中一个或多个选定(或全部)密码子的第三位被混合碱基和/或脱氧肌苷残基取代的序列来实现(batzer等人,nucleic acid res.,19:5081(1991);ohtsuka等人,j.biol.chem.,260:2605-2608(1985);rossolini等人,mol.cell.probes,8:91-98(1994))。“核苷酸”含有以下糖:脱氧核糖(dna)或核糖(rna);碱基和磷酸基团。核苷酸通过磷酸基团连接在一起。“碱基”包括嘌呤和嘧啶,其进一步包括天然化合物腺嘌呤、胸腺嘧啶、鸟嘌呤、胞嘧啶、尿嘧啶、肌苷和天然类似物,以及嘌呤和嘧啶的合成衍生物,包括但不限于放置新的反应性基团(如但不限于胺、醇、硫醇、羧化物和烷基卤化物)的修饰。术语“基因”是指核酸(如dna或rna)序列,其包含产生多肽或前体多肽所必需的部分长度或整个长度的编码序列。如本文所用的“基因产物”是指诸如rna转录物或多肽的基因产物。术语“脂质”是指一组有机化合物,其包括但不限于脂肪酸的酯,并且通常以难溶于水但可溶于许多有机溶剂为特征。它们通常被分为至少三类:(1)“简单脂质”,包括脂肪和油以及蜡;(2)“复合脂质”,包括磷脂和糖脂;以及(3)“衍生脂质”如类固醇。“类固醇”是包含以下碳骨架的化合物:类固醇的非限制实例包括胆固醇等。“阳离子脂质”是指能够带正电的脂质。示例性的阳离子脂质包括带有正电荷的一个或多个胺基团。优选的阳离子脂质是可电离的,使得它们可以根据ph以带正电或中性形式存在。在不同的ph条件下,阳离子脂质的电离影响脂质纳米颗粒的表面电荷。这种电荷状态可影响对于细胞内递送核酸关键的血浆蛋白吸收、血液清除和组织分布(semple,s.c.,等人,adv.drug deliv rev 32:3-17(1998))以及形成溶核内体(endosomolytic)非双层结构的能力(hafez,i.m.,等人,gene ther8:1188-1196(2001))。术语“聚合物缀合的脂质”是指包含脂质部分和聚合物部分的分子。聚合物缀合的脂质的实例是聚乙二醇化脂质。术语“聚乙二醇化脂质”是指包含脂质部分和聚乙二醇部分的分子。聚乙二醇化脂质在本领域中是已知的,并且包括1-(单甲氧基-聚乙二醇)-2,3-二肉豆蔻酰甘油(peg-dmg)等。术语“中性脂质”是指在选定的ph下以不带电或中性的两性离子形式存在的多种脂质物质中的任一种。在生理ph下,此类脂质包括但不限于:磷脂酰胆碱如1,2-二硬脂酰基-sn-甘油基-3-磷酸胆碱(dspc)、1,2-二棕榈酰基-sn-甘油基-3-磷酸胆碱(dppc)、1,2-二肉豆蔻酰基-sn-甘油基-3-磷酸胆碱(dmpc)、1-棕榈酰基-2-油酰基-sn-甘油基-3-磷酸胆碱(popc)、1,2-二油酰基-sn-甘油基-3-磷酸胆碱(dopc),磷脂酰乙醇胺如1,2-二油酰基-sn-甘油基-3-磷酸乙醇胺(dope),鞘磷脂(sm),神经酰胺,类固醇如固醇及其衍生物。中性脂质可以是合成的或天然来源的。术语“带电脂质”是指在有用的生理范围(如ph~3至ph~9)内,以不依赖于ph的带正电或带负电形式存在的多种脂质物质中的任一种。带电脂质可以是合成的或天然来源的。带电脂质的实例包括磷脂酰丝氨酸、磷脂酸、磷脂酰甘油、磷脂酰肌醇、固醇半琥珀酸酯、二烷基三甲铵丙烷(如dotap,dotma)、二烷基二甲氨基丙烷、乙基磷酸胆碱、二甲氨基乙烷氨基甲酰基固醇(如dc-chol)。术语“脂质纳米颗粒”是指具有至少一个纳米量级尺寸的颗粒(如1-1,000nm),其包含结构(i)或(ii)的化合物中的一种或多种或其他指定的阳离子脂质。在一些实施方案中,脂质纳米颗粒被包含在制剂中,其可用于将活性剂或治疗剂(诸如核酸(如mrna))递送至目标靶部位(如细胞、组织、器官、肿瘤等)。在一些实施方案中,本发明的脂质纳米颗粒包含核酸。此类脂质纳米颗粒通常包含结构(i)或(ii)的化合物和一种或多种选自中性脂质、带电脂质、类固醇和聚合物缀合的脂质的赋形剂。在一些实施方案中,活性剂或治疗剂,如核酸,可被封装在脂质纳米颗粒的脂质部分中或者由脂质纳米颗粒的一些或所有脂质部分包封的水性空间中,从而保护其免于酶促降解或者由宿主有机体或细胞的机制诱导的其他不期望的作用如不良免疫应答。在各个实施方案中,脂质纳米颗粒的平均直径为约30nm至约150nm、约40nm至约150nm、约50nm至约150nm、约60nm至约130nm、约70nm至约110nm、约70nm至约100nm、约80nm至约100nm、约90nm至约100nm、约70至约90nm、约80nm至约90nm、约70nm至约80nm,或约30nm、35nm、40nm、45nm、50nm、55nm、60nm、65nm、70nm、75nm、80nm、85nm、90nm、95nm、100nm、105nm、110nm、115nm、120nm、125nm、130nm、135nm、140nm、145nm或150nm,并且脂质纳米颗粒基本上是无毒的。在某些实施方案中,当在脂质纳米颗粒中存在时,核酸在水性溶液中对核酸酶的降解具有抗性。包含核酸的脂质纳米颗粒及其制备方法公开于如美国专利公开号2004/0142025、2007/0042031和pct公开号wo 2017/004143、wo 2015/199952、wo 2013/016058和wo 2013/086373中,其全部公开内容出于所有目的通过引用整体并入本文。如本文所用,“封装的脂质”是指为活性剂或治疗剂(诸如核酸(如mrna))提供完全封装、部分封装或两者的脂质纳米颗粒。在实施方案中,将核酸(如,mrna)完全封装在脂质纳米颗粒中。如本文所用,术语“水性溶液”是指包含水的组合物。关于核酸-脂质纳米颗粒,“血清稳定的”意指核苷酸在暴露于将显著降解游离dna或rna的血清或核酸酶测定后不显着降解。适合的测定包括例如标准血清测定、dna酶测定或rna酶测定。如本文所用的“全身递送”是指可导致有机体内活性剂广泛暴露的治疗性产物的递送。一些施用技术可以导致某些药剂的全身递送,而不可以导致其他药剂的全身递送。全身递送意指有用的,优选治疗量的药剂暴露于身体的大部分。脂质纳米颗粒的全身递送可以通过本领域已知的任何手段进行,包括例如静脉内、动脉内、皮下和腹膜内递送。在一些实施方案中,脂质纳米颗粒的全身递送通过静脉内递送进行。如本文所用的“局部递送”是指将活性剂直接递送至有机体内的靶部位。例如,可通过直接注射到疾病部位如肿瘤、其他靶部位如炎症部位,或靶器官(如肝脏、心脏、胰腺、肾脏等)中来局部递送药剂。局部递送还可以包括局部施用或局部注射技术,如肌内、皮下或皮内注射。局部递送并不排除全身性的药理学作用。“烷基”是指仅由碳和氢原子组成的直链或支化的烃链基团,其是饱和的,具有例如一至二十四个碳原子(c1-c24烷基)、四至二十个碳原子(c4-c20烷基)、六至十六个碳原子(c6-c16烷基)、六至九个碳原子(c6-c9烷基)、一至十五个碳原子(c1-c15烷基)、一至十二个碳原子(c1-c12烷基)、一至八个碳原子(c1-c8烷基)或一至六个碳原子(c1-c6烷基),并且通过单键与分子的其余部分连接,如甲基、乙基、正丙基、1甲基乙基(异丙基)、正丁基、正戊基、1,1-二甲基乙基(叔丁基)、3-甲基己基、2-甲基己基等。除非在说明书中另外特别说明,否则烷基基团是任选取代的。“烯基”是指仅由碳和氢原子组成的直链或支化的烃链基团,其含有一个或多个碳-碳双键并且具有例如二至二十四个碳原子(c2-c24烯基)、四至二十个碳原子(c4-c20烯基)、六至十六个碳原子(c6-c16烯基)、六至九个碳原子(c6-c9烯基)、二至十五个碳原子(c2-c15烯基)、二至十二个碳原子(c2-c12烯基)、二至八个碳原子(c2-c8烯基)或二至六个碳原子(c2-c6烯基)并且通过单键与分子的其余部分连接,如乙烯基、丙-1-烯基、丁-1-烯基、戊-1-烯基、戊-1,4-二烯基等。除非在说明书中另外特别说明,否则烯基基团是任选取代的。“炔基”是指仅由碳和氢原子组成的直链或支化的烃链基团,其含有一个或多个碳-碳三键并且具有例如二至二十四个碳原子(c2-c24炔基)、四至二十个碳原子(c4-c20炔基)、六至十六个碳原子(c6-c16炔基)、六至九个碳原子(c6-c9炔基)、二至十五个碳原子(c2-c15炔基)、二至十二个碳原子(c2-c12炔基)、二至八个碳原子(c2-c8炔基)或二至六个碳原子(c2-c6炔基)并且通过单键与分子的其余部分连接,如乙炔基、丙炔基、丁炔基、戊炔基等。除非在说明书中另外特别说明,否则炔基基团是任选取代的。“亚烷基”或“亚烷基链”是指仅由碳和氢组成的将分子的其余部分与基团连接的直链或支化的二价烃链,其是饱和的并且具有例如一至二十四个碳原子(c1-c24亚烷基)、一至十五个碳原子(c1-c15亚烷基)、一至十二个碳原子(c1-c12亚烷基)、一至八个碳原子(c1-c8亚烷基)、一至六个碳原子(c1-c6亚烷基)、二至四个碳原子(c2-c4亚烷基)、一至二个碳原子(c1-c2亚烷基),如亚甲基、亚乙基、亚丙基、亚正丁基等。亚烷基链通过单键与分子的其余部分连接以及通过单键与基团连接。亚烷基链与分子的其余部分和与基团的连接点可通过链内的一个碳或任何两个碳。除非在说明书中另外特别说明,否则亚烷基链可以是任选取代的。“亚烯基”或“亚烯基链”是指仅由碳和氢组成的将分子的其余部分与基团连接的直链或支化的二价烃链,其含有一个或多个碳-碳双键并且具有例如二至二十四个碳原子(c2-c24亚烯基)、二至十五个碳原子(c2-c15亚烯基)、二至十二个碳原子(c2-c12亚烯基)、二至八个碳原子(c2-c8亚烯基)、二至六个碳原子(c2-c6亚烯基)或二至四个碳原子(c2-c4亚烯基),如亚乙烯基、亚丙烯基、亚正丁烯基等。亚烯基链通过单键或双键与分子的其余部分连接以及通过单键或双键与基团连接。亚烯基链与分子的其余部分和与基团的连接点可通过链内的一个碳或任何两个碳。除非在说明书中另外特别说明,否则亚烯基链可以是任选取代的。“芳基”是指包含氢、6至18个碳原子和至少一个芳香族环的碳环环系统基团。为了本发明的目的,芳基基团是单环、双环、三环或四环环系统,其可以包括稠合或桥接的环系统。芳基基团包括但不限于源自醋蒽烯、苊、醋菲烯、蒽、薁、苯、荧蒽、芴、不对称引达省、对称引达省、茚满、茚、萘、非那烯、菲、七曜烯、芘以及三亚苯的芳基基团。除非在说明书中另外特别说明,否则术语“芳基”或前缀“芳-”(诸如在“芳烷基”中)意指包括经任选取代的芳基基团。“芳烷基”是指式-rb-rc的基团,其中rb是如上所定义的亚烷基或亚烯基并且rc是如上所定义的一种或多种芳基,例如苄基、二苯基甲基等。除非在说明书中另外特别说明,否则芳烷基基团是任选取代的。“环烷基”是指仅由碳和氢原子组成的稳定的非芳香族单环或多环烃基,其可包括具有3至15个碳原子、3至10个碳原子或3至8个碳原子的稠合或桥接环系统,是饱和的并且通过单键与分子的其余部分连接。单环环烷基基团包括例如环丙基、环丁基、环戊基、环己基、环庚基和环辛基。多环基团包括例如,金刚烷基、降冰片基、十氢萘基、7,7-二甲基-双环[2.2.1]庚基等。除非在说明书中另外特别说明,否则环烷基基团可以是任选取代的。“亚环烷基”是二价环烷基基团。除非在说明书中另外特别说明,否则亚环烷基基团可以是任选取代的。“环烯基”是指仅由碳和氢原子组成的稳定的非芳香族单环或多环烃基,其可包括具有3至15个碳原子、3至10个碳原子或3至8个碳原子的稠合或桥接环系统,包含一个或多个碳-碳双键并且通过单键与分子的其余部分连接。单环环烯基基团包括例如环丙烯基、环丁烯基、环戊烯基、环己烯基、环庚烯基和环辛烯基。除非在说明书中另外特别说明,否则环烯基基团可以是任选取代的。“亚环烯基”是二价环烯基基团。除非在说明书中另外特别说明,否则亚环烯基基团可以是任选取代的。本文使用的术语“取代的”意指以上基团(如烷基、烯基、炔基、亚烷基、亚烯基、芳基、芳烷基、环烷基、环烯基(cycloalkyenyl)、亚环烷基或亚环烯基)中的任一种,其中至少一个氢原子被至诸如但不限于以下的非氢原子的键取代:卤素原子如f、cl、br或i;氧代基团(=o);羟基基团(-oh);c1-c12烷基基团;环烷基基团;-(c=o)or’;–o(c=o)r’;-c(=o)r’;-or’;-s(o)xr’;-s-sr’;-c(=o)sr’;-sc(=o)r’;-nr’r’;-nr’c(=o)r’;-c(=o)nr’r’;-nr’c(=o)nr’r’;-oc(=o)nr’r’;-nr’c(=o)or’;-nr’s(o)xnr’r’;-nr’s(o)xr’;和-s(o)xnr’r’,其中r’在每次出现时独立地为h、c1-c15烷基或环烷基,并且x是0、1或2。在一些实施方案中,取代基是c1-c12烷基基团。在其他实施方案中,取代基是环烷基基团。在其他实施方案中,取代基是卤代基团,如氟代。在其他实施方案中,取代基是氧代基团。在其他实施方案中,取代基是羟基基团。在其他实施方案中,取代基是烷氧基基团(-or’)。在其他实施方案中,取代基是羧基基团。在其他实施方案中,取代基是胺基团(-nr’r’)。“任选的”或“任选地”(如,任选替代的)意指随后描述的情况事件可以发生或可以不发生,并且该描述包括所述事件或情况发生的情形以及所述事件或情况没有发生的情形。例如,“任选取代的烷基”意指烷基基团可以被取代或可以不被取代,并且该描述包括取代的烷基基团和没有取代的烷基基团。“前药”意指可以在生理条件下或通过溶剂分解转化为结构(i)或(ii)的生物活性化合物的化合物。因此,术语“前药”是指药学上可接受的结构(i)或(ii)的化合物的代谢前体。当施用至有需要的对象时,前药可以是无活性的,但在体内会转化为结构(i)或(ii)的活性化合物。前药通常在体内迅速转化,例如通过在血液中水解,以产生结构(i)或(ii)的母体化合物。前药化合物通常在哺乳动物有机体中提供溶解性、组织相容性或延迟释放的优点(参见bundgard,h.,design of prodrugs(1985),第7-9页,第21-24页(elsevier,amsterdam))。前药的讨论提供于higuchi,t.,等人,a.c.s.symposium series,第14卷和bioreversible carriers in drug design,edward b.roche编辑,americanpharmaceutical association and pergamon press,1987。术语“前药”还意在包括任何共价键合的载体,当将此类前药施用至哺乳动物对象时,其在体内释放结构(i)或(ii)的活性化合物。结构(i)或(ii)的化合物的前药可以通过在常规操作中或在体内将修饰切割为结构(i)或(ii)的母体化合物的方式修饰结构(i)或(ii)的化合物中存在的官能团来制备。前药包括结构(i)或(ii)的化合物,其中羟基、氨基或巯基基团与以下任何基团键合,当将结构(i)或(ii)的化合物的前药施用至哺乳动物对象时,所述任何基团切割以分别形成游离羟基、游离氨基或游离巯基基团。前药的实例包括但不限于结构(i)或(ii)的化合物中的胺官能团的醇或酰胺衍生物的乙酸酯、甲酸酯和苯甲酸酯衍生物等。本文公开的本发明的实施方案还意在涵盖通过一个或多个原子被具有不同原子量或质量数的原子替代而被同位素标记的结构(i)或(ii)的化合物的所有药学上可接受的化合物。可掺入所公开化合物的同位素的实例包括氢、碳、氮、氧、磷、氟、氯和碘的同位素,如分别为2h、3h、11c、13c、14c、13n、15n、15o、17o、18o、31p、32p、35s、18f、36cl、123i和125i。这些放射性标记的化合物可用于通过表征例如作用位点或作用模式或者与药理学重要的作用位点的结合亲和力来帮助确定或测量化合物的有效性。结构(i)或(ii)的某些同位素标记的化合物,例如掺入放射性同位素的那些,可用于药物和/或底物组织分布研究。鉴于放射性同位素氚即3h和碳-14即14c掺入容易和检测手段现成,它们可特别用于该目的。用较重的同位素如氘(即2h)进行取代可能会因更高的代谢稳定性而提供某些治疗优势,例如增加的体内半衰期或降低的剂量要求,因此在某些情况下可能是优选的。用正电子发射同位素如11c、18f、15o和13n取代可用于正电子发射断层扫描(pet)研究中,以检查底物受体占有率。结构(i)的同位素标记的化合物通常可以通过本领域技术人员已知的常规技术或通过与下文阐述的制备和实施例中描述的那些过程类似的过程使用适当的同位素标记的试剂来代替先前使用的非标记的试剂来制备。本文公开的本发明的实施方案还意在涵盖公开的化合物的体内代谢产物。此类产物可能主要由于酶促过程而例如由所施用化合物的氧化、还原、水解、酰胺化、酯化等产生。因此,本发明的实施方案包括通过以下方法产生的化合物,所述方法包括向哺乳动物施用本发明的化合物持续足以产生其代谢产物的时间段。此类产物通常通过以下来鉴定:向动物如大鼠、小鼠、豚鼠、猴或人施用可检测剂量的放射性标记的结构(i)或(ii)的化合物,允许足够的时间进行代谢,以及从尿液、血液或其他生物样品中分离其转化产物。“稳定的化合物”和“稳定的结构”意在指足够稳健以经受得住从反应混合物中分离至有用程度的纯度并配制成有效治疗剂的化合物。“哺乳动物”包括人类以及家养动物如实验室动物和家庭宠物(如猫、狗、猪、牛、绵羊、山羊、马、兔)和非家养动物(如野生动物等)。“药学上可接受的载体、稀释剂或赋形剂”包括但不限于已被美国食品和药品管理局批准对于用于人类或家养动物是可接受的任何佐剂、载体、赋形剂、助流剂、甜味剂、稀释剂、防腐剂、染料/着色剂、增味剂、表面活性剂、润湿剂、分散剂、助悬剂、稳定剂、等渗剂、溶剂或乳化剂。“药学上可接受的盐”包括酸加成盐和碱加成盐。“药学上可接受的酸加成盐”是指保留了游离碱的生物效力和性能,不是生物学上或其他方面不期望的,并且与无机酸(如但不限于盐酸、氢溴酸、硫酸、硝酸、磷酸等)或与有机酸(如但不限于乙酸、2,2-二氯乙酸、己二酸、藻酸、抗坏血酸、天冬氨酸、苯磺酸、苯甲酸、4-乙酰氨基苯甲酸、樟脑酸、樟脑-10-磺酸、癸酸、己酸、辛酸、碳酸、肉桂酸、柠檬酸、环拉酸、十二烷基硫酸、乙烷-1,2-二磺酸、乙磺酸、2-羟基乙磺酸、甲酸、富马酸、半乳糖二酸(galactaric acid)、龙胆酸、葡庚糖酸、葡萄糖酸、葡萄糖醛酸、谷氨酸、戊二酸、2-氧代-戊二酸、甘油磷酸、乙醇酸、马尿酸、异丁酸、乳酸、乳糖酸、月桂酸、马来酸、苹果酸、丙二酸、扁桃酸、甲磺酸、粘酸、萘-1,5-二磺酸、萘-2-磺酸、1-羟基-2-萘甲酸、烟酸、油酸、乳清酸、草酸、棕榈酸、双羟萘酸、丙酸、焦谷氨酸、丙酮酸、水杨酸、4-氨基水杨酸、癸二酸、硬脂酸、琥珀酸、酒石酸、硫氰酸、对甲苯磺酸、三氟乙酸、十一碳烯酸等)形成的那些盐。“药学上可接受的碱加成盐”是指保留了游离酸的生物效力和性能,不是生物学上或其他方面不期望的那些盐。这些盐是通过将无机碱或有机碱加到游离酸中来制备的。衍生自无机碱的盐包括但不限于钠盐、钾盐、锂盐、铵盐、钙盐、镁盐、铁盐、锌盐、铜盐、锰盐、铝盐等。优选的无机盐是铵盐、钠盐、钾盐、钙盐和镁盐。衍生自有机碱的盐包括但不限于伯胺、仲胺和叔胺的盐,取代的胺,其包括天然存在的取代的胺、环胺和碱性离子交换树脂,如氨、异丙胺、三甲胺、二乙胺、三乙胺、三丙胺、二乙醇胺、乙醇胺、地阿诺、2-二甲基氨基乙醇、2-二乙基氨基乙醇、二环己胺、赖氨酸、精氨酸、组氨酸、咖啡因、普鲁卡因、海巴明、胆碱、甜菜碱、苯那明(benethamine)、苄星、乙二胺、葡糖胺、甲基葡糖胺、可可碱、三乙醇胺、氨丁三醇、嘌呤、哌嗪、哌啶、n-乙基哌啶、多胺树脂等。特别优选的有机碱是异丙胺、二乙胺、乙醇胺、三甲胺、二环己胺、胆碱和咖啡因。通常结晶产生结构(i)或(ii)的化合物的溶剂化物。如本文所用,术语“溶剂化物”是指包含一个或多个结构(i)或(ii)的化合物的分子与一个或多个溶剂分子的聚集体。溶剂可以是水,在这种情况下,溶剂化物可以是水合物。可选地,溶剂可以是有机溶剂。因此,本发明的化合物可以以水合物形式(包括一水合物、二水合物、半水合物、倍半水合物、三水合物、四水合物等)以及相应的溶剂化形式存在。在一些实施方案中,结构(i)或(ii)的化合物可以以真正的溶剂化物存在,而在其他情况下,结构(i)或(ii)的化合物可仅保留外来水或为水加一些外来溶剂的混合物。“药物组合物”是指结构(i)的化合物和本领域普遍接受的用于将生物活性化合物递送至哺乳动物如人类的介质的制剂。此类介质包括用于其的所有药学上可接受的载体、稀释剂或赋形剂。“有效量”或“治疗有效量”是指当施用至哺乳动物优选人时足以在哺乳动物优选人中实现治疗的结构(i)或(ii)的化合物或者包含结构(i)或(ii)的化合物的脂质纳米颗粒的量。构成“治疗有效量”的本发明的实施方案的脂质纳米颗粒的量将根据化合物、病况及其严重程度、施用方式和待治疗哺乳动物的年龄而变化,但是可以由本领域的普通技术人员根据自己的知识和本公开内容常规确定。如本文所用,“治疗(treating)”或“治疗(treatment)”涵盖在患有目标疾病或病况的哺乳动物,优选人中针对目标疾病或病况的治疗,并且包括:(i)预防该疾病或病况在哺乳动物中发生,特别是当此类哺乳动物易患该病况但尚未被诊断为患有该病况时;(ii)抑制该疾病或病况,即阻止其发展;(iii)减轻该疾病或病况,即导致该疾病或病况消退;或者(iv)缓解由该疾病或病况引起的症状,即缓解疼痛而不解决潜在的疾病或病况。如本文所用,术语“疾病”和“病况”可以互换使用,或可以不同,因为特定的疾病或病况可能没有已知的病原体(使得病因尚未查明),因此其尚未被确认为疾病而仅被视为不期望的状况或综合征,其中临床医生已鉴定出或多或少特定的症状组。结构(i)或(ii)的化合物或者其药学上可接受的盐可包含一个或多个不对称中心,因此可产生对映异构体、非对映异构体和可就绝对立体化学而言被定义为(r)-或(s)-或为(d)-或(l)-(对于氨基酸)的其他立体异构体形式。本发明的实施方案意在包括所有此类可能的异构体,以及它们的外消旋和光学纯的形式。光学活性的(+)和(-)、(r)-和(s)-、或(d)-和(l)-异构体可以使用手性合成子或手性试剂制备,或者使用常规技术例如色谱和分步结晶拆分。用于制备/分离单独对映异构体的常规技术包括由适合的光学纯前体进行手性合成或使用例如手性高压液相色谱(hplc)拆分外消旋物(或盐或衍生物的外消旋物)。当本文所述的化合物含有烯属双键或其他几何不对称中心时,并且除非另有说明,该化合物旨在包括e和z几何异构体。同样地,也旨在包括所有互变异构体形式。“立体异构体”是指由通过相同键键合的相同原子组成但具有不可互换的不同三维结构的化合物。本发明考虑了各种立体异构体及其混合物,并且包括“对映异构体”,其是指分子彼此为不重叠镜像的两种立体异构体。“互变异构体”是指从分子的一个原子到同一分子的另一个原子的质子转移。本发明包括任何所述化合物的互变异构体。化合物在一方面,本发明提供了新型脂质化合物,其能够与其他脂质组分如中性脂质、带电脂质、类固醇和/或聚合物缀合的脂质组合以形成具有寡核苷酸的脂质纳米颗粒。不希望受到理论的束缚,认为,这些脂质纳米颗粒庇护寡核苷酸免于在血清中降解,并提供了在体外和体内有效递送寡核苷酸至细胞。结构(i)的化合物在一个实施方案中,化合物具有以下结构(i):或者其药学上可接受的盐、互变异构体、前药或立体异构体,其中:l1是-o(c=o)r1、-(c=o)or1、-c(=o)r1、-or1、-s(o)xr1、-s-sr1、-c(=o)sr1、-sc(=o)r1、-nrac(=o)r1、-c(=o)nrbrc、-nrac(=o)nrbrc、-oc(=o)nrbrc或-nrac(=o)or1;l2是-o(c=o)r2、-(c=o)or2、-c(=o)r2、-or2、-s(o)xr2、-s-sr2、-c(=o)sr2、-sc(=o)r2、-nrdc(=o)r2、-c(=o)nrerf、-nrcc(=o)nrerf、-oc(=o)nrerf;-nrdc(=o)or2或至r2的直连键;g1a和g2a各自独立地为c2-c12亚烷基或c2-c12亚烯基;g3是c1-c24亚烷基、c2-c24亚烯基、c3-c8亚环烷基或c3-c8亚环烯基;ra、rb、rd和re各自独立地为h或c1-c12烷基或c2-c12烯基;rc和rf各自独立地为c1-c12烷基或c2-c12烯基;r1和r2各自独立地为支化的c6-c24烷基或支化的c6-c24烯基;r3a是-c(=o)n(r4a)r5a或-c(=o)or6;r4a是c1-c12烷基;r5a是h或c1-c8烷基或c2-c8烯基;r6是h、芳基或芳烷基;和x是0、1或2,和其中每个烷基、烯基、亚烷基、亚烯基、亚环烷基、亚环烯基、芳基和芳烷基独立地为取代或未取代的。在结构(i)的某些实施方案中,g3是未取代的。在结构(i)的更特定的实施方案中,g3是c2-c12亚烷基,例如在结构(i)的一些实施方案中,g3是c3-c7亚烷基,或在结构(i)的其他实施方案中,g3是c3-c12亚烷基。在结构(i)的一些实施方案中,g3是c2或c3亚烷基。在结构(i)的前述一些实施方案的中,化合物具有以下结构(ia):其中y1和z1各自独立地是范围为2至12的整数,例如范围为2至6的整数,例如4。在结构(i)的前述一些实施方案中,l1是-o(c=o)r1、-(c=o)or1或-c(=o)nrbrc,和l2是-o(c=o)r2、-(c=o)or2或-c(=o)nrerf。例如,在结构(i)的一些实施方案中,l1和l2分别是-(c=o)or1和-(c=o)or2。在结构(i)的其他实施方案中,l1是-(c=o)or1并且l2是-c(=o)nrerf。在结构(i)的其他实施方案中,l1是-c(=o)nrbrc并且l2是-c(=o)nrerf。在前述的其他实施方案中,化合物具有以下结构(ib)、(ic)、(id)或(ie)中的一种:在前述一些实施方案中,化合物具有结构(ib),在其他实施方案中,化合物具有结构(ic),以及在其他实施方案中化合物具有结构(id)。在其他实施方案中,化合物具有结构(ie)。在前述一些不同的实施方案中,化合物具有以下结构(if)、(ig)、(ih)或(ij)中的一种:其中y1和z1各自独立地是范围为2至12的整数,例如范围为2至6的整数,例如4。在结构(i)的前述一些实施方案中,y1和z1各自独立地是范围为2至10、2至8、4至10或4至7的整数。例如,在结构(i)的一些实施方案中,y1是4、5、6、7、8、9、10、11或12。在结构(i)的一些实施方案中,z1是4、5、6、7、8、9、10、11或12。在结构(i)的一些实施方案中,y1和z1是相同的,而在结构(i)的其他实施方案中,y1和z1是不同的。在结构(i)的前述一些实施方案中,r1或r2或两者是支化的c6-c24烷基。例如,在结构(i)的一些实施方案中,r1和r2各自独立地具有以下结构:其中:r7a和r7b在每次出现时独立地为h或c1-c12烷基;和a是2至12的整数,其中各自选择r7a、r7b和a,使得r1和r2各自独立地包含6至20个碳原子。例如,在一些实施方案中,a是范围为5至9或8至12的整数。在结构(i)的前述一些实施方案中,至少一次出现的r7a是h。例如,在结构(i)的一些实施方案中,r7a在每次出现时是h。在前述的其他不同的实施方案中,至少一次出现的r7b是c1-c8烷基。例如,在一些实施方案中,c1-c8烷基是甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正己基或正辛基。在结构(i)的不同实施方案中,r1或r2或两者具有以下结构中的一种:在结构(i)的前述一些实施方案中,rb、rc、re和rf各自独立地为c3-c12烷基。例如,在结构(i)的一些实施方案中,rb、rc、re和rf是正己基以及在结构(i)的其他实施方案中,rb、rc、re和rf是正辛基。在结构(i)的前述一些实施方案中,r3a是–c(=o)n(r4a)r5a。在结构(i)的更特定的实施方案中,r4a是乙基、丙基、正丁基、正己基、正辛基或正壬基。在结构(i)的某些实施方案中,r5a是h、甲基、乙基、丙基、正丁基、正己基或正辛基。在结构(i)的这些实施方案的一些中,r4a和/或r5a任选地被取代基例如羟基取代。在结构(i)的一些实施方案中,r3a是-c(=o)or6。在结构(i)的某些实施方案中,r6是苄基以及在其他实施方案中,r6是h。在结构(i)的前述一些实施方案中,r4a、r5a和r6独立地任选被一个或多个选自以下的取代基取代:-org、-nrgc(=o)rh、-c(=o)nrgrh、-c(=o)rh、-oc(=o)rh、-c(=o)orh和–orioh,其中:rg在每次出现时独立地为h或c1-c6烷基;rh在每次出现时独立地为c1-c6烷基;和ri在每次出现时独立地为c1-c6亚烷基。在结构(i)的某些特定的实施方案中,r3a具有以下结构中的一种:在各种不同的实施方案中,化合物具有下表1所示的结构中的一种。表1结构(i)的代表性化合物结构(ii)的化合物在一个实施方案中,化合物具有以下结构(ii):或者其药学上可接受的盐、互变异构体、前药或立体异构体,其中:l1是-o(c=o)r1、-(c=o)or1、-c(=o)r1、-or1、-s(o)xr1、-s-sr1、-c(=o)sr1、-sc(=o)r1、-nrac(=o)r1、-c(=o)nrbrc、-nrac(=o)nrbrc、-oc(=o)nrbrc或-nrac(=o)or1;l2是-o(c=o)r2、-(c=o)or2、-c(=o)r2、-or2、-s(o)xr2、-s-sr2、-c(=o)sr2、-sc(=o)r2、-nrdc(=o)r2、-c(=o)nrerf、-nrcc(=o)nrerf、-oc(=o)nrerf;-nrdc(=o)or2或直连键;g1b和g2b各自独立地为c1-c12亚烷基或c2-c12亚烯基;g3是c1-c24亚烷基、c2-c24亚烯基、c3-c8亚环烷基、c3-c8亚环烯基;ra、rb、rd和re各自独立地为h或c1-c12烷基或c2-c12烯基;rc和rf各自独立地为c1-c12烷基或c2-c12烯基;r1和r2各自独立地为支化的c6-c24烷基或支化的c6-c24烯基;r3b是–nr4bc(=o)r5b;r4b是h、c1-c12烷基或c2-c12烯基;当r4b是h时,r5b是c2-c12烷基或c2-c12烯基;或当r4b是c1-c12烷基或c2-c12烯基时,r5是c1-c12烷基或c2-c12烯基;和x是0、1或2,和其中每个烷基、烯基、亚烷基、亚烯基、亚环烷基和亚环烯基独立地为取代的或未取代的。在结构(ii)的某些实施方案中,g3是未取代的。在结构(ii)的更特定的实施方案中,g3是c1-c12亚烷基,例如g3是c3-c5亚烷基或g3是c3-c12亚烷基。在前述一些实施方案中,化合物具有以下结构(iia):其中y2和z2各自独立地是范围为1至12的整数。在结构(ii)的前述一些实施方案中,l1和l2各自独立地为-o(c=o)r1或-(c=o)or1。在前述的其他实施方案中,化合物具有以下结构(iib)或(iic)中的一种:在前述一些实施方案中,化合物具有结构(iib),在其他实施方案中,化合物具有结构(iic)。在一些实施方案中,化合物具有以下结构(iid)或(iie)中的一种:其中y2和z2各自独立地是范围为1至12的整数。在结构(ii)的前述一些实施方案中,y2和z2各自独立地是范围为2至12的整数,例如2至10、2至8、4至7或4至10。例如,在结构(ii)的一些实施方案中,y2是4、5、6、7、8、9、10、11或12。在结构(ii)的一些实施方案中,z2是4、5、6、7、8、9、10、11或12。在结构(ii)的一些实施方案中,y2和z2是相同的,而在结构(ii)的其他实施方案中,y2和z2是不同的。在结构(ii)的前述实施方案的一些中,r1或r2或两者是支化的c6-c24烷基。例如,在结构(ii)的一些实施方案中,r1和r2各自独立地具有以下结构:其中:r7a和r7b在每次出现时独立地为h或c1-c12烷基;和a是2至12的整数,其中各自选择r7a、r7b和a,使得r1和r2各自独立地包含6至20个碳原子。例如,在一些实施方案中,a是范围为5至9或8至12的整数。在结构(ii)的前述实施方案的一些中,至少一次出现的r7a是h。例如,在结构(ii)的一些实施方案中,r7a在每次出现时是h。在前述的其他不同实施方案中,至少一次出现的r7b是c1-c8烷基。例如,在结构(ii)的一些实施方案中,c1-c8烷基是甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正己基或正辛基。在结构(ii)的不同实施方案中,r1或r2或两者具有以下结构中的一种:在结构(ii)的前述一些实施方案中,r4b是h、甲基、乙基、丙基或辛基。在结构(ii)的一些实施方案中,r5b是甲基、乙基、丙基、庚基或辛基,例如正庚基或正辛基。在结构(ii)的某些相关的实施方案中,r4b和r5b独立地任选被一各或多个选自以下的取代基取代:-org、-nrgc(=o)rh、-c(=o)nrgrh、-c(=o)rh、-oc(=o)rh、-c(=o)orh和-orhoh,其中:rg在每次出现时独立地为h或c1-c6烷基;rh在每次出现时独立地为c1-c6烷基;和ri在每次出现时独立地为c1-c6亚烷基。在结构(ii)的某些特定的实施方案中,r3b具有以下结构中的一种:在各种不同的实施方案中,结构(ii)的化合物具有下表2中所示的结构中的一种。表2结构ii的代表性化合物应理解,如上所示的结构(i)或(ii)的化合物的任何实施方案,以及如上所示的化合物结构(i)或(ii)的任何特定的取代基和/或变量可以独立地与结构(i)或(ii)的化合物的其他实施方案和/或取代基和/或变量组合以形成以上未具体示出的本发明的实施方案。另外,如果在特定的实施方案和/或权利要求书中列出了任何特定的r基团、l基团、g基团或变量a、x、y或z的取代基和/或变量列表,则应理解每个单独的取代基和/或变量可以从特定的实施方案和/或权利要求书中删除,并且取代基和/或变量的其余列表将被认为在本发明的范围内。应理解,在本说明书中,仅当这样的贡献产生稳定的化合物时,所描绘的式的取代基和/或变量的组合才是允许的。在一些实施方案中,提供了包含任一种或多种结构(i)或(ii)的化合物和治疗剂的组合物。例如,在一些实施方案中,组合物包含任一种结构(i)或(ii)的化合物和治疗剂及一种或多种选自中性脂质、类固醇和聚合物缀合的脂质的赋形剂。其他药学上可接受的赋形剂和/或载体也被包含在组合物的各种实施方案中。在一些实施方案中,中性脂质选自dspc、dppc、dmpc、dopc、popc、dope和sm。在一些实施方案中,中性脂质是dspc。在各个实施方案中,化合物与中性脂质的摩尔比的范围为约2:1至约8:1。在各个实施方案中,组合物还包含类固醇或类固醇类似物。在某些实施方案中,类固醇或类固醇类似物是胆固醇。在这些实施方案的一些中,化合物与胆固醇的摩尔比的范围为约5:1至1:1。在各个实施方案中,聚合物缀合的脂质是聚乙二醇化脂质。例如,一些实施方案包括聚乙二醇化二酰基甘油(peg-dag)如1-(单甲氧基-聚乙二醇)-2,3-二肉豆蔻酰甘油(peg-dmg)、聚乙二醇化磷脂酰乙醇胺(peg-pe)、peg琥珀酸酯二酰基甘油(peg-s-dag)如4-o-(2’,3’-二(十四烷酰氧基)丙基-1-o-(ω-甲氧基(聚乙氧基)乙基)丁二酸酯(peg-s-dmg)、聚乙二醇化神经酰胺(peg-cer)或peg二烷氧基丙基氨基甲酸酯如ω-甲氧基(聚乙氧基)乙基-n-(2,3-二(十四烷氧基)丙基)氨基甲酸酯或2,3-二(十四烷氧基)丙基-n-(ω-甲氧基(聚乙氧基)乙基)氨基甲酸酯。在各个实施方案中,化合物与聚乙二醇化脂质的摩尔比的范围为约100:1至约20:1。在一些实施方案中,组合物包含具有以下结构(iii)的聚乙二醇化脂质:或者其药学上可接受的盐、互变异构体或立体异构体,其中:r8和r9各自独立地为含有10至30个碳原子的直链或支化的烷基、烯基或炔基,其中所述烷基、烯基或炔基任选地被一个或多个酯键中断;和w的平均值范围为30至60。在一些实施方案中,r8和r9各自独立地为含有12至16个碳原子的直链烷基。在一些实施方案中,w的平均值范围为43至53。在其他实施方案中,平均值w为约45。在其他不同的实施方案中,平均值w为约49。在一些实施方案中,提供了包含任一种或多种结构(i)或(ii)的化合物和治疗剂的脂质纳米颗粒(lnp)。例如,在一些实施方案中,lnp包含任一种结构(i)或(ii)的化合物和治疗剂及一种或多种选自中性脂质、类固醇和聚合物缀合的脂质的赋形剂。在lnp的一些实施方案中,中性脂质选自dspc、dppc、dmpc、dopc、popc、dope和sm。在一些实施方案中,中性脂质是dspc。在各个实施方案中,化合物与中性脂质的摩尔比的范围为约2:1至约8:1。在lnp的各个实施方案中,组合物还包含类固醇或类固醇类似物。在某些实施方案中,类固醇或类固醇类似物是胆固醇。在这些实施方案的一些中,化合物与胆固醇的摩尔比的范围为约5:1至1:1。在lnp的各个实施方案中,聚合物缀合的脂质是聚乙二醇化脂质。例如,一些实施方案包括聚乙二醇化二酰基甘油(peg-dag)如1-(单甲氧基-聚乙二醇)-2,3-二肉豆蔻酰甘油(peg-dmg),聚乙二醇化磷脂酰乙醇胺(peg-pe),peg琥珀酸酯二酰基甘油(peg-s-dag)如4-o-(2’,3’-二(十四烷酰氧基)丙基-1-o-(ω-甲氧基(聚乙氧基)乙基)丁二酸酯(peg-s-dmg),聚乙二醇化神经酰胺(peg-cer),或peg二烷氧基丙基氨基甲酸酯如ω-甲氧基(聚乙氧基)乙基-n-(2,3-二(十四烷氧基)丙基)氨基甲酸酯或2,3-二(十四烷氧基)丙基-n-(ω-甲氧基(聚乙氧基)乙基)氨基甲酸酯。在各个实施方案中,化合物与聚乙二醇化脂质的摩尔比的范围为约100:1至约20:1。在一些实施方案中,lnp包含具有以下结构(iii)的聚乙二醇化脂质:或者其药学上可接受的盐、互变异构体或立体异构体,其中:r8和r9各自独立地为含有10至30个碳原子的直链或支化的烷基、烯基或炔基,其中所述烷基、烯基或炔基任选地被一个或多个酯键中断;和w的平均值范围为30至60。在一些实施方案中,r8和r9各自独立地为含有12至16个碳原子的直链烷基。在一些实施方案中,w的平均值范围为43至53。在其他实施方案中,平均值w为约45。在其他不同的实施方案中,平均值w为约49。上述脂质、脂质纳米颗粒和组合物的制备方法描述在下文中和/或是本领域已知的,例如在pct公开号wo 2015/199952和wo 2017/004143中,这两者通过引用整体并入本文。在前述组合物的一些实施方案中,治疗剂包含核酸。例如,在一些实施方案中,核酸选自反义rna和信使rna。在其他不同的实施方案中,本发明涉及用于向有需要的患者施用治疗剂的方法,所述方法包括制备或提供前述组合物中的任一种和向患者施用所述组合物。为了施用目的,可以将结构(i)或(ii)的化合物(通常呈与治疗剂组合的脂质纳米颗粒的形式)作为化学原料施用或可以配制成药物组合物。本发明的实施方案的药物组合物包含结构(i)或(ii)的化合物(如,作为lnp中的组分)和一种或多种药学上可接受的载体、稀释剂或赋形剂。结构(i)或(ii)的化合物以有效形成脂质纳米颗粒并递送治疗剂如用于治疗特定的目标疾病或病况的量存在于组合物中。适当的浓度和剂量可以由本领域技术人员容易地确定。本发明的实施方案的组合物和/或lnp的施用可以经由用于相似效用的试剂的任何可接受的施用模式来进行。本发明的实施方案的药物组合物可以配制成呈固体、半固体、液体或气体形式的制剂,如片剂、胶囊剂、粉剂、颗粒剂、软膏剂、溶液、混悬剂、栓剂、注射剂、吸入剂、凝胶剂、微球和气雾剂。施用此类药物组合物的典型途径包括但不限于经口、局部、透皮、吸入、腹膜、舌下、经颊、经直肠、经阴道和鼻内。如本文所用的术语“腹膜内”包括皮下注射、静脉内、肌内、皮内、胸骨内注射或输注技术。配制本发明的药物组合物,以使得其中包含的活性成分在将组合物施用至患者后是生物可利用的。将要施用至对象或患者的组合物采取一个或多个剂量单位的形式,其中例如片剂可以是单个剂量单位,呈气雾剂形式的结构(i)或(ii)的化合物的容器可以容纳多个剂量单位。制备此类剂型的实际方法对于本领域技术人员而言是已知的,或者将是显而易见的;例如,参见remington:thescience and practice of pharmacy,第20版(philadelphia college of pharmacy andscience,2000)。根据本发明的实施方案的教导,在任何情况下,待施用的组合物将含有治疗有效量的结构(i)或(ii)的化合物(如,呈包含治疗剂的lnp形式)或者其药学上可接受的盐用于治疗目标疾病或病况。本发明的实施方案的药物组合物可以呈固体或液体的形式。在一方面,一种或多种载体是颗粒状的,使得组合物呈例如片剂或粉末形式。一种或多种载体可以是液体,其中组合物例如是口服糖浆、可注射液体或气雾剂,其可用于例如吸入施用。当意在经口施用时,药物组合物优选呈固体或液体形式,其中半固体、半液体、混悬液和凝胶形式被包括在本文中被视为固体或液体的形式内。作为用于经口施用的固体组合物,可以将药物组合物配制成粉剂、颗粒剂、压制片剂、丸剂、胶囊剂、口香糖、薄片(wafer)等形式。此类固体组合物通常含有一种或多种惰性稀释剂或可食用载体。此外,可以存在以下中的一种或多种:粘合剂如羧甲基纤维素、乙基纤维素、微晶纤维素、黄蓍胶或明胶;赋形剂如淀粉、乳糖或糊精,崩解剂如海藻酸、海藻酸钠、primogel、玉米淀粉等;润滑剂如硬脂酸镁或sterotex;助流剂如胶态二氧化硅;甜味剂如蔗糖或糖精;调味剂如胡椒薄荷、水杨酸甲酯或橙香精;以及着色剂。当药物组合物呈胶囊例如明胶胶囊形式时,除了上述类型的材料外,它还可以含有液体载体如聚乙二醇或油。药物组合物可以呈液体的形式,例如酏剂、糖浆剂、溶液、乳剂或混悬剂。作为两个实例,该液体可以用于经口施用或用于通过注射递送。当意在用于经口施用时,除了本发明的化合物或lnp之外,优选的组合物还包含甜味剂、防腐剂、染料/着色剂和增味剂中的一种或多种。在旨在通过注射施用的组合物中,可以包含表面活性剂、防腐剂、湿润剂、分散剂、助悬剂、缓冲剂、稳定剂和等渗剂中的一种或多种。本发明的实施方案的液体药物组合物,无论它们是溶液、混悬剂或其他类似形式,都可以包含以下佐剂中的一种或多种:无菌稀释剂如注射用水、盐水溶液优选生理盐水、林格氏溶液、等渗氯化钠、可以用作溶剂或悬浮介质的诸如合成的甘油单酯或甘油二酯的不挥发油、聚乙二醇、甘油、丙二醇或其他溶剂;抗细菌剂如苄醇或对羟基苯甲酸甲酯;抗氧化剂如抗坏血酸或亚硫酸氢钠;螯合剂如乙二胺四乙酸;缓冲剂如乙酸盐、柠檬酸盐或磷酸盐,以及用于调节张力的试剂如氯化钠或右旋糖;用作冷冻保护剂的试剂,如蔗糖或海藻糖。腹膜制剂可以装在玻璃或塑料制成的安瓿瓶、一次性注射器或多剂量小瓶中。生理盐水是优选的佐剂。可注射的药物组合物优选是无菌的。意在用于腹膜或经口施用的本发明的实施方案的液体药物组合物应含有一定量的结构(i)或(ii)的化合物,以便获得适合的lnp。本发明的实施方案的药物组合物可以意在用于局部施用,在这种情况下,载体可以适合地包括溶液、乳剂、软膏剂或凝胶基质。基质例如可以包括以下中的一种或多种:凡士林、羊毛脂、聚乙二醇、蜂蜡、矿物油、稀释剂(如水和醇)以及乳化剂和稳定剂。增稠剂可存在于药物组合物中以用于局部施用。如果意在用于透皮施用,则组合物可以包括透皮贴剂或离子电渗疗法装置。本发明的实施方案的药物组合物可以意在例如以栓剂的形式用于经直肠施用,所述栓剂将在直肠中融化并释放药物。用于经直肠施用的组合物可含有油性基质作为适合的非刺激性赋形剂。此类基质包括但不限于羊毛脂、可可脂和聚乙二醇。本发明的实施方案的药物组合物可以包含改变固体或液体剂量单位的物理形式的各种材料。例如,组合物可以包含在活性成分周围形成包衣壳的材料。形成包衣壳的材料通常是惰性的,并且可以选自例如糖、虫胶和其他肠溶包衣剂。可选地,活性成分可以装在明胶胶囊中。呈固体或液体形式的本发明的实施方案的药物组合物可包含结合结构(i)或(ii)的化合物并从而有助于递送该化合物的试剂。可以这种能力发挥作用的适合试剂包括单克隆抗体或多克隆抗体或蛋白质。本发明的实施方案的药物组合物可以由可作为气雾剂施用的剂量单位组成。术语“气雾剂”用于表示范围从胶体性质的那些系统到由加压包装组成的系统的各种系统。可以通过液化或压缩气体或者通过分配活性成分的适合泵系统进行递送。可以以单相、两相或三相体系递送包含结构(i)或(ii)的化合物的气雾剂,以便递送一种或多种活性成分。气雾剂的递送包括必需的容器、激活剂、阀、子容器等,其一起可以形成试剂盒。本领域技术人员无需过度实验就可以确定优选的气雾剂。本发明的实施方案的药物组合物可以通过制药领域众所周知的方法来制备。例如,可以通过将本发明的脂质纳米颗粒与无菌蒸馏水或其他载体组合以形成溶液来制备意在通过注射施用的药物组合物。可以添加表面活性剂以促进均匀溶液或混悬液的形成。表面活性剂是与结构(i)或(ii)的化合物非共价相互作用从而促进化合物在水性递送系统中的溶解或均匀悬浮的化合物。本发明的实施方案的组合物或其药学上可接受的盐以治疗有效量施用,所述量将根据多种因素而变化,这些因素包括所用具体治疗剂的活性;治疗剂的代谢稳定性和作用时长;患者的年龄、体重、总体健康、性别和饮食;施用方式和时间;排泄率;药物组合;特定病症或病况的严重程度;以及正在接受治疗的对象。本发明的实施方案的组合物也可以在施用一种或多种其他治疗剂的同时、之前或之后施用。此类组合疗法包括施用本发明的实施方案的组合物和一种或多种另外的活性剂的单一药物剂量制剂,以及以其自身分开的药物剂量制剂施用本发明的组合物和每种活性剂。例如,可以将本发明的实施方案的组合物和其他活性剂一起以单一口服剂量组合物(如片剂或胶囊剂)或以分开的口服剂量制剂施用的每种药剂施用至患者。当使用分开的剂量制剂时,结构(i)或(ii)的化合物和一种或多种另外的活性剂可以在基本上相同的时间即同时地,或在分别错开的时间即依序地施用;组合疗法被理解为包括所有这些方案。上述化合物和组合物的制备方法在下文中描述和/或是本领域已知的。本领域技术人员将理解,在本文所述的过程中,中间体化合物的官能团可能需要被适合的保护基团保护。此类官能团包括羟基、氨基、巯基和羧酸。适合的羟基保护基团包括三烷基甲硅烷基或二芳基烷基甲硅烷基(例如,叔丁基二甲基甲硅烷基、叔丁基二苯基甲硅烷基或三甲基甲硅烷基)、四氢吡喃基、苄基等。适合的氨基、脒基和胍基的保护基团包括叔丁氧羰基、苄氧羰基等。适合的巯基保护基团包括-c(o)-r″(其中r″是烷基、芳基或芳基烷基)、对甲氧基苄基、三苯甲基等。适合的羧酸保护基包括烷基、芳基或芳基烷基酯。可以根据本领域技术人员已知并且如本文所述的标准技术来添加或去除保护基团。保护基团的使用详细描述于green,t.w.和p.g.m.wutz,protective groups in organic synthesis(1999),第3版,wiley中。如本领域技术人员将理解的,保护基团也可以是聚合物树脂,如wang树脂、rink树脂或2-氯三苯甲基-氯化物树脂。此外,可以通过本领域技术人员已知的方法,通过用适当的无机或有机碱或酸处理,将以游离碱或酸形式存在的所有结构(i)或(ii)的化合物转化为它们的药学上可接受的盐。结构(i)或(ii)的化合物的盐可以通过标准技术转化为它们的游离碱或酸形式。以下一般反应方案说明了制备结构(i)或(ii)的化合物或者其药学上可接受的盐、互变异构体或立体异构体的方法,其中r3a、r3b、l1、l2、g1a、g1b、g2a、g2b和g3如本文所定义。应理解,本领域技术人员可以能够通过相似的方法或通过组合本领域技术人员已知的其他方法来制备这些化合物。还应理解,本领域技术人员将能够通过使用适当的起始组分并根据需要改变合成参数以如下所述的类似方式制备以下未具体说明的结构(i)或(ii)的其他化合物。通常,起始组分可从诸如sigma aldrich、lancaster synthesis,inc.、maybridge、matrix scientific、tci和fluorochem usa等的来源获得,或根据本领域技术人员已知的来源合成(参见例如,advanced organic chemistry:reactions,mechanisms,and structure,第5版(wiley,2000年12月))或如本发明中所述制备。一般反应方案1一般反应方案1(“方法a”)提供了用于制备结构(i)的化合物的示例性方法。一般反应方案1中的r1、r2、r4、r5、r6、y和z如本文所定义。r’、x、m和n是指这样选择的变量,使得a-5、a-6、a-8和a-10是具有结构(i)的化合物。例如,r’是r1或r2,x是br,m是y或z,并且n是范围为0至23的整数。结构a-1的化合物是购买的或根据本领域已知的方法制备的。使用适合的条件和试剂(如p-tsa),用醇a-2(如苄醇)保护胺/酸a-1,以获得酯/胺a-3。将酯/胺a-3与酯a-4(如,使用dipea)偶联以得到苄酯a-5。化合物a-5任选地使用适当的条件(如,pd/c,h2)去保护以获得酸a-6。酸a-6可与胺a-7(如,使用草酰氯/dmf)反应以获得酰胺a-8,或可选地,与醇a-9(如,使用dcc/dmap)反应以产生酯a-10。a-5、a-6、a-8和a-10中的每一个为结构(i)的化合物。一般反应方案2一般反应方案2(“方法b”)提供了用于制备结构(i)的化合物的示例性方法。一般反应方案2中的r1、r2、r4、r5、r6、y和z如本文所定义。r’、x、m和n是指这样选择的变量,使得b-6是具有结构(i)的化合物。例如,r’是r1或r2,x是br,m是y或z,并且n是范围为0至23的整数。结构b-1的化合物是购买的或根据本领域已知的方法制备的。保护的胺/酸b-1与胺b-2的反应在适当的偶联条件(如nhs,dcc)下进行以得到酰胺b-3。在使用酸性条件(如,tfa)的去保护步骤之后,将胺b-4在适合的条件(如,dipea)下与酯b-5偶联以得到结构(i)的化合物b-6。一般反应方案3一般反应方案3(“方法c”)提供了用于制备结构(i)的化合物的示例性方法。一般反应方案3中的r1、r4、r5、re、rf、y和z如本文所定义。r’、x、m和n是指这样选择的变量,使得c-7是具有结构(i)的化合物。例如,r’是r1或r2,x是br,m是y或z,并且n是范围为0至23的整数。结构c-1、c-2、c-4和c-5的化合物是购买的或根据本领域已知的方法制备的。胺/酸c-1与醇c-2的反应在适当的偶联条件(如对-tsa)下进行以得到胺/酯c-3。平行地,通过在适合的条件(如草酰氯/dmf)下将酸c-4与胺c-5偶联来制备酰胺c-6。将c-3和c-6在碱性条件(如dipea)下结合以得到结构(i)的化合物c-7。一般反应方案4一般反应方案4(“方法d”)提供了用于制备结构(ii)的化合物的示例性方法。一般反应方案1中的r1、r2、r4、r5、y和z如本文所定义。r’、x、m和n是指选择的变量,使得d-10是具有结构(i)的化合物。例如,r’是r1或r2,x是br,m是y或z,并且n是范围为0至23的整数。结构d-1的化合物是购买的或根据本领域已知的方法制备的。d-1与醇d-2在适当条件(例如,koh/加热)下反应得到酯d-3,然后可将酯d-3与胺d-4偶联以产生保护的胺d-5。可以使用碱性试剂(如三乙胺/dmap)将保护的胺d-5与酰氯d-6偶联以得到d-7,并使用酸(如tfa)去保护以得到去保护的胺d-8。d-8和d-9之间的最终偶联可以在碱性条件(如dipea)下进行以得到结构(ii)的化合物d-10。一般反应方案5一般反应方案5(“方法e”)提供了用于制备结构(ii)的化合物的示例性方法。一般反应方案2中的r1、r2、r5、y和z如本文所定义。r’、x、m和n是指这样选择的变量,使得e-6是具有结构(i)的化合物。例如,r’是r1或r2,x是br,m是y或z,并且n是范围为0至23的整数。结构e-1的化合物是购买的或根据本领域已知的方法制备的。e-1与甲醇反应得到酯e-2是在适当的条件(如乙酰氯)下进行的。可以通过使用例如甲醇和加热添加二胺e-3来制备酯e-2。可以使用碱性条件(如dipea)将所得酰胺e-4与e-5偶联以得到结构(ii)的化合物e-6。一般反应方案6一般反应方案6(“方法f”)提供了用于制备结构(ii)的化合物的示例性方法。一般反应方案3中的r1、r2、r4、r5、y和z如本文所定义。r’、x、m和n是指这样选择的变量,使得f-8是具有结构(i)的化合物。例如,r’是r1或r2,x是br,m是y或z,并且n是范围为0至23的整数。结构f-1的化合物是购买的或根据本领域已知的方法制备的。f-1醇/胺f-2的反应在适当的条件(如kco3、ce2co3和nai)下进行以得到二酯/醇f-3。获得甲磺酸酯f-4(如,使用mscl、三乙胺和dmap),并将其与胺f-5(如,使用加热)偶联,得到二酯f-6。f-6和酰氯f-7之间的最终偶联使用碱性偶联条件(如,三乙胺,dmap)进行以得到结构(ii)的化合物f-8。一般反应方案7一般反应方案7(“方法g”)提供了用于制备结构(ii)的化合物的示例性方法。一般反应方案4中的r1、r2、r4、r5、y和z如本文所定义。r’、x、m和n是指这样选择的变量,使得g-8是具有结构(i)的化合物。例如,r’是r1或r2,x是br,m是y或z,并且n是范围为0至23的整数。结构g-1的化合物是购买的或根据本领域已知的方法制备的。甲磺酸酯g-1的反应与胺g-2偶联(如,使用加热至75℃)以得到保护的胺g-3,将其与酰氯g-4反应(如,使用三乙胺/dmap)以得到酰胺g-5。在酸性条件(如tfa)下去除保护基团,然后在碱性条件(如dipea)下将胺g-6与g-7偶联以得到结构(ii)的化合物g-8。应注意,用于制备结构(i)或(ii)的化合物的各种替代策略对本领域普通技术人员而言是可用的。根据需要使用保护基团和对上述一般反应方案1-7的其他修改对于本领域普通技术人员而言将是显而易见的。提供以下实施例是为了说明而非限制的目的。实施例1使用脂质纳米颗粒组合物进行的荧光素酶mrna体内评价将结构(i)或(ii)的脂质、dspc、胆固醇和peg-脂质以50:10:38.5:1.5或47.5:10:40.8:1.7的摩尔比溶解在乙醇中。以总脂质与mrna的重量比为约10:1至30:1制备脂质纳米颗粒(lnp)。简而言之,将mrna在10至50mm柠檬酸盐缓冲液(ph 4)中稀释至0.2mg/ml。使用注射器泵将乙醇脂质溶液与mrna水性溶液以约1:5至1:3(vol/vol)的比率混合,其中总流速高于15ml/min。然后去除乙醇,并通过透析用pbs代替外部缓冲液。最后,通过0.2μm孔无菌过滤器过滤脂质纳米颗粒。根据机构动物护理委员会(acc)和加拿大动物护理议会(ccac)建立的指南,在6-8周龄雌性c57bl/6小鼠(charles river)8-10周龄cd-1(harlan)小鼠(charles river)中进行了研究。通过尾静脉注射全身施用各种剂量的mrna-脂质纳米颗粒,并且在施用后的特定时间点(如4小时)使动物安乐死。将肝脏和脾脏收集在预先称重的管中,确定重量,立即在液氮中速冻并保存在-80℃直至处理用于分析。对于肝脏,在2ml fastprep管(mp biomedicals,solon oh)中解剖约50mg进行分析。向每个管中加入1/4”陶瓷球(mp biomedicals),并向肝脏组织中加入500μl平衡至室温的glo裂解缓冲液(glo lysis buffer)–glb(promega,madison wi)。用fastprep24仪器(mpbiomedicals)以2×6.0m/s将肝组织匀浆15秒。将匀浆在室温下孵育5分钟,然后在glb中以1:4稀释并使用steadyglo荧光素酶测定系统(promega)进行评估。具体而言,将50μl稀释的组织匀浆与50μl steadyglo底物反应,振荡10秒,随后5分钟孵育,然后使用centroxs3lb960发光计(berthold technologies,germany)进行定量。通过使用bca蛋白测定试剂盒(pierce,rockford,il)确定测定的蛋白质的量。然后将相对发光单位(rlu)归一化至经测定的总μg蛋白质。为了将rlu转换为ng荧光素酶,用quantilum重组荧光素酶(promega)生成标准曲线。来自trilink biotechnologies的fluc mrna(l-6107)将表达最初从萤火虫北斗萤火虫(photinus pyralis)中分离出来的荧光素酶蛋白。fluc通常用于哺乳动物细胞培养中以测量基因表达和细胞活力。在底物荧光素的存在下,它会发出生物发光。该加帽和聚腺苷酸化的mrna被5-甲基胞苷和假尿苷完全取代。实施例2测定配制的脂质的pka如别处所述,配制的脂质的pka与lnp递送核酸的效力相关(参见jayaraman等人,angewandte chemie,international edition(2012),51(34),8529-8533;semple等人,nature biotechnology 28,172–176(2010))。pka的优选范围是~5至~7。使用基于2-(对甲苯氨基)-6-萘磺酸(tns)的荧光的测定,在脂质纳米颗粒中确定每种脂质的pka。使用如实施例1所述的在线方法(in-line process)制备浓度为0.4mm总脂质的在pbs中包含新型脂质或结构(i)或(ii)/dspc/胆固醇/peg-脂质(50/10/38.5/1.5或47.5:10:40.8:1.7mol%)的脂质纳米颗粒。将tns制备成100μm于蒸馏水中的储备液。在含10mm hepes、10mm mes、10mm乙酸铵和130mm nacl的2ml缓冲溶液中将囊泡稀释至24μm脂质,其中ph范围为2.5至11。将tns溶液的等分试样加入以得到1μm的最终浓度,并且在涡旋混合后,在室温下使用321nm和445nm的激发和发射波长在slm aminco series 2luminescence分光光度计中测量荧光强度。将s形最佳拟合分析应用于荧光数据,并将pka测量为产生最大荧光强度一半的ph。如通过使用malvern zetasizer nano zs(malvern,uk)进行的准弹性光散射测定的,脂质纳米颗粒粒度的直径为约55-95nm,并且在一些情况下直径为约70-90nm。给出的直径是强度加权平均值。使用基于荧光嵌入染料的测定(ribogreen)确定封装。表3和4分别提供了使用以下摩尔比配制的结构(i)和(ii)的代表性化合物的性能:47.5%阳离子脂质/10%二硬脂酰基磷脂酰胆碱(dspc)/40.8%胆固醇/1.7% peg脂质(“peg-dma”2-[2-(ω-甲氧基(聚乙二醇2000)乙氧基]-n,n-双十四烷基乙酰胺)。相对活性如实施例1所述通过在经由尾静脉注射施用后4小时测量肝脏中的荧光素酶表达来确定。将活性在0.3和1.0mg mrna/kg的剂量下比较,并表示为如实施例1所述施用后4小时测量的ng荧光素酶/g肝脏。表3结构(i)的代表性化合物的性能表4结构(ii)的代表性化合物的性能实施例3化合物i-1的合成将5-氨基戊酸(1当量,2.5g,21.3mmol)、苄醇(3当量,64mmol,6.92g,6.63ml)、甲苯(60ml)和对甲苯磺酸单水合物(1.1当量,23.4mmol,4.45g)的混合物在dean-stark条件下加热回流保持16小时。将反应混合物冷却至室温并过滤。将白色固体用甲苯(40ml)洗涤,得到6.06g呈白色固体的期望产物(16mmol,75%,磺酸盐)。化合物i-1将2-己基癸基6-溴己酸酯(1.6当量,6.31mmol,2.646g)、5-氨基戊酸苄酯(1.5g,3.94mmol)、n,n-二异丙基乙胺(3.5当量,13.8mmol,1.78g,2.40ml)和无水乙腈(20ml)的混合物在密封压力烧瓶中在82℃下在油浴中加热3天。将反应混合物浓缩并将残余物溶解于己烷(40ml)中。将混合物通过硅胶垫过滤,并用己烷/乙酸乙酯梯度(1:0至49:1)洗涤直至去除所有未反应的2-己基癸基6-溴己酸酯。然后将垫用己烷/乙酸乙酯/三乙胺(400ml,4:1:0.1)的混合物洗涤并浓缩以得到呈黄色油状物的粗产物(870mg)。将粗产物通过硅胶快速柱色谱(230-400目硅胶,40g,梯度4至5%甲醇于二氯甲烷中)纯化。得到呈浅黄色油状物的期望产物(704,0.8mmol,25%)。1h nmr(400mhz,cdcl3)δ:7.39-7.30(m,5h),5.12(s,2h),3.97(d,5.8hz,4h),2.41-2.33(m,8h),2.30(t,7.5hz,4h),1.68-1.59(m,8h),1.49-1.38(m,6h),1.39-1.17(m,52h),0.89(类t,6.8hz,12h)。实施例4化合物i-2的合成将含有10% pd/c(0.026当量,0.019mmol,20mg)的化合物i-1(640mg,0.72mmol)于乙醇/乙酸乙酯(1:10ml)中的溶液在氢气下搅拌16小时。将反应混合物用己烷/乙酸乙酯(98:2)的混合物稀释,并通过celite垫过滤。将滤液浓缩(>500mg,浅黄色油状物)。将所得的残余物通过硅胶快速柱色谱(梯度为1%至12.5%甲醇于氯仿中)纯化,得到呈无色油状物的期望产物(403mg,0.51mmol,70%)。1h nmr(400mhz,cdcl3)δ:3.97(d,5.8hz,4h),2.83-2.71(m,6h),2.34-2.26(m,6h),1.75-1.56(m,12h),1.39-1.19(m,52h),0.89(类t,6.7hz,12h)。实施例5化合物i-3的合成在氩气气氛下在室温下向化合物i-2(403mg,0.51mmol)于二氯甲烷(5ml)和dmf(8mg)中的溶液经由注射器添加草酰氯(5当量,2.54mmol,322mg,221μl)。将混合物在室温搅拌2小时。将混合物浓缩,将所得的残余物溶解于二氯甲烷(5ml)中,并再次浓缩至干燥。在室温下,将残余的黄色油状物溶解于8ml二氯甲烷中,并将其一半(4ml)经由注射器添加至辛胺(0.5mmol,65mg,83μl)和三乙胺(250μl)及4-二甲基氨基吡啶(dmap,10mg)于二氯甲烷(5ml)中的溶液中。添加后,将混合物在室温搅拌过夜。将混合物浓缩并将残余物溶解于己烷/乙酸乙酯/三乙胺的混合物中。将混合物通过硅胶垫过滤,并用己烷/乙酸乙酯/三乙胺(100ml 70:30:1)的混合物洗涤。将滤液和洗涤液合并并浓缩以得到黄色油状物(210mg)。粗产物(210mg)通过硅胶快速干柱色谱(梯度为0至5%甲醇于氯仿中)纯化,得到呈无色油状物的期望产物(178mg,0.20mmol,78%)。1h nmr(400mhz,cdcl3)δ:5.55(宽,类t,1h),3.97(d,5.8hz,4h),3.25-3.21(m,2h),2.44-2.34(m,6h),2.31(t,7.5hz,4h),2.18(t,7.5hz,2h),1.68-1.58(m,8h),1.53-1.38(m,8h),1.32-1.19(62h),0.91-0.87(m,15h)。实施例6化合物i-6的合成根据方法a制备化合物i-6,得到84mg无色油状物。1h nmr(400mhz,cdcl3)δ:3.97(d,5.8hz,4h),3.77(类t,4.9hz,2h),3.73-3.61(br.1h),3.53,3.45(类三重峰的组,4.8hz,5.5hz,比率1.5/0.5,2h),3.34,3.29(两组的类三重峰,7.7hz,7.7hz,比率0.5/1.5,2h),3.09-3.83(br,2h),2.57-2.34(br.,6h),2.32(t,7.4hz,4h),1.95-1.51(br,12h),1.51-1.38(br,4h),1.38-1.08(64h),0.91-0.86(m,15h)。实施例7化合物i-7的合成根据方法b,如下制备化合物i-7:(4-(二丁基氨基)-4-氧代丁基)氨基甲酸叔丁酯的合成向4-((叔丁氧基羰基)氨基)丁酸(1.0当量,2mmol,406mg)、n-羟基琥珀酰亚胺(1.0当量,2mmol,230mg)和dmap(20mg)于20ml二氯甲烷中的溶液添加n,n'-二环己基碳二亚胺(dcc,1.2当量,2.4mmol,494mg),并将混合物在室温搅拌1小时。将反应混合物过滤。向滤液中添加二丁胺(1.5当量,3mmol,387mg,504μl)。在室温搅拌8小时后,将混合物过滤,用二氯甲烷稀释,并用稀氯化铵溶液(ph 6-7)和饱和碳酸氢钠水溶液洗涤。将有机层在室温下经硫酸钠干燥过夜。浓缩萃取物(0.8g油状物/固体)并将粗产物通过硅胶快速柱色谱(梯度为10至35%乙酸乙酯于己烷中)纯化。得到呈无色油状物的期望产物(630mg,2mmol,100%)。4-氨基-n,n-二丁基丁酰胺的合成在氩气气氛下,在配备有搅拌棒和橡胶隔片的圆底烧瓶中,放入于二氯甲烷(10ml)中的粗(4-(二丁基氨基)-4-氧代丁基)氨基甲酸叔丁酯(630mg,2mmol)。在搅拌期间在室温下添加三氟乙酸(tfa,40mmol,3ml,4.56g)。将反应混合物在室温搅拌16小时。将混合物用二氯甲烷稀释,并在搅拌下缓慢添加饱和碳酸氢钠。分离两相,并将水相用二氯甲烷(4×)萃取。将无水碳酸钠和盐水添加至水相。再用二氯甲烷(2×)萃取水相。将合并的萃取物经无水碳酸钠和硫酸钠干燥,过滤并浓缩。将所得的残余物溶解于二氯甲烷(4ml)中,通过硅胶垫过滤,并用氯仿/乙醇/水/氢氧化铵(40:24:1.5:1)的混合物洗涤。合并滤液和洗涤液,并浓缩至干燥(517mg,2.4mmol),得到褐色油状物/固体。将残余物溶解于乙腈(15ml)中,并通过棉布过滤,用乙腈(5ml×3)洗涤。将滤液浓缩至干燥(467mg,2.17mmol)。该产物无需进一步纯化即可用于以下合成步骤。化合物i-7的合成将2-丁基辛基6-溴己酸酯(1.85当量,450mg,1.24mmol)、4-氨基-n,n-二丁基丁酰胺(143mg,0.67mmol)、n,n-二异丙基乙胺(2.5mmol,323mg,0.435ml)和无水乙腈(15ml)的溶液在密封耐压烧瓶中在75℃下在油浴中加热16小时。将反应混合物冷却并浓缩,得到褐色油状物/固体。将粗产物溶解于己烷/乙酸乙酯/三乙胺(20ml,~85:15:1)的混合物中,通过硅胶垫过滤,并用己烷/乙酸乙酯/三乙胺(100ml,4:1:0.1)的混合物洗涤。浓缩滤液,并得到400mg呈黄色油状物/固体的粗产物。将粗产物通过硅胶快速干柱色谱(梯度为0至4%甲醇于氯仿中,0至4%)再次纯化,得到呈浅黄色油状物的期望产物(213mg,0.27mmol,44%)。1h nmr(400mhz,cdcl3)δ:3.97(d,5.8hz,4h),3.31(类t,7.6hz,2h),3.22(类t,7.8hz,2h),2.45-2.36(m,6h),2.30(t,7.5hz,6h),1.76(五重峰,7.2hz,2h),1.63(类五重峰,7.6hz,6h),1.56-1.47(m,4h),1.47-1.36(m,4h),1.36-1.20(40h),0.96(t,7.2hz,3h),0.93(t,7.2hz,3h),0.93-0.87(m,12h)。实施例8化合物i-8的合成根据方法b(以与化合物7类似的方式)制备化合物i-8,得到207mg(0.25mmol,40%)的浅黄色油状物。1h nmr(400mhz,cdcl3)δ:3.97(d,5.8hz,4h),3.31(类t,7.6hz,2h),3.22(类t,7.8hz,2h),2.43(类t,7.1hz,2h),2.37(类t,7.5hz,4h),2.31(t,7.4hz,2h),2.30(t,7.5hz,4h),1.76(五重峰,7.3hz,2h),1.66-1.57(m,6h),1.56-1.46(m,4h),1.45-1.36(m,4h),1.36-1.20(48h),0.96(t,7.3hz,3h),0.93(t,7.2hz,3h),0.93-0.87(m,12h)。实施例9化合物i-10的合成根据方法c,如下制备化合物i-10:2-丁基辛基6-氨基己酸酯的合成将2-丁基-1-辛醇(1.25当量,4.65g,25mmol)、6-氨基己酸(2.62g,20mmol)和对甲苯磺酸单水合物(1.1当量,22mmol,4.18g)于甲苯(70ml)中的溶液在dean-stark条件下加热回流保持16小时。使反应混合物冷却。向反应混合物中添加饱和碳酸氢钠水溶液直至水层的ph高于9。分离两层,将有机层用盐水洗涤并经无水硫酸钠干燥。浓缩过滤的有机层,得到浑浊的油状物。将粗产物溶解于己烷/乙酸乙酯的混合物(100ml,19:1)中,并通过硅胶垫过滤。将垫用己烷/乙酸乙酯的混合物(200ml)洗涤,然后用己烷/乙酸乙酯/三乙胺(200ml,~80:20:1)洗涤。最后,将垫用二氯甲烷/甲醇/氢氧化铵的混合物(400ml,95:5:0.13)洗涤。将最后的洗涤液浓缩至干燥,并得到呈无色油状物的期望产物(7.19g),其含有约1.2g的p-tsa并且无需进一步纯化即可使用。6-溴-n,n-二辛基己酰胺的合成在室温下在氩气气氛下,向6-溴己酸(2.93g,15mmol)于二氯甲烷(25ml)和dmf(0.1ml)中的溶液添加草酰氯(3当量,45mmol,5.7g,3.93ml)。将所得混合物在室温搅拌过夜。将混合物在减压下浓缩约2小时。在室温下,将残余的液体/固体(黄色)溶解在20ml的二氯甲烷中,并添加至二辛胺(1.1当量,16.5mmol,3.98g,4.98ml)、三乙胺(90mmol,9.09g,12.5ml)和dmap(10mg)于二氯甲烷(20ml)中的溶液。搅拌2.5小时后将所得的混合物浓缩。将浓缩的黄色油状物/固体溶解在己烷和乙酸乙酯的混合物(~75:25)中,并添加1m盐酸。过滤混合物,并分离两层。将水层用二氯甲烷(×3)萃取,将合并的萃取物经无水硫酸钠干燥并浓缩,得到呈黄色油状物的粗产物。将粗油状物通过硅胶快速干柱色谱(梯度为1:0至4:1,己烷/乙酸乙酯)纯化。得到期望的浅黄色油状物(5.09g,12.2mmol,81%)。化合物i-10的合成向2-丁基辛基6-氨基己酸酯(0.76mmol,228mg)添加6-溴-n,n-二辛基己酰胺(1.89当量,1.44mmol,603mg),然后添加无水乙腈(15ml)和n,n-二异丙基乙胺(3.2当量,2.4mmol,310mg,0.417ml)。使用热油浴将混合物在密封压力烧瓶中在80℃下加热16小时。使混合物冷却并浓缩。通过硅胶快速柱色谱(40g硅胶,梯度为0至5%甲醇于氯仿中)纯化所得的残余物,得到呈无色油状物的期望产物(198mg,0.20mmol,28%)。实施例10化合物i-12的合成如下制备化合物i-12:a的合成将5-氨基戊酸(1当量,2.9g,24.8mmol)、苄醇(2.3当量,58mmol,6.26g,6ml)、甲苯(70ml)和对甲苯磺酸单水合物(1.1当量,23.4mmol,4.45g)的混合物在dean-stark条件下加热回流保持20小时。将混合物冷却至室温。将固体通过过滤收集,并用甲苯(20ml x 2)和乙醚(20ml)洗涤。获得呈白色固体的期望产物(为t-tsoh盐)(7.503g,19.8mmol,80%)。c的合成将a(1当量,5.59mmol,2.5g)、b(盐形式,1.4当量,3g,7.9mmol,mw 379.47)、n,n-二异丙基乙胺(3.5当量,27.67mmol,3.58g,4.82ml)和无水乙腈(20ml)的混合物在密封压力烧瓶(油浴83c)中加热16小时。将粗产物通过硅胶柱色谱(己烷-etoac-et3n,95:5:0至75:25:1)纯化。这得到呈黄色油状物的期望产物c(912mg,0.97mmol,35%)。d的合成向c(912mg,0.97mmol)于etoh-etoac(1:10ml)中的溶液添加10% pd/c(25mg),并将混合物在氢气下搅拌16小时。将反应混合物通过垫过滤,并用乙酸乙酯(100ml)洗涤。浓缩滤液,得到呈浅黄色油状物的粗产物(902mg)。粗产物通过硅胶柱色谱(0至10%甲醇于氯仿中)纯化。这得到呈浅色蜡状物的期望产物d(492mg,0.58mmol,60%)。i-12的合成在室温下在ar下,向d(492mg,0.58mmol)于dcm(5ml)和dmf(8mg)中的溶液添加草酰氯(3.2mmol,406mg)。将该混合物在室温搅拌过夜并浓缩。将残余物溶解于dcm(5ml)中,并再次浓缩以去除任何草酰氯。将残余油状物(粘稠的黄色油状物)溶解于10ml dcm中,经由注射器添加至e(1.9mmol,356mg)和三乙胺(750ul)及dmap(5mg)于dcm(10ml)中的溶液(在-15c下于5分钟内)。添加后,使混合物缓慢升至室温并搅拌过夜。通过柱色谱(0至5%甲醇于氯仿中)纯化后,得到呈无色油状物的期望化合物12(100mg)。1hnmr(400mhz,cdcl3)δ:4.08(类t,7.1hz,1h),3.97(d,5.8hz,4h),3.54-3.44(m,4h),3.23-3.17(m,2h),2.44-2.33(m,8h),2.30(t,7.5hz,4h),1.71-1.55(m,12h),1.52-1.36(m,6h),1.36-1.08(70h),0.92-0.86(m,15h)。实施例11化合物i-11的合成以类似于化合物i-12的方式制备化合物i-11,得到60mg无色油状物。1hnmr(400mhz,cdcl3)δ:3.97(d,5.8hz,4h),3.38(q,7.1hz,2h),3.21(q,7.1hz,2h),2.44-2.27(m,12h),1.68-1.54(m,8h),1.52-1.36(m,6h),1.36-1.20(56h),1.18(t,7.1hz,3h),1.11(t,7.1hz,3h),0.89(类t,6.8hz,12h)。实施例12化合物i-18的合成a的合成向5-(二苄基氨基)戊酸(1.0当量,1.32g,4.4mmol,由5-氨基戊酸和苄基溴制备)、n-羟基琥珀酰亚胺(1.0当量,4.4mmol,506mg,mw115.09)和4-二甲基氨基吡啶(添加4.4mmol,537mg)于20ml ch2cl2中的混合物添加dcc(1当量,4.4mmol,906mg),并将混合物在室温搅拌2.5小时。将混合物过滤到含有2-(辛基氨基)乙醇(1.5当量,6.6mmol,1.14g,由2-氨基乙醇和辛胺制备)的烧瓶中。在室温搅拌2天后,将混合物过滤,用dcm稀释,并用稀hcl溶液(1m)和饱和水性nahco3洗涤。将有机层经na2so4干燥。将萃取物真空浓缩(0.8g油状物/固体)。将粗产物通过柱色谱(己烷、乙酸乙酯和三乙胺的混合物,90:10:0至60:40:1)纯化。这得到呈无色油状物的期望产物(浅色油状物,0.98g,2.16mmol,49%)。b的合成在氢气下将含有10% pd/c(100mg)的a(0.98g,2.2mmol)于甲醇(20ml)中的溶液搅拌4天。将混合物通过垫过滤,并甲醇洗涤。浓缩滤液(643mg无色油状物)。该产物无需进一步纯化即可用于下一步。化合物i-18的合成向b(0.7mmol,191mg)添加2-己基癸基8-溴辛酸酯(1.9当量,1.33mmol,558mg,由8-溴辛酸和2-己基-1-癸醇制备),然后添加无水乙腈(15ml)和n,n-二异丙基乙胺(3当量,2.1mmol,271mg)。将混合物在密封压力烧瓶中于84℃下加热16小时。将混合物冷却并浓缩。将粗产物通过柱色谱(氯仿和甲醇的混合物,100:0至95:5)纯化。这得到呈浅黄色油状物的期望产物(251mg)。1hnmr(400mhz,cdcl3)δ:实施例13化合物i-19的合成a的合成向5-(二苄基氨基)戊酸(1.0当量,1.32g,4.4mmol,由-氨基戊酸和苄基溴制备)和4-二甲基氨基吡啶(4.4mmol,537mg)于20ml ch2cl2中的混合物添加n-羟基琥珀酰亚胺(1.0当量,4.4mmol,506mg),然后添加dcc(1当量,4.4mmol,906mg)并将混合物在室温搅拌2.5小时。将反应混合物过滤至含4-(辛基氨基)丁-1-醇(2.0g,由γ-丁内酯和辛胺以两步制备)的烧瓶中。在室温搅拌4天后,将混合物用dcm稀释并用稀hcl溶液(0.5m,100ml)和饱和水性nahco3洗涤。有机层经na2so4干燥。将萃取物真空浓缩(0.8g油状物/固体)。将粗产物通过柱色谱(己烷、乙酸乙酯和三乙胺的混合物,90:10:0至60:40:1)纯化。这得到呈无色油状物的期望产物(浅色油状物,0.554g)。b的合成将含有10% pd/c(50mg)的a(0.554g,1.15mmol)于甲醇(10ml)中的溶液在氢气下搅拌2天。将混合物通过垫过滤,并甲醇洗涤。浓缩滤液(mg无色油状物,mmol)。化合物i-19的合成向b(180mg,0.6mmol)添加2-己基癸基8-溴辛酸酯(1.9当量,1.14mmol,509mg),然后添加无水乙腈(15ml)和n,n-二异丙基乙胺(3当量,1.8mmol,233mg)。将混合物在密封压力烧瓶中于84℃下加热16小时。将混合物冷却并浓缩。将粗产物通过柱色谱(氯仿和甲醇的混合物,100:0至95:5)纯化。这得到呈浅黄色油状物的期望产物(117mg)。实施例14化合物ii-3的合成根据方法d,如下制备化合物ii-3:(3-(甲基氨基)丙基)氨基甲酸叔丁酯的合成将氢氧化钾粉末(20mol%,168mg,3mmol)、二(1h-咪唑-1-基)甲酮(2.43g,15mmol)和叔丁醇(15mmol,1.112g)于无水甲苯(76ml)中的混合物在氩气气氛下于60℃(油浴)搅拌加热3小时。然后滴加n-甲基-1,3-二氨基丙烷(15mmol,1.322g,1.566ml)。将所得混合物在60℃下再加热3小时。使反应混合物冷却至室温后,向混合物中加入水。分离两层,并将有机层用盐水洗涤,经硫酸钠干燥并浓缩至干燥,得到浅黄色油状物(0.966g)。将水相用二氯甲烷(3×30ml)萃取。将合并的有机萃取物经硫酸钠干燥,过滤并浓缩,得到浅黄色油状物(0.941g)。合并两个级分,得到1.9g期望产物(10mmol,67%)。该产物无需进一步纯化即可用于下一个合成步骤。(3-(n-甲基辛酰氨基)丙基)氨基甲酸叔丁酯的合成在室温下经5分钟,将辛酰氯(1.3当量,2.08mmol,338mg,355μl)于二氯甲烷(10ml)中的溶液经由注射器添加至化合物(3-(甲基氨基)丙基)氨基甲酸叔丁酯(1.6mmol,301mg)和三乙胺(5当量,8mmol,810mg,1.11ml)及dmap(10mg)于二氯甲烷(15ml)中的溶液。将所得混合物在室温搅拌过夜,然后添加甲醇(1ml)。将反应混合物搅拌1小时。搅拌后,将混合物通过硅胶垫(3cm宽和2cm高)过滤,并用二氯甲烷洗涤。将滤液用二氯甲烷稀释并用水洗涤。将有机相分离,并经硫酸钠干燥、过滤并浓缩,得到呈黄色油状物的期望产物(460mg,1.46mmol,91%)。该产物无需进一步纯化即可用于下一个合成步骤。n-(3-氨基丙基)-n-甲基辛酰胺的合成在氩气气氛下,在配备有搅拌棒和橡胶隔片的圆底烧瓶中,放置于二氯甲烷(10ml)中的粗(3-(n-甲基辛酰氨基)丙基)氨基甲酸叔丁酯(1.46mmol,460mg)。在室温下添加三氟乙酸(2.9ml)。将反应混合物在室温搅拌3.5小时,然后添加1.5m盐酸(100ml)。用二氯甲烷(2×)萃取水层。将合并的有机萃取物用2m盐酸(50ml)洗涤。将合并的酸级分汇集,用浓氢氧化钠水溶液(50% naoh)碱化,并用二氯甲烷(3×)萃取。将合并的有机层经硫酸钠干燥,过滤并浓缩。得到呈无色油状物的期望产物(160mg,0.75mmol)。该产物无需进一步纯化即可用于下一个合成步骤。化合物ii-3的合成向n-(3-氨基丙基)-n-甲基辛酰胺(0.75mmol,160mg)添加2-己基癸基6-溴己酸酯(1.9当量,1.43mmol,598mg),然后添加无水乙腈(15ml)和n,n-二异丙基乙胺(3当量,2.25mmol,290mg,0.391ml)。将混合物使用油浴在密封压力烧瓶中加热至80℃,保持2天。浓缩反应混合物,并将残余物溶解于己烷/乙酸乙酯(约5:1,100ml)的混合物中,用水、盐水洗涤,经硫酸钠干燥,过滤并浓缩。得到呈浅黄色油状物的粗产物(约0.6g)。将粗产物于己烷(10ml)中稀释,并通过硅胶垫过滤。用己烷/乙酸乙酯/三乙胺(200ml,4:1:0.1)的混合物洗涤该垫。浓缩滤液得到呈浅黄色油状物的粗产物。将粗产物通过硅胶快速柱色谱(40g硅胶;梯度为0至6%甲醇于氯仿中)纯化,得到呈无色油状物的期望产物(216mg,0.24mmol,34%)。1h nmr(400mhz,cdcl3)δ:3.97(dd,5.8hz,1.2hz,4h),3.37(类t,7.5hz,1h),3.30(类t,7.5hz,1h),2.98(s,1.5h),2.91(s,1.5h),2.41-2.35(m,6h),2.34-2.26(m,6h),1.71-1.58(m,10h),1.48-1.38(m,4h),1.37-1.18(m,60h),0.92-0.86(m,15h)。实施例15化合物ii-4的合成根据方法e,如下制备化合物ii-4:辛酸甲酯的合成在氩气气氛下,向辛酸(50mmol,7.21g)于200ml甲醇中的冰盐冷却的溶液缓慢添加乙酰氯(10ml)。将所得溶液搅拌20分钟,然后除去冷却浴。将溶液在室温搅拌过夜。在32℃下减压去除溶剂(两层)。向残余物中添加饱和碳酸氢钠水溶液(100ml)和己烷(200ml)。将己烷萃取物用盐水(70ml)洗涤,经硫酸钠干燥,过滤并浓缩,得到无色油状物。将油状物在高真空管线上干燥过夜(6.439g,40.7mmol,93%)。n-(4-氨基丁基)辛酰胺的合成在回流下向1,4-丁二胺(5当量,100mmol,8.8g)于50ml甲醇中的溶液缓慢(经15分钟)添加于甲醇(20ml)中的辛酸甲酯(20mmol,3.16g)。将反应混合物保持回流48小时。然后在减压下蒸发溶剂,并将残余物溶解于水(70ml)和乙酸乙酯(100ml)的混合物中。分离各相,并将水层用乙酸乙酯(2×)萃取。将合并的有机萃取物用水、盐水洗涤,经硫酸钠干燥并过滤。浓缩得到油状物和白色固体的混合物。将粗残余物溶解在二氯甲烷和甲醇的混合物中。将溶液通过硅胶垫(1.5cm高x 6.5cm宽)过滤,并用5%甲醇于二氯甲烷中的混合物洗涤,直到薄层色谱分析显示所有二酰基化产物均被去除。然后将垫用氯仿/乙醇/水/氨的混合物(30/25/3/2,225ml)洗涤。将含有期望产物的滤液浓缩至干燥(白色固体,2.52g,11.8mmol,59%)。化合物ii-4的合成向2-己基癸基6-溴己酸酯(1.9当量,1.00g,2.38mmol)于无水乙腈(15ml)中的悬浮液添加n-(4-氨基丁基)辛酰胺(1.25mmol,269mg)和n,n-二异丙基乙胺(2当量,2.5mmol,323mg,0.435ml)。使用油浴在密封压力烧瓶中将混合物加热至80℃,保持32小时。浓缩反应混合物,并将残余物溶解于己烷/乙酸乙酯的混合物(~5:1,100ml)中,用水、盐水洗涤,经硫酸钠干燥,过滤并浓缩。得到呈浅黄色油状物的粗产物(~1.2g)。将粗产物于己烷(10ml)中稀释,通过硅胶垫过滤,并用己烷/乙酸乙酯(1:0至49:1)的混合物洗涤,直到去除所有未反应的2-己基癸基6-溴己酸酯。然后将垫用己烷/乙酸乙酯/三乙胺的混合物(200ml,4:1:0.1)洗涤并浓缩,得到褐色油状物(~650mg)。将粗产物(650mg)通过硅胶快速柱色谱(230-400目硅胶,40g,梯度为0至6%甲醇于氯仿中)纯化。获得呈无色油状物的期望产物(438mg,0.49mmol,41%)。1h nmr(400mhz,cdcl3)δ:5.95(类t,未良好解析,5.3hz,1h,nh),3.98(d,5.8hz,4h),3.25(q-样,6.3hz,2h),2.42-2.35(m,6h),2.31(t,7.5hz,4h),2.15(类t,7.7hz,2h),1.68-1.58(m,8h),1.54-1.38(m,8h),1.36-1.18(m,60h),0.92-0.86(m,15h)。实施例16化合物ii-5的合成根据方法f,如下制备化合物ii-5:8,8'-((4-羟丁基)氮烷二基)二辛酸双(2-己基癸基)酯的合成向2-己基癸基8-溴辛酸酯(2当量,3.09g,6.9mmol)于30ml无水四氢呋喃的溶液中添加4-氨基-1-丁醇(1当量,3.45mmol,308mg,318μl)、碳酸钾(2当量,6.9mmol,954mg)、碳酸铯(0.3当量,1.04mmol,337mg)和碘化钠(10mg)。使用油浴在压力圆底烧瓶中在氩气气氛下将混合物加热至64℃保持6天。将所得的粗产物溶解于己烷(50ml)中,并加样至短硅胶柱(1cm高x 6.5cm宽)上。将柱用己烷(50ml,级分1)、乙酸乙酯/己烷的混合物(0至3%乙酸乙酯)的混合物洗脱。回收未反应的2-己基癸基8-溴辛酸酯(1.27g,2.84mmol,41%,无色油状物)。用己烷/乙酸乙酯/三乙胺(~4:1:0.1)的混合物洗脱该柱,得到呈浅黄色油状物的粗产物(1.2g)。将粗产物通过硅胶快速干柱色谱(梯度为0至4.2%甲醇于氯仿中)进一步纯化,得到期望产物(1.28g,1.56mmol,45%)。1h nmr(400mhz,cdcl3)δ:6.64-6.45(br.s,1h),3.97(d,5.8hz,4h),3.62-3.51(br.2h),3.07-2.34(br.6h),2.30(t,7.5hz,4h),1.71-1.40(m,14h),1.39-1.19(m,60h),0.89(类t,6.8hz,12h)。双(2-己基癸基)8,8'-((4-((甲基磺酰基)氧基)丁基)氮烷二基)二辛酸酯的合成向双(2-己基癸基)8,8'-((4-羟丁基)氮烷二基)二辛酸酯(542mg,0.66mmol)于二氯甲烷(15ml)中的冷却(-15℃)溶液添加三乙胺(0.23ml,2.5当量)和4-二甲基氨基吡啶(10mg,0.1当量),然后一次性添加甲磺酰氯(1.2e.,0.79mmol,91mg,62μl)。添加完成后,将混合物在-15℃搅拌30分钟,并在室温搅拌2小时。然后将反应混合物倒入饱和碳酸氢钠水溶液中。分离两层,并将水层用二氯甲烷萃取。将合并的有机层(100ml)用盐水洗涤并经硫酸钠干燥。将三乙胺(2ml)添加至萃取物,然后通过硅胶垫(0.3cm)过滤。将垫用二氯甲烷/甲醇/三乙胺的混合物(200ml,~85:15:1)洗涤,然后浓缩,得到浅黄色固体(~600mg)。将所得的固体溶解于己烷/乙酸乙酯/三乙胺(80:20:1)的混合物中,并过滤以去除固体。浓缩滤液,并得到呈黄色油状物的期望产物(501mg,0.55mmol,84%)。双(2-己基癸基)8,8'-((4-(甲基氨基)丁基)氮烷二基)二辛酸酯的合成将双(2-己基癸基)8,8'-((4-((甲基磺酰基)氧基)丁基)氮烷二基)二辛酸酯(501mg,0.55mmol)溶解在甲基胺的四氢呋喃溶液(2m,10ml,20mmol)中。将所得溶液在密封压力管中于60-80℃下搅拌6天。将混合物在减压下浓缩。将所得的残余物溶解于二氯甲烷和甲醇(~85:15)的混合物中,通过硅胶垫(0.5cm)过滤并浓缩,得到黄色油状物(480mg)。粗产物无需进一步纯化即可用于下一个合成步骤。化合物ii-5的合成在室温下经10分钟将于二氯甲烷(10ml)中的乙酰氯(1mmol,40mg,71μl)添加至双(2-己基癸基)8,8'-((4-((甲基磺酰基)氧基)丁基)氮烷二基)二辛酸酯(480mg,约0.55mmol)和三乙胺(350μl)及dmap(10mg)于二氯甲烷(10ml)中的溶液。添加后,将所得混合物在室温搅拌过夜。减压去除溶剂,将残余物溶解于己烷中,并通过celite垫过滤。浓缩滤液,将所得的残余物(600mg,黄色油状物)溶解于己烷中,并通过硅胶垫过滤。将该垫用~0-3%于己烷中的乙酸乙酯(弃去)洗涤,然后用己烷/乙酸乙酯/三乙胺(100ml,~4:1:0.1)的混合物洗涤。浓缩滤液,得到浅黄色油状物(170mg)。将粗油状物(170mg)通过硅胶快速干柱色谱(梯度为1至4%甲醇于氯仿中)纯化,得到呈无色油状物的期望产物(46mg)。1h nmr(400mhz,cdcl3)δ:3.97(d,5.8hz,4h),3.37(类t,7.5hz,1h),3.27(类t,7.5hz,1h),2.98(s,1.5h),2.92(s,1.5h),2.42-2.33(m,6h),2.30(t,7.5hz,4h),2.10,2.08(两组单重峰,1:1,3h),1.68-1.57(m,8h),1.45-1.36(m,6h),1.35-1.21(m,60h),0.89(类t,6.8hz,12h)。实施例17化合物ii-6的合成将2-丁基辛基8-溴辛酸酯(1.6当量,783mg,2.0mmol)、n-(4-氨基丁基)辛酰胺(1.25mmol,269mg)、n,n-二异丙基乙胺(2当量,2.5mmol,323mg)和无水乙腈(15ml)的混合物在密封压力烧瓶中使用油浴加热至85℃,保持16小时。加热后,减压去除溶剂。将所得的残余物溶解于己烷/乙酸乙酯的混合物(~49:1,150ml)中,用稀氯化铵水溶液(ph 6-7)、盐水洗涤,经硫酸钠干燥,过滤并浓缩,得到褐色粘稠油状物。将粗产物通过硅胶柱色谱(梯度为0%至5%甲醇于氯仿中)纯化,得到呈无色油状物的期望产物(320mg,0.38mmol,38%)。1h nmr(400mhz,cdcl3)δ:6.11-6.03(br.1h,nh),3.98(d,5.8hz,4h),3.25(q-样,6.3hz,2h),2.43-2.34(m,6h),2.31(t,7.5hz,4h),2.14(类t,7.6hz,2h),1.67-1.57(m,8h),1.56-1.46(m,4h),1.46-1.36(m,4h),1.36-1.20(m,52h),0.92-0.86(m,15h)。实施例18化合物ii-7的合成根据方法d制备化合物ii-7,得到235mg无色油状物(0.30mmol,对于最后一步为30%)。1h nmr(400mhz,cdcl3)δ:5.95(类t,未良好解析,5.3hz,1h,nh),3.98(d,5.8hz,4h),3.25(类q,6.3hz,2h),2.42-2.35(m,6h),2.31(t,7.5hz,4h),2.15(类t,7.7hz,2h),1.68-1.58(m,8h),1.54-1.38(m,8h),1.36-1.18(m,44h),0.92-0.86(m,15h)。实施例19化合物ii-10和ii-15的合成(3-((2-羟乙基)氨基)丙基)氨基甲酸叔丁酯的合成将甲磺酸3-((叔丁氧基羰基)氨基)丙酯(1.02g,4mmol)溶解在无水乙腈(10ml)中,并向其中添加2-氨基乙醇(5当量,20.5mmol,1.25g,1.24ml)。将混合物在75℃下加热18小时。加热后,将反应混合物浓缩,并将所得的残余物溶解于乙酸乙酯(30ml,两层)中。向混合物中添加水,并分离有机层。用乙酸乙酯(3×30ml)萃取水层。将有机层经无水硫酸钠干燥,过滤并浓缩,得到呈浅黄色油状物的粗产物(0.96g)。将粗产物通过硅胶柱色谱(氯仿/甲醇/浓氨水,梯度为90:10:0.5至80:20:3)纯化,得到呈油状物的期望产物(649mg,2.98mmol,74%)。(3-(n-(2-羟乙基)辛酰氨基)丙基)氨基甲酸叔丁酯的合成在10-20℃下,经5分钟,向辛酰氯(1.3当量,2.57mmol,419mg,439μl)于二氯甲烷(10ml)中的溶液经由注射器添加至化合物(3-((2-羟乙基)氨基)丙基)氨基甲酸叔丁酯(1.98mmol,433mg)和三乙胺(5当量,9.9mmol,1.00g,1.38ml)及dmap(5mg)于二氯甲烷(10ml)中的溶液中。使所得混合物升温并在室温搅拌过夜,然后添加甲醇(1ml)。添加水,并分离各层。将水相用二氯甲烷(30ml×1)萃取,经硫酸钠干燥,过滤并浓缩,得到油状物/固体(0.764g)。向粗混合物(0.764g)于乙醇(10ml)中的溶液添加氢氧化钾(100mg,~1.5mmol,于1.5ml水中)。将所得混合物在室温搅拌2.5小时,然后减压浓缩。将所得的残余物于乙酸乙酯中稀释,并向混合物中添加无水硫酸钠和无水碳酸钾。将混合物过滤并浓缩,得到呈澄清无色油状物的期望产物(650mg,1.88mmol,95%)。n-(3-氨基丙基)-n-(2-羟乙基)辛酰胺的合成在室温下于氩气气氛中添加粗(3-(n-(2-羟乙基)辛酰氨基)丙基)氨基甲酸叔丁酯(650mg,1.88mmol)于二氯甲烷(10ml)中的溶液。将反应混合物在室温搅拌16小时。将混合物用二氯甲烷稀释,然后添加水(40ml)、饱和氯化钠水溶液(40ml)和饱和碳酸氢钠水溶液(40ml)。在搅拌下缓慢添加固体碳酸氢钠直至混合物的ph达到9。分离两相,并将水相用二氯甲烷萃取(3×)。在提取物中仅发现少量期望产物,因此将水相减压浓缩。将残余物溶解于异丙醇中并过滤。浓缩异丙醇滤液,并得到白色固体(5.1g)。将所得的残余物溶解于二氯甲烷、甲醇和三乙胺(~85:1:1)的混合物中,并通过二氧化硅垫过滤。浓缩滤液,得到呈油状物/固体的期望产物(190mg)。粗产物无需进一步纯化即可用于下一个合成步骤。化合物ii-10和化合物ii-15的合成将2-己基癸基6-溴己酸酯(1.0g,2.4mmol)、n-(3-氨基丙基)-n-(2-羟乙基)辛酰胺(190mg)、n,n-二异丙基乙胺(2.6mmol,338mg,0.456ml)和无水乙腈(15ml)的溶液在密封压力烧瓶中使用油浴加热至80℃,保持16小时。浓缩反应混合物,并将所得残余物溶解于己烷/乙酸乙酯的混合物(~19:1,200ml)中。将混合物用水洗涤,经硫酸钠干燥,过滤并浓缩,得到褐色油状物。将粗产物通过硅胶快速干柱色谱(梯度为0至4%甲醇于氯仿中,0至4%)纯化。获得呈浅黄色油状物的产物(37mg),并基于1h分析将其暂定为化合物15。1h nmr(400mhz,cdcl3)δ:4.23-4.13(m,2h),3.976,3.973(两组双重峰,5.8hz,4h),3.59-3.53(m,2h),3.37-3.29(m,2h),2.41-2.28(m,12h),2.07,2.05(两组单重峰,3h),1.71-1.58(m,10h),1.49-1.38(m,4h),1.37-1.10(58h),0.92-0.86(m,15h)。实施例20化合物ii-12的合成根据方法g制备化合物ii-12,得到34mg无色油状物。1h nmr(400mhz,cdcl3)δ:3.976,3.974(两组双重峰,5.8hz,4h),3.33-3.27(m,2h),3.26-3.19(m,2h),2.42-2.35(m,6h),2.31(t,7.5hz,2h),2.30(t,7.5hz,2h),2.09,2.08(两组单重峰,3h),1.71-1.59(m,8h),1.59-1.49(m,2h),1.48-1.39(m,4h),1.37-1.19(m,62h),0.92-0.86(m,15h)。实施例21化合物ii-14的合成根据方法d(以与化合物ii-3类似的方式)制备化合物ii-14,得到241mg无色油状物(0.31mmol,41%)。1h nmr(400mhz,cdcl3)δ:3.97(dd,5.8hz,1.1hz,4h),3.36(类t,7.5hz,1h),3.30(类t,7.5hz,1h),2.98,2.91(两组单重峰,3h),2.41-2.35(m,6h),2.34-2.26(m,6h),1.71-1.58(m,10h),1.48-1.38(m,4h),1.37-1.18(m,44h),0.92-0.86(m,15h)。实施例22化合物ii-16的合成(3-((3-羟丙基)氨基)丙基)氨基甲酸叔丁酯的合成将甲磺酸3-((叔丁氧基羰基)氨基)丙酯(1.05g,4.1mmol)和3-氨基-1-丙醇(5当量,20.5mmol,1.54g,1.57ml)溶解于乙腈(10ml)中。然后将混合物在65℃下搅拌过夜。向混合物中加入水(10-20ml)后,分离有机层,并用乙酸乙酯(3×30ml)萃取水层。将有机萃取物经硫酸钠干燥,过滤并浓缩,得到无色油状物(0.75g)。将粗产物通过硅胶柱色谱(氯仿/甲醇/浓氨水,梯度为90:10:0.5至80:20:3)纯化。将含有产物的级分合并并浓缩。将所得的残余物溶解在乙醇中,并通过棉布过滤。浓缩滤液,得到期望产物(591mg,2.54mmol,64%)。(3-(n-(3-羟丙基)辛酰氨基)丙基)氨基甲酸叔丁酯的合成在5℃下经5分钟将辛酰氯(1当量,1.6mmol,260mg,273μl)于二氯甲烷(10ml)中的溶液经由注射器添加至(3-((3-羟丙基)氨基)丙基)氨基甲酸叔丁酯(1.6mmol,371mg)和三乙胺(5当量,8mmol,808mg,1.11ml)和dmap(5mg)于二氯甲烷(10ml)中的溶液中。使混合物升温至室温并搅拌3.5小时,然后添加甲醇(1ml)。再搅拌1小时后,加水并分离两层。用二氯甲烷(30ml×1)萃取水相。将萃取物经硫酸钠干燥并浓缩,得到呈无色油状物的期望产物(0.59g,1.64mmol,100%)。n-(3-氨基丙基)-n-(3-羟丙基)辛酰胺的合成在氩气气氛下,在配备有搅拌棒和橡胶隔片的圆底烧瓶中放置于二氯甲烷(10ml)中的(3-(n-(3-羟丙基)辛酰氨基)丙基)氨基甲酸叔丁酯(1.6mmol,590mg)。将三氟乙酸(3ml)添加至混合物中,并将反应混合物在室温搅拌3.5小时。搅拌后,将反应混合物浓缩以去除溶剂。将所得的残余物溶解在二氯甲烷中,并再次浓缩,得到无色油状物(1.1g)。将该油状物溶解在二氯甲烷中并通过碳酸氢钠粉末过滤。浓缩滤液,得到油状物(1.1g)。粗产物无需进一步纯化即可用于下一个合成步骤。化合物ii-16的合成将2-己基癸基6-溴己酸酯(2.59mmol,1.09g)、n-(3-氨基丙基)-n-(3-羟丙基)辛酰胺(1.1g)、n,n-二异丙基乙胺(2.8mmol,361mmg,0.487ml)、碳酸钾(2.8mmol,386mg)和无水乙腈(15ml)的混合物在密封压力烧瓶中使用油浴加热至83℃,保持16小时。浓缩反应混合物,并将残余物溶解于己烷/乙酸乙酯(~75:25)与0.5%三乙胺(20ml)的混合物中。将混合物通过二氧化硅垫过滤,并将该垫用己烷/乙酸乙酯/三乙胺的混合物(100ml,4:1:0.1)洗涤。将滤液浓缩并将残余物再次通过硅胶快速干柱色谱(梯度为0至4%甲醇于氯仿中)纯化,得到呈浅黄色油状物的期望产物(240mg,0.26mmol,20%)。可以将上述各种实施方案组合以提供另外的实施方案。本说明书中引用和/或申请数据表中列出的所有美国专利、美国专利申请公开、美国专利申请、外国专利、外国专利申请和非专利公开,包括2017年4月28日提交的美国临时专利申请第62/491,664号、2017年4月28日提交的美国临时专利申请第62/491,659号、2017年8月16日提交的美国临时专利申请第62/546,227号和2017年12月6日提交的美国临时专利申请第62/595,497号,通过引用整体并入本文。如果必需采用各种专利、申请和公开的概念,则可以修改实施方案的各方面以提供另外的实施方案。可以根据以上详细描述对实施方案进行这些和其他改变。通常,在所附权利要求书中,所使用的术语不应解释为将权利要求限制为本说明书和权利要求书中公开的特定实施方案,而应解释为包括所有可能的实施方案以及此类权利要求所赋予的等同物的全部范围。因此,权利要求不受本公开内容的限制。
背景技术:
技术实现思路
- 还没有人留言评论。精彩留言会获得点赞!