一种肿瘤原位催化产硫化氢的纳米药物及其制备和应用
本发明涉及一种肿瘤原位催化产硫化氢的纳米药物及其制备和应用,属于医药。
背景技术:
1、近年来,肿瘤免疫治疗成为基础与临床研究领域的热点。但是,由于对免疫检查点阻断剂不敏感、肿瘤部位的免疫原性差以及强的免疫抑制环境的存在,利用激活机体自身免疫系统进行癌症治疗常常无法获得持久的应答率。一方面,肿瘤浸润的抗肿瘤淋巴细胞可能受到多种免疫抑制机制的限制,例如调节性t细胞(tregs)的抑制作用和抑制性检查点受体的诱导表达。另一方面,具有高突变率的癌细胞可以产生使树突状细胞(dcs)无法识别或者识别较差的新抗原,从而逃避免疫反应。此外,肿瘤内部的酸性和低氧微环境的特征使得淋巴细胞浸润减少和免疫逃逸增强,也影响肿瘤免疫治疗效果。因此,为了实现有效的癌症免疫治疗,需要促进抗原的产生来提高肿瘤的免疫原性,同时克服肿瘤的免疫抑制增强免疫应答率。
2、诱导癌细胞的免疫原性细胞死亡(icd)是实现上述目标的一种有前途的方法,因为它可以同时从垂死的细胞中引发佐剂和抗原性,并有效促进先天性免疫和适应性免疫,从而增敏肿瘤免疫治疗效果。在肿瘤细胞发生icd的过程中,垂死的肿瘤细胞将释放与肿瘤相关抗原(taas)以及与损伤相关的分子模式(damps)。但是,icd在提升肿瘤免疫原性的同时也充当一把“双刃剑”来激活肿瘤的免疫抑制环境,从而削弱icd诱导的抗肿瘤免疫效果。icd对免疫抑制微环境的影响是因为效应t细胞分泌的干扰素γ(ifn-γ,一种有效的抗肿瘤细胞因子,可阻止癌细胞生长)能够诱导吲哚胺2,3-二加氧酶(ido1)启动子的转录激活,使ido1在肿瘤细胞和dcs中的表达上调。作为负调节反应,ido1的免疫代谢途径与icd的免疫原性作用相反。肿瘤细胞和dcs中的高水平ido1可消耗催化色氨酸(trp)转化为过量的犬尿氨酸(kyn),使dcs趋向免疫抑制表型并促进tregs分化,导致肿瘤的免疫抑制环境增强。
3、h2s是第三种气体信号分子,在肿瘤的发展过程中起重要作用。相关研究表明,高浓度的外源h2s能够抑制细胞色素c氧化酶(cytochrome c oxidase,cox)的功能,从而抑制氧化磷酸化(oxidative phosphorylation,oxphos),产生过量活性氧(reactive oxygenspecies,ros)破坏了肿瘤细胞的氧化还原稳态,从而造成细胞的“化学窒息”。同时,过量的ros可能诱导肿瘤的细胞氧化损伤和icd,可以激活肿瘤危险信号通路实现damps的释放,为免疫系统提供潜在的抗原刺激从而提高特异性抗肿瘤免疫反应。此外,文献中也证明h2s通过阻断nf-κb和stat3途径下调ido1表达,并通过h2s/no串扰抑制ido1活性,降低了色氨酸代谢和犬尿氨酸的生成,诱导t效应细胞和抑制mdscs,对肿瘤发展实现有效抑制。因此,向肿瘤部位输送h2s有望成功诱导肿瘤icd,同时下调ido1表达并抑制ido1活性,是增强肿瘤免疫治疗的潜在性突破口。
4、目前,递送h2s的方法主要包括直接吸入、无机硫化盐、小分子h2s供体。其中,直接吸入是外源h2s施用的最直接方法,但由于气体的恶臭性质和缺乏靶向性,直接吸入h2s进行递送很难达到临床环境。无机硫化盐是目前在生物学和临床前研究中最广泛采用的递送策略,但是h2s从硫化盐中的释放不受控制,很难在靶标位置释放,无法达到有效的药物浓度,从而需要大剂量给药,导致h2s血液和组织浓度飙升至超生理水平,给机体带来危害。小分子h2s供体近来受到了广泛关注,但是仍然有稳定性差,溶解度不高,靶向性弱,半衰期短的特点。
5、近年来,共价有机框架(covalent organic frameworks,cof)作为一类新兴的结晶多孔聚合物受到了广泛的研究关注,尤其是纳米级cof(ncof)迅速在肿瘤治疗中崭露头角。目前,有文献采用ncof作为药物载体负载一些药物进行靶向传递,但是由于载体和药物之间是物理作用,使得其稳定性较差。
6、因此,如何采用共价有机框架作为载体递送h2s,来达到更好的肿瘤治疗效果,是目前亟需解决的问题。
技术实现思路
1、[技术问题]
2、目前,递送h2s的方法存在稳定性差,溶解度不高,靶向性弱,半衰期短。
3、[技术方案]
4、为了解决上述问题,本发明以纳米共价有机框架tfppa为主体结构,之后键合硫化氢供体小分子s-苯甲酰硫羟胺制备得到了纳米药物,实现肿瘤原位催化产h2s。本发明的纳米药物能通过递送h2s至肿瘤部位,诱导肿瘤icd,同时下调ido1表达并抑制ido1活性,从而触发特异性抗肿瘤免疫应答杀伤肿瘤,并且逆转肿瘤的免疫抑制环境增敏肿瘤免疫治疗效果,最终达到抑制肿瘤转移和复发的效果。
5、本发明的第一个目的是提供一种制备肿瘤原位催化产硫化氢的纳米药物的方法,包括如下步骤:
6、将共价有机框架tfppa和s-苯甲酰硫羟胺sta分散在二氯甲烷中进行反应,反应结束后,离心、洗涤、干燥,得到肿瘤原位催化产硫化氢的纳米药物。
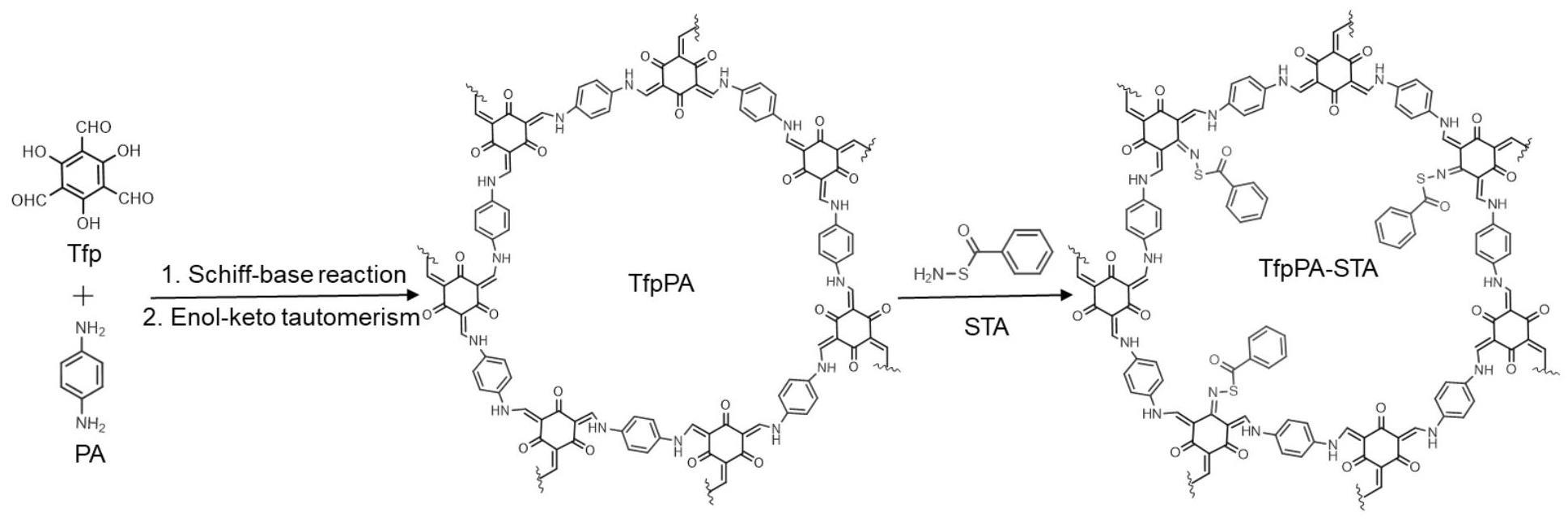
7、在本发明的一种实施方式中,所述的共价有机框架tfppa是2,4,6-三羟基苯-1,3,5-三甲醛和1,4-苯二胺为原料。
8、在本发明的一种实施方式中,所述的共价有机框架tfppa的制备方法如下:
9、将2,4,6-三羟基苯-1,3,5-三甲醛(tfp)和1,4-苯二胺(pa)加入丁醇和1,2-二氯苯的混合溶剂中,得到混合物;将混合物超声处理20分钟,然后添加乙酸水溶液,通过冷冻-泵-解冻循环脱气,真空密封加热进行反应;反应结束后,将反应后的混合物冷却、洗涤、干燥,得到共价有机框架tfppa;
10、其中,2,4,6-三羟基苯-1,3,5-三甲醛和1,4-苯二胺的摩尔比为2:3;
11、丁醇和1,2-二氯苯的混合溶剂中丁醇和1,2-二氯苯的体积比为1:1;
12、2,4,6-三羟基苯-1,3,5-三甲醛、混合溶剂、乙酸水溶液的用量比为0.3mmol:3ml:0.5ml;
13、乙酸水溶液的浓度为3mol/l;
14、冷冻-泵-解冻循环脱气的次数为3次;
15、真空密封加热是在真空下密封,在120℃加热3天;
16、冷却是冷却至室温;
17、洗涤是用无水四氢呋喃、无水丙酮和无水二氯甲烷洗涤分别洗涤;
18、干燥是在真空下于120℃干燥12小时;
19、共价有机框架tfppa是深红色粉末。
20、在本发明的一种实施方式中,所述的共价有机框架tfppa和s-苯甲酰硫羟胺sta的质量比为100:20-30。
21、在本发明的一种实施方式中,所述的共价有机框架tfppa和二氯甲烷的用量比为100mg:5ml。
22、在本发明的一种实施方式中,所述的反应是在120℃下反应12h。
23、在本发明的一种实施方式中,所述的反应是s-苯甲酰硫羟胺sta的氨基与共价有机框架的羰基(或醛基)相连接。
24、在本发明的一种实施方式中,所述的离心是8000rpm进行离心,洗涤是采用乙醇洗涤,干燥是60℃干燥。
25、本发明的第二个目的是本发明所述的方法制备得到的肿瘤原位催化产硫化氢的纳米药物。
26、在本发明的一种实施方式中,所述的纳米药物的尺寸大约为120nm
27、在本发明的一种实施方式中,所述的纳米药物是以纳米共价有机框架为主体结构,之后键合硫化氢供体小分子实现肿瘤原位催化产h2s。
28、本发明的第三个目的是本发明所述的纳米药物在制备治疗肿瘤药物中的应用。
29、[有益效果]
30、(1)本发明所述的纳米药物是以纳米共价有机框架为主体结构,可实现在肿瘤原位高效产h2s,诱导肿瘤icd的同时下调ido1表达并抑制ido1活性,实现对原发瘤和远端转移瘤的强效抑制效果。
31、(2)本发明将小分子h2s供体s-苯甲酰硫羟胺与主体结构共价有机框架tfppa键合后,可在肿瘤部位高含量的谷胱甘肽作用下实现h2s释放,从而实现靶向释放的效果。
32、(3)本发明所述的制备纳米药物的方法简单,具有良好的分散性和稳定性,有利于体内递送h2s载体的生物应用。
33、(4)本发明所述的肿瘤原位催化产硫化氢的纳米药物为增强肿瘤免疫治疗的研究和应用提供新思路和指导,并为临床应用提供了研究基础。
- 还没有人留言评论。精彩留言会获得点赞!