Arf1基因或蛋白在调控早期胚胎成腔中的应用
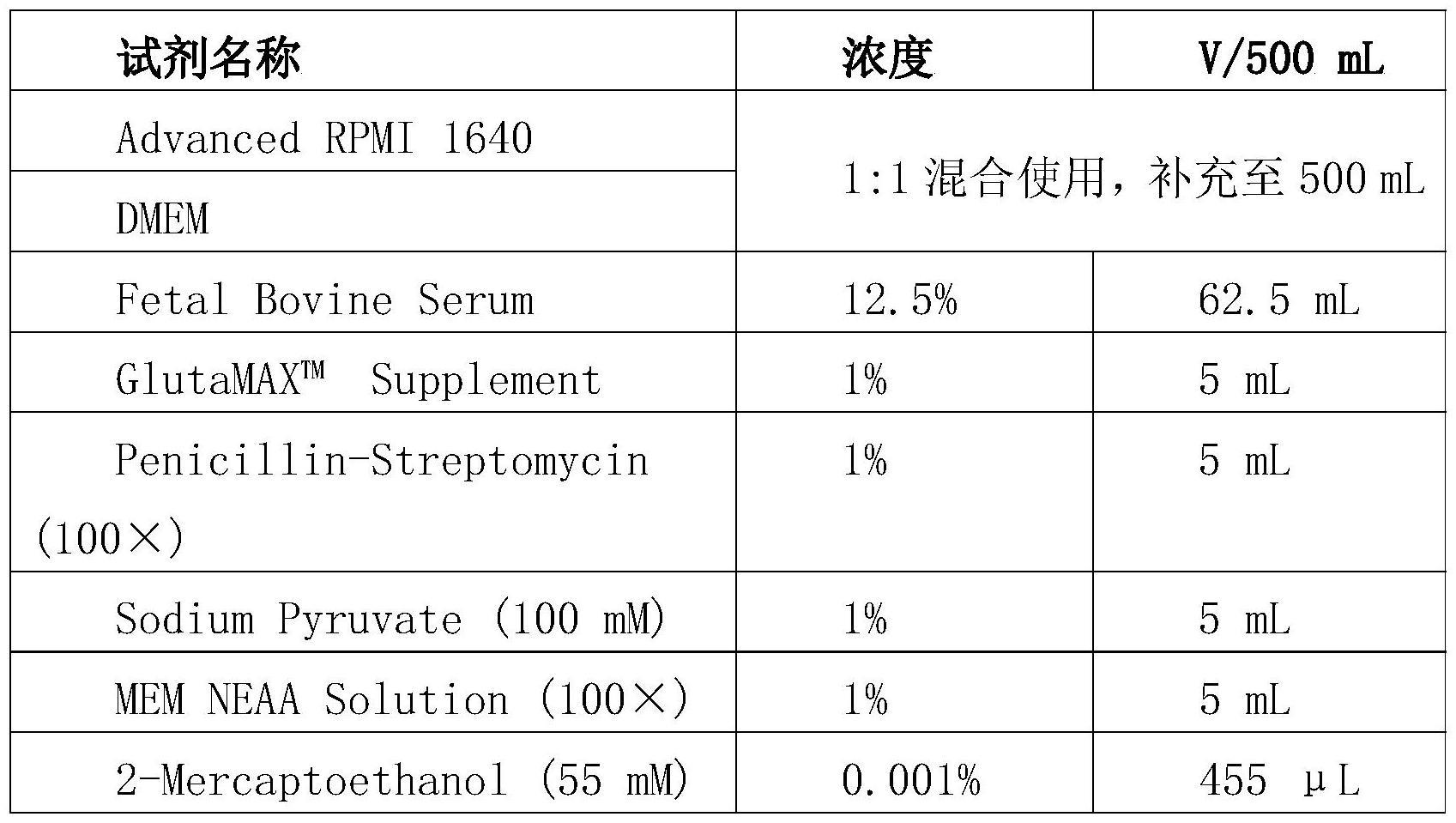
本发明属于生物,涉及一种arf1基因或蛋白在调控早期胚胎成腔中的应用。
背景技术:
1、哺乳动物早期胚胎前羊膜腔的形成对胚胎发育具有重要意义,如促进胚轴建立、各胚层间信号交流及物质传递等。附植后胚胎的前羊膜腔形成对早期胚胎发育至关重要,胚胎前羊膜腔的形成缺陷导致胚胎出现发育异常、结构混乱,最终导致胎儿流产。虽然胚胎植入子宫前的发育过程已被广泛研究,但附植后胚胎的发育事件及背后机制在很大程度上仍然未知。这是由于该过程发生在子宫内部,胚胎被母体组织完全包裹,不易取材且不能直接观察,因此体外胚胎模型的出现使解析附植后胚胎发育“黑匣子”成为可能。
2、早期胚胎前羊膜腔的形成具有两种假说,凋亡成腔和极化成腔。凋亡成腔指通过内部细胞发生凋亡从而形成中空的腔。而极化成腔指细胞接收到细胞外基质的极化信号,通过极化蛋白转运及细胞骨架牵拉等过程共同调控形成腔。小鼠早期胚胎成腔过程一直被认为是由于凋亡成腔,直至2014年magdalena课题组发现敲除凋亡基因p53后胚胎仍能正常发育并发生成腔,证明了前羊膜腔的形成不依赖于凋亡而是通过极化成腔。虽然对前羊膜腔形成有了初步了解,但仍有许多未知尚待解析,且目前所知的大部分成腔机制仍借鉴于mdck极化模型,而mdck模型并不具备模拟体内胚胎发育的能力,因此仍缺乏模拟前羊膜腔形成的类胚胎模型。
3、目前建立的由囊胚来源干细胞自组织重构形成的etx-类胚胎和exe-类胚胎,是模拟附植后胚胎发育的良好模型,在空间结构及发育事件上均与体内胚胎保持一致且可起始细胞极化形成类前羊膜腔,为研究早期胚胎前羊膜腔形成提供了良好基础。其中仅由两种细胞类型构成的exe-类胚胎,结构简单、重复率高,且成腔率为100%,是研究早期胚胎前羊膜腔形成的优势模型。
4、arf1(adp-ribosylation factor 1)为小gtp酶,是arf基因家族成员,主要参与调控膜蛋白的运输和细胞器结构组装(donaldson and jackson,2011)。和其它小gtp酶一样,arf1有两种分子形式并可相互转化:当与gtp结合(arf1-gtp)时,arf1定位在高尔基体膜上,呈活性状态并发挥功能;当与gtp解离和gdp结合(arf1-gdp)时,arf1呈非活性状态并从高尔基体膜上释放到细胞质中(cherfils,2014;muccini et al.,2022)。这种gdp和gtp间的解离及结合循环由高尔基体相关的鸟嘌呤核苷酸交换因子(guanine nucleotideexchange factors,gefs)和gtp酶激活蛋白(gtpase activating proteins,gaps)调控,gefs促进了arf1与gtp结合,而gaps催化了arf1与gtp的解离以及与gdp的结合(christisand munro,2012;gillingham and munro,2007;manolea et al.,2008)。因此,arf1的活性调控主要受特定的gefs和gaps调控。
技术实现思路
1、本发明的目的是提供arf1基因或蛋白在调控早期胚胎成腔中的应用。
2、第一方面,本发明提供了arf1蛋白或基因或其他生物材料在制备具有如下任一功能产品中的应用:
3、1)调控胚胎或类胚胎成腔;
4、2)调控胚胎或类胚胎发育中细胞发生极化;
5、3)作为标志物筛查或辅助筛查成腔异常胚胎或类胚胎。
6、上文中所述调控胚胎或类胚胎成腔为促进胚胎或类胚胎成腔;
7、上述促进胚胎成腔为促进胚胎前羊膜腔形成或促进类胚胎类前羊膜腔形成。
8、上文中胚胎成腔进一步为胚胎极化成腔;
9、上文中所述极化为从头极化。
10、上文中作为标志物筛查或辅助筛查成腔异常胚胎,应用于试管婴儿优势胚胎筛选,如试管婴儿胚胎移植前的基因筛查,arf1缺陷的胚胎不作为优势胚胎移植。
11、上文所述应用中,所述成腔异常胚胎为前羊膜腔发育异常胚胎。
12、上文所述应用中,所述胚胎或类胚胎为人源或动物源。
13、上文所述动物进一步为哺乳动物,在本发明的实施例中具体为小鼠。
14、所述arf1蛋白为活化形式arf1,具体为arf1-gtp。
15、第二方面,本发明提供了抑制arf1基因表达或降低arf1蛋白活性的物质在如下任一种的应用:
16、1)制备arf1基因表达或降低arf1蛋白活性的esc细胞系;
17、2)制备抑制胚胎或类胚胎成腔产品;
18、3)制备抑制胚胎或类胚胎发育中细胞发生极化产品;
19、4)制备模拟体内胚胎成腔缺陷的类胚胎模型。
20、第三方面,本发明提供了arf1蛋白或基因作为靶点在制备模拟体内成腔缺陷的类胚胎模型中的应用。
21、第四方面,本发明提供了一种模拟体内成腔缺陷的类胚胎模型的构建方法,包括如下步骤:
22、1)敲除或抑制胚胎干细胞中arf1基因的表达,得到敲除arf1基因的胚胎干细胞;
23、2)将所述敲除arf1基因的胚胎干细胞和胚外内胚层干细胞悬浮培养,重构得到exe-类胚胎,所述exe-类胚胎为成腔缺陷exe-类胚胎;
24、或将所述敲除arf1基因的esc细胞、滋养层干细胞和胚外内胚层干细胞悬浮培养,重构得到etx-类胚胎,所述etx-类胚胎为成腔缺陷etx-类胚胎。
25、上文中,所述成腔缺陷为胚胎前羊膜腔或类胚胎类前羊膜腔发育异常。
26、第五方面,本发明提供了exe-类胚胎或etx-类胚胎在筛选极化成腔基因中的应用;
27、或本发明提供了exe-类胚胎或etx-类胚胎在制备筛选极化成腔基因产品中的应用。
28、第六方面,本发明提供了一种利用类胚胎筛选极化成腔基因的方法,包括如下步骤:
29、1)对exe-类胚胎或etx-类胚胎构建中不同悬浮培养时间收集的类胚胎进行形态学检测,确定起始出现极化成腔表型对应的候选悬浮培养时间点;再对所述起始出现极化成腔表型对应的候选悬浮培养时间点收集的类胚胎进行单细胞测序,若该候选时间点的类胚胎中可富集到已知极化基因,则该候选时间点为极化成腔对应的悬浮培养时间点;上文中,所述已知极化基因包括stx3和、cdc42、exoc5、cldn6、cldn7、rab8a和rab11a等;
30、所述不同悬浮培养时间间隔12小时;
31、2)将所述exe-类胚胎或etx-类胚胎构建中极化成腔对应的悬浮培养时间点和其前期间隔12小时的时间点的收集的类胚胎的单细胞测序结果(各个基因的表达量)进行分析,选取与所述前期间隔12小时的时间点的测序结果相比,在所述极化成腔对应的悬浮培养时间点的测序结果中显著高表达的基因作为候选基因;
32、上文中,显著高表达为deseq2软件计算,p值小于0.05。
33、再从所述候选基因中选取在eb拟胚体中显著低表达或不表达的基因作为极化候选基因;
34、上文中,显著低表达为deseq2软件计算,p值为小于0.05。
35、所述eb拟胚体为仅具备分化的能力且不能极化成腔;
36、3)从所述极化候选基因中确定未报道与极化成腔相关且与胚胎疾病相关的基因,命名为成腔候选基因,将所述成腔候选基因进行如下验证:
37、所述验证包括如下步骤:
38、3)-1)、敲除或抑制esc细胞中成腔候选基因的表达,得到敲除成腔候选基因的esc细胞;
39、3)-2)、将所述敲除成腔候选基因的esc细胞和xenc细胞悬浮培养,重构得到exe-类胚胎,检测所述exe-类胚胎是否为成腔缺陷,若发生成腔缺陷,则所述成腔候选基因为或候选为成腔相关基因;若未发生成腔缺陷,则所述成腔候选基因不为或候选不为成腔相关基因;
40、或将所述敲除成腔候选基因的esc细胞、tsc细胞和xenc细胞悬浮培养,重构得到etx-类胚胎,所述etx-类胚胎为成腔缺陷etx-类胚胎,若发生成腔缺陷,则所述成腔候选基因为或候选为成腔相关基因;若未发生成腔缺陷,则所述成腔候选基因不为或候选不为成腔相关基因。
41、上文中,所述检测为免疫荧光染色检测胚层标志蛋白oct4或gata4和/或极化蛋白pcx。
42、在本发明的实施例中,利用类胚胎筛选极化成腔基因为arf1基因。
43、第七个方面,本发明提供了一种筛查或辅助筛查成腔异常胚胎或成腔异常类胚胎的方法,通过检测待测样品中arf1基因或蛋白的表达筛查或辅助筛查成腔异常胚胎或成腔异常类胚胎。
44、上述方法可以包括如下步骤:检测待测样品中arf1基因或蛋白的表达,若arf1基因或蛋白的表达量与健康样本差异或显著差异,则该待测样品来源于成腔异常胚胎或成腔异常类胚胎。
45、上述待测样品为非胚胎组织,具体可以为羊水。
46、上述健康样本可以为健康人或鼠的羊水。
47、本发明采用的胚胎干细胞为非人胚胎干细胞,例如鼠胚胎干细胞,例如野生型escs(g4 cell line)、dsred-escs(g4-dsred-mst escs)或bvsc escs(blimp1-mvenus andstella-ecfp[bvsc]double-transgenic esc line)。滋养层干细胞为非人滋养层干细胞,例如鼠滋养层干细胞,例如野生型tscs(从cd1雌鼠体内的囊胚中分离获得的tscs)或egfp-tscs。胚外内胚层干细胞为非人胚外内胚层干细胞,例如鼠胚外内胚层干细胞,例如野生型xencs(129雌鼠体内的囊胚中分离获得的xencs)、egfp-xencs(从actin-egfp雌鼠体内的囊胚中分离获得的xencs)或lefty1-mcherry xencs。类胚胎具体可来源于鼠的类胚胎或来源于人的类胚胎。
48、现有构建的etx-和exe-类胚胎是模拟植入后早期胚胎前羊膜腔形成的良好模型,本研究通过对etx-和exe-类胚胎进行连续时间点的单细胞测序,测序样品涵盖了类胚胎从聚合形成至成腔整个发育过程,为研究类胚胎及早期胚胎发育提供了丰富的数据资源。通过对数据进行分析和挖掘,揭示了类胚胎极化成腔时的基因表达模式,发现类胚胎成腔受细胞多能性退出和极化蛋白共同调控。利用exe-类胚胎对成腔候选基因进行表型筛选,发现arf1是调控胚胎极化成腔的关键基因,arf1的敲除导致体内胚胎及类胚胎均发生成腔缺陷。对arf1敲除类胚胎回补arf1结果显示,仅过表达arf1wt和活化形式的arf1-gtp可回补成腔缺陷表型,说明类胚胎的极化成腔依赖于活化形式的arf1。对其机制进行解析证明了arf1受formative多能性转录因子otx2和zic2调控。本研究发现了arf1在极化成腔过程中的新功能,解析了早期胚胎前羊膜腔的形成的原因,为哺乳动物早期胚胎发育研究提供了理论借鉴。arf1功能及作用机制的发现为研究植入后胚胎前羊膜腔形成过程提供了新思路,也为人早期胚胎发育研究提供了理论借鉴。etx-和exe-类胚胎单细胞转录组数据也为研究细胞间识别及自组织、细胞多能性调控及分化、极化成腔等发育过程提供了丰富资源,可用于挖掘潜在的调控因子及信号通路,也为挖掘前羊膜腔形成等发育事件中的关键调控因子提供了良好的筛选平台。
49、具体结论如下:
50、(1)本研究对0-72 h etx-和exe-类胚胎进行单细胞转录组测序,通过与早期胚胎数据比对,证明了类胚胎可模拟e3.5-6.0时期早期胚胎的发育过程。
51、(2)etx-和exe-类胚胎成腔依赖于细胞多能性从退出至formative阶段及细胞极化的共同调控。
52、(3)arf1是调控etx-和exe-类胚胎以及植入后早期胚胎极化成腔的关键基因,arf1的敲除导致类胚胎和植入后胚胎均不能成腔。arf1有两种分子形式,即活化形式的arf1-gtp和非活化形式的arf1-gdp,而类胚胎的极化成腔依赖于活化形式的arf1-gtp。
53、(4)arf1的表达受formative多能性转录因子otx2和zic2共同调控,otx2和zic2的敲除导致arf1表达显著下调并导致类胚胎极化成腔发生时间显著推迟。
54、本研究揭示了早期胚胎前羊膜腔形成的原因,为了解早期胚胎前羊膜腔形成过程提供了新思路,为试管婴儿优势胚胎选取、胎儿流产及生殖发育等临床应用提供了理论依据,为利用类胚胎研究早期胚胎发育提供了理论基础,也为构建具有更复杂组织结构的类胚胎模型提供了借鉴及技术支持。
- 还没有人留言评论。精彩留言会获得点赞!