一种表达FASLG的通用型细胞及其制备方法与流程
本发明属于基因工程与干细胞技术交叉领域,具体涉及一种表达faslg的通用型细胞及其制备方法。
背景技术:
1、通过细胞的体外培养或干细胞的诱导分化,能够在体外大量的再生健康的功能细胞,能够通过异体功能细胞移植治疗疾病,但是,免疫不相容和移植细胞遭受的免疫排斥仍然是其临床应用的关键障碍。干细胞是一类具备自我更新能力及向特定功能体细胞分化能力的“种子”细胞,依据干细胞特性的程度差异,主要将干细胞分为:全能干细胞(totipotent stem cells)、多能干细胞(pluripotent stem cells,pscs)和成体干细胞(adult stem cell)。人类胚胎干细胞(hesc)和诱导多能干细胞(ipsc)具有无限增殖、自我更新和分化到各种类型细胞的潜力,在治疗癌症、神经相关、心血管等疾病具有重要应用前景。
2、移植自体细胞治疗可以回避免疫排斥问题,但是从病人身上制造自体细胞成本高昂且制备流程周期长(khera et al.,2013),并且个体来源的细胞产品的质量和有效性不确定。有数据表明病人体内的细胞与正常人的存在差异,治疗效果可能受影响。
3、可通过免疫抑制药物、hla匹配和基因编辑来降低免疫原性,或降低宿主免疫系统对异体移植细胞的排斥反应。免疫抑制药物副作用大,会导致骨髓抑制、肝毒性、脱发和胃肠道不良反应。现在美国、日本、中国都在建立hla匹配的ipsc库,但建库和维护都需要高额的成本,因为hla抗原的基因是在人类基因组中观察到的最具多态性的基因。目前各地的ipsc库无法为各自国家的大多数人提供匹配,覆盖的只能是特定人群(solomon et al.,2015;turner et al.,2013)。针对大患者群体的异体细胞治疗可能在经济上和建设及运行成本上相对配型库具有非常明显的优势,但异体细胞治疗会受到强烈的免疫排斥。于是,构建同种异体免疫兼容的通用型pscs迫在眉睫。
4、人类的主要组织相容性复合体(mhc),即人白细胞抗原(hla),是导致免疫不相容的主要原因。hla复合体由一系列基因组成,可分为i类、ii类和iii类。mhc-i基因在几乎所有的组织细胞类型中表达,表达“非己”mhc-i类分子的移植细胞将刺激cd8+t细胞的活化而被消除。cd4+辅助t细胞识别“非己”细胞的mhc-ii基因,从而进行免疫排斥,而iii类分子不参与免疫活动。使用基因编辑的方法改变免疫原性元件,以产生低免疫原性细胞,使得具备免疫豁免性的“off-the-shelf”细胞治疗产品的大规模制造成为可能。
5、近年已有先驱报道通过敲除b2m、ciita等基因,实现mhc-i和mhc-ii细胞表面或本身基因的缺失表达,进而使细胞具备免疫耐受或逃逸t/b细胞特异性免疫应答,产生免疫兼容的通用型pscs,为更广泛的通用型pscs源细胞、组织、器官应用奠定了重要的基础。然而,hla分子是自然杀伤细胞(nk细胞)的主要抑制性配体,mhc-i类阴性细胞易受天然杀伤(nk)细胞裂解。体内外数据均显示宿主nk细胞可消除植入的b2m-/-供体细胞(flahou et al.,2021)。因此,需要改善先前的方法以产生可以避免免疫反应的通用供体细胞。
6、人体免疫系统能识别并攻击非自身抗原,从而抵抗感染。因此在异体器官移植过程中,免疫系统会攻击移植的器官,导致免疫排斥和移植失败。虽然胚胎和胎盘是半同种异体移植物,类似于移植的器官,但它们可以诱导母体耐受,并且不会产生强烈的免疫反应。胎盘高表达的hla-g通过与蜕膜自然杀伤细胞相互作用调节母胎耐受,同时在胎盘中也检测到cd47高表达(liu et al.,2021;than et al.,2019)。另一方面,肿瘤细胞可逃逸免疫监视已经众所周知,其通过减少hla的表达,减少抗原呈递,从而阻止它们被免疫细胞识别;并增加表达免疫抑制成分如hla-g、pd-l1和ctla-4等(de charette and houot,2018)。
7、已有一些研究探索母胎免疫耐受,肿瘤免疫逃逸与器官移植之间的关系。已报道模拟母胎耐受和肿瘤逃逸机制在破坏mhc-i和mhc-ii类基因表达的基础上使细胞表达hlag等非经典hla-i类分子,或表达pd-l1、ctla4-ig、cd47、cd24等免疫抑制检查点蛋白,对nk细胞表现出一定的免疫耐受保护(zhao,w.et al.,2020;ye,q.etal.,2020)。
8、然而,这些方案存在仅基于领域已知常识明星分子的直接应用,而免疫逃逸和耐受大多依赖于免疫抑制受体-配体结合,而且在肿瘤状态或母胎界面具有特定的微环境。低免因子的跨领域直接应用于异体移植存在不确定性,配对受体或配体是否存在于移植细胞和免疫细胞上,移植环境是否满足逃逸条件?怀孕的母胎中是什么状态,可能和器官移植时的状态不同。因此,现有技术存在免疫兼容性不彻底、不明确或缺乏持久性、有效剂量窗口窄等技术问题。且到目前为止,母胎免疫耐受和肿瘤逃逸的潜在分子机制仍在不断摸索,持续发现的新基因可以进一步开发低免疫原性细胞。由此表明需要筛选出更多新的分子来实现更优化的改造干细胞,以获得更优的免疫豁免性方案。
9、参考文献:
10、de charette,m.,and houot,r.(2018).hide or defend,the two strategiesof lymphoma immune evasion:potential implications forimmunotherapy.haematologica 103,1256-1268.liu,y.,gao,s.,zhao,y.,wang,h.,pan,q.,and shao,q.(2021).decidual natural killer cells:a good nanny at thematernal-fetal interface during early pregnancy.front immunol12,663660.
11、than,n.g.,hahn,s.,rossi,s.w.,and szekeres-bartho,j.(2019).editorial:fetal-maternal immune interactions in pregnancy.front immunol 10,2729.
12、zhao,w.,lei,a.,tian,l.,wang,x.,correia,c.,weiskittel,t.,li,h.,trounson,a.,fu,q.,yao,k.,et al.(2020).strategies for genetically engineeringhypoimmunogenic universal pluripotent stem cells.iscience 23,101162.
技术实现思路
1、针对现有技术所存在的不足,本发明提供了改造细胞获得低免疫原性的新方法,首次采取将涉及到母胎耐受和肿瘤逃逸的各机制分子进行大批量筛选的策略,通过多轮功能检测,最终鉴定出了代表性的新基因faslg。该基因能够显著减少或逃逸免疫系统的识别和攻击,尤其是自然杀伤细胞、巨噬细胞等的攻击,本发明提出了通过不可预料的领域转化开发新基因实现细胞的免疫豁免性的可行策略。
2、本发明通过敲除人多能干细胞内质网中β-2-微球蛋白(b2m)和敲除mhc-ii基因转录的正调节因子ciita,成功构建b2m/ciita双等位基因敲除阳性克隆dko细胞;然后使用慢病毒载体在dko细胞中过表达本发明鉴定出的新基因,由此获得的人多能干细胞可在逃逸t细胞攻击的基础上,进一步逃逸nk细胞的杀伤,从而能够获得相对dko+cd47(下文简称“cd47现有技术”)的出人意料的优异的免疫逃逸效果。同时这些低免疫原性的多能干细胞保留了其干性和分化能力等多能干细胞的关键生物学功能。
3、为了实现上述目的,本发明采用如下技术方案:
4、第一方面,本发明提供一种通用型细胞,其相对于野生型细胞,包含:
5、1)mhc-i和/或mhc-ii人类白细胞抗原的表达降低或不表达;
6、2)faslg的表达序列;
7、所述细胞能逃逸t细胞攻击及nk细胞的杀伤。
8、在某些方面,所述细胞包括mhc-i和mhc-ii人类白细胞抗原的表达降低或不表达。
9、在某些方面,所述细胞还包括修饰以增加一种或多种多肽的表达,增加的多肽选自:dux4,cd27,cd35,cd200,hla-c,pd-l1,cd47,cd24,cd26,ccl21,mfge8和serpinb9。
10、在某些方面,所述细胞中使用基因编辑工具(诸如talen和/或crispr系统)靶向编码mhc-i的一种或多种转录调节因子的一个或多个基因,以及编码mhc-ii的一种或多种转录调节因子的一个或多个基因,来实现mhc-i和mhc-ii基因的表达降低或不表达。
11、在某些实施方式中,为实现mhc-i和mhc-ii基因的表达降低或不表达,所述mhc-i的转录调节因子可优选自:b2m、tap1、tap2、tap相关糖蛋白(tapasin)或nlrc5中的一个或多个;所述mhc-ii的转录调节因子可优选自:ciita、rfxank、rfx5、rfxap中的一个或多个;
12、所述转录调节因子优选b2m和ciita。
13、在某些实施方式中,所述细胞还包括通过选择性灭活ciita基因的稀有切割核酸内切酶靶向ciita基因的遗传修饰。
14、在某些实施方式中,所述细胞还包括通过选择性灭活b2m基因的稀有切割核酸内切酶靶向b2m基因的遗传修饰。
15、在某些实施方式中,所述稀有切割核酸内切酶选自cas蛋白,tale-核酸酶,锌指核酸酶,大核酸酶和归巢核酸酶。
16、在某些实施方式中,其中通过稀有切割内切核酸酶靶向ciita基因或b2m基因的遗传修饰包括cas蛋白或编码cas蛋白的多核苷酸,和至少一个用于特异性靶向ciita基因或b2m基因的导向核糖核酸序列。
17、在具体的实施方式中,使用crispr/cas9系统分别对b2m和ciita外显子区段进行两端直接敲除,其中,针对b2m基因的grna的靶序列为seq id no:2和seq id no:3,针对ciita基因的grna的靶序列为seq id no:4和seq id no:5。
18、在某些方面,所述细胞中通过引入针对编码mhc-i的一种或多种转录调节因子的一个或多个基因,或编码mhc-ii的一种或多种转录调节因子的一个或多个基因的基因表达修饰分子,来实现mhc-i和/或mhc-ii基因的表达降低或不表达,其中所述基因表达修饰分子包括选自sirna,shrna,microrna,反义rna和另一种rna介导的抑制分子中的一种。
19、在某些方面,所述faslg的氨基酸序列与如seq id no:1所示的序列具有70%以上的同源性,例如80%以上的同源性,再例如90%以上、95%以上、98%以上的同源性;
20、进一步优选地,所述faslg的氨基酸序列如seq id no:1所示。
21、在某些方面,所述细胞是胚胎干细胞。
22、在某些方面,所述细胞是多能干细胞。
23、在某些方面,所述细胞是诱导型多能干细胞。
24、在某些实施方案中,所述细胞是低免疫原性干细胞。
25、在某些实施方案中,所述细胞是人类干细胞或人类体细胞。
26、在某些具体实施方案中,所述细胞是人诱导多能干细胞或人多能干细胞。
27、第二方面,本发明提供一种第一方面通用型细胞的制备方法,包含如下步骤:
28、1)敲除细胞的mhc-i的一种或多种转录调节因子的一个或多个基因;和/或,
29、2)敲除细胞的mhc-ii的一种或多种转录调节因子的一个或多个基因;
30、3)在细胞中引入编码faslg蛋白的核酸序列。
31、在某些方面,所述mhc-i的转录调节因子可优选自:b2m、tap1、tap2、tap相关糖蛋白(tapasin)或nlrc5中的一个或多个;所述mhc-ii的转录调节因子可优选自:ciita、rfxank、rfx5、rfxap中的一个或多个。
32、在某些实施例方式中,所述转录调节因子选自b2m和ciita。
33、在某些方面,步骤1)和2)所述的敲除为通过选择性灭活ciita基因或b2m基因的稀有切割核酸内切酶靶向ciita基因或b2m基因的遗传修饰。
34、优选地,所述稀有切割核酸内切酶选自cas蛋白,tale-核酸酶,锌指核酸酶,大核酸酶和归巢核酸酶。
35、进一步优选地,其中通过稀有切割内切核酸酶靶向ciita基因或b2m基因的遗传修饰包括cas蛋白或编码cas蛋白的多核苷酸,和至少一个用于特异性靶向ciita基因或b2m基因的导向核糖核酸序列。
36、在某些实施例方式中,步骤1)和2)使用crispr系统分别对b2m和ciita外显子区段进行两端直接敲除,其中,针对b2m基因的grna的靶序列为seq id no:2、3,针对ciita基因的grna的靶序列为seq id no:4、5。
37、在某些方面,步骤1)或2)所述的敲除为通过引入针对编码mhc-i的一种或多种转录调节因子的一个或多个基因,或编码mhc-ii的一种或多种转录调节因子的一个或多个基因的基因表达修饰分子,来实现mhc-i和/或mhc-ii基因的表达降低或不表达,其中所述基因表达修饰分子包括选自sirna,shrna,microrna,反义rna和另一种rna介导的抑制分子中的一种。
38、在某些方面,步骤3)采用表达载体将编码faslg蛋白的核酸序列引入细胞中。
39、优选地,所述步骤3)采用的表达载体为病毒载体。
40、在某些实施例方式中,步骤3)采用的病毒载体为慢病毒。
41、在某些方面,步骤3)将编码faslg蛋白的核酸序列导入所述细胞的选定位点;优选地,所述细胞的选定位点是安全港基因位点。
42、在某些方面,所述faslg的氨基酸序列与如seq id no:1所示的序列具有70%以上的同源性,例如80%以上的同源性,再例如90%以上、95%以上、98%以上的同源性;
43、进一步优选地,所述faslg的氨基酸序列如seq id no:1所示。
44、在某些方面,所述通用型细胞还包括第二表达载体,其包含编码选自dux4,cd27,cd35,cd200,hla-c,pd-l1,cd47,cd24,cd26,ccl21,mfge8和serpinb9中的一种的多核苷酸序列。
45、在某些实施方案中,所述第二表达载体是诱导型表达载体;优选地,所述第二表达载体是病毒载体。
46、第三方面,本发明提供一种制备分化的通用型细胞的方法,包括在分化条件下培养根据第二方面的方法制备的通用型细胞,从而制备分化的低免疫原性细胞。
47、在某些方面,其中所述分化条件适于将细胞分化为选自心肌细胞,神经细胞,胶质细胞,内皮细胞,t细胞,nk细胞,nkt细胞,巨噬细胞,造血祖细胞,间充质细胞,胰岛细胞,软骨细胞,视网膜色素上皮细胞,肾细胞,肝细胞,甲状腺细胞,皮肤细胞,血细胞和上皮细胞的细胞类型。
48、第四方面,本发明提供一种治疗需要细胞治疗的患者的方法,包括给予根据第三方面的方法制备的分化的低免疫原性细胞群。
49、第五方面,本发明提供一种组合物,所述组合物包含第一方面所述的通用型细胞。
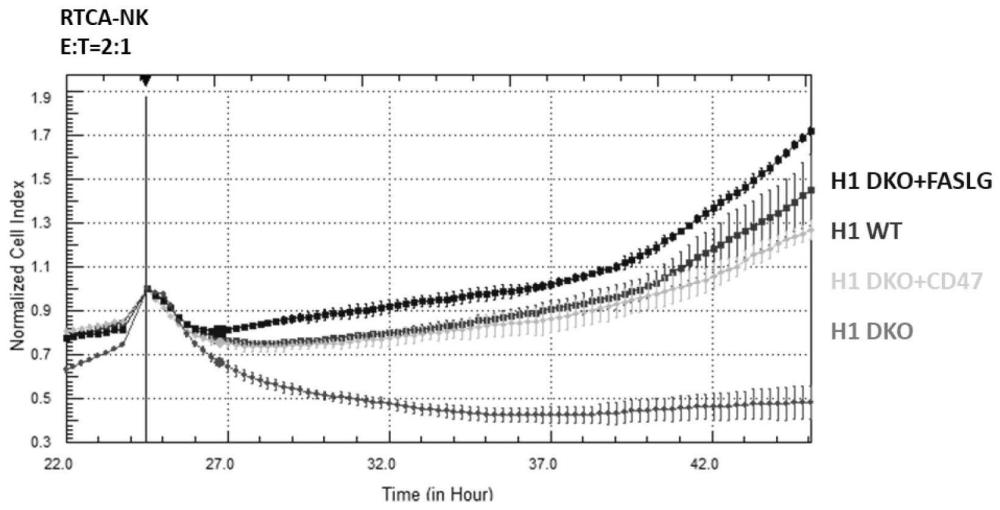
50、在某些方面,所述组合物包含第一方面所述的通用型细胞和一种或多种治疗剂,所述治疗剂包含肽、细胞因子、小分子化合物、大分子、adc、抗体、纳米粒子、生物类似物、mrna、中药、蛋白、疫苗、检查点抑制剂、丝裂原、生长因子、小rna、双链rna(doublestranded rna;dsrna)、单核血细胞、饲养细胞、饲养细胞组分或其置换因子、包含一种或多种所关注多核酸的载体、抗体等。
51、第六方面,本发明提供一种表达faslg蛋白,并具有表达降低或不表达的mhc i类和/或mhc ii类人白细胞抗原的细胞。
52、第七方面,本发明提供一种不表达ciita,表达faslg蛋白,并且具有表达降低或不表达的mhc i类和/或mhc ii类人白细胞抗原的细胞。
53、第八方面,本发明提供一种不表达b2m,表达faslg蛋白,并具有表达降低或不表达的mhc i类和/或mhc ii类人白细胞抗原的细胞。
54、第九方面,本发明提供一种不表达ciita和b2m,表达faslg蛋白,并具有表达降低或不表达的mhc i类和/或mhc ii类人白细胞抗原的细胞。
55、第十方面,本发明提供一种表达faslg蛋白和至少一种选自:dux4,cd27,cd35,cd200,hla-c,pd-l1,cd47,cd24,cd26,ccl21,mfge8和serpinb9的多肽,并具有表达降低或不表达的mhc i类和/或mhc ii类人白细胞抗原的的细胞。
56、第十一方面,本发明提供一种不表达ciita,表达faslg蛋白和至少一种选自:dux4,cd27,cd35,cd200,hla-c,pd-l1,cd47,cd24,cd26,ccl21,mfge8和serpinb9,并且具有表达降低或不表达的mhc i类和/或mhc ii类人白细胞抗原的细胞。
57、第十二方面,本发明提供一种不表达b2m,表达faslg蛋白和至少一种选自:dux4,cd27,cd35,cd200,hla-c,pd-l1,cd47,cd24,cd26,ccl21,mfge8和serpinb9的多肽,并且具有表达降低或不表达的mhc i类和/或mhc ii类人白细胞抗原的细胞。
58、第十三方面,本发明提供一种不表达ciita和b2m,表达faslg蛋白和至少一种选自:dux4,cd27,cd35,cd200,hla-c,pd-l1,cd47,cd24,cd26,ccl21,mfge8和serpinb9的多肽,并且具有表达降低或不表达的mhc i类和/或mhc ii类人白细胞抗原的细胞。
59、第十四方面,本发明提供一种上述第六方面~第十三方面所述的细胞,其中所述细胞选自干细胞,分化细胞,多能干细胞,诱导的多能干细胞,成体干细胞,祖细胞,体细胞,原代t细胞和嵌合抗原受体t细胞。
60、第十五方面,本发明提供第一方面所述的通用型细胞、第五方面所述的组合物或第六方面~第十三方面所述的细胞在制备用于细胞治疗的产品中的应用。
61、第十六方面,本发明提供第一方面所述的通用型细胞、第五方面所述的组合物或第六方面~第十三方面所述的细胞在制备用于器官移植的产品中的应用。
62、第十七方面,本发明提供第一方面所述的通用型细胞、第五方面所述的组合物或第六方面~第十三方面所述的细胞在构建通用型pscs细胞库中的应用。
63、第十八方面,本发明提供第一方面所述的通用型细胞、第五方面所述的组合物或第六方面~第十三方面所述的细胞作为基因药物载体的应用。
64、本发明的有益效果:
65、1、本发明在干细胞中失活主要组织相容性复合体mhc-i和ii类基因后,过表达faslg,获得的人多能干细胞或人诱导多能干细胞可在逃逸t细胞攻击的基础上,进一步逃逸nk细胞的杀伤,其效果甚至优于已经报道的阳性靶点cd47和cd24。
66、2、获得的人诱导多能干细胞dko+faslg可显著逃逸pbmc的杀伤,逃逸效果优于wt、dko+cd47及dko+cd24细胞;获得的人诱导多能干细胞dko+faslg可显著逃逸巨噬细胞(mac)的杀伤,逃逸效果优于wt细胞。
67、3、同时这些低免疫原性的多能干细胞保留了其干性和分化能力。将免疫豁免的hipsc-dko+faslg细胞往中胚层分化为imsc,可显著逃逸nk的杀伤、pbmc的杀伤。
68、将免疫豁免的hipsc-dko+faslg细胞往外胚层分化为idap,可显著逃逸nk、mac、pbmc的杀伤。
69、5、在非人灵长类(nhp)模型上探究通用型猴干细胞(ipsc)的体内外免疫原性,发现构建的nhp dko+faslg可显著逃逸pbmc的杀伤,依旧可以不激活免疫系统;nhp dko+faslg细胞在体内的存活时间最长。
- 还没有人留言评论。精彩留言会获得点赞!