一种基因修饰的肿瘤细胞系、人源化动物肿瘤模型的构建方法及其应用与流程
本发明属于动物基因工程领域,具体而言,涉及一种基因修饰的肿瘤细胞系、人源化动物肿瘤模型的构建方法及其在医药生物领域中的应用。
背景技术:
1、随着传染病等疾病逐渐被人们所控制,近年来,恶性肿瘤(癌症)的发生率变相对显得突出和增高了,因恶性肿瘤而死亡的人亦显著增多。恶性肿瘤的治疗通常包括手术治疗、抗癌药物治疗、放射治疗、生物治疗和中西医结合治疗。
2、生物治疗中的免疫疗法代表着成功治疗癌症的重大飞跃,在不同适应症下具有前所未有的长期存活率。然而,许多患者仍然无法从这些免疫疗法中受益,导致人们越来越关注确定可以延长或改变患者反应的新型免疫疗法或组合。为此,对更具预测性的临床前模型的需求不断增加,以推动合理的免疫治疗药物/组合开发,并最大限度地减少临床试验的失败。小鼠动物模型长期以来一直是生物医学研究的关键工具。用于评估免疫疗法的小鼠模型的四种主要方法是:(1)具有完全免疫活性宿主的同基因的小鼠肿瘤模型;(2)基因工程小鼠模型;(3)化学诱导模型;(4)其他模型。虽然前三种方法被广泛使用,但一个主要缺点是它们依赖于鼠类免疫系统,然而鼠类免疫系统并不能完全重现人类免疫反应。因此,非常需要重现功能性人类免疫系统的临床前模型。
3、用于癌症免疫疗法研究的人源化小鼠模型包括三个要素:(1)免疫缺陷宿主小鼠;(2)人类免疫细胞;(3)人类肿瘤细胞。最近开发了多种可以在体内研究人体免疫系统的人源化小鼠。最常用的人源化小鼠模型是il2rγnull小鼠品系,如nog(nod/shi-prkdcscidil2rγtm1sug/jic)小鼠或nsg(nod/ltsz-prkdcscidil2rγtm1wjl/j)小鼠,移植人体组织、人造血细胞(hsc)或人外周血单核细胞(pbmc)重建人的免疫系统。其中最简单、最经济的方法是将人pbmc移植到免疫缺陷小鼠中。然而,在这些小鼠中存在严重的异种移植物抗宿主病(xeno-gvhd),所有移植的t细胞都被gvhd激活,最后所有小鼠死于异种gvhd,导致实验窗口有限,这使得长期且精确分析人免疫反应变得困难。为了避免在hu-pbmc小鼠中异种gvhd,基于mhc分子的遗传操作开发了不同的策略。将pbmc移植于敲出小鼠i类和ii类mhc分子的nsg或nog小鼠中,会降低和延长异种gvhd产生。也有研究者发现,在移植前将pbmc中cd4+t细胞清除可有效减少gvhd的发生。
4、在肿瘤免疫学研究中,人类癌细胞,无论是肿瘤细胞系还是患者肿瘤细胞,都可被移植到上述人源化小鼠中,研究人类免疫细胞和人类肿瘤细胞之间的相互作用。虽然上述人源化小鼠模型为在体内研究人类免疫细胞和人类肿瘤细胞提供了独特的机会,但由于缺乏抗原呈递细胞,传统模型仅限于评估非特异性t细胞相互作用。近年来,专职抗原呈递细胞——树突状细胞(dc)疫苗在诱导癌症患者的抗肿瘤免疫方面,具有很高的治疗潜力。但少有基于人源化肿瘤细胞系或者小鼠模型评估接种dc的疫苗后免疫反应的报告。
技术实现思路
1、因此,本发明开发了一种体外或体内系统,提供一种基因修饰的肿瘤细胞系,所述肿瘤细胞系在制备荷瘤非人动物模型中的应用,制备获得的荷瘤非人动物模型在筛选疫苗或者药物中的用途或方法,以及筛选得到的疫苗或者药物。具体的,
2、本发明第一方面,提供一种基因修饰的肿瘤细胞系,所述基因修饰包括向肿瘤细胞系导入编码人白细胞抗原(human leucocyte antigen,hla)的核苷酸序列。
3、优选的,所述hla基因包括hla-i基因,hla-ii基因,或者hla-iii基因,更优选的,所述hla-i基因包括hla-a,hla-b,hla-c;所述hla-ii基因包括hla-dr,hla-dp,hla-dq;进一步优选的,所述hla基因包括hla-a*02:01。
4、优选的,所述肿瘤细胞系来自于任一恶性肿瘤,更优选的,所述恶性肿瘤包括生殖系统、呼吸系统、心血管系统、消化系统、泌尿系统、内分泌系统、神经系统、血液系统、骨骼肌肉系统等等的恶性肿瘤。进一步优选的,所述恶性肿瘤包括生殖系统、消化系统、血液系统的恶性肿瘤,例如卵巢癌、宫颈癌、肝癌、急性白血病等等。
5、在一个具体的实施方式中,所述肿瘤细胞系包括ovcar8、hepg2、mda-mb-453或者mv4-11。
6、优选的,所述基因修饰还包括向肿瘤细胞系导入编码肿瘤相关抗原的核苷酸序列。所述肿瘤相关基因由所述肿瘤细胞系确定。
7、更优选的,所述肿瘤相关抗原是肿瘤细胞系相对特异的抗原,可作为肿瘤诊断、肿瘤侵袭和/或转移、治疗效果和预后的判断标志,进一步优选的,所述肿瘤相关抗原包括ca125、claudin 6、ny-nso-1、afp、magea3、hsp70、bage、prtn3、prame、mart、肿瘤新生抗原和/或wt1蛋白。
8、在一个具体的实施方式中,所述ca125、claudin 6、ny-nso-1、mart、wt1是卵巢癌相对特异的肿瘤相关抗原;
9、在一个具体的实施方式中,所述afp、magea3、hsp70、ca125是肝癌相对特异的肿瘤相关抗原;
10、在一个具体的实施方式中,所述bage、prtn3、prame、wt1是急性白血病相对特异的肿瘤相关抗原。
11、在一个具体的实施方式中,所述肿瘤新生抗原是乳腺癌相对特异的肿瘤相关抗原。
12、本发明第二方面,提供一种上述基因修饰的肿瘤细胞系的制备方法,所述制备方法包括向肿瘤细胞系导入编码人白细胞抗原(human leucocyte antigen,hla)的核苷酸序列。
13、优选的,所述制备方法还包括向肿瘤细胞系导入编码肿瘤相关抗原的核苷酸序列。
14、优选的,所述的导入包括使用基因编辑技术将编码肿瘤相关抗原的核苷酸序列导入到肿瘤细胞系中,所述基因编辑技术包括基于胚胎干细胞的基因同源重组技术、crispr/cas9、锌指核酸酶技术、转录激活子样效应因子核酸酶技术、归巢核酸内切酶或其他分子生物学技术;进一步优选的,使用基于crispr/cas9的基因编辑技术进行基因导入。
15、更优选的,所述导入包括使用靶向载体将上述核苷酸序列导入到肿瘤细胞系。
16、本发明第三方面,提供一种上述基因修饰的肿瘤细胞系的应用,所述应用包括在筛选药物或者制备疾病模型中的应用。
17、优选的,所述药物用于治疗肿瘤。
18、所述疾病模型包括肿瘤疾病模型。
19、本发明第四方面,提供一种基因修饰的树突状细胞(dendritic cells,dc),所述基因修饰包括在树突状细胞中导入编码肿瘤相关抗原的rna序列。
20、优选的,所述肿瘤相关抗原来自于任一恶性肿瘤,更优选的,所述恶性肿瘤包括生殖系统、呼吸系统、心血管系统、消化系统、泌尿系统、内分泌系统、神经系统、血液系统、骨骼肌肉系统等等的恶性肿瘤。进一步优选的,所述恶性肿瘤包括生殖系统、消化系统、血液系统的恶性肿瘤,例如卵巢癌相关抗原、宫颈癌相关抗原、肝癌相关抗原、急性白血病相关抗原等等。
21、更优选的,本发明所述的“肿瘤相关抗原”包括但不限于afp、ca125、ca199、ny-eso-1、alk、bage蛋白、birc5(存活素)、birc7、ca9、calr、ccr5、cd19、cd20(ms4a1)、cd22、cd27、cd30、cd33、cd38、cd40、cd40l、cd44、cd52、cd56、cd79、cdk4、ceacam3、ceacam5、clec12a、egfr、egfr变体iii、erbb2(her2)、erbb3、erbb4、epcam、epha2、epha3、fcrl5、flt3、folr1、gage蛋白、gcp3、gd2、gd3、gpnmb、gm3、gpr112、il3ra、kit、kras、lgr5、ebv衍生的lmp2、l1cam、mage蛋白、mlana、msln、muc1、muc2、muc3、muc4、muc5、muc16、mum1、ankrd30a、ny-eso1(ctag1b)、ox40、pap、pax3、pax5、plac1、prlr、pmel、prame、psma(folh1)、rage蛋白、ret、rgs5、ror1、sart1、sart3、slamf7、slc39a6(liv1)、steap1、steap2、tert、tmprss2、thompson-nouvelle抗原、tnfrsf17、tyr、upk3a、vtcn1、肿瘤新生抗原或wt1的一种或者多种。
22、进一步优选的,所述肿瘤相关抗原包括卵巢癌、肝癌、乳腺癌和/或急性白血病相关抗原,例如ca125、claudin 6、ny-nso-1、afp、magea3、hsp70、bage、prtn3、prame、肿瘤新生抗原和/或wt1蛋白。
23、在一个具体的实施方式中,所述ca125、claudin 6、ny-nso-1、mart、wt1是卵巢癌相对特异的肿瘤相关抗原;
24、在一个具体的实施方式中,所述afp、magea3、hsp70、ca125是肝癌相对特异的肿瘤相关抗原;
25、在一个具体的实施方式中,所述bage、prtn3、prame、wt1是急性白血病相对特异的肿瘤相关抗原。
26、在一个具体的实施方式中,所述肿瘤新生抗原是乳腺癌相对特异的肿瘤相关抗原。
27、在一个具体的实施方式中,上述肿瘤相关抗原的氨基酸结构和编码上述肿瘤相关抗原的rna序列如下表所示:
28、表1:肿瘤相关抗原的氨基酸序列和rna序列
29、
30、
31、或者所述氨基酸序列或者rna序列与表1所示的氨基酸或者rna序列具有至少90%的同一性,并具有肿瘤相关抗原或者编码肿瘤相关抗原的功能。
32、优选的,所述基因修饰还包括在树突状细胞中导入编码免疫佐剂的rna序列。
33、优选的,所述免疫佐剂包括cd40l,更优选的,所述cd40l的氨基酸序列来自登录号ncbi reference sequence:np_000065.1。
34、所述编码cd40l的rna序列包括:nm_000074.3。
35、优选的,所述dc包含的hla与上述肿瘤细胞系的hla相同。
36、本发明第五方面,提供一种上述基因修饰的树突状细胞(dc)的构建方法,所述构建方法包括将编码肿瘤相关抗原的rna导入到dc基因座中。
37、优选的,所述导入包括使用基因编辑技术将编码肿瘤相关抗原的核苷酸序列导入到dc中,所述基因编辑技术包括基于胚胎干细胞的基因同源重组技术、crispr/cas9、锌指核酸酶技术、转录激活子样效应因子核酸酶技术、归巢核酸内切酶或其他分子生物学技术;进一步优选的,使用基于crispr/cas9的基因编辑技术进行dc的构建。
38、更优选的,所述构建方法包括使用靶向载体将编码肿瘤相关抗原的核苷酸序列导入到dc的上述基因座。
39、本发明第六方面,提供一种cd8+t细胞的驯化方法,所述驯化方法包括将上述基因修饰的dc和cd8+t细胞共培养。
40、优选的,所述驯化方法包括dc:cd8+t细胞比例为1:(1-15),更优选的,所述比例为1:(8-15),进一步优选的,所述比例为1:10。
41、优选的,所述培养步骤包括每3天进行一次半量更换培养液。
42、优选的,所述培养步骤包括每7天进行1轮刺激,共进行2-3轮刺激。
43、本发明第七方面,提供一种驯化的cd8+t细胞,所述驯化的cd8+t细胞由上述的驯化方法获得。
44、本发明第八方面,提供一种上述基因修饰的dc或驯化的cd8+t细胞在制备药物中的用途。
45、优选的,所述药物用于治疗或者预防肿瘤等疾病。
46、更优选的,所述肿瘤来自于任一恶性肿瘤,更优选的,所述恶性肿瘤包括生殖系统、呼吸系统、心血管系统、消化系统、泌尿系统、内分泌系统、神经系统、血液系统、骨骼肌肉系统等等的恶性肿瘤。进一步优选的,所述恶性肿瘤包括生殖系统、消化系统、血液系统的恶性肿瘤,例如卵巢癌、宫颈癌、肝癌、急性白血病等等。
47、本发明第九方面,提供一种药物组合物,所述药物组合物包括上述基因修饰的dc或驯化的cd8+t细胞。优选的,所述药物组合物还包括药学上可接受的辅料。
48、优选的,所述药物组合物可以是任意的剂型,例如注射剂等等。
49、在一个具体的实施方式中,所述药物组合物包括导入编码ca125、wt1、claudin 6、肿瘤新生抗原和/或ny-nso-1的rna的树突状细胞;
50、在一个具体的实施方式中,所述药物组合物包括导入编码afp、ca125、magea3和/或hsp70的rna的树突状细胞;
51、在一个具体的实施方式中,所述药物组合物包括导入编码wt1、bage、prtn3和/或prame的rna的树突状细胞。
52、在一个具体的实施方式中,所述药物组合物包括导入编码肿瘤新生抗原的rna的树突状细胞。
53、优选的,所述导入是分别导入。
54、本发明第十方面,提供一种荷瘤非人动物模型的制备方法,所述制备方法包括将上述基因修饰的肿瘤细胞系植入到非人动物中。
55、优选的,所述非人动物包括免疫缺陷非人动物,更优选的,所述制备方法包括用人的pbmc对免疫缺陷非人动物进行人源化。
56、优选的,所述的植入方式包括皮下注射、腹腔注射等等。
57、更优选的,所述的基因修饰的肿瘤细胞系具有与候选的药物或者疫苗相同的hla型。
58、优选的,所述的非人动物可以选自啮齿类动物、猪、兔子、猴子等任何可以进行研究的非人动物。
59、优选的,所述的非人动物为非人哺乳动物,进一步优选的,所述的非人哺乳动物为啮齿类动物,更进一步优选的,所述的啮齿类动物为大鼠或小鼠。
60、优选的,所述的免疫缺陷鼠选自nog或者nod免疫缺陷鼠,例如nod-prkdcscid il-2rγnul小鼠、nod-rag 1-/--il2rg-/-(nrg)、rag 2-/--il2rg-/-(rg)、nod/scid、nog-dko等等。
61、本发明第十一方面,提供一种上述制备方法获得的荷瘤非人动物模型。
62、本发明第十二方面,提供一种上述基因修饰的肿瘤细胞系或者荷瘤非人动物模型的应用,所述应用包括:
63、1)在涉及人类细胞的免疫过程的产品开发,筛选疫苗、药物中的应用;
64、2)作为药理学、免疫学、微生物学和/或其它医学研究的疾病模型系统中的应用;
65、3)在开发新的诊断策略和/或治疗策略中的应用。
66、优选的,所述疫苗或药物包括各种外源抗原、自体抗原、肿瘤相关抗原,或其编码rna或dna序列,更优选的,所述疫苗或药物为dc,所述dc携带各种外源抗原、自体抗原、肿瘤相关抗原,或其编码rna或dna序列。进一步优选的,所述树突状细胞与荷瘤非人动物模型中植入的肿瘤细胞系具有相同的hla型。
67、进一步优选的,所述外源抗原来源于病毒、细菌、真菌等。
68、优选的,所述应用不是疾病的诊断和治疗方法。
69、本发明第十三方面,提供一种筛选疫苗或者药物的方法,所述方法包括将上述任一的荷瘤非人动物模型用于筛选候选的疫苗或者药物。
70、优选的,所述方法还包括将驯化的cd8+t细胞植入到荷瘤非人动物模型中的步骤,更优选的,所述驯化的cd8+t细胞包括用候选的疫苗或者药物进行驯化,进一步优选的,所述驯化的cd8+t细胞包括利用上述任一的树突状细胞驯化的cd8+t细胞。
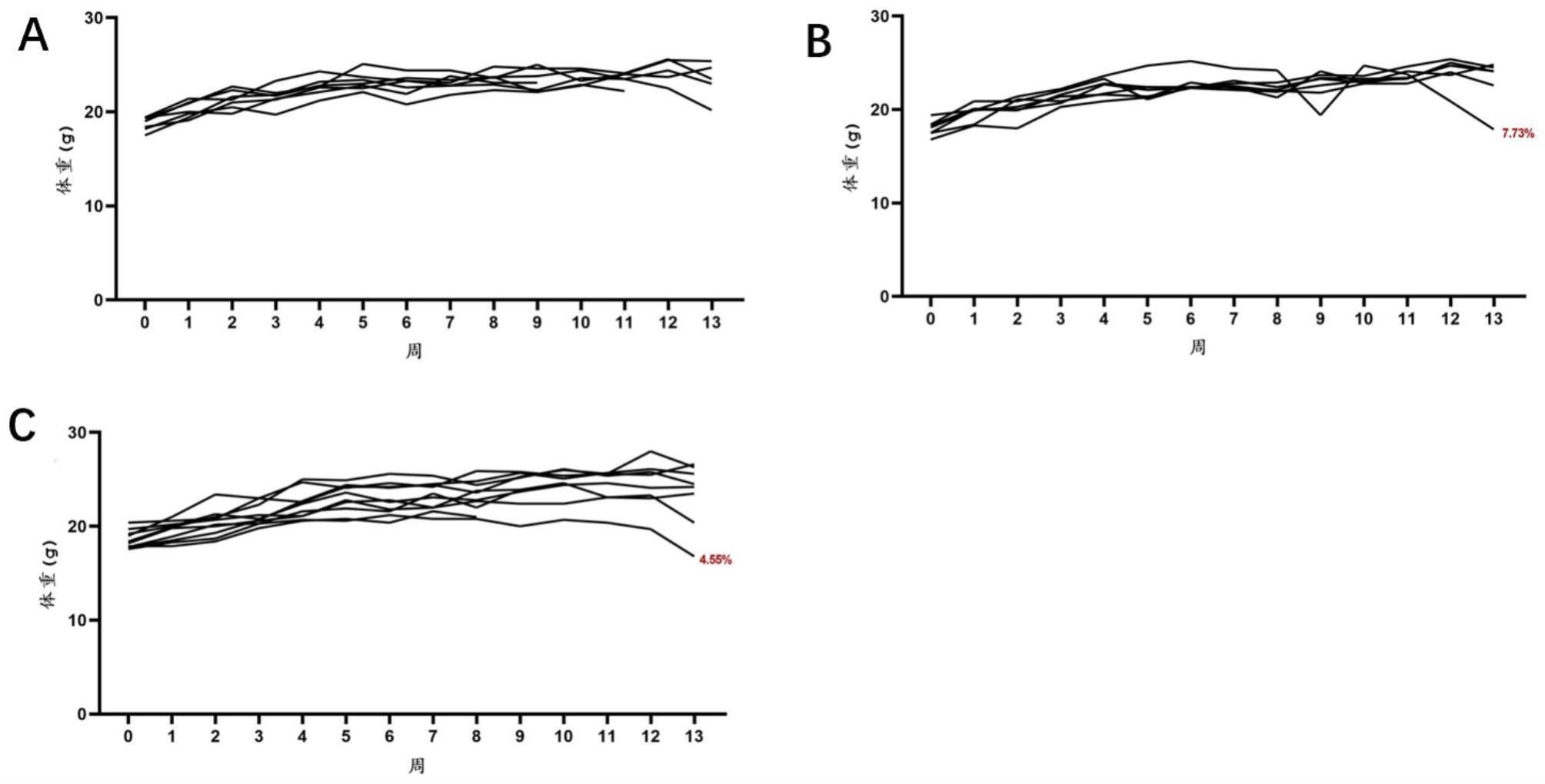
71、本发明第十四方面,提供一种肿瘤的预防和/或治疗方法,所述方法包括向机体施予上述药物组合物。
72、优选的,所述疫苗和/或药物用于预防或者治疗感染、自身免疫性疾病、过敏性疾病、或者如上所定义的恶性肿瘤。
73、更优选的,所述感染来源于病毒、细菌、真菌等导致的感染。
74、本发明所述“治疗(treating、treat或treatment)”表示减缓、中断、阻止、控制、停止、减轻、或逆转一种体征、症状、失调、病症、或疾病的进展或严重性,但不一定涉及所有疾病相关体征、症状、病症、或失调的完全消除。术语“预防”是指避免疾病的发生,改善或者减轻疾病的症状、病理状态或发展。
75、本发明的有益效果;
76、1、构建一种基因修饰的肿瘤细胞系,所述肿瘤细胞系可用于体外有效筛选药物,植入动物体内后可较好的重现肿瘤疾病的临床特征,并在体内有效筛选出药物,尤其是治疗肿瘤的dc疫苗。
77、2、构建一种基因修饰的树突状细胞,所述树突状细胞可高表达外源抗原,所有抗原均大于50%的表达,有的甚至超过80%。所述树突状细胞同时具有治疗相关肿瘤的作用,可诱导抗原特异性t细胞增殖、产生效应因子、并且抑制肿瘤生长。
78、3、构建一种有效筛选疫苗和药物的人源化动物模型,所述动物模型未出现gvhd反应,实验窗口可延长至13周,并对外源抗原表现出良好的cd4+t细胞和cd8+t细胞的活化。
79、4、利用体外抗原驯化的cd8+t细胞植入到荷瘤非人动物模型,将候选的基因修饰的树突状细胞接种到上述动物模型中,能够作为肿瘤特异性抗原免疫治疗的疫苗或者药物的药效评价的良好疾病模型,筛选出的树突状细胞疫苗能够有效的治疗相应的肿瘤。
80、以上只是概括了本发明的一些方面,不是也不应该认为是在任何方面限制本发明。
81、本说明书提到的所有专利和出版物都是通过参考文献作为整体而引入本发明的。本领域的技术人员应认识到,对本发明可作某些改变并不偏离本发明的构思或范围。
82、下面的实施例进一步详细说明本发明,不能认为是限制本发明或本发明所说明的具体方法的范围。
- 还没有人留言评论。精彩留言会获得点赞!