一种高纯度重组肠激酶的纯化方法与流程
本发明涉及药物合成及化工领域,特别涉及一种高纯度重组肠激酶的纯化方法。
背景技术:
1、肠激酶(enterokinase)存在于高等动物的十二指肠粘膜中,是使胰蛋白酶原水解而成为活性胰蛋白酶的肽链内切酶(endo-peptidase)。此反应要比由胰蛋白酶自身触媒引起的活性化快数十倍,ec3.4.21.9.是分子量约10万的含糖蛋白质。肠激酶是一种高度专一性识别asp-asp-asp-asp-lys序列的蛋白酶,在lys的c端水解多肽。它可以将胰蛋白酶原转变为胰酶,也可以将带有这个识别序列的融合蛋白切开。由于肠激酶的底物酶切位点序列具有上述高度的特异性,使得其成为基因工程融合蛋白表达后修饰过程中一个极其有用的工具酶而被广泛应用。
2、目前,重组基因工程菌表达是制备重组工具酶的主要方法,表达系统包括原核基因表达系统、真核基因表达系统和动物细胞表达系统。而在工具酶制备中,前两者是最为常用的表达系统。对于原核基因表达系统,使用最多的即为大肠杆菌来作为宿主菌,这也是目前应用最广泛的蛋白表达系统。原因是大肠杆菌表达系统遗传背景和生理特性研究清楚,已开发有多种商业化工程菌可以使用;且大肠杆菌易于培养和控制、转化操作简单,并具有表达水平高、成本低、周期短等特点。对于应用原核系统表达外源基因时,大多研究利用融合蛋白表达方式,将各种不同的引导肽序列融合到目的基因上,形成重组融合蛋白。在大肠杆菌中表达时,引导肽可以将目的蛋白分泌到细胞周质甚至细胞外,最后,通过蛋白酶等将引导肽切除去。
3、在复性系统中加入氧化-还原系统可以显著提高蛋白质的复性效率,最常见的是加入氧化型谷胱甘肽和还原型谷胱甘肽,但氧化型谷胱甘肽和还原型的谷胱甘肽对ph,光照等环境因素比较敏感,因而对复性效果带来较大不利影响。
4、此外,中国专利文件cn 114807101 a公开了一种包含牛肠激酶轻链蛋白的融合蛋白,及其表达载体和重组大肠杆菌工程菌,通过对肠激酶酶切位点多肽、连接体多肽和伴侣蛋白的选择,提高了融合蛋白的表达量和表达稳定性。在进行重组蛋白的诱导表达及sds-page检测时,提供了一种重组蛋白的纯化方法,其复性缓冲液配方为2m尿素+1% peg1000+2mm还原型半胱氨酸+1mm氧化型半胱氨酸+50mm tris,ph=8.0,其中还原型半胱氨酸不仅价格昂贵且其硫基极易被氧化,其纯化并复性后的活性蛋白回收率也较低(仅为4%左右),因此,仍需要一种能够降低成本、提高活性蛋白回收率的纯化方法。
技术实现思路
1、为克服上述缺点,本发明的目的在于提供一种成本低、活性蛋白回收率高的纯化方法。
2、为了达到以上目的,本发明采用的技术方案是:一种高纯度重组肠激酶的纯化方法,具体包括以下步骤:
3、步骤(1)将含有重组肠激酶包涵体的大肠杆菌原料液放入离心机进行离心后,弃上清,获得菌泥;
4、步骤(2)按照w/v=1:10的比例用重悬缓冲液重悬菌泥后,采用高压均质机进行破碎处理、离心,离心结束后留沉淀;
5、其中,所述重悬缓冲液的配方为:50mm tris-hac,0.5m nacl,ph=8.0;步骤(3)按照w/v=1:10的比例用洗涤缓冲液重悬对步骤(2)所得的沉淀进行洗涤后离心,离心结束后将离心所得沉淀用纯水按照w/v=1:10的比例重悬洗涤去除残留污剂,再次离心,离心结束后留沉淀;
6、所述洗涤缓冲液的配方为50mm tris-hac,0.5m nacl,2m urea,0.5%(v/v)triton,ph=8.0;
7、步骤(4)按照w/v=1:10的比例用变性缓冲液重悬步骤(3)所得沉淀,在室温下进行搅拌,得到包涵体变性液,2-8℃冰箱保存;
8、所述变性缓冲液的配方为50mm tris-hac,8m urea,10mm dtt,ph=8.0;
9、步骤(5)取一定量步骤(4)所得的包涵体变性液,加入复性缓冲液中,使复性缓冲液中蛋白终浓度为0.25mg/ml,在2-8℃低温下低速搅拌复性;
10、所述复性缓冲液的配方为50mm tris-hac,1m urea,5mm cysteine,1mm cystine,ph=8.0;
11、步骤(6)将步骤(5)复性成功的料液进行镍柱亲和层析;
12、平衡:3cv平衡缓冲液:50mm tris-hac,0.5m nacl,ph=8.0;
13、上样:复性成功的料液0.2μm过滤后上样;
14、淋洗:3cv淋洗缓冲液:50mm tris-hac,0.5m nacl,ph=8.0;
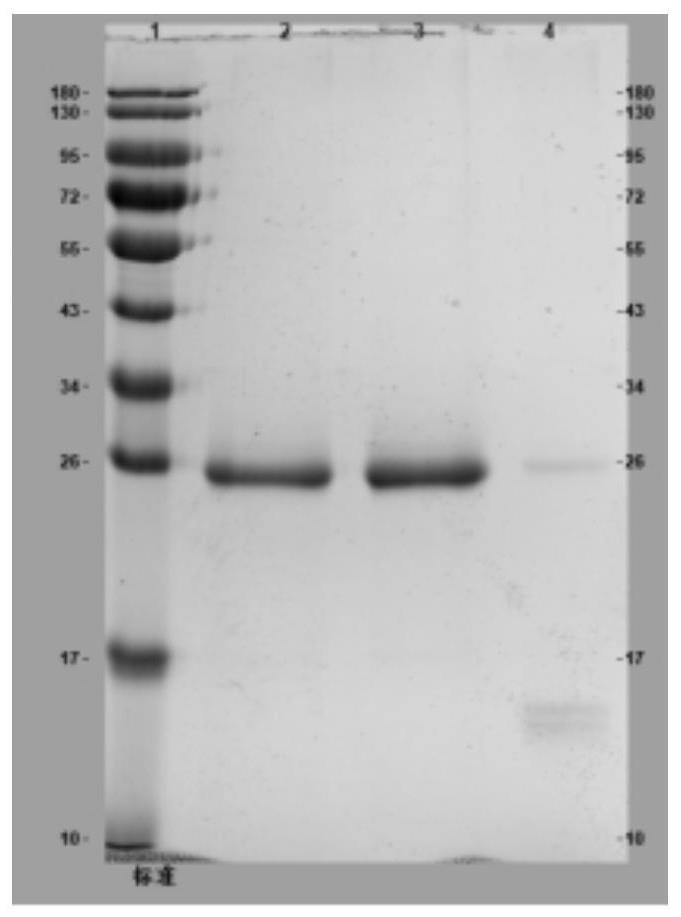
15、洗脱:5cv洗脱缓冲液:50mm tris-hac,0.5m nacl,0.3m咪唑,ph=7.4,在uv280波长监测下收集含有样品峰的洗脱液得到重组肠激酶纯品;
16、再生:3cv再生缓冲液:50mm tris-hac,0.5m nacl,0.5m咪唑,ph=7.4;
17、洗涤:纯化水洗涤。
18、进一步的,所述步骤(5)中2-8℃低温下低速搅拌复性的时间不低于24h。
19、在2-8℃低温下低速搅拌复性的时间不低于24h能够保证包涵体变性液中的蛋白复性充分。
20、进一步的,步骤(6)中镍柱亲和层析中所选填料为polar mc60 ni excel。
21、复性成功的料液中含有低浓度还原剂dtt,因此筛选polar mc60 ni excel作为填料,可以防止镍被还原。
22、进一步的,所述洗脱峰收集范围为:100-max-100mau/mm。
23、此收集范围下洗脱体积小,所得到的的重组肠激酶纯度和收率高。
24、进一步的,洗脱用洗脱缓冲液流速不超过150cm/h。
25、进一步的,洗脱用洗脱缓冲液流速为150cm/h。
26、该流速下洗脱效果最好。
27、与现有技术相比,本发明具有以下优点:
28、1、本发明方法采用配方为50mm tris-hac+1m urea+5mm cysteine+1mm cystine,ph=8.0的溶液作为复性缓冲液,采用半胱氨酸和胱氨酸联合使用,且半胱氨酸和胱氨酸的浓度比为5:1,有类似氧化-还原系统作用,且在该氧化剂和还原剂的浓度比下,蛋白的复性率最高,降低成本的同时能够显著提高蛋白活性率。
29、2、蛋白质复性过程中,蛋白浓度对蛋白复性率影响也极大,控制复性过程复性缓冲液中蛋白浓度,能够减少中间体的形成,提高复性率,由于本发明方法在蛋白复性过程中,控制复性缓冲液中蛋白终浓度为0.25mg/ml,使重组肠激酶在复性过程中不易产生中间体,稳定性好,复性率高,纯化效果好。
30、3、重组肠激酶通过变复性工艺和一步镍柱亲和层析工艺后,活性蛋白收率提高至7%左右,且整个工艺流程成本低,时间短,工艺操作简便,适用于放大生产。
31、4、选用polar mc60 ni excel作为层析柱填料,可以防止镍被复性成功的料液中含有的低浓度还原剂dtt还原。
- 还没有人留言评论。精彩留言会获得点赞!