一种杂芳基三氟甲基化合物的合成方法与流程
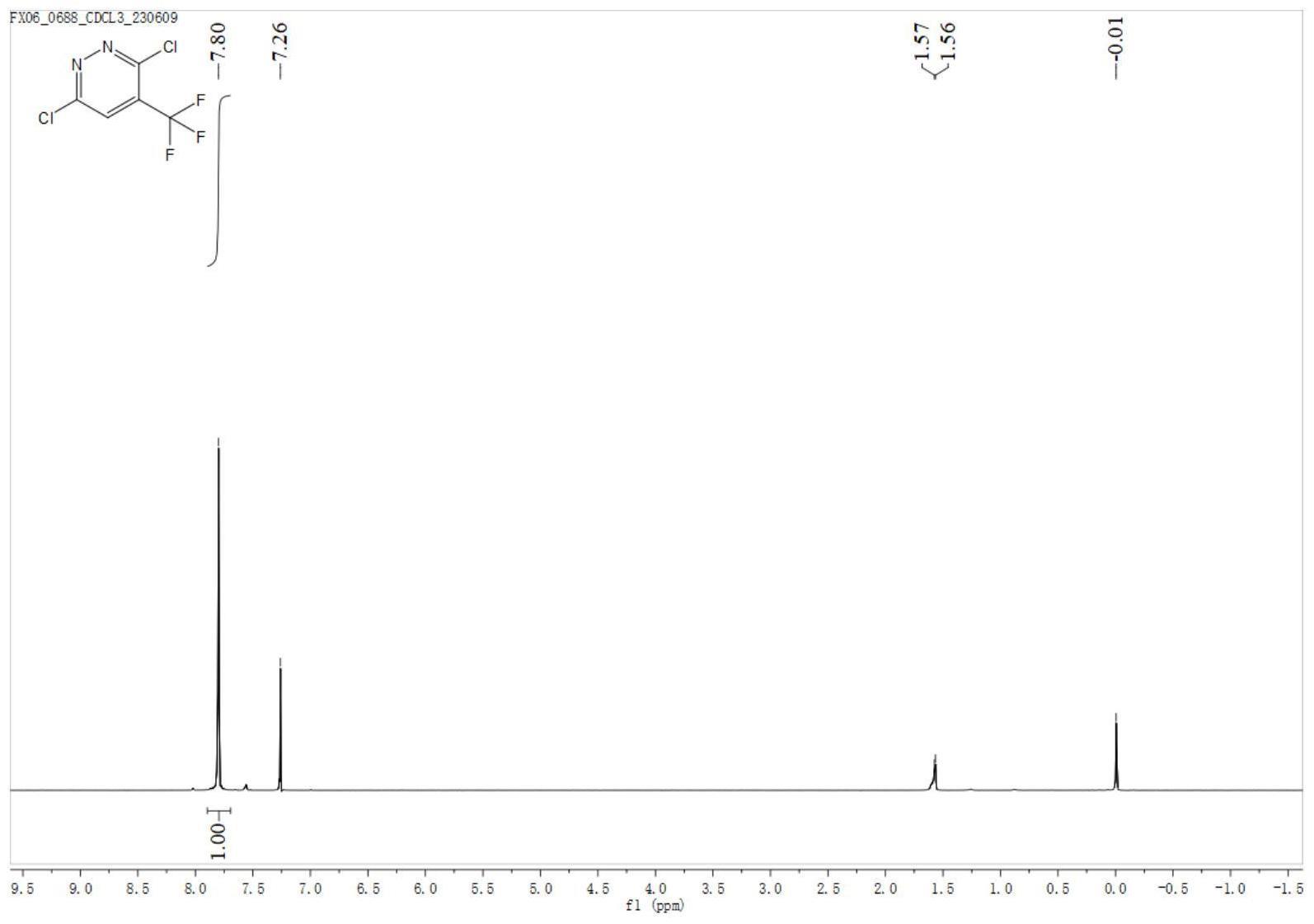
本发明属于有机合成领域,具体涉及一种杂芳基三氟甲基化合物的合成方法。
背景技术:
1、氟原子的引入导致有机及无机化合物具有独特的物理、化学性能及生理活性。从二十世纪三十年代初期氟里昂问世以来,氟化学一直表现出蓬勃发展的趋势。许多尖端技术(原子能工业、火箭、宇航等),和一些重大的工业项目及药物都采用了含氟的化合物。
2、合成有机氟化合物一般采用的方法有:通过不饱和c-c键的加成合成氟化合物,通过重氮盐合成氟化合物,亲核氟代,亲电氟代,以及三氟甲基的引入(三氟甲基化反应)等。
3、三氟甲基具有强吸电子诱导效应、亲脂性以及稳定的c-f键,将其引入到有机分子中能够显著改变目标分子的各种性质。比如,往药物分子中引入三氟甲基可以有效延长其在生物体内的作用时间,增强代谢稳定性;同时三氟甲基的引入通常会增加药物分子的脂溶性,从而有助于药物分子在生物体内的吸收、传递和扩散。抗癌药索拉非尼(sorafenibtosylate)、抗抑郁药氟西汀(fluoxetine)、新型植物广谱杀菌剂肟菌酯(trifloxystrobin)和液晶显示屏典型材料zli-2857等都含有三氟甲基。所以如何将三氟甲基引入目标分子,成为氟化学中的一个重要的课题。
4、
5、经过多年的研究,已经发展了许多引入三氟甲基的方法,如用sf4将羧基转化为三氟甲基,按照反应机理,三氟甲基的引入主要分为三大类:自由基三氟甲基化,亲核三氟甲基化,和亲电三氟甲基化。
6、就自由基三氟甲基化而言,三氟甲基自由基能通过多种途径得到,由于其亲电性强,所以能与富电子的苯环发生亲电加成反应。但这种方法产率低,选择性差,而且反应难于控制,所以在有机合成中的应用受到限制。
7、就亲电三氟甲基化而言,1990年umemoto报道了化合物ⅰ和ⅱ的合成及应用,这是第一种亲电性的三氟甲基化试剂。随后umemoto报道了化合物ⅲ和ⅳ的合成及应用。这几个化合物是稳定的晶体,具有良好的稳定性。苯并环是很好的离去基团,在取代过程中容易离去,有利反应进行。反应易于处理,特别是化合物ⅳ,反应生成后的磺酸是水溶性的,极易除去。另外,化合物ⅴ、化合物ⅵ、化合物ⅶ也都是常见的亲电性三氟甲基化试剂。
8、
9、这种三氟甲基化并不是通过cf3+进行,也不是sn2取代,可能是通过set机理产生三氟甲基自由基,然后对碳负离子的亲电加成。这种方法通用型强,通过这种方法,可以在多种亲核性化合物上引入三氟甲基。但这几个试剂制备困难,价格较高,限制了其应用。
10、就亲核三氟甲基化而言,在化合物中引入三氟甲基的另一类方法就是通过cf3-的亲核反应实现,主要包括两大类:基于cucf3对卤代苯的亲核取代和tmscf3对羰基化合物的亲核取代。
11、最早发现的方法是基于cucf3作为cf3-源对卤代苯(通常为溴代苯或碘代苯,后者活性更高)的亲核取代,从而合成三氟甲基取代的芳基化合物。这个方法是由mcloughlin于1969年首先报导,经过多年的发展,成为三氟甲基化最主要的方法之一。
12、cucf3可以通过多种方法,在cu的存在下现制现用。
13、另一个方法就是tmscf3(prakash试剂)对羰基化合物的亲核取代。此方法是在1984年由ruppert首先报道,随后prakash对其应用做了大量的工作,这是从羰基化合物合成三氟甲基化合物最便捷的方法,反应条件温和,操作方便,产率较高,在有机合成中的应用也很广泛。
14、另外,近来dolbier等使用cf3i/tdae体系,在温和的条件下也成功地实现了对亲电物种的三氟甲基化。
15、通过多年的研究,已经发展出了很多三氟甲基化的方法。但杂芳基的三氟甲基化还是比较难实现,一般都是通过cu,ag,pd等催化杂芳基卤化物和三氟甲基试剂亲核反应来实现,诸如ruppert试剂,umemoto试剂,陈试剂等,这些试剂都涉及到对反应体系要求严格无水,以及价格较为昂贵,副产物后处理麻烦或者会产生有害气体等,没有办法适用工业上放大生产。
技术实现思路
1、针对现有技术的不足,本发明提供了一种杂芳基三氟甲基化合物的合成方法。本发明首次提出了一种铜催化下,杂芳基碘代物与三氟甲磺酸钠反应生成杂芳基三氟甲基化合物的方法,该反应用到便宜的铜粉和三氟甲磺酸钠,对于反应体系的水分要求不大,没有副产物产生,后处理简单,具有很好的底物兼容性,适合于工业上放大生产。
2、本发明的技术方案如下:
3、一种杂芳基三氟甲基化合物的合成方法,所述合成方法是将杂芳基碘代物,催化剂,三氟甲基试剂混合,进行三氟甲基化反应得到;
4、所述三氟甲基试剂为三氟甲磺酸钠。
5、进一步地,所述催化剂包括铜、金、银中的一种或多种。
6、进一步地,所述催化剂优选为铜。
7、进一步地,所述合成方法的路线如下:
8、
9、其中:
10、r1包括杂环芳香基中的一种;
11、r2包括氢原子、卤素、c1-c6的烷基、c1-c6的烷氧基、卤代烷基、卤代烷氧基、c1-c6的烷硫基、c1-c6的烷氧基羰基、c1-c3的氰基中的一种或多种。
12、进一步地,所述r1包括五元、六元、七元杂环及稠杂环芳香基中的一种。
13、进一步地,所述r2包括氢原子、氟、氯、溴、甲基、甲氧基、苄氧基、三氟甲基、三氟甲氧基、甲酯基、甲氰基中的一种或多种。
14、进一步地,所述r1包括噻唑基、噻吩基、哒嗪基、吡嗪基、吡啶基、吡唑并吡啶基中的一种。
15、进一步地,所述合成方法具体包括如下步骤:
16、(1)将化合物1溶于有机溶剂ⅰ,并加催化剂、三氟甲基试剂,在惰性气体保护下反应,得到反应液;
17、(2)向反应液中加入水,用有机溶剂ⅱ萃取,有机相合并,洗涤,干燥,减压旋干,得到目标化合物2;
18、所述化合物1为杂芳基碘化物。
19、进一步地,所述萃取是用有机溶剂ⅱ萃取,洗涤是用饱和食盐水洗涤,干燥是用无水硫酸盐进行干燥,减压旋干是采用低温减压旋干。
20、进一步地,所述无水硫酸盐包括但不限于无水硫酸钠,无水硫酸镁。
21、进一步地,步骤(1)中,所述有机溶剂ⅰ选自n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、二甲基亚砜、甲苯、丙酮、1,3-二甲基-2-咪唑啉酮、六甲基磷酰三胺、n-甲基吡咯烷酮中的一种或多种。
22、进一步地,步骤(1)中,所述化合物1、催化剂、三氟甲基试剂的摩尔比为1.0:(1.0~4.0):(1.0~6.0);所述化合物1与有机溶剂ⅰ的质量体积比g/ml为1:3~40。
23、进一步地,步骤(1)中,所述惰性气体选自氮气、氩气中的一种或多种;所述反应的温度为40~130℃,优选30~100℃,最优选70℃;所述反应的时间为1~30h,优选5~30h,最优选12h。
24、进一步地,步骤(2)中,所述加水是指加适量水,优选反应液与水的体积比为1:1-1:20;
25、进一步地,步骤(2)中,所述有机溶剂ⅱ选自乙酸乙酯、醋酸丁酯、氯仿、甲苯,二氯甲烷、二氯乙烷中的一种或多种。
26、本发明有益的技术效果在于:
27、本发明采用杂芳基碘代物作为原料,铜粉作为催化剂,三氟甲磺酸钠作为三氟甲基试剂,进行三氟甲基化反应,获得了杂芳基三氟甲基化合物。
28、本发明所述方法所用铜粉和三氟甲磺酸钠比较廉价,对于反应体系的水分要求不高,且反应操作简便,没有副产物产生,后处理简单,同时具有很好的底物兼容性,适合于工业上放大生产。一定程度上弥补了杂芳基的三氟甲基化的现有技术中,所用催化剂和三氟甲基试剂价格较为昂贵,对反应体系要求严格无水,有副产物产生,难以纯化,产率低,难以工业放大生产等一些缺点。
- 还没有人留言评论。精彩留言会获得点赞!