一种生物全合成紫杉醇前体物质巴卡亭III的方法、生物材料及应用
本技术涉及植物代谢生物学与合成生物学,具体涉及一种生物全合成紫杉醇关键前体物质巴卡亭iii的方法、生物材料及应用。
背景技术:
1、紫杉醇是来源于红豆杉植物的二萜生物碱化合物,结构式如式i所示。其在临床上已经广泛用于乳腺癌、卵巢癌和部分头颈癌、肺癌的治疗。目前一般采用半化学合成的方法生产紫杉醇,即首先通过从叶片中提取天然前体物质巴卡亭ⅲ(baccatinⅲ)或10-去乙酰巴卡亭ⅲ(10-deacetylbaccatinⅲ,10-dab),然后化学合成紫杉醇。
2、
3、自紫杉醇结构于1971年首次被发现以来,其生物合成途径的解析一直是天然产物研究领域的一个焦点。如图1所示,紫杉醇生物合成途径起始于异戊二烯基前体(ipp和dmapp)与ggpp线性偶联形成紫杉二烯。紫杉二烯经过一系列氧化、酰基化和环氧化形成关键中间体巴卡亭iii。巴卡亭iii最后与c13侧链结合生成紫杉醇。根据中间体结构推测,紫杉醇的合成需要经过约19步酶促反应,其中还有4个氧化酶和1个变位酶未被鉴定,分别是c9羟化酶(taxane9αhydroxylase,t9αh)、c9氧化酶(taxane 9αdioxygenase,t9αo)、c1羟化酶(taxane 1βhydroxylase,t1βh)、c4-c20环氧酶(c4β,c20-epoxidase,epox)和环氧变位酶(oxomutase,oxm)。由于c4-c20氧杂环形成与c9氧化的关键酶尚不清楚,导致无法生物合成紫杉醇中间体巴卡亭iii,并长期缺乏完整的紫杉醇生物合成途径。
技术实现思路
1、有鉴于此,本发明提供了一种生物全合成紫杉醇关键前体物质巴卡亭iii的方法、生物材料及应用。本技术成功鉴定了紫杉烷c4-c20氧杂环丁烷形成酶的基因(tot)和紫杉烷9α羟基化酶的基因(t9αh),鉴定了巴卡亭iii生物合成途径的核心成分,为通过合成生物学高效开发紫杉醇等紫杉烷类产品的绿色低碳生产途径开辟了道路。
2、为了实现上述发明目的,本发明提供以下技术方案:
3、第一方面,本发明提供了一种生物酶组合物,该生物酶组合物包括紫杉烷9α羟基化酶(t9αh),以及紫杉烷c4-c20氧杂环丁烷形成酶(tot);
4、t9αh的氨基酸序列包括如下(a1)~(a4)中的至少一种:
5、(a1)seq id no:1~14所示氨基酸序列中的至少一种;
6、(a2)seq id no:1~14所示氨基酸序列中的至少一种的n端和/或c端连接标签得到的融合氨基酸序列;
7、(a3)seq id no:1~14所示氨基酸序列中的至少一种经过一个或多个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的氨基酸序列;
8、(a4)与seq id no:1~14所示氨基酸序列中的至少一种具有至少60%同一性且具有相同功能的氨基酸序列;
9、tot的氨基酸序列包括如下(b1)~(b4)中的至少一种:
10、(b1)seq id no:29~52所示氨基酸序列中的至少一种;
11、(b2)seq id no:29~52所示氨基酸序列中的至少一种的n端和/或c端连接标签得到的融合氨基酸序列;
12、(b3)seq id no:29~52所示氨基酸序列中的至少一种经过一个或多个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的氨基酸序列;
13、(b4)与seq id no:29~52所示氨基酸序列中的至少一种具有至少60%同一性且具有相同功能的氨基酸序列。
14、上述(a4)或(b4)中,具有至少60%同一性的氨基酸序列示例性的为具有至少60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列。
15、本发明研究发现,在巴卡亭iii生物合成途径中,在紫杉二烯合成酶ts催化下,ggpp转化为紫杉二烯;随后,紫杉二烯被6个内质网相关的p450酶协同催化修饰,包括紫杉烷5α羟基化酶t5αh、紫杉烷2α羟基化酶t2αh、紫杉烷7β羟基化酶t7βh、紫杉烷9α羟基化酶t9αh、紫杉烷13α羟基化酶t13αh和紫杉烷c4-c20氧杂环丁烷形成酶tot,并在两种胞质酰基转移酶(紫杉烷5α乙酰基转移酶tat和紫杉烷2α-氧-苯甲酰基转移酶tbt)的催化下,最终转化为巴卡亭iii。
16、在本发明一实施方式中,当起始原料为牻牛儿基牻牛儿基焦磷酸(ggpp),合成巴卡亭iii时,本发明生物酶组合物还包括紫杉二烯合成酶(ts)、紫杉烷5α羟基化酶(t5αh)、紫杉烷13α羟基化酶(t13αh)、紫杉烷2α羟基化酶(t2αh)、紫杉烷7β羟基化酶(t7βh)、紫杉烷5α乙酰基转移酶(tat)、紫杉烷2α-氧-苯甲酰基转移酶(tbt)中的至少一种。
17、在一些实施方式中,上述多种生物酶的天然氨基酸序列可为来源于红豆杉属不同种和或不同株的变体序列。上述多种生物酶的人工氨基酸序列可为天然氨基酸序列通过适当修饰得到的变体序列,所述修饰包括但不限于不影响目标蛋白的生物活性的适当氨基酸取代/添加/缺失、n-端的氨基酸被截短、适用于宿主细胞偏好的密码子优化、标签的添加、融合等。
18、上述生物酶可为去除信号肽的生物酶,也可为包括信号肽的生物酶。
19、在本发明另一实施方式中,当起始原料为牻牛儿基牻牛儿基焦磷酸(ggpp),合成巴卡亭iii的下游产物紫杉醇时,除了上述t9αh、tot,以及除了ts、t5αh、t13αh、t2αh、t7βh、tat、tbt中的至少一种,生物酶组合物还包括苯丙氨酰coa连接酶(phenylalanoyl coaligase,pcl)、苯丙氨酸氨基变位酶(phenylalanine aminomutase,pam)、巴卡亭ⅲ3氨基3苯丙醇基转移酶(baccatinⅲ:3amino 3phenylpropanoyl transferase,bapt)、细胞色素p450羟化酶(t2′αh)、3′n去苯甲酰2′脱氧紫杉醇n苯甲酰基转移酶(3′n debenzoyl2′deoxytaxol n benzoyl transferase,dbtnpt)中的至少一种。
20、在本发明另一实施方式中,当起始原料为ggpp的前体物质异戊烯焦磷酸(ipp)和/或焦磷酸二甲基烯丙酯(dmapp),合成巴卡亭iii时,在本发明实施方式中,生物酶组合物还包括牻牛儿基牻牛儿基焦磷酸合成酶(ggpps)。合成ggpp的前体分子ipp和dmapp可由宿主细胞自身提供。
21、第二方面,本发明提供了编码上述生物酶组合物的核酸分子组合物,其包括编码t9αh的核酸分子和编码tot的核酸分子;
22、编码t9αh的核酸分子的核苷酸序列包括如下序列中的至少一种:
23、(c1)seq id no:15~28所示核苷酸序列中的至少一种;
24、(c2)seq id no:15~28所示核苷酸序列中的至少一种的互补序列、简并序列或同源序列,同源序列为与seq id no:15~28所示核苷酸序列具有至少75%同一性的核苷酸序列;具有至少75%同一性的核苷酸序列示例性的为具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的核苷酸序列。
25、(c3)在严格条件下与(c1)或(c2)所示的核苷酸序列杂交,且能够编码相同功能蛋白质的核苷酸序列;
26、编码tot的核酸分子的核苷酸序列包括如下序列中的至少一种:
27、(d1)seq id no:53~76所示核苷酸序列中的至少一种;
28、(d2)seq id no:53~76所示核苷酸序列中的至少一种的互补序列、简并序列或同源序列,同源序列为与seq id no:53~76所示核苷酸序列具有至少74%同一性的核苷酸序列;具有至少74%同一性的核苷酸序列示例性的为具有至少74%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的核苷酸序列。
29、(d3)在严格条件下与(d1)或(d2)所示的核苷酸序列杂交,且能够编码相同功能蛋白质的核苷酸序列。
30、在本发明一实施方式中,由ggpp合成巴卡亭iii时,上述核酸分子组合物还包括编码如下生物酶中的至少一种的核酸分子:紫杉二烯合成酶(ts)、紫杉烷5α羟基化酶(t5αh)、紫杉烷13α羟基化酶(t13αh)、紫杉烷2α羟基化酶(t2αh)、紫杉烷7β羟基化酶(t7βh)、紫杉烷5α乙酰基转移酶(tat)、紫杉烷2α-氧-苯甲酰基转移酶(tbt)。
31、在一些实施方式中,本发明相关核酸分子的天然核苷酸序列可为来源于红豆杉属不同种和或不同株的变体序列,其人工核苷酸序列可为天然核苷酸序列通过适当修饰得到的变体序列,所述修饰包括但不限于不影响目标蛋白的生物活性的适当核苷酸取代/添加/缺失、n-端氨基酸被截短、适用于宿主细胞偏好的密码子优化、标签的添加、融合等对应的核苷酸变体序列。
32、在本发明另一实施方式中,由ggpp合成巴卡亭iii的下游产物紫杉醇时,核酸分子组合物还包括编码苯丙氨酰coa连接酶(pcl)、苯丙氨酸氨基变位酶(pam)、巴卡亭ⅲ3氨基3苯丙醇基转移酶(bapt)、细胞色素p450羟化酶(t2′αh)、3′n去苯甲酰2′脱氧紫杉醇n苯甲酰基转移酶(dbtnpt)中的至少一种核酸分子。
33、在本发明实施方式中,由ggpp的前体物质ipp和/或dmapp合成巴卡亭iii时,核酸分子组合物还包括编码牻牛儿基牻牛儿基焦磷酸合成酶(ggpps)的核酸分子,和/或ipp异构酶。
34、本发明相关核酸分子可从多种来源获得。在一些实施方案中,部分核酸分子由宿主细胞自身提供,例如合成ggpp所需的核苷酸分子可由宿主细胞自身提供,合成紫杉二烯和或紫杉二烯5α-醇可由的已记载的转化宿主细胞提供,例如ajikumar pk,xiao wh,tyoke,et al.isoprenoid pathway optimization for taxol precursor overproductionin escherichia coli[j].science,2010,330(6000):70-74.;zhou k,qiao k,edgar s,etal.distributing a metabolic pathway among a microbial consortium enhancesproduction of natural products[j].nature biotechnology,2015,doi:10.1038/nbt.3095等中的相应记载。
35、任选的,所述核酸分子为合成的和/或分离的。
36、第三方面,本发明提供了一种生物材料,生物材料为下述(e1)~(e3)中的任一种:
37、(e1)含有上述核酸分子组合物的表达盒或其组合物;
38、(e2)含有上述核酸分子组合物或(e1)表达盒或其组合物的载体或其组合物;
39、(e3)含有上述核酸分子组合物、(e1)表达盒或其组合物、(e2)载体或其组合物中的至少一种的宿主细胞或其组合物。
40、在本发明一实施方式中,生物材料为表达盒或其组合物。
41、在本发明实施方式中,核酸分子组合物包括编码t9αh和tot两种生物酶的核酸分子时,可将其制备成一个表达盒,在一个表达盒表达t9αh基因和tot基因,也可将其制备成多个表达盒组成的组合物,在两个表达盒分别表达t9αh基因和tot基因。
42、在本发明实施方式中,核酸分子组合物包括编码t9αh和tot两种生物酶的核酸分子,还包括编码ts、t5αh、t13αh、t2αh、t7βh、tat、tbt中的至少一种的核酸分子时,可将其制备成一个表达盒,在一个表达盒中表达所有核酸分子;也可将其制备成多个表达盒组成的组合物,在多个表达盒中表达所有核酸分子,一个表达盒中表达一种或多种核酸分子,只要能够实现所有核酸分子的共表达即可。
43、在本发明实施方式中,表达盒还包括调控元件,调控元件包括启动子、增强子、前导序列、转座子、终止子、标记基因中的至少一种。
44、在本发明实施方式中,表达盒包括天然启动子和/或异源启动子。
45、在本发明实施方式中,可操作连接的异源启动子的选择可取决于许多因素,诸如例如期望的时间安排、定位和表达模式以及对特定生物或非生物刺激的响应性。异源启动子包括但不限于诱导型启动子、组成型启动子、组织特异性启动子、伤口可诱导的启动子和化学调节的启动子等。例如trc、t5、tac、t7、t7lac、sp6、arabad、trp、lac、ptac、pl、t3、gal1、gal10、met17、cup1、aox1、polyhedrin、cmv、ef1a、efs、cag、pgk1、cbh、sffv、mscv、sv40、mpgk、hpgk、ubc、human beta actin、actin、camv35s、tef1、gpd、gds、ubi、adh1、gap、actin5c、polyubiquitin、a1tubulin、tre、tre3g、uas、ac5等。
46、在本发明实施方式中,表达盒还包括(a)-(d)中酶的修饰核酸序列的表达盒,其中,修饰可以为增加5'前导序列,增强序列翻译表达的作用;修饰还可以为增加调控元件,或者对启动子修饰等。
47、基因表达所需调控序列的确切性质在物种或细胞类型之间可能会有所不同,但一般按需要应包括转录和翻译起始的5'非转录和5'非翻译序列,例如tata盒、加帽序列、caat序列等等。尤其是,这种5'非转录调控序列将包括启动子区域,其包括控制对有效连接的基因进行转录控制的启动子序列。调控序列也可包括增强子序列或所需的上游激活子序列。本发明表达盒可任选地包括5'前导或信号序列。
48、在本发明实施方式中,核酸分子的表达可通过操作基因或操纵子在细胞中的拷贝数来调节。
49、在一些实施方案中,核酸分子的表达可通过操作模块内核酸分子的顺序来调节。
50、在一些实施方案中,核酸分子的表达通过将一个或更多个核酸分子或操纵子整合到染色体上来调节。
51、在本发明另一实施方式中,生物材料为载体或其组合物。
52、在一些实施方案中,一个或更多个本发明相关的核酸分子在表达载体中表达。本文所用的“载体”可是大量核酸中的任何一种,其中可通过限制性酶切和连接来插入所需的一个或更多个序列,以便在不同的遗传环境中运送或在宿主细胞中表达。载体通常是由dna组成,也可由rna组成。
53、在本发明实施方式中,载体包括质粒、叶绿体、病毒载体、噬菌体、噬菌粒、黏粒、f黏粒、细菌噬菌体或人工染色体,并且任选地,病毒载体包括腺病毒载体、反转录病毒载体或腺相关病毒载体,并且任选地,载体包括细菌人工染色体(bac)、质粒、细菌噬菌体p1-衍生的载体(pac)、酵母人工染色体(yac)或哺乳动物人工染色体(mac)。例如载体包括pfastbac1、pyes2、pyes2.1、pesc-ura、pesc-trp、pesc-leu、pesc-his、pgex2t、ptaex3、pusa、pymb0、pht43、pet28b、pij702、pucp19、pymb03、pht43、peaq等。
54、克隆载体能自主复制或整合在宿主细胞基因组中,其还以一个或更多个限制性内切酶位点为特征,可以在该位点以确定的方式切割载体并可将期望的dna序列连接到载体中,从而新的质粒保留了它在宿主细胞中复制的能力。在质粒的情况下,期望序列的复制可随着质粒在宿主细胞(如细菌宿主)中的拷贝数增加而多次发生,或仅在宿主通过有丝分裂繁殖前在每个宿主中发生一次。在噬菌体的情况下,复制可在裂解期过程中主动发生或在溶原期过程中被动发生。
55、表达载体可通过限制性酶切和连接将期望的dna序列插入其中,以使其与调控序列有效连接中并可表达为rna转录本。载体还可包含适合用于鉴定细胞是否已被载体转化或转染的一种或更多种标记序列。标记包括如编码提高或降低其对抗生素或其他化合物之抗性或敏感性的蛋白质的基因,编码可通过本领域已知标准方法检测活性的酶的基因(例如β-半乳糖苷酶、萤光素酶或碱性磷酸酶),以及对转化或转染细胞、宿主、菌落或菌斑的表型有可见影响的基因(例如绿色荧光蛋白)。优选的载体是能够自主复制和表达与其有效连接的dna片段中所存在的结构基因产物的载体。
56、在一些实施方案中,可将本发明的核酸分子组合物稳定地整合到宿主细胞的基因组(包括叶绿体基因组)中。
57、在另一些实施方案中,通过显微注射、微粒轰击、病毒载体侵染等方式,或者通过喷雾、灌溉、撒粉等向植物或其部分施用经修饰的病毒和/或经修饰的病毒核酸,将核酸分子不是稳定地整合到宿主细胞的基因组中,使宿主或宿主细胞瞬时表达目的基因。
58、在本发明实施方式中,核酸分子组合物包括编码t9αh和tot两种生物酶的核酸分子时,可将其制备成一个载体,在一个载体表达t9αh核酸分子和tot核酸分子,也可将其制备成多个载体组成的组合物,在两个载体分别表达t9αh核酸分子和tot核酸分子。
59、在本发明实施方式中,核酸分子组合物包括编码t9αh和tot两种生物酶的核酸分子,还包括编码ts、t5αh、t13αh、t2αh、t7βh、tat、tbt中的至少一种核酸分子时,可将其制备成一个载体,在一个载体中表达所有核酸分子;也可将其制备成多个载体组成的组合物,在多个载体中表达所有核酸分子,一个载体中表达一种或多种核酸分子,只要能够实现所有核酸分子的共表达即可。
60、在本发明实施方式中,载体或其组合物中还包括编码苯丙氨酰coa连接酶(pcl)、苯丙氨酸氨基变位酶(pam)、巴卡亭ⅲ3氨基3苯丙醇基转移酶(bapt)、细胞色素p450羟化酶(t2′αh)、3′n去苯甲酰2′脱氧紫杉醇n苯甲酰基转移酶(dbtnpt)等侧链酯化相关核酸分子中的至少一种。
61、在本发明实施方式中,载体或其组合物中还包括编码牻牛儿基牻牛儿基焦磷酸合成酶(ggpps)的核酸分子。
62、在本发明实施方式中,载体还包括转录调控因子。例如转录调控因子包括tcwrky1、tcwrky2、tcwrky6、tcwrky8、tcwrky47、tcmyc2a等等。
63、在本发明另一实施方式中,生物材料为宿主细胞或其组合物。
64、任选的,宿主细胞包括微生物细胞、植物细胞、动物细胞、藻类细胞中的至少一种。
65、在本发明实施方式中,所述宿主细胞为微生物。
66、在本发明实施方式中,微生物包括细菌和/或真菌。
67、在本发明实施方式中,所述宿主细胞组合物包括但不限于细菌之间、真菌之间、细菌和真菌之间的组合。例如大肠杆菌和酵母的组合。不同宿主细胞组成的组合物可以通过共培养、多段培养等方式实现本发明目的。
68、在本发明实施方式中,细菌包括但不限于埃希氏菌属细胞、乳杆菌属细胞、乳球菌属细胞、棒杆菌属细菌、醋杆菌属细菌、不动杆菌属细菌、假单胞菌属细胞、链霉菌属细胞、芽孢杆菌属细胞、葡萄球菌属细胞、农杆菌属细胞、红豆杉内生菌。例如大肠杆菌、枯草芽孢杆菌、根癌农杆菌、发根农杆菌、乳酸乳球菌、蜡状芽孢杆菌、荧光假单胞菌等等。在一些实施方案中,细菌细胞例如埃希氏菌(escherichia spp.)、链霉菌(streptomyces spp.)、zymonas spp.、醋酸菌(acetobacter spp.)、柠檬酸菌(citrobacter spp.)、synechocystis spp.、根瘤菌(rhizobium spp.)、梭状芽孢杆菌(clostridium spp.)、棒状杆菌(corynebacteriumspp.)、链球菌(streptococcus spp.)、黄单胞菌(xanthomonasspp.)、乳杆菌(lactobacillus spp.)、乳球菌(lactococcus spp.)、芽孢杆菌(bacillusspp.)、产碱杆菌(alcaligenes spp.)、假单胞菌(pseudomonas spp.)、气单胞菌(aeromonasspp.)、固氮菌(azotobacter spp.)、丛毛单胞菌(comamonas spp.)、结核分枝杆菌(mycobacterium spp.)、红球菌(rhodococcus spp.)、葡糖杆菌(gluconobacterspp.)、雷尔氏菌(ralstonia spp.)、硫杆菌(acidithiobacillus spp.)、microlunatusspp.、地杆菌(geobacter spp.)、地芽孢杆菌(geobacillus spp.)、节杆菌(arthrobacterspp.)、黄杆菌(flavobacterium spp.)、沙雷氏菌(serratia spp.)、糖多孢菌(saccharopolyspora spp.)、栖热菌(thermus spp.)、寡养单胞菌(stenotrophomonasspp)、色杆菌(chromobacterium spp)、中华根瘤菌(sinorhizobiumspp)、糖多孢菌(saccharopolyspora spp)、农杆菌(agrobacterium spp)和泛菌(pantoeaspp)。细菌细胞可是革兰氏阴性细胞,如大肠杆菌(e.coli)细胞,或革兰氏阳性细胞,如芽孢杆菌种。
69、在本发明实施方式中,真菌包括但不限于酵母、丝状真菌或蘑菇。
70、在本发明具体实施方式中,酵母包括但不限于酿酒酵母、粟酒裂殖酵母、解脂耶氏酵母、产朊假丝酵母、巴斯德毕赤酵母、乳酸克鲁维酵母、多形汉逊酵母、博伊丁假丝酵母、解腺嘌呤阿氏酵母、红发夫酵母、白假丝酵母菌。酵母细胞例如为酵母菌(saccharomycesspp.)、裂殖酵母(schizosaccharomyces spp.)、毕赤酵母(pichia spp.)、paffia spp.、克鲁维酵母(kluyveromyces spp.)、念珠菌(candida spp.)、蓝状菌(talaromyces spp.)、酒香酵母(brettanomycesspp.)、管囊酵母(pachysolen spp.)、德巴利酵母(debaryomycesspp.)、耶氏酵母(yarrowia spp.)和工业上的多倍体酵母菌株。优选地,酵母菌株是酿酒酵母(s.cerevisiae)菌株或耶氏酵母菌株。
71、在本发明具体实施方式中,丝状真菌包括但不限于红曲菌、米曲霉、黑曲霉、黄曲霉、青霉。真菌例如为曲霉(aspergillusspp.)、青霉(pennicilium spp.)、镰孢菌(fusarium spp.)、根霉(rhizopus spp.)、顶孢霉(acremonium spp.)、脉孢霉(neurosporaspp.)、粪壳菌(sordaria spp.)、稻瘟病菌(magnaporthe spp.)、异水霉(allomycesspp.)、黑粉菌(ustilago spp.)、葡萄孢霉(botrytisspp.)和木霉(trichoderma spp)。
72、在本发明实施方式中,所述宿主细胞为植物细胞。
73、在本发明具体实施方式中,植物细胞包括但不限于烟草细胞、白豆杉细胞、青蒿细胞、拟南芥细胞、小立碗藓细胞、地钱细胞、番茄细胞、人参细胞、棉花细胞、甘蔗细胞、马铃薯细胞、玉米细胞、小麦细胞、水稻细胞、萝卜细胞、莴苣细胞等,所述细胞包括原生质体、悬浮细胞等。
74、在本发明实施方式中,所述宿主细胞为动物细胞。
75、在本发明实施方式中,动物细胞包括昆虫细胞、哺乳动物细胞、线虫细胞、鱼类细胞。
76、在本发明具体实施方式中,昆虫细胞包括但不限于s2果蝇细胞或sf9细胞。
77、在本发明具体实施方式中,哺乳动物细胞包括但不限于成纤维细胞、淋巴细胞、上皮细胞、成髓细胞。例如hek293细胞、cho细胞、cos细胞、bhk细胞、海拉细胞、中国仓鼠卵巢细胞、vero细胞、sp2/0细胞、ns/0骨髓瘤细胞、小仓鼠肾细胞、人b细胞、人t细胞jurkat、神经元细胞、cv-i/ebna细胞、l细胞、3t3细胞、hepg2细胞、mdck细胞。
78、在本发明具体实施方式中,鱼类细胞包括但不限于斑马鱼细胞。
79、在本发明的实施方式中,植物细胞和/或动物细胞包括非生物性转换(non-biologically transformed)的重组植物细胞和/或重组动物细胞。
80、任选的,植物细胞或动物细胞可通过细胞培养方式表达生物酶、生产目标产物。
81、在本发明实施方式中,所述宿主细胞为藻类细胞。
82、在本发明实施方式中,藻类细胞包括但不限于蓝藻(蓝细菌)、绿藻、聚球藻、细长聚球藻、集胞藻、鱼腥藻、衣藻、莱茵衣藻中的至少一种。
83、本发明还提供了一种用于产生宿主细胞的方法,该方法包括用上述核酸分子、生物材料中的表达盒或载体中的至少一种转化宿主细胞。
84、本发明提供了一种用于产生植物或植物细胞的方法,该方法包括用上述核酸分子、生物材料中的表达盒或载体中的至少一种转化植物或植物细胞。
85、第四方面,本发明提供了一种产生上述生物酶组合物的方法,将本发明的核酸分子组合物,或生物材料中的表达盒或其组合物、载体或其组合物中的至少一种,转化宿主细胞中,使宿主细胞产生生物酶组合物。
86、在本发明的实施方式中,所述宿主细胞包括微生物细胞、植物细胞、动物细胞和/或藻类细胞。
87、在上述方法中,将核酸分子、表达盒、载体转化宿主细胞的方法包括但不限于农杆菌介导的转化、基因枪转化、电穿孔、聚乙二醇(peg)转化、脂质转染、热休克、磷酸钙沉淀、病毒介导、显微注射、基因工程编辑技术。宿主细胞包括微生物、植物细胞、动物细胞和/或藻类细胞。
88、在本发明具体实施方式中,产生生物酶组合物的方法例如为:(1)构建包含本发明核酸分子组合物的载体;(2)将所得的载体转化宿主细胞(包括微生物细胞、植物细胞、动物细胞、藻类细胞等);(3)将所得的宿主细胞进行培养,使基因共表达生成巴卡亭iii。
89、在本发明具体实施方式中,在产生生物酶组合物的方法中,当在多个载体中表达核酸分子,载体包括表达至少两种核酸分子的载体,包含多个核酸分子的载体的构建可采用多元模块工程技术(multivariate modular metabolic engineering,mmme)进行构建。
90、在一些实施方案中,本发明相关的一个或更多个核酸分子在细菌细胞中重组表达。本发明的细菌细胞可培养在任何类型(丰富或基本)和任何组成的培养基中。本领域普通技术人员将可以理解,常规优化将允许使用多种类型的培养基。选定的培养基可补充多种额外组分。补充组分的一些非限定性实例包括葡萄糖、抗生素、用于基因诱导的iptg、atcc微量矿物质补充剂和乙醇酸。同样,培养基的其他方面和本发明细胞的生长条件可通过常规实验来优化。例如,ph和温度是可优化因素的非限定性实例。在一些实施方案中,如培养基选择、培养基补充和温度等因素可影响巴卡亭iii、紫杉醇等紫杉烷类产品的生产水平。在一些实施方案中,可优化补充性组分的浓度和量。在一些实施方案中,优化了用一种或更多种补充性组分来补充培养基的频率和在收获萜类化合物如紫杉二烯之前培养基的培养时间。
91、用于本发明相关细胞生长的液体培养物可储于任何本领域已知和使用的培养容器中。在一些实施方案中,通气反应容器(如搅拌反应釜)中的大规模生产可用于产生大量的紫杉烷类产品,其可从细胞培养物中回收。在一些实施方案中,紫杉烷类产品是从细胞培养物的气相中回收的,例如通过向细胞培养物中加入有机层如十二烷并从有机层中回收紫杉烷类产品。
92、第五方面,本发明提供了本发明生物酶组合物、核酸分子组合物、生物材料中的任一种在合成巴卡亭iii和/或其中间体中的应用。
93、在本发明实施方式中,巴卡亭iii中间体包括如式ii和/或式iii所示的化合物:
94、
95、其中,r1、r3、r4各自独立地选自h、-oh、-oac;r2、r6选自h、-oh、-oac、-obz;r5、r7选自h、-oh、=o、-oac。
96、在本发明实施方式中,巴卡亭ⅲ还包括巴卡亭ⅲ衍生物。
97、第六方面,本发明提供了一种合成巴卡亭iii和/或其中间体的方法,以巴卡亭iii和/或其中间体的前体物质为底物,在本发明生物酶组合物或上述方法产生的生物酶组合物的作用下,催化紫杉烷环骨架c9位羟基化,以及催化紫杉烷环骨架c4-c20氧杂环丁烷的形成,合成巴卡亭iii和/或其中间体;
98、和/或,
99、将本发明核酸分子组合物、生物材料(e1)~(e2)中的任一种转化宿主细胞,使宿主细胞产生生物酶组合物;宿主细胞包括微生物细胞、植物细胞、动物细胞、藻类细胞中的至少一种;以巴卡亭iii和/或其中间体的前体物质为底物,在产生的生物酶组合物的作用下,催化紫杉烷环骨架c9位羟基化,以及催化紫杉烷环骨架c4-c20氧杂环丁烷的形成,合成巴卡亭iii和/或其中间体。
100、在本发明实施方式中,合成巴卡亭iii和/或其中间体的方法中还包括如下(f1)~(f3)反应中的任一种:
101、(f1)紫杉烷环骨架c1、c2、c5、c7、c10、c13中的至少一个碳位的羟基化;
102、(f2)c2、c5、c10中的至少一个羟基的酰基化;
103、(f3)c9位羟基的酮基化。
104、在本发明实施方式中,宿主细胞为微生物细胞,合成巴卡亭iii和/或其中间体的方法还包括发酵培养的步骤。
105、在本发明实施方式中,宿主细胞为植物细胞或动物细胞,合成巴卡亭iii和/或其中间体的方法还包括细胞培养的步骤。
106、任选的,所述培养的方法包括固定化细胞培养、两段培养、两相培养、添加诱导物(例如水杨酸、硝酸银、茉莉酸甲酯、花生四烯酸、柠檬酸铵等)、添加旁路抑制剂(例如矮壮素)、添加底物(ggpp、紫杉二烯和/或其他巴卡亭iii中间体)等。
107、在本发明实施方式中,宿主细胞为植物细胞,合成巴卡亭iii和/或其中间体的方法还包括种植植物、收获植物、提取产物的步骤。
108、在本发明实施方式中,合成巴卡亭iii的方法包括以紫杉二烯为底物,至少在6个p450酶(即t2αh、t5αh、t7βh、t9αh、t13αh和tot)以及两种胞质酰基转移酶(tat和tbt)的作用下,合成巴卡亭iii。
109、在本发明的具体实施方式中,所述底物紫杉二烯在ts酶的作用下合成。
110、第七方面,本发明提供了本发明生物酶组合物、核酸分子组合物、生物材料中的任一种在合成紫杉烷类化合物和/或其中间体中的应用。
111、第八方面,本发明提供了一种合成紫杉烷类化合物和/或其中间体的方法,包括如下步骤:
112、采用前述的方法合成巴卡亭iii;
113、以巴卡亭iii为底物,进一步催化合成紫杉烷类化合物和/或其中间体。
114、在上述合成巴卡亭iii、紫杉烷类化合物和/或其中间体的方法中,还包括优化步骤。优化步骤包括如下优化方式中的至少一种:
115、基因表达优化:例如密码子优化、转录调控因子优化、启动子优化、融合蛋白优化等。密码子优化(包括鉴定多种生物的最佳密码子,以及实现密码子优化的方法)是本领域普通技术人员熟知的,而且可使用标准方法来完成。转录调控因子orca3基因是一个受meja诱导的调控植物基础和次生代谢的转录调控因子。基因表达的优化也可通过选择合适的启动子和核糖体结合位点来实现。在一些实施方案中,这可包括选择高拷贝数的质粒,或者低或中等拷贝数的质粒。也可以靶向转录终止的步骤来调节基因表达,这通过引入或消除诸如茎环的结构来实现。
116、代谢工程优化:例如通过克服限速步骤、减少流向竞争途径的代谢流、降低分解代谢、以及过量表达调节基因等一些通过代谢工程来增加次级代谢物产量的方法;
117、调节因子优化:添加meja及其类似物、水杨酸、花生四烯酸、冠菌素等调节生物合成;
118、培养方法优化:例如改善培养基、调节培养温度时间等环境因素、优化培养流程、组合培养等;例如zhou k等给出了大肠杆菌和酵母共培养的培养实例(zhou,k.,qiao,k.,edgar,s.,and stephanopoulos,g.(2015).distributing a metabolic pathway among amicrobial consortium enhances production of natural products.nat biotechnol33,377-383.)。
119、在本发明实施方式中,紫杉烷类化合物包括但不限于紫杉醇及其衍生物、紫杉素及其衍生物、多西他赛及其衍生物、卡巴他赛及其衍生物中的至少一种。
120、在本发明实施方式中,紫杉烷类化合物中间体包括但不限于β-苯丙氨酰巴卡亭iii(β-phenylalanoyl baccatin iii)、3’-氮-脱苯甲酰基紫杉醇(3′-n-debenzoyltaxol)。
121、第九方面,本发明提供了一种植物或其植物部分,植物为如下植物之一:
122、(g1)上述植物细胞生长形成的植物;
123、(g2)采用上述在植物中产生生物酶组合物的方法生产获得的植物;
124、(g3)所述(g1)-(g2)中任一植物自交所形成的后代,以及后代生长形成的植物;
125、(g4)所述(g1)-(g2)中任一植物与其它品种杂交所形成的后代,以及后代生长形成的植物;
126、上述植物部分为根、茎、叶、花、果实、花粉或种子。
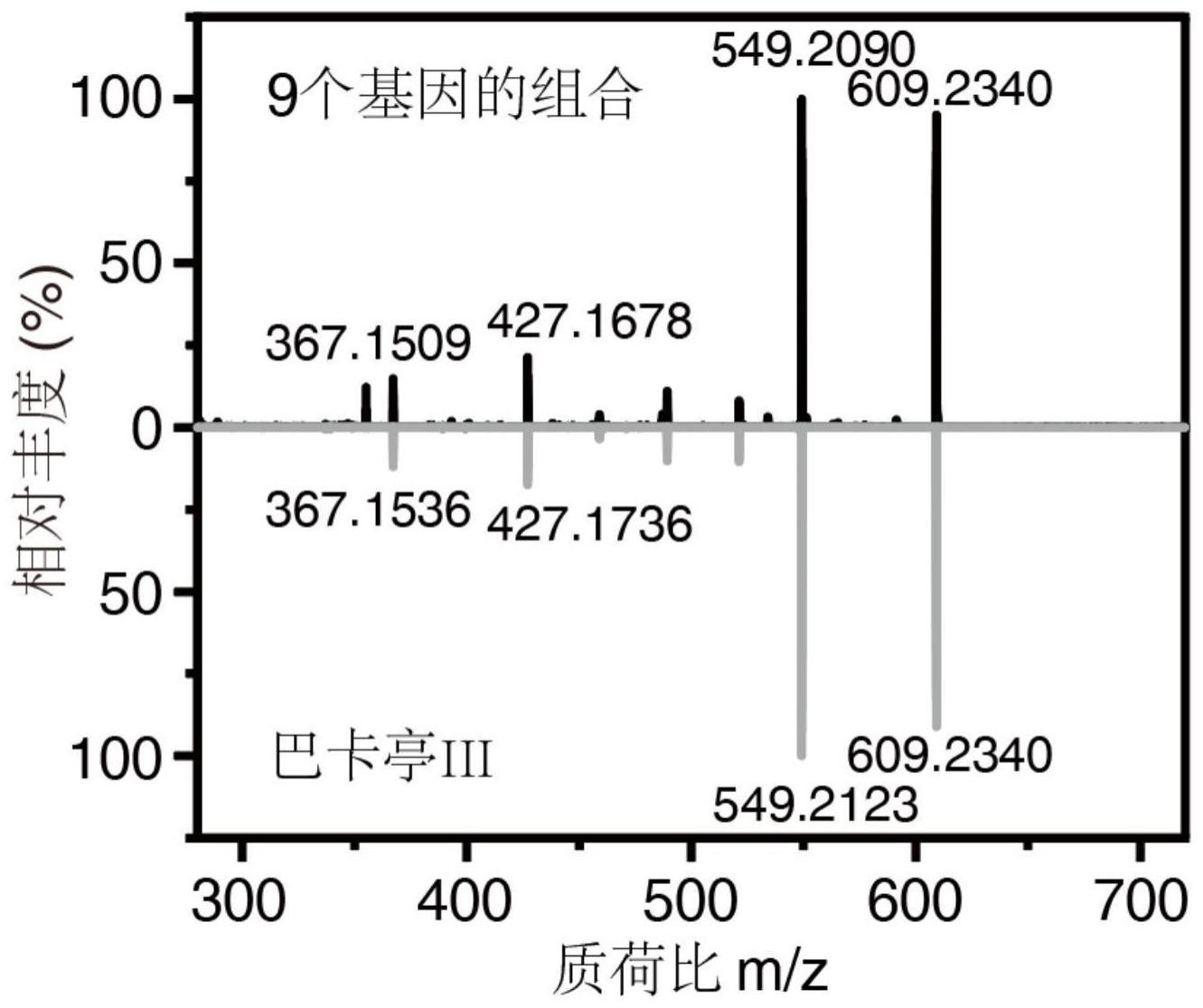
127、第十方面,本发明提供了一种植物或其植物部分,植物包括含有上述核酸分子组合物的转基因植物。
128、第十一方面,本发明还提供了植物或其植物部分的制备方法,该制备方法包括组织培养和/或诱导培养的步骤。
129、第十二方面,本发明还提供了一种制造商业产品的方法,其包括获得第九和第十方面中任一项所述的植物或其植物部分,及由所述植物或其植物部分制造所述商业产品,其中所述商业产品是选自由以下组成的群组:含有巴卡亭iii及其衍生物、紫杉醇及其衍生物、紫杉素及其衍生物、多西他赛及其衍生物、卡巴他赛及其衍生物中的至少一种的粗提物、原料药和/或药品制剂。
130、第十三方面,本发明还提供第六、第八和第十二方面中任一项方法生产获得的产品,其中所述产品含有以下成分:巴卡亭iii及其衍生物、紫杉醇及其衍生物、紫杉素及其衍生物、多西他赛及其衍生物、卡巴他赛及其衍生物中的至少一种。
131、与现有技术相比,本发明具有的有益效果为:
132、本技术成功鉴定了巴卡亭iii合成的两个必需基因——紫杉烷c4-c20氧杂环丁烷形成酶的基因(tot)和紫杉烷9α羟基化酶的基因(t9αh)。其中,tot具有前人推测的c4-c20环氧酶(c4β,c20-epoxidase,epox)和环氧变位酶(oxomutase,oxm)两个酶的作用,能够催化紫杉烷类分子的碳碳双键氧化为氧杂环丁烷和氧杂环丙烷。
133、进一步地,本技术将tot、t9αh这两个新基因和参与巴卡亭iii生物合成的其他已知基因(ts、t5αh、t13αh、t2αh、t7βh、tat和tbt)共表达,惊喜地发现,9个基因即能够成功重建巴卡亭iii在烟草中从ggpp到巴卡亭iii的生物合成途径。结果表明,这9种酶是从ggpp到巴卡亭iii生物合成的核心成分,包括紫杉二烯合成酶(ts)、2种酰基转移酶和6种cyp450酶。前人推测的c9氧化酶(t9αo)、c1羟化酶(t1βh)可能由本技术基因组合中的其他酶代为行使功能。本技术的研究结果揭示了一种前所未有的氧化重排反应机制,鉴定了巴卡亭iii生物合成途径的核心成分,构建了巴卡亭iii人工合成线路。
134、进一步地,现有技术中一直被认为是巴卡亭iii生物合成的必要基因t10βh、10-去乙酰巴卡亭iii-10-β-o-乙酰转移酶(dbat),在本技术巴卡亭iii生物合成方法中,在没有这两种酶的情况下,巴卡亭iii仍然能够被合成。本发明研究表明,t10βh和dbat并不是必要的,可能也由本技术基因组合中的其他酶代为行使功能。
135、更进一步地,通过成功构建烟草中巴卡亭iii的完整生物合成途径,揭示了紫杉醇生物合成中新的酶学机制,填补了其完整的生物合成途径的关键空白,为通过合成生物学高效开发紫杉醇等紫杉烷类产品绿色低碳生产途径开辟了道路。
- 还没有人留言评论。精彩留言会获得点赞!