一种非天然抗人CD45RA鼠源性嵌合抗原受体的制备及用途
本发明属生物技术,主要涉及一种非天然抗人cd45ra鼠源性嵌合抗原受体的制备及用途,是一种新颖的,非天然鼠抗人白细胞膜抗原cd45ra新靶点的嵌合抗原受体(murinechimeric antigen receptor,简称car)基因(mu3a4-car)的设计制备及其在制备cd45ra-car基因修饰t细胞(mucd45ra-car-t细胞)靶向治疗血液系统恶性肿瘤药物制剂中的用途。
背景技术:
1、白血病是一种最常见的血液系统恶性肿瘤,根据2011年至2015年在美国收集的数据,白血病发病率表明每年每10万名男性和女性中有13.8例新病例和6.7例白血病相关死亡。近几十年随着采用多种化疗药物、危险度分层化疗方案的应用,造血干细胞移植的实施,白血病的预后有了显著的改善,但是白血病的复发及耐药仍然是临床治疗的难题。据报道,目前仍有20%的儿童急性淋巴细胞白血病(acute lymphoblastic leukemia,all)患者面临复发的问题,而成人all的整体生存率只有30%-40%,复发耐药的病例缺乏有效的备选药物,给临床治疗带来了极大的困难。
2、近年来随着分子生物学及抗体工程技术的进步,仅杀伤肿瘤细胞而不损伤正常细胞的白血病靶向治疗得到了广泛的关注和发展。其中car-t细胞疗法是代表之一。其靶向治疗作用是对自体或异体t细胞进行嵌合抗原受体(car)基因设计构建成一个具有识别带有特定抗原靶点的car基因,通过各种生物转染技术安装到人t细胞中,使之持续表达car融合蛋白在t细胞表面,制成car-t细胞制剂,再通过输注car-t细胞用于选择性靶向杀伤具有抗原靶点的肿瘤而发挥临床治疗作用。car基因是人工构建的融合蛋白基因,其包含抗原识别结构域和t细胞信号传导结构域。经基因工程改造以表达car的t细胞可特异性识别抗原和消除恶性肿瘤。car-t疗法结合了car抗体靶向识别抗原的特异性和t细胞的强效杀伤效应机制,以主要组织相容性复合物非依赖性方式消除肿瘤。不同识别结构域的car具有不同的靶向性,如cd19car主要靶向b细胞系统的细胞,cd33car则主要是靶向髓细胞系统的细胞。可见,car基因结构中识别结构域(通常用抗体结构中单链抗体即scfv的识别特性决定)决定了一个car基因的靶向治疗用途。近年来,cd19car-t细胞靶向治疗b系肿瘤已经证明可取得持续的疾病缓解和生存时间的延长,这也为car-t细胞给儿童复发难治性aml的治疗带来新的希望。但与b细胞恶性肿瘤相比,该疗法在治疗aml的临床试验结果则明显差于all,最具挑战性的任务是如何选择理想的靶标分子。通常,存在于aml细胞膜上的靶向抗原在正常髓细胞表面也有高表达,因此,这种car-t细胞的应用在治疗复发难治性aml的同时,也会导致严重的中性粒细胞减少而引起容易招来严重的细菌感染,从而会对患者的健康造成破坏性影响。少有aml靶点被批准用于临床治疗,到目前为止,仅cd123car被美国fda批准用于复发难治性aml的临床治疗,而其他靶点包括cd33,cd45,flt3,lewis-y和cll-1的car仍在进行治疗试验,但效果大多不良。在car-t细胞治疗研究中,至关重要的问题是确定特异性强的靶点,在提高car-t细胞对肿瘤细胞的靶向杀伤的同时,尽量减少对正常组织细胞的毒副作用。
3、cd45是白细胞共同抗原,是造血细胞特异性酪氨酸磷酸酶。cd45在造血系统的所有有核白细胞膜上表达,而在红细胞系统、巨核细胞系统细胞、造血干细胞及其它实体组织细胞上不表达。cd45抗原分子中的三个外显子4(a),5(b)和6(c)的选择性剪接可产生多种变构体。为了证实cd45类抗体及其靶点能否用于临床病人的治疗,peter kletting为了获得在不同饱和度条件下111in标记的抗cd45单抗的生物学分布,用预加载和无预加载两个测量系列对5位患者进行了测定,生物学分布检测表明红骨髓中的浓度明显高于肝脏等重要组织,最佳的预加载将骨髓超肝选择性提高了3.9倍(kletting p,kull t,bunjes d,luster m,reske sn,glatting g.optimal preloading in radioimmunotherapy withanti-cd45 antibody.medical physics.2011;38(5):2572-2578.).目前国际上已经采用放射性核素标记的cd45抗体用于造血干细胞移植前的预处理。pagel jm在临床试验中,对58例晚期aml或者高危骨髓增生异常综合征的患者,在同种异体造血干细胞移植前预处理方案中采用131i-抗cd45抗体联合氟达拉滨和2gy全身照射治疗,所有患者获完全缓解(pagel jm,gooley ta,rajendran j,et al.allogeneic hematopoietic celltransplantation after conditioning with 131i-anti-cd45 antibody plusfludarabine and low-dose total body irradiation for elderly patients withadvanced acute myeloid leukemia or high-risk myelodysplasticsyndrome.blood.2009,114(27):5444-5453.),说明cd45类抗体可以在人体中应用而对人体其他组织细胞没有产生临床不可接受的毒副作用。但是,由于普通cd45抗体与造血组织的反应性过于广泛,特别是其在所有t、b、粒细胞、单核细胞、nk细胞、dc细胞表面均有表达,cd45类抗体一般不能常规用于靶向治疗白血病,以免导致严重的细胞免疫缺陷或嗜中性粒细胞缺乏而招致严重的细菌和/或病毒感染(michelle l.hermiston1,zheng xu,etal.cd45:a critical regulator of signaling thresholds in immunecells.annu.rev.immunol.2003,21:107–137)。
4、cd45ra是cd45分子的一种变构体,在初始t细胞、b细胞、部分粒细胞、部分单核细胞表面表达,而在活化t细胞、记忆t细胞、成熟红细胞和血小板及机体实质器官组织细胞上不表达,因此不会导致贫血和血小板减少及其它实体组织细胞的损伤(li s,tang y,zhangj,et al.3a4,a new potential target for b and myeloid lineage leukemias[j].jdrug target,2011,19(9):797-804.)。耐药性白血病干细胞(lsc)被认为是急性髓细胞性白血病(aml)治疗后复发的原因。cd45ra在大多数aml患者的白血病细胞中表达,cd45ra是aml-lsc细胞亚群的特异性标志物(kersten b,valkering m,wouters r,et al.cd45ra,aspecific marker for leukaemia stem cell sub-populations in acute myeloidleukaemia.british journal of haematology.2016,173(2):219-235.)。抗cd45ra单克隆抗体通过其效应子功能和凋亡诱导作用,可以有效靶向aml癌细胞(habibi-anbouhi m,kafi z,ghazizadeh l,et al.cytotoxicity assessment and apoptosis-related geneprofiling of antibody treated acute myeloid leukemia(aml)and acutelymphocytic leukemia(all)cancerous cell lines.iranian journal of allergy,asthma,and immunology.2019;18(6):679-687.)。cd45ra对已经受过抗原刺激并使机体对已接触过的抗原建立了免疫活性的记忆t细胞亚群(cd45ro+)细胞不反应,仅与未受刺激过的t细胞亚群(t)反应(tchilian ez,beverley pc.altered cd45 expression anddisease.trends in immunology.2006;27(3):146-153.),所以,采用cd45ra作为分子靶向杀伤或治疗时,应该不会破坏机体业已建立的细胞免疫功能,而t细胞因受cd45ra抗体清除,机体会失去部分细胞免疫反应,但待治疗结束后,正常造血干细胞能产生后备的t细胞可以弥补这种暂时性细胞免疫功能低下。至于b细胞上有cd45ra高表达,可以通过输注丙种球蛋白来弥补体液免疫功能低下。因此,cd45ra应该是一种较为理想的靶向杀伤白血病细胞的靶点,开发针对cd45ra抗原的car-t细胞将有可能为白血病临床治疗提供新的靶向治疗制剂。
技术实现思路
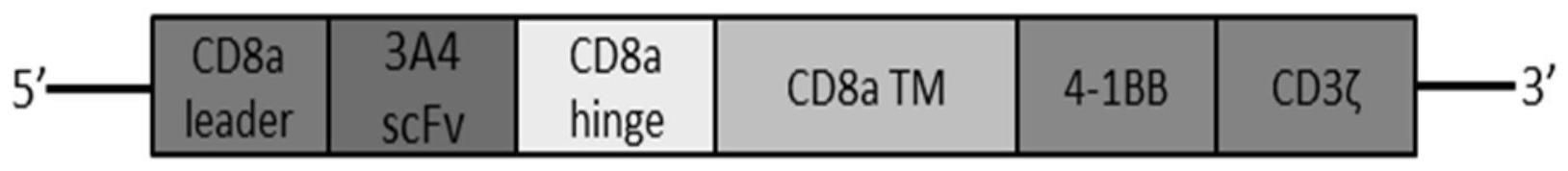
1、本发明的目的是提供一种非天然抗人cd45ra鼠源性嵌合抗原受体,是一种能识别cd45ra抗原阳性白血病细胞car-t细胞制剂即非天然鼠源性抗人cd45ra-car基因修饰的car-t细胞,cd45ra-car基因由下列结构构成:cd8a leader为car的前导链,3a4scfv为靶向识别区,cd8a hinge为铰链区,cd8a的transmembrane为car跨膜区,4-1bb(cd137)的胞内信号转导区与cd3ζ的胞内信号转导区串联为car的胞内段。鼠源性3a4scfv重链基因核苷酸序列如seq id no.3所示,其氨基酸序列如seq id no.4所示,3a4scfv轻链基因的核苷酸序列如seq id no.5所示,其氨基酸序列如seq id no.6所示。
2、在现有鼠(murine)抗人cd45ra免疫球蛋白(zch-6-3a4单抗,简称mu3a4)基因序列基础上,采用分子生物学技术研制出一种抗人cd45ra的鼠源性嵌合抗原受体(mu3a4-car)基因,通过以下步骤制备:
3、(1)查询比较文献,确定二代3a4car的基本结构。检索美国国家生物技术信息中心(ncbi),核实3a4car铰链区(hinge)、跨膜区及胞内信号转导区的基因序列,并委托公司合成puc/4-1bb-3ζ、puc/4-1bb-3ζ-egfp(enhanced green fluorescent protein);
4、(2)通过基因工程及分子克隆方法构建mu3a4car的真核表达载体pcdna3.1/mu3a4-4-1bb-3ζ,pcdna3.1/mu3a4-4-1bb-3ζ-egfp和慢病毒表达载体plenti/mu3a4-4-1bb-3ζ;
5、(3)mu3a4car真核表达载体及慢病毒表达载体活性鉴定:检测载体是否表达及蛋白定位是否正确,比较两种表达载体的转染及表达效率,选择最优car表达载体。
6、两种表达载体,其特征在于,所述载体包含cd8aleader(seq id no 1)-cd45scfv(seq id no 3+seq id no 5)-cd8ahinge(seq id no 7)-cd8a跨膜区(seq id no 9)-cd137(seq id no 11)-cd3ζ(seq id no 13)或cd8aleader(seq id no 1)-3a4scfv(seqid no 3+seq id no 5)-cd8a hinge(seq id no 7)-cd8a跨膜区(seq id no 9)-cd137(seq id no 11)-cd3ζ(seq id no 13)序列,所述的载体是真核表达载体pcdna3.1(+)-mucd45racar或pcdna3.1(+)-mu3a4car基因和慢病毒载体plenti-mucd45racar或plenti-mu3a4car基因。
7、本发明的另一个目的是提供所述嵌合抗原受体基因(mu3a4-car)在制备治疗由表达cd45ra的细胞介导引起的疾病的药物中的应用,即在制备cd45ra-car基因修饰t细胞(mu3a4-car-t细胞)靶向治疗血液系统恶性肿瘤药物制剂中的用途。
8、所述疾病是指表达cd45ra膜抗原的肿瘤性疾病,主要为恶性血液病,具体为急性髓系白血病,急性淋巴细胞白血病,恶性淋巴瘤,慢性髓系白血病和慢性淋巴细胞白血病。
9、本发明以鼠源性3a4抗体为基础,采用分子生物学技术进行构建真核表达载体pcdna3.1/mu3a4-4-1-bb-3z、pcdna3.1/mu3a4-4-1bb-3ζ-egfp和慢病毒表达载体plenti/mu3a4-4-1bb-3ζ。慢病毒表达载体plenti/mu3a4-4-1bb-3ζ可成功感染人t细胞,有效杀伤3a4阳性靶细胞kg1a细胞、raji细胞。mu3a4car识别抗原不依赖于抗原呈递过程,也不受mhc限制性,因而可以克服肿瘤免疫逃逸,更有效地杀伤3a4阳性肿瘤细胞。
10、本发明利用得到的mu3a4car进行了一系列的实验。mu3a4car顺利感染t细胞后,体外抗原结合活性测定结果表明mu3a4car-t能很好地与高表达cd45ra的髓系白血病细胞系kg1a特异性结合。mu3a4car-t细胞可靶向杀伤3a4阳性细胞株和新发aml患者体内的白血病细胞。mu3a4car-t细胞可用于高表达cd45ra抗原的白血病的治疗。
11、本发明利用得到的非天然mu3a4car蛋白,识别抗原不依赖于抗原呈递过程,也不受mhc限制性,因而可以克服肿瘤免疫逃逸,更有效地杀伤3a4阳性肿瘤细胞。
- 还没有人留言评论。精彩留言会获得点赞!