一种固定化海茵酶制备方法及在普瑞巴林中间体中的应用与流程
本发明属于生物催化合成,具体而言,涉及一种固定化海因酶的制备方法以及固定化海茵酶合成普瑞巴林关键手性中间体( r)-(-)-3-(氨甲酰甲基)-5-甲基己酸中的应用。
背景技术:
1、癫痫是大脑神经元突发性异常放电,导致短暂的大脑功能障碍的一种慢性疾病,据相关资料显示,癫痫已经成为神经科的第二大常见病。普瑞巴林作为一种治疗癫痫的药物,具有良好的治疗效果。普瑞巴林本身属于钙离子通道调节剂,通过对钙通道调节,进一步降低钙离子进入神经末梢,减少谷氨酸和去甲肾上腺素等兴奋性神经递质的过度释放,抑制神经冲动的产生,以达到对神经病理性疼痛以及相关神经性疾病的治疗效果。与传统药物相比,普瑞巴林的服用剂量更低、次数少、副作用小、持续时间长、耐受性强。普瑞巴林合成的关键在于手性中心的合成,,目前普瑞巴林方法多为化学合成方法,存在合成路线长、反应条件苛刻,产物或者中间体ee值不合格等诸多缺陷。相比化学合成,脂肪酶或者海茵酶参与的普瑞巴林合成路径短,原子利用率低,绿色环保,feixia liu和de-feng li等(green chem., 2022, 24, 4748)报道了来源于 bacillus stearothermophilus sd-1菌株的d-海茵酶(bshase),可催化3-异丁基戊二酰亚胺发生水解,产物ee值仅为38%,通过定点突变可提高ee值到99%;专利cn111944856b使用海茵酶催化合成普瑞巴林关键中间体( r)-(-)-3-(氨甲酰甲基)-5-甲基己酸,反应24 h,底物转化率98%,产物ee值99%,可得到高手性纯度的普瑞巴林中间体,酶法催化是目前最具优势的反应路线。但生物酶法制备普瑞巴林手性中间体仍然存在诸多不足,例如游离海茵酶稳定性较低,后期反应速率变慢、游离酶不可循环利用、反应体系引入大量游离蛋白,导致中间体产品蛋白含量高、使用游离酶导致后处理繁琐,影响收率。
技术实现思路
1、发明目的:本发明目的是提供一种固定化载体,将海茵酶突变体共价固定化获得固定化酶的制备方法,以及该固定化酶在制备普瑞巴林药物手性中间体的应用。
2、利用固定化技术固定化海茵酶,提高机械剪切力的耐受性,避免细胞过多蛋白释放至反应体系,降低对产物纯化工艺造成的影响,以增强海茵酶的稳定性,达到生物酶催化剂循环利用,进一步简化后处理工艺,提高收率。因此需寻找不同固定化载体对海茵酶进行固定化,找出固定化海茵酶的最佳载体,在不影响其催化活性前提下,达到固定化酶最大套用次数。
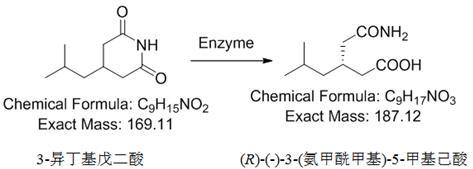
3、技术方案:本发明基于 agrobacterium tumefaciens bql9( a.tumefaciens bql9)菌株的天然d-海茵酶而改进的海茵酶突变体,利用不同的固定化载体对海茵酶突变体进行固定化,催化前体3-异丁基戊二酰亚胺生成( r)-(-)-3-(氨甲酰甲基)-5-甲基己酸,反应式如下:
4、
5、本发明提供了一种以氨基树脂为载体,将海茵酶突变体共价固定化获得固定化海茵酶的制备方法,即固定化海茵酶,该固定化海茵酶的酶活回收大于90%,以固定化海茵酶作为催化剂进行普瑞巴林药物手性中间体的制备,其底物浓度可达到140g/l,反应22h转化率可达到98%以上,( r)-型产物ee值可达到100%,固定化海茵酶的重复利用22次,转化率均大于95%。
6、本发明的技术方案是,一种固定化海茵酶,其特征在于所述固定化酶是按照下述方法制备:
7、酶液制备:将seq id no: 1所示氨基酸序列对应的编码基因(核苷酸序列为seqid no: 2)重组质粒转化至大肠杆菌中,得到基因工程菌经发酵培养,获得湿菌体悬浮于ph7.5-8.5的缓冲液得到菌悬液,经细胞破碎、离心得到海茵酶粗酶液。
8、湿菌体的制备:将海茵酶基因工程菌接种至终浓度50μg/ml硫酸卡那霉素抗性的lb培养基,37℃、200rpm下培养4h,为一级种子液;将上述种子液以体积浓度10%接种量接种至新鲜lb培养基,同样条件培养4h,为二级种子液,将二级种子液以体积浓度10%接种量接种至新鲜发酵培养基中,培养合适菌体浓度后,加入终浓度为0.2 mm的iptg,25℃下诱导培养16h,收集全细胞沉淀,即获得含海茵酶全细胞。
9、树脂活化:将氨基树脂用ph7.0-8.5缓冲液置于20℃摇床1h,抽滤的滤饼;将滤饼置于2%的戊二醛缓冲液中,于20℃摇床1h,抽滤后用去离子水洗涤载体至水清。
10、固定化酶制备:海茵酶粗酶液中加入活化后氨基树脂,氨基树脂的添加量为20g/100ml粗酶液;置于恒温摇床15-30℃、150-250rpm条件下固定化12h-24h,抽滤后滤饼用ph7.0-9.0的缓冲液淋洗两次,即得上述固定化海茵酶。
11、本发明方法采用共价固定化技术,可实现固定化海茵酶的高效制备,所得固定化转氨酶应用以制备普瑞巴林手性中间体。所得固定化海茵酶酶活回收率高、稳定性好、可重复回收利用。
12、所述缓冲液为ph 7.0-9.0缓冲液为tris-hcl、三乙醇胺-hcl缓冲液,优选ph 8.0的tris-hcl缓冲液;
13、固定化酶制备过程中ph为7.0~9.0,优选8.0;
14、菌悬液浓度为150g/l-250g/l,优选为200g/l;
15、固定化温度为15℃~45℃,优选25℃;
16、pei浓度为0.05%~0.4%,优选0.4%;
17、本发明中,所述树脂为西安蓝晓科技公司生产氨基树脂,型号为lx-1000ha。
18、本发明除海茵酶固定化的制备方法外,还涉及所述的固定化海茵酶在普瑞巴林手性药物中间体的应用。
19、具体的,所述应用为:以固定化海茵酶为催化剂、3-异丁基戊二酰亚胺为底物、氯化锰为酶激活剂,于ph 8.0、0.1mm tris-hcl缓冲液中进行水解,期间使用氢氧化钠维持体系ph 8.0,在45℃-51℃、300rpm条件下反应16-24h,制得普瑞巴林药物手性中间体( r)-(-)-3-(氨甲酰甲基)-5-甲基己酸。上述氯化锰用量为0.02-0.08 g/g、固定化海茵酶用量为0.2-1 g/g、底物浓度140g/l。
20、本发明中产物转化率检测方法如下:
21、仪器:thermo u3000 system hplc
22、色谱柱:welch c18, 4.6mm×150mm,5μm
23、检测波长:220 nm;
24、流速:1.0 ml/min;
25、柱温:35℃;
26、进样体积:10μl。
27、流动相:以0.1mol/l磷酸氢二钾(用磷酸调ph7.8)为流动相a,乙腈为流动相b,按下表所示梯度进行洗脱
28、
29、有益效果:该固定化海茵酶的酶活回收大于95%,以固定化海茵酶作为催化剂进行普瑞巴林药物手性中间体的制备,其底物浓度可达到140g/l,反应22h转化率可达到98%以上,( r)-型产物ee值可达到100%,固定化海茵酶的重复利用22次,转化率均大于95%。与目前工艺相比,固定化海茵酶,可增强海茵酶的稳定性,提高机械剪切力的耐受性,避免细胞过多蛋白释放至反应体系,降低对产物纯化工艺造成额影响,达到生物酶催化剂循环利用,进一步简化后处理工艺,提高收率。
30、具体实施案列
31、下面结合具体案例对本发明进一步描述,但本发明的保护范围并不仅限于此
32、实施例1:氨基树脂活化处理
33、溶液配置:
34、0.1m ph 8.0的缓冲液配置(1l):1l去离子水加入磷酸氢二钾23.8g,磷酸二氢钾2.75g,调节ph至7.8~8.2;
35、2%的戊二醛磷酸缓冲液配置(1l):40ml戊二醛 (50%),960ml水,磷酸氢二钾4.76g,溶解后用磷酸二氢钾调节ph至7.8-8.2。
36、载体活化:氨基树脂载体(型号lx-1000ha)10g加入100ml,0.1m ph8.0的pb缓冲液,25℃、300rpm恒温振荡15min后测ph,维持ph 7.8~8.2,慢摇1h后抽滤,加入50ml2%的戊二醛磷酸缓冲液,25℃恒温振荡1h,抽滤后用去离子水洗涤载体至水清,4℃保存备用
37、实施例2:海茵酶基因工程菌的全细胞培养以及粗酶液制备
38、于-80℃冰箱出保存菌种,转接于10ml含100mg/l卡那霉素的lb液体培养基中,37℃培养过夜;将上述菌液转接于500 ml含100 mg/l 卡那霉素的lb 液体培养基中,37°c振荡培养至od600=0.6~0.8 时,加入iptg 至终浓度分别为0.05~0.5 mm(优选0.2 mm),在22~28°c(优选25℃)下进行诱导表达12~16 h(优选15 h)后,取出菌液,6000×g 离心20min收集菌体。按照菌体浓度(200g/l)重悬于ph 8.0的tris-hcl缓冲液,用高压匀浆机破碎菌体。破碎后将粗酶液离心后取上清,即为海茵酶粗酶液。
39、实施例3固定化酶的制备
40、取实施例2所得粗酶液100g,加入活化后氨基树脂(按1/5=树脂/粗酶质量),在25℃、200rpm条件下固定化24h,抽滤后滤饼用ph 8.0、100mm tris-hcl缓冲液淋洗两次,即固定化海茵酶。
41、实施例4固定化酶的制备
42、取实施例2所得粗酶100g,加入活化后氨基树脂(按1/5=树脂/粗酶质量)),在15℃、200rpm条件下固定化24h,抽滤后滤饼用ph 7.5、100mm tris-hcl缓冲液淋洗两次,即固定化海茵酶。
43、实施例
44、取实施例2所得粗酶100g,加入活化后氨基树脂(按1/5=树脂/粗酶质量)),在30℃、200rpm条件下固定化24h,抽滤后滤饼用ph 8.5、100mm三乙醇胺-hcl缓冲液淋洗两次,即固定化海茵酶。
45、实施例
46、取实施例2所得粗酶100g,加入活化后氨基树脂(按1/5=树脂/粗酶质量)),在25℃、200rpm条件下固定化24h,抽滤后滤饼用ph 8.0、100mm三乙醇胺-hcl缓冲液淋洗两次,即固定化海茵酶。
47、实施例7固定化海茵酶的应用
48、100 ml反应瓶中加入10 g3-异丁基戊二酰亚胺,0.4g mncl2,10g固定化海茵酶(实施例3-6),最后加入10ml的0.1 mtris-hcl缓冲液,用2 m naoh溶液控制反应液ph为8.0,并于50℃反应22 h后, hplc分析其转化率。结果见表1所示:
49、
50、实施例8固定化海茵酶的酶量筛选
51、100 ml反应瓶中加入10 g3-异丁基戊二酰亚胺,0.4g mncl2,分别加入2g、5g、8g、10 g的固定化海茵酶,最后加入10 ml的0.1 mmtris-cl缓冲液(ph8.0),2 m naoh溶液控制反应液ph为8.0,并于50℃反应22 h后, hplc分析其转化率,如表5所示,固定化海茵酶最佳酶量为0.5g/g。
52、
53、实施例9 pei修饰固定化载体的浓度筛选
54、未经过修饰的固定化海茵酶3套用次数为5次,为增加固定化海茵酶的套用次数,需要用一定浓度的pei对固定化载体进行修饰,然后进行海茵酶的固定化。
55、取固定化载体10g加入100ml,0.1m ph8.0的pb缓冲液,25℃、300rpm恒温振荡15min后测ph,维持ph 7.8~8.2,慢摇1h后抽滤,往50ml2%的戊二醛磷酸缓冲液中加入终浓度为0.05%、0.1%、0.15%、0.2%、0.4%、0.8%、1.0%的pei进行性固定化载体的修饰,25℃恒温振荡1h,抽滤后用去离子水洗涤载体至水清, 4℃保存备用。
56、取ph 8.0的tris-hcl缓冲液制成200g/l的菌悬液,按照实施例2制备成粗酶液,分别加入上述经过pei修饰的固定化载体,在25℃、300rpm条件下,固定化24h;固定化结束,抽滤除去上清液,滤饼用 100mm、ph 8.0缓冲溶液清洗两次,抽滤除去多余水份后,获得固定化转氨酶。
57、采用实施例7方法测定固定化酶活性以及固定化酶的套用次数。结果如下表所述,选择pei浓度为0.4%时,对固定化载体修饰,固定化海茵酶转化率不受影响同时可增加固定化酶套用次数。
58、表6:不同pei浓度对固定化海茵酶转化率以及套用次数的影响
59、
60、实施例10 50g反应放大重复固定化海茵酶反应批次
61、在2000 ml反应瓶中加入50 g主原料3-异丁基戊二酰亚胺,2g mncl2,25g固定化酶实施例3,500 ml 的tris-cl缓冲液(100 mm,ph 8.5),48±2℃反应22 h,反应过程用2mol/l naoh溶液调节反应ph为8.0,22 h反应转化率为98.20%。将反应体系收率,收集上清液;滤饼用2v纯化水打浆抽滤后收集上清液,合并两次上清液。向上清液中加入30v甲醇,60℃回流加热变性45min-1h。加入活性炭抽滤,50%甲醇溶液淋洗滤饼,合并滤液。60℃减压蒸馏滤液。浓缩后的滤液用工业盐酸调酸,0-10℃保温30min析晶,抽滤后纯化水淋洗,滤饼于60℃鼓风干燥箱干燥得粉末状( r)-(-)-3-(氨甲酰甲基)-5-甲基己酸44.35g,收率80.6%,有关纯度99.43%,ee值100%,50g规模反应所用的固定化酶可回收套用次数达22次,每次固定化酶套用时,其转化率均达到95%以上。
62、将套用22次的固定化海茵酶进行第23次套用,反应转化率降低13%,转化率为82%,继续套用,转化率进一步降低,具体每次套用次数转化率见下表7。
63、
64、从上表数据可以看出,固定化海茵酶的重复使用次数可达到22次,尽管每次重复使用时转化率不同,但和未进行套用次数的固定化海茵酶相比,无明显差别,与之相比,第23次套用转化率明显降低,因此固定化酶的套用次数为22次。
65、上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其它的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!