一种含环己烷的化合物及有机电致发光器件的制作方法
本发明涉及有机电致发光,尤其涉及一种提供适用于有机电致发光器件中的有机发光材料,特别涉及一种含环己烷的化合物及有机电致发光器件。
背景技术:
1、目前,作为新一代显示技术的有机电致发光器件(oled)在显示和照明技术方面都获得了越来越多的关注,应用前景十分广泛。但是,和市场应用要求相比,oled器件的发光效率、驱动电压、使用寿命等性能还需要继续加强和改进。
2、一般来说,oled器件基本结构为在金属电极中间夹杂各种不同功能的有机功能材料薄膜,犹如一个三明治的结构,在电流的驱动下,从阴阳两极分别注入空穴和电子,空穴和电子在移动一段距离后,在发光层得到复合,并以光或热的形式进行释放,从而产生了oled的发光。然而,有机功能材料是有机电致发光器件的核心组成部分,材料的热稳定性、光化学稳定性、电化学稳定性、量子产率、成膜稳定性、结晶性、色饱和度等都是影响器件性能表现的主要因素。
3、专利文献1(cn106132937a)记载了9,9-二苯基芴经由连接体键合于三嗪环的化合物,这些化合物可作为电子注入和传输材料用于有机电致发光器件,器件电压较高,同时效率及寿命有待进一步提升。专利文献2(cn111433190a)记载了环己基芴经由连接体键合于三嗪环的化合物,这些化合物可作为主体材料和电子传输材料用于有机电致发光器件,其器件效率有待提升,同时也并未报道环己基芴上进一步衍生对材料性能的提升,与本发明不同。专利文献3(cn110615759b)记载了金刚烷基芴经由连接体键合于三嗪环的化合物,这些化合物作为电子传输层材料被用于有机电致发光器件中,其发光效率、寿命等性能方面还有待于进一步提高。专利文献4(cn114763341a)记载了降冰片烷基芴基经由连接体键合于氮杂环的化合物,这些化合物作为电子传输层材料被用于有机电致发光器件中,其材料稳定性、发光效率、寿命等性能方面还有待于进一步提高。专利文献5(kr1020210156912a)记载了苯并杂环并芴基经由连接体键合于氮杂环的化合物,这些化合物作为电子传输层材料被用于有机电致发光器件中,其平面性强,升华温度高,材料稳定性不佳,同时器件的发光效率、寿命等性能方面还有待于进一步提高。
技术实现思路
1、本发明是为了解决上述课题而完成的,目的在于提供高性能的有机电致发光器件及可实现这样的有机电致发光器件的新型材料。
2、本发明人为了达成前述目的而反复进行了深入的研究,结果发现,通过在分子中引入环状不饱和烃基得到(1)表示的化合物,可以得到高性能的有机电致发光器件。
3、本发明的目的之一在于提供一种包含环己烷的化合物,该类化合物具有成膜性好,光、电、热稳定性好,折射率低,发光效率高,电压低、寿命长等优点,可用于有机发光器件中。特别是作为空穴阻挡层材料、电子传输层材料,具有应用于amoled产业的可能。
4、为达到上述目的,本发明采用如下技术方案:
5、一种含环己烷的化合物,其结构式如式(1)所示:
6、
7、其中,x1、x2独立地选自n或cr4,且不能同时为n;
8、l1、l2各自独立地选自单键,r取代或未取代环原子数为6-30的芳香基团、r取代或未取代环原子数为5-30的杂芳香基团;
9、ar1、ar 2、ar 3、ar 4独立地选自具有6至40个环原子的r取代或未取代的芳香基团、具有5至40个环原子的r取代或未取代的杂芳香基团、具有6至40个环原子的r取代或未取代的芳氧基、具有5至40个环原子的r取代或未取代的杂芳氧基基团,或这些基团的任意组合,或其和与所述基团键合的环形成单环或多环;
10、r、r1、r2、r3、r4分别独立选自:氢或d,或具有1至20个c原子的取代或未取代的直链烷基,或具有1至20个c原子的取代或未取代的直链烷氧基,或具有1至20个c原子的取代或未取代直链硫代烷氧基,或具有3至20个c原子的取代或未取代的支链烷基或环烷基,或具有3至20个c原子的取代或未取代的支链或环状的烷氧基,或具有3至20个c原子的取代或未取代的支链或环状的硫代烷氧基、甲硅烷基,或具有1至20个c原子的取代或未取代的酮基,或具有2至20个c原子的取代或未取代的烷氧基羰基、或具有7至20个c原子的取代或未取代的芳氧基羰基、氰基、氨基甲酰基、卤甲酰基、甲酰基、异氰基、异氰酸酯、硫氰酸酯、异硫氰酸酯、羟基、硝基、卤素、或可交联的基团,或具有6至60个环原子的取代或未取代的芳香基团,或具有5至60个环原子的取代或未取代的杂芳香基团,或具有6至60个环原子的芳氧基,或具有5至60个环原子的杂芳氧基基团,或这些基团的任意组合;
11、n选自为1-6的整数。
12、在一些实施例中,所述单环或多环可以为脂肪族环或者芳族环。
13、在一些实施例中,所述化合物选自以下式(2)结构;
14、
15、其中,x1、x2、l1、l2、ar1-ar4、n的含义同上;
16、在一些实施例中,x1、x2独立地选自n或cr4,且不能同时为n;和/或者r4为氢或氘;
17、在一些实施例中,x1为n,x2为ch;
18、在一些实施例中,x2为n,x1为ch;
19、在一些实施例中,所述杂芳香基团、杂芳氧基基团中的杂原子选自n、s、o、si、se中的至少一个;
20、在一些实施例中,所述取代为被d、卤素、氰基、c1-c4烷基、c1-c3卤代烷基、c6-c10的芳基或c3-c10环烷基所取代。
21、在一些实施例中,所述化合物选自式(3-1)至式(3-2)的结构;
22、
23、在一些实施例中,l1、l2各自独立地选自选自单键,r取代或未取代环原子数为6-30的芳香基团或杂芳香基团;
24、更具体地,所述l1、l2中的取代基具体实例包括但不限于:氟、氰基、甲基、乙基、正丙基、异丙基、叔丁基或苯基。
25、在本发明的一些实施方式中,l1、l2选自单键;
26、在本发明的另一些实施方式中,l1、l2选自以下式a-1至式a-18所示的结构及其组合;
27、
28、上述基团可任选地被0,1,2或3个选自d、f、cl、br、氰基、c1-c4烷基、c1-c3卤代烷基、苯基、萘基、芴基、螺芴基和c3-c10环烷基所取代。
29、上述式a-1至式a-18中的两个键接位点可以是芳环上任意位置的组合。
30、在一些优选的实施例中,ar1-ar4选自具有6至40个环原子的r取代或未取代的芳香基团、5至40个环原子的r取代或未取代的杂芳香基团、6至40个环原子的r取代或未取代的芳氧基或5至40个环原子的r取代或未取代的杂芳氧基基团,或这些体系的组合,其中一个或多个基团彼此和/或与所述基团键合的环形成多环的脂族或芳族环系。
31、在一些实施例中,ar1-ar4选自氘代或未氘代的具有6至20个环原子的取代或未取代的芳族或氘代或未氘代的具有5至20个环原子的取代或未取代的杂芳族环系,或是氘代或未氘代的具有6至20个环原子的芳氧基或氘代或未氘代的具有5至20个环原子杂芳氧基基团,或这些体系的组合,其中一个或多个基团可以彼此和/或与所述基团键合的环形成单环或多环的脂族或芳族环系。
32、在一些实施例中,ar1-ar4选自氘代或未氘代的具有6至15个环原子的取代或未取代的芳香基团或氘代或未氘代的具有5至15个环原子的取代或未取代的杂芳香基团,或是氘代或未氘代的具有6至15个环原子的芳氧基或氘代或未氘代的具有5至15个环原子的杂芳氧基基团,或这些体系的组合,其中一个或多个基团可以彼此和/或与所述基团键合的环形成单环或多环的脂族或芳族环系。
33、具体的,芳香基团的例子有:苯、萘、蒽、菲、二萘嵌苯、并四苯、芘、苯并芘、三亚苯、苊、芴、及其衍生物。
34、具体的,杂芳香基团的例子有:呋喃、苯并呋喃、噻吩、苯并噻吩、吡咯、吡唑、三唑、咪唑、噁唑、噁二唑、噻唑、四唑、吲哚、咔唑、吡咯并咪唑、吡咯并吡咯、噻吩并吡咯、噻吩并噻吩、呋喃并吡咯、呋喃并呋喃、噻吩并呋喃、苯并异噁唑、苯并异噻唑、苯并咪唑、吡啶、吡嗪、哒嗪、嘧啶、三嗪、喹啉、异喹啉、邻二氮萘、喹喔啉、菲啶、伯啶、喹唑啉、喹唑啉酮、及其衍生物。
35、在一实施例中,通式(1)或通式(3-1)-(3-2)中ar1-ar4独立选自以下所示结构中的任意一种或其任一组合:
36、
37、各个w分别独立选自n或cr5;
38、v选自o、s、s=o、so2、nr6、cr7r8或sir9r10;
39、r5-r10分别独立选自:氢,d,具有1至20个c原子的直链烷基,具有1至20个c原子的直链烷氧基,具有1至20个c原子的直链硫代烷氧基,具有3至20个c原子的支链烷基或环烷基,具有3至20个c原子的支链烷氧基或环状的烷氧基,具有3至20个c原子的支链硫代烷氧基或环状的硫代烷氧基,甲硅烷基,具有1至20个c原子的酮基,具有2至20个c原子的烷氧基羰基,具有7至20个c原子的芳氧基羰基,氰基,氨基甲酰基,卤甲酰基、甲酰基,异氰基,异氰酸酯基,硫氰酸酯基,异硫氰酸酯基,羟基,硝基,cf3,cl,br,f,可交联的基团,具有6至60个环原子的取代或未取代的芳香基团,具有5至60个环原子的取代或未取代的杂芳香基团,具有6至60个环原子的芳氧基,具有5至60个环原子的杂芳氧基基团,或这些基团的组合,r5-r10中的所述取代为被d、卤素、氰基、c1-c4烷基或c3-c10环烷基所取代。
40、在一实施例中,所述的r5-r10选自氢,d,或具有1至10个c原子的直链烷基,或具有3至10个c原子的支链烷基,或具有3至10个c原子的环烷基,cl,br,f,氰基或苯基。
41、在一实施例中,ar1-ar4分别独立地选自取代或未取代的苯基、取代或未取代的萘基、取代或未取代的联苯基、取代或未取代的菲基、取代或未取代的芴基、取代或未取代的三联苯基、取代或未取代的三亚苯基、取代或未取代的螺二芴基、取代或未取代的二苯并呋喃基、取代或未取代的二苯并噻吩基、取代或未取代的咔唑基、取代或未取代的吲哚并咔唑基;
42、在一些实施例中,通式(1)或通式(3-1)-(3-2)中的ar1-ar4分别独立地选自以下基团中的一种,或任意组合:
43、
44、r5的含义同r1;
45、*代表键接位置,m为式(5-1)至式(5-7)中最大取代整数。
46、可选地,所述ar1-ar4中的取代基分别独立地选自氟、氰基、甲基、乙基、正丙基、异丙基、叔丁基、三氟甲基、三苯基硅基、环己烷基、金刚烷基、苯基、联苯基;
47、可选地,所述ar1-ar4分别独立地选自以下基团组成的组及其组合;
48、
49、
50、在一些实施例中,n为1-4的整数,环己烷基键接于ar1-ar4上,且每一个ar1-ar4上至多键接有一个环己烷基。
51、在一个较为优选的实施例中,按照通式(1)的有机化合物部分被氘代,较好是10%的h被氘代,更好是20%的h被氘代,很好是30%的h被氘代,最好是40%的h被氘代。
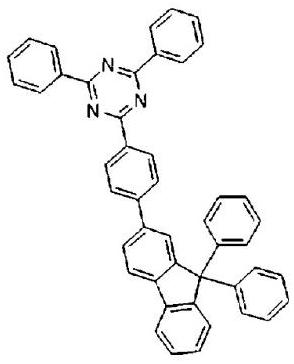
52、下面列出按照本发明的通式(1)所示的有机化合物的具体例子,但并不限定于此:
53、
54、
55、
56、
57、
58、本发明的目的之一还在于提供一种包含上述化合物的有机电致发光器件,其包含阳极、阴极以及介于所述阳极和阴极之间的一层以上的有机物层,所述一层以上的有机物层中至少一层包含所述的化合物;
59、本发明的材料在有机电致发光器件中作为至少其中一层有机物层为发光层、空穴阻挡层、电子传输层;
60、本发明的材料在有机电致发光器件中作为电子传输层材料。
61、本发明的材料具有成膜性好,光、电、热稳定性好,发光效率高,电压低、寿命长等优点,可用于有机发光器件中。特别是作为空穴阻挡层材料、电子传输层材料,具有应用于amoled产业的可能。
- 还没有人留言评论。精彩留言会获得点赞!