用于识别或量化在生物样品中的靶标的方法和组合物与流程
背景技术:
1、在异质群体中表征个体细胞的能力在生物学研究和临床诊断中变得越来越重要。已证明现代单细胞rna-seq(scrna-seq)方法的无偏差和高通量性质对于描述异质细胞群非常有价值1-3。在单细胞基因组学之前,常规地使用策划组的针对细胞表面蛋白质的荧光标记的抗体(其通常是细胞活性和功能的可靠指标)来描述细胞状态7。最近的研究8,9已经证明了将来自细胞分选仪的“索引分选”测量值与单细胞转录组学相结合的潜能;该过程允许将免疫表型映射到转录组衍生的聚类。然而,基于液滴微流控1-3、微孔47,48或组合索引20,30的大规模平行方法与细胞计数不兼容,因此不能用蛋白质信息增强。同时测量单细胞中转录物和蛋白质的靶向方法在规模上有局限性,或者只能并行分析几个基因和蛋白质10-14。
2、传统上,大多数分类方法依赖于细胞表面蛋白质的光学检测。分选细胞的下游分析为细胞表型和表征提供了另外的信息层。随着过去几年高通量测序成本的降低,出现了各种实验室方法来分离和测序单细胞的rna内容(单细胞rna测序,scrna-seq)。最初的单细胞测序方法采用荧光激活细胞分选(facs)以将细胞从群体分离并划分到微量滴定板的各个孔中,以便将它们的转录组的内容与特定细胞表面标志物的表达相关联。facs/scrna-seq方法虽然有效,但具有相对低的通量和实验偏差,因为只有先验选择的细胞类型被分选和测序。因此,这些方法不适合于发现新细胞群或用于表征需要分析数万个细胞的复杂组织。
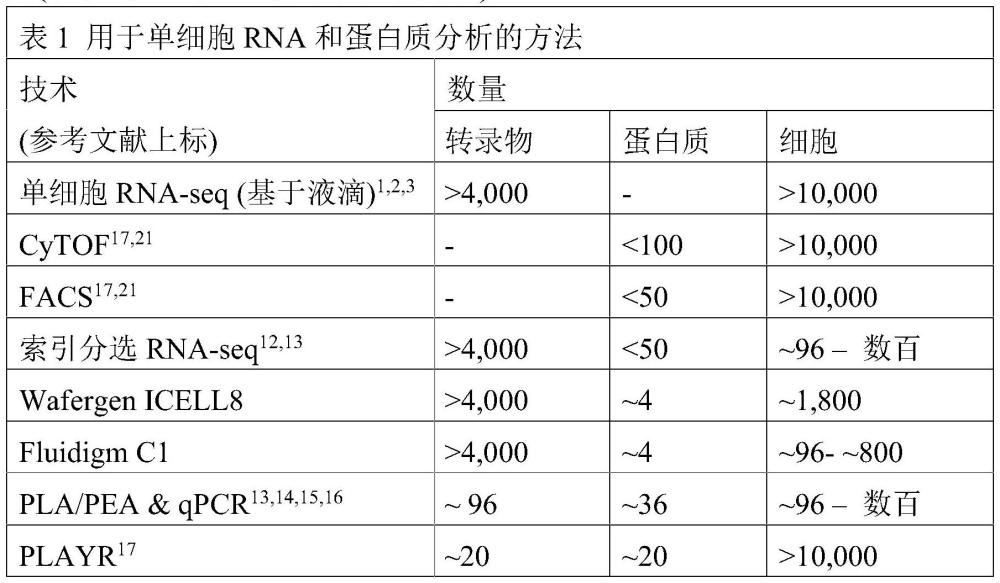
3、从基于板的方法转变到fluidigm和wafergen开发的微流控/纳米孔方法允许研究人员扩展到巨大数量的细胞,缓解通量瓶颈,避开facs遇到的实验偏差,并使scrna-seq所需的细胞捕获过程和文库制备过程自动化。最近采用基于液滴的微流控方法,如dropseq1、indrop2、10x genomics3和illumina/bio-rad产品,已允许scrna-seq扩展到大量细胞。目前基于液滴的微流控平台以超过每秒1,000个液滴的速率产生纳升级大小的油包水乳液。具有独特分子条形码的微粒与细胞共封装在液滴中,允许对源自相同细胞的转录物进行分组。该方法通过每次实验产生数万个个体单细胞反应而显著提高了通量,同时实现与纳升体积试剂使用相关的显著成本降低。虽然单细胞基因组学中基于液滴的进展显著改变了scrna-seq实验的规模,但这些方法存在关键的缺点:所有基于液滴的单细胞rna测序方法都丢失了除了总体上蛋白质水平或特别是细胞表面蛋白质表达以外的重要表型信息(表1)。
4、目前同时检测和/或测量单细胞中的转录物和蛋白质的方法基于使用有限数量的标志物的索引细胞分选与基于板的rna测序8,9组合或者邻位连接测定(pla及其衍生技术)与数字pcr10-13或质谱流式细胞术14组合。这些测定的规模有限和/或只能并行分析几个基因和蛋白质(参见表1以比较不同的技术)。
5、
6、虽然转录组可以充当细胞状态的详细读数,但已经表明,mrna丰度通常不能良好代表蛋白质水平,特别是在发育过程中4-6。细胞表面标志物的表达传统上通过细胞计数法经由荧光标记的抗体测量,并且复杂细胞群可以通过它们表达的标志物的组合来表征。例如,近年来已经基于免疫系统和神经系统中的蛋白质标志物确定了细胞类型的精细地图7。这引领使用细胞计数法作为许多疾病领域的诊断和监测工具,最突出的是肿瘤学和免疫学。然而,基于facs的方法在可以同时测定的标志物的数量方面,由于选择用于分析的细胞因已知表面标志物的选择而具有偏差的事实而受到限制。
7、因此,需要更有效的组合物和方法用于定性和定量分析众多细胞靶标(和其他靶标),以用于诊断和研究应用。
技术实现思路
1、在一个方面,组合物包括构建体,该构建体包括通过连接体与聚合物构建体(即寡核苷酸序列)连接或缀合的配体。配体被设计为与生物样品中的靶标特异性结合。聚合物构建体,例如,寡核苷酸序列,包括扩增柄;特异性识别配体的条形码;可选的随机分子标签(rmt)或独特分子标识符(umi),以下称为“umi”,其定位于邻近条形码的5'或3'端;和锚,该锚用于与捕获序列杂交并用于随后产生双链序列,该捕获序列包括与锚互补的序列。
2、在另一方面,配体和聚合物构建体之间的连接体可以是可切割的共价键。
3、在另一方面,组合物可以进一步含有一个或多个“另外的”构建体,该“另外的”构建体与组合物中任何其他构建体的不同之处至少在于靶标、配体和条形码以及umi中的至少一个。在又进一步的方面,组合物包括一个或多个“基本上相同”的构建体。在某些实施方式中,每个“基本上相同”的构建体与组合物中任何其他参考构建体(例如,“第一”构建体或“另外的”构建体)的不同之处仅在于可选的umi的序列的身份或没有来自参考构建体的umi。
4、在又另一方面,试剂盒包括一个或多个本文描述的组合物和实施方式,以及可选的用于实施一个或多个方法的试剂。
5、在另一方面,用于检测生物样品中的一个或多个靶标的方法使用本文描述的一个或多个组合物和构建体。在一个方面,靶标是细胞表面抗原或表位,并且组合物含有针对该靶标的单个构建体,即“第一”构建体。在另一个实施方式中,如上文所述和下文所限定的,组合物含有多个“基本上相同”的构建体(即与“第一”构建体基本上相同),或针对不同的靶标并因此具有不同组分的一个或多个“另外的”构建体。该方法涉及使生物样品与一个或多个上述组合物接触。另外的步骤涉及洗涤以去除未结合的构建体,和/或使各个构建体中的每个锚序列与捕获序列杂交。另一步骤涉及延伸与锚序列杂交的捕获,以将构建体条形码、umi和扩增柄复制到双链序列上。然后扩增或检测聚合物构建体条形码序列以鉴定生物样品是否表达或含有单个靶标、一个或多个另外的靶标,或多个靶标的组合。可替换地,样品中靶标的表达水平通过检测通过处理的样品中任何umi的量或两个或更多个umi的平均量归一化的相应的聚合物构建体条形码的量来确定。
6、在另一方面,如上所述的方法包括在洗涤步骤后从与一个或多个针对检测一个或多个靶标的构建体结合的生物样品中分离个体细胞、细胞片段或细胞群。又另一步骤涉及用与扩增柄退火的引物扩增双链序列。
7、在又进一步的方面,方法使用本文描述的组合物通过同时检测位于细胞中或细胞上的一个或多个表位和/或其转录组来表征细胞。一种这样的方法包括使含有细胞的生物样品与一个或多个本文描述的组合物接触。在该方法的一个实施方式中,配体是与位于细胞中或细胞表面上的靶向表位特异性结合的抗体或其片段。这样的方法可以使用drop-seq1技术的步骤,例如,将与一个或多个构建体结合的个体单细胞封装到含有微流控珠的水滴中。每个珠与捕获寡核苷酸序列缀合。细胞裂解后,细胞中的mrna和构建体寡核苷酸序列与珠上的捕获寡核苷酸的多聚t序列退火。从与珠退火的序列产生含有珠条形码序列和细胞mrna的反转录物的双链cdna以及含有珠条形码序列和构建体寡核苷酸序列的双链dna。产生含有来自细胞转录物的cdna和含有构建体寡核苷酸序列的dna的扩增文库。在该方法中,文库的转录组同时与通过特异性识别的构建体上的抗体所识别的细胞相关联。通过使用本文描述的组合物,使用聚合物构建体条形码序列鉴定单细胞是否表达靶向表位。同时文库的转录组与鉴定为表达靶标的细胞相关联。
8、在又另一方面,上述构建体用于批量条形码编码或细胞“散列标签化(hashtagging)”的方法中。上述构建体,例如,与细胞结合的抗体或任何配体,与寡核苷酸序列缀合或缔合,该寡核苷酸序列包括扩增柄;特异性识别配体的条形码;可选的随机分子标签(rmt)或独特分子标识符(umi),以下称为“umi”,其定位于邻近条形码的5'或3'端;和锚,例如多聚a序列,如本文描述的其用于在合并之前标记样品内的每个细胞。然后将用这样的构建体标记的若干样品合并,然后通过使用如本文描述的scrna-seq或cite-seq方法分析。用于标记样品内每个细胞的构建体具有与用于scrna-seq或cite-seq方法不同的扩增柄序列。标记中的这种复用(multiplexing)允许明确地确定大多数双联体(doublets)和控制批次效应的能力。
9、本文提出的一些方面是用于在多重测定中检测样品或靶标的方法,该方法包括:a)使第一样品与第一构建体接触,该第一构建体包括与第一寡核苷酸连接的第一配体,其中第一配体与第一靶标特异性结合,并且第一寡核苷酸包括:i)第一扩增柄,ii)特异性识别第一样品的第一条形码,和iii)第一锚。在一些方面,该方法进一步包括:b)使第二样品与第二构建体接触,该第二构建体包括与第二寡核苷酸连接的第二配体,其中第二配体与第二靶标特异性结合,并且第二寡核苷酸包括:i)第二扩增柄,ii)特异性识别第二样品的第二条形码,和iii)第二锚。在一些实施方式中,第一靶标和第二靶标是相同的靶标,并且可选地,第一扩增柄和第二扩增柄基本上相同,并且可选地,第一锚和第二锚基本上相同。在一些方面,该方法进一步包括:c)使第一和第二样品与第三构建体接触,该第三构建体包括与第三寡核苷酸连接的第三配体,其中第三配体与第三靶标特异性结合,并且第三寡核苷酸包括:(i)第三扩增柄,(ii)特异性识别第三配体的第三条形码,和(iii)第三锚。在一些方面,该方法进一步包括d)使第一和第二样品与第四构建体接触,该第四构建体包括与第四寡核苷酸连接的第四配体,其中第四配体与第四靶标特异性结合,并且第四寡核苷酸包括:i)第四扩增柄,ii)特异性识别第四配体的第四条形码,和iii)第四锚。
10、在一些实施方式中,第三扩增柄和第四扩增柄基本上相同,并且不同于第一扩增柄和第二扩增柄。在一些实施方式中,第一锚、第二锚、第三锚和第四锚基本上相同,并且可选地包括长度为至少10个核苷酸的多聚a序列。在一些实施方式中,第三靶标和第四靶标是不同的靶标,并且可选地,第三靶标不同于第一或第二靶标,并且可选地,第四靶标不同于第一或第二靶标。
11、在一些方面,该方法进一步包括e)使第三样品与第五构建体接触,该第五构建体包括与第五靶标特异性结合的第五配体,其中第五靶标可选地与第一靶标相同,并且第五配体与第五寡核苷酸连接,该第五寡核苷酸包括:i)第五扩增柄,该第五扩增柄可选地与第一扩增柄基本上相同,ii)特异性识别第三样品的第五条形码,和iii)第五锚,该第五锚可选地与第一锚基本上相同,并且可选地包括多聚a序列。
12、在一些方面,该方法进一步包括f)使第一和第二样品以及可选地另外的样品与包括第六配体的第六构建体接触,其中第六配体与第六靶标特异性结合,并与第六寡核苷酸连接,该第六寡核苷酸包括:i)第六扩增柄,该第六扩增柄可选地与第三扩增柄基本上相同,ii)特异性识别第六靶的第六条形码,和iii)第六锚,该第六锚可选地与第三锚相同,并且可选地包括多聚a序列。
13、在一些实施方式中,第一和第二样品、可选地一个或多个另外的样品,包括一个或多个细胞,并且第一、第二、第三、第四、第五和第六靶标存在于一个或多个细胞中的至少一个中或其表面上。在一些实施方式中,(a)、(b)、(c)、(d)、(e)或(f)的接触包括使第一样品、第二样品和可选的另外样品的一个或多个细胞与第一、第二、第三、第四、第五或第六构建体接触。在一些实施方式中,第一和第二样品、可选地一个或多个另外的样品,包括一个或多个细胞器、线粒体、外来体、脂质体、合成或天然存在的囊泡、微囊泡、外体(ectosomes)、细胞核、细菌、病毒、珠、颗粒、微粒、纳米颗粒、大分子以及合成或天然存在的脂质、磷脂或膜球,并且第一、第二、第三、第四、第五和第六靶标存在于一个或多个细胞器、线粒体、外来体、脂质体、合成或天然存在的囊泡、微囊泡、外体、细胞核、细菌、病毒、珠、颗粒、微粒、纳米颗粒、大分子以及合成或天然存在的脂质、磷脂或膜球中的至少一个中或其表面上。在一些实施方式中,(a)、(b)、(c)、(d)、(e)或(f)的接触包括使第一样品、第二样品和可选的另外的样品的一个或多个细胞器、线粒体、外来体、脂质体、合成或天然存在的囊泡、微囊泡、外体、细胞核、细菌、病毒、珠、颗粒、微粒、纳米颗粒、大分子以及合成或天然存在的脂质、磷脂或膜球与第一、第二、第三、第四、第五或第六构建体接触。在一些实施方式中,(a)和(b)以及可选地(e)的接触在(c)、(d)或(f)中任一个的接触之前发生。在一些实施方式中,(c)、(d)或(f)的接触包括使第一样品、第二样品和可选地另外的样品的混合物与第三、第四或第六构建体接触。在一些实施方式中,第一、第二、第三、第四、第五或第六配体包括抗体或其抗原结合片段。在一些实施方式中(i)第一、第二、第三、第四、第五或第六锚分别位于第一、第二、第三、第四、第五或第六扩增柄的3',且分别位于第一、第二、第三、第四、第五或第六条形码的3';并且可选地,(ii)第一、第二、第三、第四、第五或第六扩增柄分别位于第一、第二、第三、第四、第五或第六条形码的5',且分别位于第一、第二、第三、第四、第五或第六锚的5'。在一些实施方式中,该方法进一步包括在步骤(a)、(b)、(c)、(d)、(e)或(f)中的任何一个或多个之后洗涤第一样品、第二样品或第一样品和第二样品以及可选地另外的样品的混合物,以去除未结合的构建体。在一些实施方式中,在(a)、(b)、(c)、(d)、(e)或(f)之后,将第一、第二或第三样品中的一个的第一单细胞封装在第一液滴中,该第一液滴包括与多个第一捕获寡核苷酸缀合的第一珠,该第一捕获寡核苷酸从5'至3'包括第七扩增柄、识别第一珠的第七条形码和与第一、第二、第三、第四、第五或第六锚序列互补的序列,并且可选地将第一、第二或第三样品中的一个的第二单细胞封装在第二液滴中,该第二液滴包括与多个第二捕获寡核苷酸缀合的第二珠,该第二捕获寡核苷酸从5'至3'包括第七扩增柄、识别第二珠的第八条形码和与第一、第二、第三、第四、第五或第六锚序列互补的序列。在一些实施方式中,该方法进一步包括使第一和第二单细胞裂解,从而提供封装在第一液滴中的第一裂解物和封装在第二液滴中的第二裂解物,其中第一和第二裂解物可选地包括mrna。在一些实施方式中,该方法进一步包括使第一和第二细胞的裂解物与聚合酶接触。在一些实施方式中,该方法进一步包括产生第一、第二、第三、第四、第五或第六寡核苷酸的cdna和双链寡核苷酸序列。
14、在一些方面,本文提出了一种用于检测生物样品中的一个或多个靶标的方法,该方法包括使生物样品与以下中的一个或多个接触:a)包括第一构建体的组合物,该第一构建体包括通过连接体与聚合物构建体连接或缀合的第一配体,所述第一配体与第一靶标特异性结合,并且所述聚合物构建体包括:扩增柄;特异性识别所述第一配体的条形码;可选的独特分子标识符,该独特分子标识符定位于邻近条形码的5'或3'端;和锚,该锚用于与捕获序列杂交,该捕获序列包括与所述锚互补的序列;b)包括至少一个另外的构建体的组合物,该构建体包括通过连接体与另外的聚合物构建体连接或缀合的另外的配体,所述另外的配体与另外的靶标特异性结合,并且所述另外的聚合物构建体包括扩增柄;特异性识别所述另外的配体的另外的条形码;可选的另外的独特分子标识符,该另外的独特分子标识符定位于邻近另外的条形码的5'或3'端;和锚,该锚用于与捕获序列杂交,该捕获序列包括与所述锚互补的序列;和c)包括一个或多个基本上相同的构建体的组合物,每个基本上相同的构建体与任何其他参考第一构建体或另外的构建体的不同之处在于其可选的独特分子标识符(umi)的序列或没有umi。
15、在一些方面,本文提出了一种用于检测生物样品中的一个或多个表位的高通量方法,该方法包括使生物样品与以下中的一个或多个接触(i)包括第一构建体的组合物,第一构建体包括与第一表位特异性结合的第一抗体或其片段,所述第一抗体或片段通过连接体与第一聚合物构建体连接或缀合,其中第一聚合物构建体包括:扩增柄;条形码序列,该条形码序列从辨识不同表位的任何其他抗体或片段中特异性识别所述第一抗体或片段;可选的独特分子标识符序列,该独特分子标识符序列定位于邻近条形码的5'或3'端;和锚序列,该锚序列用于与捕获序列杂交,该捕获序列包括与所述锚互补的序列;(ii)包括至少一个另外的构建体的(i)的组合物,该另外的构建体包括通过连接体与另外的聚合物构建体连接或缀合的另外的抗体或其片段,所述另外的抗体或其片段与另外的表位特异性结合,并且所述另外的聚合物构建体包括:扩增柄;特异性识别所述另外的抗体或其片段的另外的条形码;可选的另外的独特分子标识符,该另外的独特分子标识符定位于邻近另外的条形码的5'或3'端;和(i)的锚序列,其中所述另外的构建体与组合物中的任何其他构建体的不同之处在于其抗体、表位、条形码和umi;和(iii)包括一个或多个基本上相同的构建体的(i)或(ii)的组合物,每个基本上相同的构建体与任何其他参考第一构建体或另外的构建体的不同之处在于其可选的独特分子标识符(umi)的序列或没有umi。
16、在一些方面,本文提出了一种用于检测在至少第一和第二样品中的至少两个靶标的方法,该方法包括:a)使第一样品与第一构建体接触,该第一构建体包括与第一寡核苷酸连接的第一配体,其中第一配体与第一靶标特异性结合,并且该第一寡核苷酸包括:i)第一扩增柄,ii)特异性识别第一样品的第一条形码,和iii)包括多聚a序列的锚;b)使第二样品与第二构建体接触,该第二构建体包括与第二寡核苷酸连接的第一配体,其中第二寡核苷酸包括:i)第一扩增柄,ii)特异性识别第二样品的第二条形码,和iii)锚;c)使第一和第二样品与第三构建体接触,该第三构建体包括与第三寡核苷酸连接的第二配体,其中第二配体与第二靶标特异性结合,并且第三寡核苷酸包括:(i)第二扩增柄,(ii)特异性识别第二配体的第三条形码,和(iii)锚;和d)使第一和第二样品与第四构建体接触,该第四构建体包括与第四寡核苷酸连接的第三配体,其中第三配体与第三靶标特异性结合,并且第四寡核苷酸包括:i)第二扩增柄,ii)特异性识别第三配体的第四条形码,和iii)锚。
17、在一些方面,本文提出了一种试剂盒,该试剂盒包括:a)第一构建体,该第一构建体包括与第一寡核苷酸连接的第一配体,其中第一配体与第一靶标特异性结合,并且第一寡核苷酸包括:i)第一扩增柄,ii)第一独特条形码,该第一独特条形码被配置为特异性识别第一样品,和iii)包括多聚a序列的锚;b)第二构建体,该第二构建体包括与第二寡核苷酸连接的第一配体,其中该第二寡核苷酸包括:i)第一扩增柄,ii)第二独特条形码,该第二独特条形码被配置为特异性识别第二样品,和iii)锚;c)第三构建体,该第三构建体包括与第三寡核苷酸连接的第二配体,其中第二配体与第二靶标特异性结合,并且该第三寡核苷酸包括:(i)第二扩增柄,(ii)第三独特条形码,该第三独特条形码被配置为特异性识别第二配体,和(iii)锚;和d)第四构建体,该第四构建体包括与第四寡核苷酸连接的第三配体,其中该第三配体与第三靶标特异性结合,并且第四寡核苷酸包括:i)第二扩增柄,ii)第四独特条形码,该第四独特条形码被配置为特异性识别第三配体,和iii)锚。
18、在一些方面,本文提出了一种包括构建体的组合物,该构建体包括与寡核苷酸连接的配体,其中配体与靶标特异性结合,并且寡核苷酸包括:i)扩增柄,ii)独特条形码,该独特条形码被配置为特异性识别第一样品,和iii)锚,该锚可选地包括多聚a序列。
19、在又另一方面,本文描述的方法是高通量方法并采用其他已知的检测和测序技术。
20、这些组合物和方法的其他方面和优点在以下对其优选实施方式的具体描述中进一步描述。
- 还没有人留言评论。精彩留言会获得点赞!