一种重组人促黄体激素α生物活性的检测方法与流程
本发明属于分子,具体涉及一种重组人促黄体激素α生物活性的检测方法。
背景技术:
1、促黄体生成素(lh)由腺垂体细胞分泌的一种糖蛋白类促性腺激素,可促进胆固醇在性腺细胞内转化为性激素。对于女性来说,与促卵泡激素(fsh)共同作用促进卵泡成熟,分泌雌激素、排卵,以及黄体的生成和维持,分泌孕激素和雌激素。对于男性来说,促黄体生产素促成睾丸间质细胞合成和释放睾酮。重组人促黄体激素α(rhlh),通过基因工程由中国仓鼠(cho)卵巢细胞生产,用于严重缺乏lh和fsh的患者。
2、现有研究报道了使用免疫学技术测定促黄体生成素的方法如酶联免疫技术(elisa)、放射免疫分析技术、电化学发光免疫检测(eclia)等,但这些方法不能准确反应促黄体生成素在生物体内生物活性信息,且方法耐用性和重复性较差。《中国药典》收录的测定促黄体生成素诱导幼大鼠精囊增重法,但该方法操作复杂、实验周期长,检测结果易受动物个体差异影响,存在较大的变异系数。目前关于使用重组活细胞检测外源性物质的方法研究很多,但还没有利用重组细胞针对性检测外源性物质重组人促黄体激素α生物活性,以控制重组人促黄体激素α的质量和临床应用的研究报道。
技术实现思路
1、为解决上述问题,本发明提供了一种用于重组人促黄体激素α生物活性检测的基因,其核苷酸序列如seq id no.1所示。
2、本发明还提供了一种重组载体,它是连接有核苷酸序列如seq id no.1所示的载体;所述载体为慢病毒载体;
3、所述慢病毒载体包括lenti-cmv-mcs-pgk-puro质粒载体。
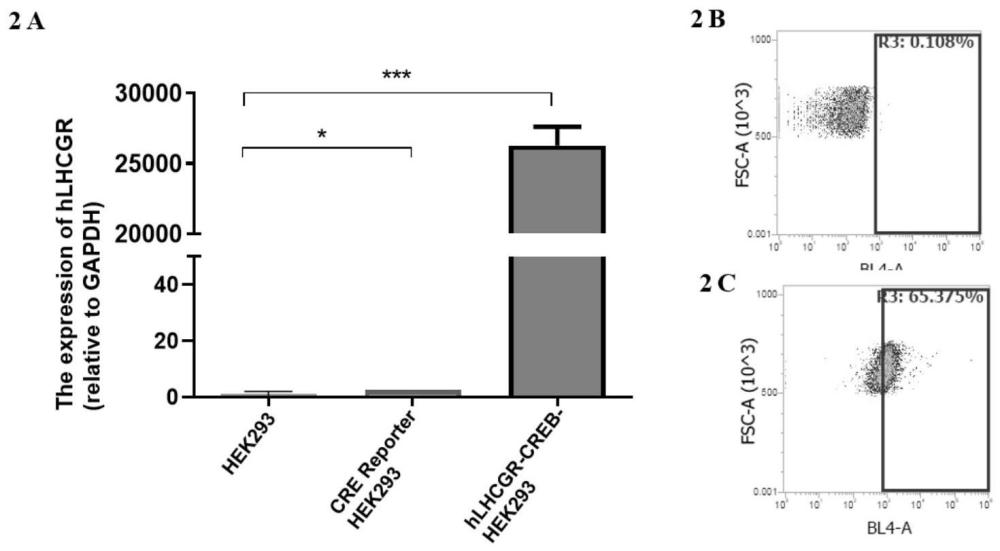
4、本发明还提供了一种用于重组人促黄体激素α生物活性检测的细胞株,它是经慢病毒感染的整合有seq id no.1所示基因的细胞株;
5、所述慢病毒是由前述的重组载体转染细胞制成;优选所述细胞株包括crereporter hek293细胞株。
6、本发明的关键之一在于:确定了特定lhcgr基因序列与特定的环磷酸腺苷反应元件(cre)控制下的萤光素酶报告基因构建的重组活细胞株,才能实现重组人促黄体激素α生物活性检测。
7、本发明提供了一种前述用于重组人促黄体激素α生物活性检测的细胞株的构建方法,包括如下步骤:
8、a、取核苷酸序列如seq id no.1所示的基因,插入到lenti-cmv-mcs-pgk-puro质粒载体中,即得重组载体lenti-cmv-hlhcgr-pgk-puro;
9、b、使用hg-transgene reagent将步骤a所得重组载体共转染进293t细胞中,再加enhancing buffer培养,收集细胞上清液浓缩,即得病毒原液;
10、c、取步骤b)所得病毒原液,用dmem培养基按moi=10稀释,得病毒感染稀释液;
11、d、取cre reporter hek293细胞,加步骤c所得病毒感染稀释液感染,培养,再用嘌呤霉素筛选,测序鉴定获得稳转细胞株hlhcgr-creb-hek293。
12、在某些具体实施例中,步骤c所述dmem培养基含10%fbs,4μg/ml杀稻瘟菌素和1%p.s。
13、本发明还提供了前述的基因、前述的重组载体、前述的细胞株在重组人促黄体激素α生物活性检测中的应用。
14、本发明最后提供了一种重组人促黄体激素α生物活性检测方法,它包括如下步骤:
15、1)取处于对数生长期的前述细胞株,加胰蛋白酶消化成单细胞,再加检测培养基重悬,培养得检测用细胞溶液;
16、2)取待测重组人促黄体激素α,加检测培养基稀释成系列浓度的检测用样品溶液;
17、3)取步骤1)所得检测用细胞溶液,分别与步骤2)所得系列浓度的检测用样品溶液混合,孵育,再加bio-litetm luciferase检测试剂裂解细胞,最后用酶标仪读取荧光信号值;
18、所述检测培养基是含fbs的dmem培养基。
19、在某些具体实施例中,步骤1)所述胰蛋白酶含0.25%edta;消化完成后用完全培养基终止消化;所述检测用细胞溶液的密度为1.0×105~6.0×105个/ml,优选2±1.0×105个/ml;所述培养是在37℃、5% co2条件下培养0~24h,优选培养20h±2h。
20、在某些具体实施例中,步骤2)所述待测重组人促黄体激素α,加检测培养基稀释至1600miu/ml,再按照1:4倍系列稀释成系列浓度的检测用样品溶液。
21、在某些具体实施例中,步骤3)所述检测用细胞溶液与各系列浓度的检测用样品溶液按体积比1:1混合;所述孵育是在37℃、5%co2条件下孵育4~6h,优选5h;裂解是在室温避光条件下裂解。
22、在某些具体实施例中,所述检测培养基是含5%~10%fbs的dmem培养基,优选5%fbs的dmem培养基。
23、在某些具体实施例中,所述待测重组人促黄体激素α的生物活性是以检测用样品溶液的浓度为横坐标,酶标仪读取的荧光信号值经softmax pro软件分析的luminescence值均值为纵坐标,通过四参数拟合得到的药物剂量-效应曲线确定的。
24、本发明基于密码子优化获得的特定lhcgr基因序列和特定的环磷酸腺苷反应元件(cre)控制下的萤光素酶报告基因,构建得到的重组活细胞既能稳定表达人黄体生成素/绒毛膜促性腺激素受体(hlhcgr),也能稳定表达环磷酸腺苷反应元件(cre)控制下的萤光素酶报告基因。利用该重组活细胞对重组人促黄体激素α体外生物活性进行检测的原理为,lhcgr属于g蛋白偶联受体家族,rhlh与lhcgr结合激发gs/camp/pka信号转导系统,该转导系统进一步激活creb-luc基因表达,通过读取分析不同rhlh样品浓度下的荧光信号值,获得rhlh的生活活性。具体为,rhlh与lhcgr结合,激活腺苷酸环化酶,在腺苷酸环化酶的作用下atp环化形成a环磷腺苷(camp)。camp可以激活pka(protein kinase a),pka介导creb-luc荧光素酶基因表达,加入检测试剂,通过酶标仪读取荧光信号值,得到rhlh相关生物活性测试结果。
25、目前有关重组人促黄体激素α体外生物学活性的检测方法研究报道较少。本发明通过获得的特定重组活细胞对重组人促黄体激素α生物活性进行检测研究时发现:重组活细胞溶液的浓度和培养时间,重组人促黄体激素α稀释的方式和浓度,以及两者混合孵育的时间都会影响到重组人促黄体激素α生物活性的测定。本发明利用重组活细胞在特定的检测条件下最终实现了rhlh体外生物学活性准确、高效的检测。
26、经方法学验证显示:本发明检测方法专属性强,对rhlh表现出很好的四参数量效曲线,对类似结构rhfsh或rhfsh-ctp却表现出不明显量效曲线。同时本发明检测方法具有很好的精密度和线性范围,检测结果稳定可靠,准确度高,能够实现rhlh浓度范围为0.003~800miu/ml的生物学活性检测,相关检测结果的回收率均值在94%~110%左右。将本发明检测方法用于rhlh生物类似药有效性、安全性等方面评估,对于rhlh生物类似药的质量控制与临床应用具有较高的应用价值。
27、显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
28、以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
- 还没有人留言评论。精彩留言会获得点赞!