聚己内酯及其制备方法
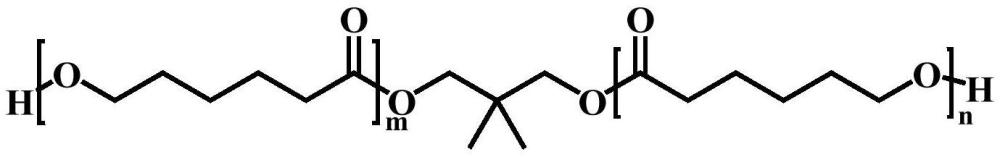
本发明涉及高分子及可降解塑料,具体涉及一种聚己内酯及其制备方法。
背景技术:
1、塑料在给我们带来便利的同时,也不可避免的产生了一系列的问题。其中最突出的问题是白色污染、“微塑料”问题。自然界中的塑料垃圾之所以危害如此之大,是因为它们难以降解,会长久的存在于环境中。
2、针对这一问题,可降解塑料的开发利用成为目前亟待解决的问题。聚己内酯(pcl)是由ε-己内酯开环聚合所得的线性脂肪族聚酯,易溶于多种极性有机溶剂,熔点低,易于加工,和多种聚合物均有良好的相容性,同时具有良好的生物降解性和生物相容性的聚合物材料,一直作为理想的生物材料受到学术界和工业界的广泛关注。聚己内酯广泛应用于可降解塑料(如包装材料、一次性塑料餐具等)、体内生物医药降解材料(如人体内用胶带、绷带、矫正器、缝合线、药物缓释剂、生物接骨板及螺钉等)、树脂绷带、热塑性聚氨酯tpu、涂料添加剂、胶粘剂、合成皮革、材料改性等多种应用领域。
3、迄今为止,人们对pcl的活性聚合做出了巨大努力。目前常用于pcl的可控/活性聚合方法是使用金属醇盐引发剂和衍生自碱金属、过渡金属和稀土/镧系金属(例如铝、锡、锌、钛、钙和镧)的催化剂进行开环聚合。而使用这类聚合方法得到的聚合物往往有难以去除的金属残留物,限制了pcl在生物医药、微电子及食品包装领域的应用。因此,内酯的无金属活性聚合是迫切所需的。
4、经过对现有技术文献的检索,本发明人发现使用有机碱如n-杂环卡宾、硫脲/胺、硫脲/磷腈、胍、磷腈催化内酯开环聚合,属于阴离子聚合范畴。但本发明人希望指出的是这些体系聚合条件苛刻,催化剂合成复杂,容易发生酯交换副反应。此外,另一种可以实现ε-cl活性开环聚合的路径是通过阳离子活化单体进行开环聚合,本发明人也发现这种体系存在如下问题:速率反应较慢,得到的聚合物酸值过高。
技术实现思路
1、本发明的目的在于克服上述现有技术的不足,而提供一种聚己内酯及其制备方法。本发明人经过广泛而深入地研究后发现,采用本发明的制备方法,能够获得分布窄(分子量分布指数为1.0~1.3)、分子量可控(数均分子量可以达到100×103dal)、端基明确、无金属残留的聚己内酯。此外,该制备方法还具有以下优点:开环聚合反应条件温和,无需高温,产率高;催化剂稳定且已商业化,价格便宜,有利于大规模使用;避免了单一催化剂造成的酸值过高、速率慢、产生环状聚合物的问题。
2、本发明通过以下技术方案解决上述技术问题:
3、第一方面,本发明提供一种聚己内酯的制备方法,其包括如下步骤:
4、步骤s:含有引发剂、单体和催化剂的混合液,进行单体的开环聚合反应,即得聚己内酯;
5、其中,所述引发剂为亲核性物质;所述单体为己内酯;所述催化剂为有机碱和有机酸构成的酸碱二元催化体系。
6、在另一优选例中,所述引发剂选自:水、单元醇、多元醇或其组合。
7、其中,所述单元醇选自:甲醇、乙醇、丙醇、异丙醇、丁醇、异丁醇、叔丁醇、正戊醇、异戊醇、苯甲醇或其组合。
8、其中,所述多元醇选自:乙二醇、丙二醇、1,4-丁二醇、己二醇、新戊二醇、二乙二醇、三乙二醇或其组合。
9、在另一优选例中,所述引发剂选自:新戊二醇、1,4-丁二醇、己二醇、二乙二醇或其组合。
10、在另一优选例中,所述引发剂的用量为0.1%~25%,该百分比为引发剂与单体的摩尔百分比,优选为0.1%~2%或0.1%~1.2%,例如可为0.116%或1.15%。
11、在另一优选例中,所述单体选自:ε-己内酯、γ-己内酯、δ-戊内酯、γ-戊内酯、γ-丁内酯、β-丁内酯、α-甲基-γ-丁内酯、丙交酯或其组合。
12、在另一优选例中,所述单体为ε-己内酯。
13、在另一优选例中,所述有机酸选自:三氟化硼乙醚、三五氟苯基硼、三苯甲基四氟硼酸盐、甲磺酸、三氟甲磺酸、三氟乙酸、乳酸、柠檬酸、富马酸、酒石酸、双三氟甲磺酰亚胺、邻苯二磺酰亚胺、磷酸二苯酯、联萘酚磷酸酯、羟甲基膦酸、亚氨基二磷酸或其组合。
14、在另一优选例中,所述有机酸选自:磷酸二苯酯、三氟甲磺酸、三苯基甲基四氟硼酸盐或其组合。
15、在另一优选例中,所述有机酸的用量为0.01%~2%,该百分比为有机酸与单体的摩尔百分比,优选为0.01%~0.015%,例如可为0.0114%或0.0115%。
16、在另一优选例中,所述有机碱选自:4-二甲氨基吡啶、吡啶、2,6-二甲基吡啶、1,5,7-三氮杂二环[4.4.0]癸-5-烯、7-甲基-1,5,7-三氮杂二环[4.4.0]癸-5-烯、叔丁基亚氨基-三(二甲氨基)正膦、磷腈碱p4-t-bu、2-叔丁基亚氨基-2-二乙基氨基-1,3-二甲基二氢-1,3,2-二氮杂膦、1,8-二氮杂双环[5.4.0]十一碳-7-烯或其组合。
17、在另一优选例中,所述有机碱选自:1,5,7-三氮杂双环[4.4.0]癸-5-烯、叔丁基亚氨基-三(二甲氨基)正膦、1,8-二氮杂双环[5.4.0]十一碳-7-烯、7-甲基-1,5,7-三氮杂二环[4.4.0]癸-5-烯、4-二甲氨基吡啶或其组合。
18、在另一优选例中,所述有机碱的用量为0.01%~2%,该百分比为有机碱与单体的摩尔百分比,优选为0.01%~0.015%,例如可为0.0114%或0.0115%。
19、在另一优选例中,所述有机酸和所述有机碱的摩尔比为0.1~2,优选为0.8~1.2,例如可为1。
20、在另一优选例中,所述有机酸和所述有机碱的组合选自下述5个组合中的任意一个:
21、(1)磷酸二苯酯和1,5,7-三氮杂双环[4.4.0]癸-5-烯;
22、(2)三氟甲磺酸和叔丁基亚氨基-三(二甲氨基)正膦;
23、(3)三苯基甲基四氟硼酸盐和1,8-二氮杂双环[5.4.0]十一碳-7-烯;
24、(4)磷酸二苯酯和7-甲基-1,5,7-三氮杂二环[4.4.0]癸-5-烯;
25、(5)磷酸二苯酯和4-二甲氨基吡啶。
26、在另一优选例中,所述催化剂用量为0.01%~2%,该百分比为催化剂与单体的摩尔百分比,优选为0.02%~0.03%,例如可为0.0228%、0.023%或0.025%。
27、在另一优选例中,所述开环聚合反应的温度为60~180℃,优选为150~180℃。
28、在另一优选例中,所述开环聚合反应的压力为0~0.1mpa。
29、在另一优选例中,所述开环聚合反应的时间为8~96小时,优选为20-80小时,例如可为30、42或78小时。
30、在另一优选例中,所述开环聚合反应分两个步骤进行,具体为:
31、步骤p1:在130~170℃和0~0.1mpa下,反应30~80小时;
32、步骤p2:在175~200℃和0~0.1mpa下,反应4~8小时。
33、其中,步骤p1的反应温度可为150℃,反应压力可为0.1mpa,反应时间可为24、36或72小时。
34、其中,步骤p2的反应温度可为180℃,反应压力可为0~0.1mpa,反应时间可为6小时。
35、在另一优选例中,以醇类作为引发剂,己内酯作为单体,将有机碱和有机酸加入到引发剂和单体的混合液中,再进行单体的开环聚合反应。优选地,以醇类作为引发剂,己内酯作为单体,在60~90℃或70~80℃下抽真空除水,直至体系水分含量<0.05%再加入有机碱和有机酸。
36、在另一优选例中,以醇类作为引发剂,己内酯作为单体,在60~90℃温度下抽真空除水后,加入有机酸和有机碱作为催化剂,在60~180℃温度下,-0.09~0.1mpa的气压下进行己内酯的开环聚合反应,反应时间为8~96小时。
37、在另一优选例中,以醇类作为引发剂,己内酯作为单体,在60~90℃温度下抽真空除水后,加入有机酸和有机碱作为催化剂,进行如下两步反应:
38、步骤p1:在130~170℃和0~0.1mpa下,反应30~80小时;
39、步骤p2:在175~200℃和0~0.1mpa下,反应4~8小时。
40、其中,步骤p1的反应温度可为150℃,反应压力可为0.1mpa,反应时间可为24、36或72小时。
41、其中,步骤p2的反应温度可为180℃,反应压力可为0~0.1mpa,反应时间可为6小时。
42、第二方面,本发明提供一种由上述制备方法制得的聚己内酯。
43、应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
44、本发明所用试剂和原料均市售可得。
45、本发明的积极进步效果在于:本发明的制备方法,能够获得分布窄(分子量分布指数为1.0~1.3)、分子量可控(数均分子量可以达到100×103dal)、端基明确、无金属残留的聚己内酯。此外,该制备方法还具有以下优点:开环聚合反应条件温和,无需高温,产率高;催化剂稳定且已商业化,价格便宜,有利于大规模使用;避免了单一催化剂造成的酸值过高、速率慢、产生环状聚合物的问题。
- 还没有人留言评论。精彩留言会获得点赞!