核酸酶在抑制核酸扩增中非特异性扩增的用途
本发明属于快速生物检测,具体涉及核酸酶在抑制核酸扩增中非特异性扩增中的用途。
背景技术:
1、等温核酸扩增是一种在恒定温度下进行核酸扩增的分子诊断技术。目前,发展较成熟、扩增效率较高的等温扩增技术,如环介导等温扩增和重组酶聚合酶扩增(rpa),已经被广泛应用于医学、环境和公共卫生安全等领域。其中,rpa可在重组酶和低温反应的聚合酶的辅助下,实现恒温(37℃)的核酸扩增。反应无需变温仪器,甚至体温即可加热。此外,rpa能快速(20分钟)实现目标核酸的指数扩增,并且灵敏度媲美pcr(分子诊断的金标准)。基于此,rpa的仪器依赖性小、灵敏度高,是现场核酸检测的理想技术。
2、众所周知,引物与目标基因的特异性结合是rpa准确检测的基础。然而,在低温下反应,rpa引物(长度介于30~35bp)易与非目标核酸发生非特异性结合,进而引发非特异性扩增。产生的非目标产物可能导致假阳性结果,影响检测的准确性。尽管核酸探针法(如crispr技术)可提高结果的准确性,但需要额外的检测试剂和实验操作,增加了rpa在现场检测中的复杂性。因此,亟需一种简单、高效的方法解决rpa的非特异性扩增。
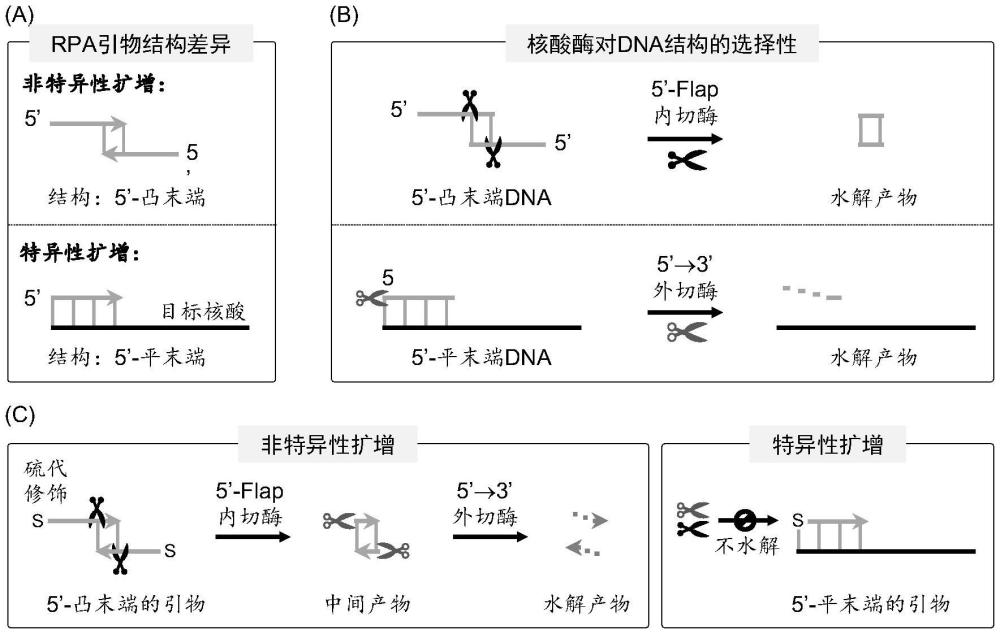
3、分析发现,在rpa的非特异性扩增中,引物与非目标核酸结合,形成含5’端单链dna的双链dna结构(即,凸末端的dsdna);而在特异性扩增中,引物与目标核酸完全互补,仅形成dsdna结构(即,平末端的dsdna)。因此,两种扩增的引物结构存在明显差异,选择性破坏凸末端的dsdna,将有望解决rpa的非特异性扩增。
技术实现思路
1、针对上述缺陷,本发明提供了一种核酸酶在抑制核酸扩增中非特异性扩增的用途:在核酸扩增中加入t7核酸外切酶(t7 exo),可以有效抑制反应中非特异性扩增。值得注意的是,需要将rpa引物的5’端进行硫代修饰。在非特异性扩增中,修饰后的引物与非目标序列结合,形成含5’-凸末端(5’-单链dna)的dsdna结构。该结构的凸末端首先被t7 exo的flap内切酶活性水解,随后dsdna部分被t7 exo的外切酶活性水解破坏,以此抑制非特异性扩增,减少检测中的假阳性结果。在特异性扩增中,引物与目标序列结合,形成平末端dsdna结构,无法被t7 exo的外切酶和内切酶活性水解。基于此,本方法实现对rpa非特异性扩增的选择性抑制。
2、本发明的技术方案:
3、本发明要解决的第一个技术问题是提供一种核酸酶在抑制核酸扩增中非特异性扩增的用途。
4、进一步的,所述核酸酶为t7核酸外切酶(t7 exo),t7 exo可以抑制等温核酸扩增中的非特异性扩增。
5、进一步,所述等温核酸扩增为重组酶聚合酶扩增。
6、进一步,在所述核酸扩增中,需要先对引物进行核苷酸修饰。
7、进一步,所述核苷酸修饰位点为引物5’-端连续的3~5个核苷酸。
8、进一步,所述核苷酸修饰方法为硫代修饰。
9、进一步,所述硫代修饰是指用硫原子代替oligo磷酸骨架中的非桥接氧原子。这种修饰可以使得核苷酸间的连接抗核酸酶降解。
10、t7核酸外切酶(t7 exo)是一类水解双链dna中磷酸二酯键的酶,主要沿5’→3’方向催化去除5’-端的单核苷酸(图8b)。然而,t7 exo的外切酶活性可被引物5’-端硫代修饰所抑制,使其无法水解“含5’-端硫代修饰的平末端dsdna”。基于此,t7 exo不影响引物(5’-端硫代修饰)的特异性扩增(图8c)。据报道,t7 exo同时具备flap内切酶的活性(j.biol.chem.,2014,289,5860),可特异性切除凸末端的dsdna。因此,t7 exo能够以flap内切酶和外切酶活性,选择性水解含5’-端硫代修饰的凸末端dna,以此抑制引物的非特异性扩增(图8b)。此外,因t7 exo与rpa扩增兼容,其有望直接参与rpa扩增,并抑制非特异性扩增。基于此,通过对引物的5’-端进行硫代修饰,同时向rpa扩增体系添加t7 exo,能够实现选择性抑制rpa非特异性扩增的目标。
11、进一步,t7 exo的最终反应浓度为1.3~2.6u/μl;更优选为1.7~2.0u/μl。
12、进一步,所述引物的最终浓度为120~480nm;更优选为240nm。
13、本发明要解决的第二个技术问题是提供一种抑制等温核酸扩增中非特异性扩增的方法,所述方法为,在扩增中加入t7核酸外切酶(t7 exo)。
14、其中,所述等温核酸扩增为重组酶聚合酶扩增。
15、进一步,在所述核酸扩增中对引物进行核苷酸修饰。
16、进一步,所述核苷酸修饰位点为引物5’-端连续的3~5个核苷酸。
17、进一步,所述核苷酸修饰方法为硫代修饰。
18、进一步,t7 exo的最终反应浓度为1.3~2.6u/μl;更优选为1.7~2.0u/μl。
19、进一步,所述引物的最终浓度为120~480nm;更优选为240nm。
20、进一步,本发明抑制等温核酸扩增中非特异性扩增的方法为:
21、(1)将引物进行核苷酸修饰;
22、(2)利用核苷酸修饰后的引物配置扩增反应液,加入t7核酸外切酶,混合均匀。随后,向反应管加入待测的目标核酸,并以超纯水控制反应的总体积为20~50μl;
23、(3)将反应管置于37℃恒温条件扩增4分钟,振荡混匀后,再扩增16分钟。最后,将反应管置于>85℃的水浴中10分钟,以停止反应。
24、上述方法中,反应时间和温度等扩增条件均为常规参数,不同厂家的检测试剂盒会有细微差别,请根据说明书使用。
25、为探究t7 exo抑制非特异性扩增的性能,利用聚丙烯酰胺凝胶电泳实验,分析扩增产物中的目标和非目标产物的含量。
26、其中,所述等温核酸扩增为重组酶聚合酶扩增。
27、进一步,在所述核酸扩增中对引物进行核苷酸修饰。
28、进一步,所述核苷酸修饰位点为引物5’-端连续的3~5个核苷酸。
29、进一步,所述核苷酸修饰方法为硫代修饰。
30、进一步,t7 exo的最终反应浓度为1.3~2.6u/μl;更优选为1.7~2.0u/μl。
31、进一步,所述引物的最终浓度为120~480nm;更优选为240nm。
32、本发明要解决的第三个技术问题是提供一种等温核酸扩增试剂盒,其中包含t7exo。
33、进一步,t7 exo的最终反应浓度为1.3~2.6u/μl;更优选为1.7~2.0u/μl。
34、进一步,所述试剂盒中还包括经核苷酸修饰的引物。
35、进一步,所述核苷酸修饰为硫代修饰。
36、进一步,所述核苷酸修饰位点为引物5’-端连续的3~5个核苷酸。
37、进一步,所述引物浓度为120~480nm。
38、进一步,所述等温核酸扩增为重组酶聚合酶扩增。
39、在核酸扩增过程中,经核苷酸修饰的引物与非目标序列结合,形成凸末端的dsdna结构。该结构的凸末端首先被t7 exo的flap内切酶活性水解,随后dsdna被t7 exo的外切酶活性水解破坏,从而抑制非特异性扩增。然而,在rpa的特异性扩增中,引物与目标序列结合,形成平末端的dsdna结构。该结构无法被t7 exo的flap内切酶和外切酶活性水解,因此特异性扩增不受影响。基于t7 exo的内切酶和外切酶活性,以及t7 exo与rpa扩增体系的兼容性,t7 exo可选择性抑制rpa的非特异性扩增。
40、综上,本发明具有如下有益效果:
41、1、t7 exo选择性抑制重组酶聚合酶扩增中的非特异性扩增,反应特异性良好,产物仅含目标产物。
42、2、t7 exo简单、高效地避免了假阳性结果,通过结合现有的比色技术,可实现非开盖的核酸检测。
- 还没有人留言评论。精彩留言会获得点赞!