D‑A‑D型弓形波拉(Bola)液晶化合物的制作方法
本发明涉及弓形波拉(Bola)液晶材料领域,特别是涉及一种非对称中心的柱相液晶化合物的制备及其光学非线性性质的研究。此类化合物有望在光通信、全光开关以及光信息存储等领域得到应用。
背景技术:
非线性光学材料是具有特殊信息处理和超快响应的光电材料。非线性光学是一种强光光学效应,主要研究物质在强光作用下输出光与原入射光强度的非线性关系。随着人们对大信息通信要求越来越高,非线性光学材料在光通信、全光开关以及光信息存储等领域潜藏着广泛的应用价值。无机晶体是人们最早研究和使用的一类二阶非线性光学材料,但是这类材料的介电常数较高,倍频系数小,半波电压往往也不低,这就决定了它们难以实现高速大容量的电光调制,这也正是当前光通讯技术发展的瓶颈之一。此外,无机材料物性很脆,在其它基底(如硅片)表面生长和加工十分困难,使得波导器件的制作成本很高,价格相当昂贵。相比较之下,有机非线性光学材料可以克服此缺陷。有机非线性光学材料具有以下优势:(1) 有机材料的光极化来源于高度离域的π电子的极化,故其非线性光学系数要比无机晶体高1~2个数量级;(2) 响应速度快,近于飞秒,而无机晶体只有皮秒:(3) 光学损伤阈值高,可达GW/cm2量级,而无机材料只能达MW/cm2量级; (4) 可通过分子剪裁、分子设计来优化分子性能,满足器件需要;(5) 易于加工,可实现光学集成。正是由于有机材料的这些优势,使其成为近二十年来非线性光学材料研究的热点,无论是结构设计还是制备方法都得到了迅猛发展。目前研究的有机非线性光学材料主要包括高性能极化聚合物(Poled Polymer)材料、具有高度规则结构的Langmuir-BlogeR(LB)膜材料和通过选择性驱动力构筑的自组装(Self-Assembly,SA)膜材料。随着器件化应用的不断发展,有机聚合物非线性光学材料也暴露出了明显的局限和不足,例如材料的电光系数还不够高,光传播损耗过大,以及热稳定性较差等。因此,二阶非线性光学材料的实用化必须达到一些基本要求。对于D-A-D型弓形波拉(Bola)化合物的合成及其非线性光学性质的研究,经文献检索,并未发现与本发明相同的公开报道。
技术实现要素:
本发明提供了一种含有极性基团的新型D-A-D型弓形波拉(Bola)化合物,将不同的极性基团引入到波拉两亲性分子当中,通过对弯曲核内部链的长度和种类调节,得到更多具有非线性光学性质的光学材料。
本发明的D-A-D型弓形波拉(Bola)液晶化合物,其特征在于该化合物具有以下结构式:
其中,
所述的D-A-D型弓形波拉(Bola)液晶化合物,其特征在于该化合物是通过以下的步骤制备而得:
步骤1,将化合物1溶于氨水和甲醇,体积比为2:1的溶液当中,缓慢滴加碘单质和碘化钾的水溶液,室温反应2小时,得到化合物2;
步骤2,化合物2与溴代烷烃或半氟链在DMF,K2CO3条件下,85℃反应12小时得到化合物3;
步骤3,其中化合物3b在乙醇作溶剂,NaOH,H2O2条件下,60℃反应1小时,将CN氧化为CONH2,得到化合物4;
步骤4,化合物5与甲基丁炔醇,以干燥THF和三乙胺,体积比为1:1为溶剂,在氮气保护下加入四(三苯基膦)合钯和碘化亚铜,室温下搅拌12小时,得到化合物6;
步骤5,化合物6在KOH的甲苯溶液当中100℃反应2小时,得到化合物7;
步骤6,化合物3a、3c、3d、4分别与化合物7以无水THF和三乙胺,体积比为1:1为溶剂,在氮气保护下加入四(三苯基膦)合钯和碘化亚铜,室温下搅拌15小时,得到化合物8;
步骤7,将化合物8溶于甲醇溶液中,在PPTS的催化作用下加热回流12小时,去保护得到最终产物化合物9;
其中,
化合物1包括化合物1a、1b、1c、1d,1a为 4-溴苯酚,1b为4-羟基苯腈, 1c为4-硝基苯酚,1d为 4-羟基苯甲酸甲酯;
化合物2包括化合物2a、2b、2c、2d, 2a为 4-溴-2,6-二碘苯酚,2b为 4-羟基-3,5-二碘苯腈;2c为 2,6-二碘-4-硝基苯酚;2d为 4-羟基-3,5-二碘苯甲酸甲酯;
化合物3包括化合物3a、3b、3c、3d,3a为5-溴-2-(十四烷氧基或7,7,8,8,9,9,10,10,10-九氟癸烷氧基)-1,3-二碘苯;
3b为4-(十四烷氧基或者7,7,8,8,9,9,10,10,10-九氟癸烷氧基或者5,5,6,6,7,7,8,8,9,9,10,10,10-十三氟癸烷氧基或者12,12,13,13,14,14,15,15,16,16,17,17,18,18,19,19,19-十七氟十九烷氧基)-3,5-二碘苯腈;
化合物3c为2-(7,7,8,8,9,9,10,10,10-九氟癸烷氧基或者5,5,6,6,7,7,8,8,9,9,10,10,10-十三氟癸烷氧基)-1,3-二碘-5-硝基苯;
化合物3d为4-(7,7,8,8,9,9,10,10,10-九氟癸烷氧基)-3,5-二碘苯甲酸甲酯;
化合物4是4-(7,7,8,8,9,9,10,10,10-九氟癸烷氧基或者5,5,6,6,7,7,8,8,9,9,10,10,10-十三氟癸烷氧基或者12,12,13,13,14,14,15,15,16,16,17,17,18,18,19,19,19-十七氟十九烷氧基)-3,5-二碘苯甲酰胺;
化合物5是4-[(4-碘苯氧基)甲基]-2,2-二甲基-1,3-二氧戊环;
化合物6是4-{[4-(2,2-二甲基-1,3-二氧戊环-4-基)甲氧基]苯基}-2-甲基丁-3-炔-2-醇;
化合物7是4-[(4-乙炔基苯氧基)甲基]-2,2-二甲基-1,3-二氧戊环;
化合物8是4-{[(2,2-二甲基-1,3-二氧戊环-4-基)甲氧基苯基]乙炔基}-4-(十四烷氧基或者7,7,8,8,9,9,10,10,10-九氟癸烷氧基或者5,5,6,6,7,7,8,8,9,9,10,10,10-十三氟癸烷氧基或者12,12,13,13,14,14,15,15,16,16,17,17,18,18,19,19,19-十七氟十九烷氧基)苯X(X=Br,CN,NO2,CONH2,COOCH3,COOH)。
最终产物化合物9有具体13种产物,分别为:
9-Br-C14
9-CN-C14
9-Br-C6H12C4F9
9-CN-C6H12C4F9
9-CN-C4H8C6F13
9-CN-C11H22C8F17
9-NO2-C6H12C4F9
9-NO2-C4H8C6F13
9-COOH-C6H12C4F9
9-COOCH3-C6H12C4F9
9-CONH2-C6H12C4F9
9-CONH2-C4H8C6F13
9-CONH2-C11H22C8F17 ;
其中的化合物9-COOH-C6H12C4F9是由化合物9-COOCH3-C6H12C4F9在乙醇,KOH条件下水解得到。
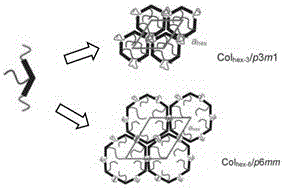
在这类新型的D-A-D型弓形波拉(Bola)化合物当中,分子自组装形成两种六方晶格,Colhex/p6mm和Colhex-3/p3m1,化合物的相转变温度列于表1中。其中,p6mm是由6个分子组装成具有对称中心的正六边形,六边形边长是由两个D-A-D型弓形波拉(Bola)分子臂构成。而p3m1也是由D-A-D型弓形波拉(Bola)分子组装成六边形,与p6mm不同的是,这个六边形是由3个分子组装成的具有非对称中心的正六边形,其中分子的一个臂构成六边形的一个边。此类化合物,有望在光通信、全光开关以及光信息存储等领域得到应用。
说明书附图
图1是本发明的制备路线图;
图2是D-A-D型弓形波拉(Bola)分子组装图;
图3a是化合物9-CONH2-C6H12C4F9相应的液晶织构图;
图3b是化合物9-CONH2-C6H12C4F9相应的XRD图;
图4a是 9-CONH2-C6H12C4F9/PC样品实时极化光学二次谐波测量结果图;
图4 b是 9-CONH2-C6H12C4F9/PC样品 SHG 信号随时间变化;
图5是9-CONH2-C6H12C4F9样品 SHG 信号随掺杂比例的关系图。
具体实施方式
实施例1:采用溴代烷和酚类衍生物为原料,经过一系列反应,合成波拉(Bola)化合物9-CONH2-C6H12C4F9 ,具体制备步骤如下。
(i)化合物2的合成
在500 mL圆底烧瓶中,将化合物4-羟基苯腈 (16.2 g, 136 mmol)溶于氨水(120 mL, 20%)和甲醇(60 mL)中,强力搅拌下,将碘单质(69.0 g, 272 mmol)和碘化钾(90.2 g, 544 mmol)溶于水(150 mL)的悬浊液滴加至其中,室温下搅拌2小时,用乙酸乙酯萃取(200 mL×3),再水洗(50mL×3),最后有机层用无水硫酸镁干燥,减压蒸馏蒸去溶剂后,用无水乙醇重结晶,得黄色固体23.2 g。产率66%,熔点:83-84 oC;
核磁谱图数据为:1H NMR (CDCl3, 400 MHz):δ = 7.96 (s, 2H, ArH), 6.23 (s, 1 H, OH)。
(ii)化合物3b的合成
在50 mL圆底烧瓶中,将化合物2 (1.08 g, 3.0 mmol),碳酸钾(0.62 g, 4.5 mmol)和溴代烷(3.3 mmol)溶于无水乙腈(12 mL)中,85 °C下搅拌12小时,抽滤。滤液中加入适量盐酸酸化至弱酸性,用乙酸乙酯萃取(50mL×3),再水洗(30mL×5),有机层用无水硫酸镁干燥,减压蒸馏蒸去溶剂后,柱层析分离提纯,得到白色固体1.49 g。产率76%,熔点:75-76 °C;
核磁谱图数据为:1H NMR (CDCl3, 400 MHz):δ = 8.05 (s, 2 H, ArH), 4.04-4.00 (t, J = 6.2 Hz, 2 H, ArOCH2), 2.14 - 2.03 (m, 2 H, CH2CF2), 1.99- 1.92 (quin, 3J(H,H) = 7.0 Hz, 2H, OCH2CH2), 1.72 - 1.60 (m, 4 H, 2 CH2), 1.46 - 1.42 (m, 2 H, CH2)。
(iii)化合物4的合成
将化合物3b(284 mg, 0.4 mmol)溶于5 mL的乙醇当中,加入NaOH (10 mg, 2.5 mmol), H2O2 5滴, 升温到60 °C反应1小时。抽滤,得到白色固体,用乙酸乙酯萃取 (50 mL×3),再水洗 (30 mL×5),有机层用无水硫酸镁干燥,减压蒸馏蒸去溶剂后,柱层析分离提纯,得到白色固体251 mg,产率86 %,熔点:85-86 oC;
核磁谱图数据为:1H NMR (CDCl3, 400 MHz): δ= 8.20 (s, 2H, ArH), 5.96-5.66 (m, 2H, NH2), 4.02-3.99 (t, 2H, ArOCH2), 2.14-2.03 (m, 2H, ArOCH2CH2), 1.99-1.92 (m, 2H, ArOCH2CH2CH2), 1.72-1.58 (m, 4H, 2CH2), 1.56-1.50 (m, 2H, CH2)。
(iv)化合物6的合成
在100mL圆底烧瓶中,将中间体4(2.16 g, 6.5 mmol),甲基丁炔醇(1.09 g, 13 mmol),无水THF(20 mL),无水三乙胺(10 mL)依次加入,氮气保护下,超声除氧15分钟, 加入四(三苯基膦)钯(70mg, 0.10 mmol),碘化亚铜(46 mg, 0.24 mmol)后,室温下搅拌12小时,抽滤,滤液通过减压蒸馏蒸去溶剂后,柱层析分离提纯(石油醚:乙酸乙酯 = 3:1)。得黄色固体1.67 g。产率89%;熔点:57-58 °C;
核磁谱图数据为:1H NMR (CDCl3, 500 MHz): δ=7.35-7.34(d, 2H, J = 7.6 Hz, ArH), 6.84-6.83(d, 2H, J = 7.7 Hz, ArH), 4.49-4.47(m, 1H, CHO), 4.17-4.15(m, 1H, ArOCH2), 4.06-4.03(m, 1H, CH2O), 3.95 -3.89(m, 2H, ArOCH2, CH2O), 1.68(s, 6H, 2CH3), 1.47(s, 3H, CH3), 1.41(s, 3H, CH3)。
(v)化合物7的合成
在50mL圆底烧瓶中,将中间体6 (1.59 g, 5.5 mmol),氢氧化钾(3.08 g, 55 mmol),无水甲苯(20 mL)依次加入,加热回流2小时,冷却至室温,加入适量稀盐酸化至中性,并用乙酸乙酯萃取(50mL×3),再水洗(30mL×3),有机层用无水硫酸镁干燥,减压蒸馏蒸去溶剂后,柱层析分离提纯(石油醚:乙酸乙酯 = 20:1),得黄色液体1.12 g,产率88%;
核磁谱图数据为:1H NMR (CDCl3, 500 MHz): δ=7.43-7.42(d, 2H, J = 8.1 Hz, ArH), 6.86-6.85(d, 2H, J = 8.2 Hz, ArH), 4.48(m, 1H, CHO), 4.17-4.15(m, 1H, ArOCH2), 4.05-4.04(m, 1H, CH2O), 3.96 -3.95(m, 1H, ArOCH2,), 3.90(m, 1H, CH2O), 3.00(s, 1H, ArCCH), 1.46(s, 3H, CH3), 1.40(s, 3H, CH3)。
(vi)化合物8的合成
在25mL两口圆底烧瓶中,将化合物3 (0.5 mmol)和化合物7 (0.28 g, 1.2 mmol)溶于无水THF (7 mL)和无水三乙胺 (5 mL)中,氮气保护下,超声除氧15分钟,加入四(三苯基膦)钯 (35 mg, 0.05 mmol),碘化亚铜 (23 mg, 0.12 mmol)后,室温下搅拌15小时,抽滤,滤液通过减压蒸馏蒸去溶剂后,柱层析分离提纯,得到棕红色固体:396 mg, 产率88 %,熔点:71-72 °C;
核磁谱图数据为:1H NMR (CDCl3, 400 MHz):.δ= 7.89 (s, 2H, ArH), 7.46-7.44 (d, 4H, J = 8.8 Hz ArH), 6.91-6.89 (d, 4H, J = 8.8 Hz, ArH), 4.52-4.46 (m, 2H, 2OCH), 4.42 (s, 2H, ArOCH2CH2), 4.20-4.16 (m, 2H, ArOCH2), 4.09-4.05 (m, 2H, OCH2), 3.99-3.95 (m, 2H, ArOCH2), 3.92-3.89 (m, 2H, OCH2), 2.00-1.87 (m, 6H, 3ArOCH2CH2), 1.87-1.83 (m, 2H, CH2), 1.60-1.56 (m, 2H, CH2), 1.47 (s, 6H, 2CH3), 1.41 (s, 6H, 2CH3)。
(vii)化合物9-CONH2-C6H12C4F9的合成
在50mL圆底烧瓶中,将化合物8 (0.25 mmol)、PPTS (63 mg, 0.25 mmol)和无水甲醇(15 mL)依次加入,加热回流12小时,冷却至室温。将乙酸乙酯(50 mL)加入其中,饱和碳酸氢钠溶液洗涤,水层用乙酸乙酯萃取(20mL×3),合并有机层,并用水洗(20mL×3),有机层用无水硫酸镁干燥,硅胶拌样并减压蒸馏蒸去溶剂后,柱层析分离提纯,得到白色固体:129 mg, 产率63 %,熔点:73-74 °C;
核磁谱图数据为:1H NMR (CDCl3, 400 MHz): δ (ppm): 1H NMR (CDCl3, 400 MHz): δ (ppm): 7.87 (s, 2 H, ArH), 7.39-7.37 (d, 4 H, J = 8.4 Hz, ArH), 6.86-6.84 (d, 4 H, J = 8.8 Hz, ArH ), 4.35-4.32 (t, 2 H, J = 6.0 Hz, ArOCH2CH2), 4.00-3.95 (m, 6 H, 3CH2), 3.73-3.69 (m, 2 H, CH2), 3.66-3.62 (m, 2 H, CH2), 1.99-1.90 (m, 2 H, CH2), 1.85-1.80 (m, 2 H, ArOCH2CH2CH2), 1.62-1.55 (m, 2 H, ArOCH2CH2CH2CH2), 1.53-1.45 (m, 2 H, ArOCH2CH2CH2CH2CH2), 1.41-1.37 (m, 2 H, ArOCH2CH2CH2CH2CH2CH2). 13C NMR (100 MHz, CDCl3), δ (ppm): 168.78(1C), 162.91(1C), 159.05(2C), 132.82(6C), 132.26(2C), 128.30(1C), 117.87(2C), 115.10(2C), 114.55(6C), 94.34(2C), 83.45(2C), 74.03(1C), 70.23(2C), 68.90(2C), 63.19(2C), 30.49(1C), 30.11(1C), 28.83(1C), 25.85(1C), 19.93(1C)。
所述的D-A-D型弓形波拉(Bola)化合物分子9-CONH2-C6H12C4F9,将该D-A-D型弓形波拉(Bola)化合物以 5%的重量百分比掺杂在聚合物材料聚碳酸脂(PC)中。在 5 g PC中加入 20 mL 四氢呋喃(THF)作为溶剂,充分搅拌均匀,用 0.22 μm 的针筒过滤器去除少量不溶杂质。然后采用提拉法,在经过清洁处理的导电玻璃(ITO 玻璃)上制备厚度为 0.5~1 μm 的薄膜。将所制得的薄膜置于烘箱中,在 70 °C温度下加热 2 小时,用以去除膜内的溶剂。利用 ZYGONewView200 表面轮廓仪测量薄膜的厚度,用自建的棱镜耦合法测量薄膜材料折射率的装置,测量得到薄膜材料的折射率。
通过测量实时极化过程中的光学二次谐波产生来研究有机分子掺杂聚合物薄膜的最佳极化温度和二阶光学非线性的大小。聚合膜样品垂直固定于一个加热盒内,采用电晕极化法对样品进行极化,从而使其中的非线性有机分子有序排列。锁模Nd:YAG激光器产生的1.064 µm的激光(脉宽为 30ps,重复率为 10Hz)经格兰棱镜和λ/2 波片成为p偏振的光,入射到极化聚合膜样品上。产生的 532nm的倍频光经干涉滤光片后用光电倍增管探测,经Boxcar处理后由计算机记录。在实验过程中,先给样品加上3-5 kV的极化电压,然后给样品加温。随着温度的增加,有机分子的取向性增加,光学二次谐波信号增大;但当温度增加到一定程度时,样品的导电性增强,有机分子的热运动也加强,使得有机分子取向性变差,光学二次谐波信号变小;我们将信号开始变小时的温度定义为最佳极化温度。它和聚合物基质的玻转温度直接相关。这时,保持极化电场,将温度慢慢降至室温,然后再撤去电场。
吸收光谱的测量:采用岛津UV-3101PC型紫外-可见-近红外分光光度计。分别测量极化前后的吸收光谱,并进行比对。
结果发现,将有机分子掺杂的聚合物薄膜9-CONH2-C6H12C4F9/PC进行了实时极化光学二次谐波信号测量,测量结果见图5所示。图5中,方块表示升温过程中SHG的信号,圆点表示降温过程中的SHG信号。
极化聚合膜的二阶非线性系数的大小,除取决于分子二阶非线性极化率β大小和非线性有机分子的取向外,还和聚合物中所含非线性有机分子的数密度N(cm-3)直接相关。因此我们改变了9-CONH2-C6H12C4F9有机分子在PC基质中掺杂的量的大小,对9-CONH2-C6H12C4F9/PC样品SHG信号随9-CONH2-C6H12C4F9有机分子掺杂浓度的关系进行了研究,结果见图 6 所示。
采用Maker条纹法测量了不同入射角度下9-CONH2-C6H12C4F9/PC样品的SHG信号,和标准石英样品SHG信号相比对,并根据考虑吸收时极化聚合膜二阶光学非线性系数计算的H-H理论,计算得到9-CONH2-C6H12C4F9/PC样品的二阶光学非线性系数。对30%比例9-CONH2-C6H12C4F9掺杂的极化聚合膜样品,经计算得到,二阶光学非线性系数值为227 pm/V。这个数值要高于大多数先前报道的树枝状聚合物(约为221 pm/V)的二阶光学非线性系数值。该类化合物分子量小,且分子基团容易调节,既具有了无机非线性光学材料的优势,同时避免了高分子聚合物的弊端,因此该类化合物在光学材料方面具有更广阔的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!