高稳定性近红外二区纳米荧光探针及其制备方法和应用与流程
本发明属于近红外二区纳米探针生物成像技术领域,具体涉及新型高稳定性近红外二区纳米荧光探针及其制备方法,以及q3-nps探针在多模态成像及光热治疗上的应用。
背景技术:
众所周知,癌症是威胁人类生命健康的最主要疾病之一,对经济社会的健康发展造成了极大的阻碍。根据国家癌症中心发布的数据,我国的肿瘤发病率逐年增长,并且呈现年轻化趋势,发展肿瘤诊断及治疗的材料、新技术迫在眉睫。近年来,纳米探针作为肿瘤诊疗一体化的新策略受到越来越多研究者的关注,它通过将肿瘤诊断剂及治疗剂结合一起制备成纳米颗粒,一次给药同时实现肿瘤的成像及治疗,极大了简化了传统肿瘤诊疗步骤,最重要的是纳米药物可以克服小分子药物体内循环时间短的缺陷,通过epr效应可以更好的在肿瘤细胞内聚集。因此,开发新型的肿瘤诊疗一体化试剂具有重要的临床应用价值。近红外二区材料是指发射波长在1000-1700nm波长范围的材料,与传统近红外一区材料相比,近红外二区材料具有更长的发射波长;但是现有近红外二区材料稳定性较差,而且诊疗一体化能力弱。
技术实现要素:
为了克服上述现有材料及技术中存在的问题,本发明构建两种新型高稳定性近红外二区纳米荧光探针,利用其近红外二区发射的优势进行深组织活体荧光、光声多模态成像,同时进行光热治疗实现肿瘤诊疗一体化。
本发明采用以下技术方案:
高稳定性近红外二区纳米荧光探针,其具有核壳结构;
所述壳为聚合物,核为如下化学结构式:
或者所述核为dsf,壳为如下化学结构式:
本发明中,ha为透明质酸,优选分子量为3.5~5万。
本发明中,作为壳的聚合物为聚乙二醇-聚酯(peg-pcl),化学结构式如下:
优选聚乙二醇的分子量为2000~10000,聚酯的分子量为2000~5000。
本发明中,dsf为如下化学结构式:
本发明公开了上述高稳定性近红外二区纳米荧光探针在制备近红外二区成像试剂中的应用或者上述高稳定性近红外二区纳米荧光探针在小动物活体近红外二区荧光成像或者光声成像中的应用;或者在制备近红外二区活体荧光成像试剂或者光声成像试剂中的应用;或者在肿瘤靶向性光热治疗中的应用;或者在制备近红外二区肿瘤靶向性光热试剂中的应用。
本发明所述高稳定性近红外二区纳米荧光探针的制备方法包括如下步骤:
(1)萘二甲酰亚胺与3-溴丙炔反应,得到化合物q1;
(2)化合物q1与甲基氯化镁反应,得到化合物q2;
(3)化合物q2与2-氯-3-(羟亚甲基)-1-环己烯-1-羧醛反应,得到化合物q3;
(4)化合物q3与聚合物在超声条件下自组装反应,得到高稳定性近红外二区纳米荧光探针,称为q3-nps;
或者
(5)萘二甲酰亚胺与3-溴丙酸甲酯反应,得到化合物m1;
(6)化合物m1与甲基氯化镁反应,得到化合物m2;
(7)化合物m2与2-氯-3-(羟亚甲基)-1-环己烯-1-羧醛反应,得到化合物m3;
(8)化合物m3与巯基乙胺反应,得到化合物ha-m3;
(9)化合物m3-nh2与透明质酸钠反应,得到化合物ha-m3;
(10)化合物ha-m3与双硫仑(dsf)在超声条件下自组装反应,得到高稳定性近红外二区纳米荧光探针,称为ha-m3-dsf。
上述技术方案中,萘二甲酰亚胺与3-溴丙炔的反应在第一有机溶剂中进行;化合物q1与甲基氯化镁的反应在第二有机溶剂中进行;化合物q2与2-氯-3-(羟亚甲基)-1-环己烯-1-羧醛的反应在第三有机溶剂中进行;化合物q3与聚合物的自组装反应在第四无机溶剂中进行。优选的,所述第一有机溶剂为n,n-二甲基甲酰胺;所述第二有机溶剂为四氢呋喃;所述第三有机溶剂为含有乙酸钠的乙酸酐,2-氯-3-(羟亚甲基)-1-环己烯-1-羧醛、乙酸钠的摩尔比为1∶2.2;所述第四无机溶剂为水,比如去离子水或者超纯水。
上述技术方案中,萘二甲酰亚胺与3-溴丙炔的摩尔比为1∶3;化合物q1和甲基氯化镁的摩尔比为1∶8;化合物q2、2-氯-3-(羟亚甲基)-1-环己烯-1-羧醛的摩尔比为2.2∶1;化合物q3与聚合物的质量比为1∶4,利用两亲性聚合物peg-pcl在水相中的自组装包裹化合物q3,得到近红外二区成像剂。
根据本发明技术方案,其中:
步骤(1)中,萘二甲酰亚胺与3-溴丙炔的反应在n,n-二甲基甲酰胺溶剂中进行,萘二甲酰亚胺与3-溴丙炔的摩尔比为1∶3;优选的,反应在氮气保护下进行,反应为回流反应6h;
步骤(2)中,化合物q1与甲基氯化镁的反应在四氢呋喃中进行,化合物q1和甲基氯化镁的摩尔比为1∶8;优选的,反应在氮气保护下进行,所述反应为回流反应2h;
步骤(3)中,化合物q2与2-氯-3-(羟亚甲基)-1-环己烯-1-羧醛的反应在乙酸钠存在的乙酸酐溶剂中进行,化合物q2、2-氯-3-(羟亚甲基)-1-环己烯-1-羧醛和乙酸钠的摩尔比为2.2∶1∶2.2;优选的,反应在氮气保护下进行,反应为常温反应4h;
步骤(4)中,自组装反应在水相溶剂中进行,化合物q3与聚合物的质量比为1∶4;优选的,自组装为室温超声反应20min;将化合物q3与聚合物的混合溶液加入水中进行自组装。
上述技术方案中,萘二甲酰亚胺与3-溴丙酸甲酯的反应在第一有机溶剂中进行;化合物m1与甲基氯化镁的反应在第二有机溶剂中进行;化合物m2与2-氯-3-(羟亚甲基)-1-环己烯-1-羧醛的反应在第三有机溶剂中进行;化合物m3与巯基乙胺的反应在第一有机溶剂中进行;化合物m3-nh2与ha的反应在第一无机溶剂中进行;化合物ha-m3与双硫仑(dsf)在超声条件下自组装反应在第一无机溶剂中进行。优选的,所述第一有机溶剂为n,n-二甲基甲酰胺;所述第二有机溶剂为四氢呋喃;所述第三有机溶剂为含有乙酸钠的乙酸酐,2-氯-3-(羟亚甲基)-1-环己烯-1-羧醛、乙酸钠的摩尔比为1∶2.2;所述第一无机溶剂为水,比如去离子水或者超纯水。
上述技术方案中,萘二甲酰亚胺与3-溴丙酸甲酯的摩尔比为1∶3;化合物m1和甲基氯化镁的摩尔比为1∶8;化合物m2、2-氯-3-(羟亚甲基)-1-环己烯-1-羧醛的摩尔比为2.2∶1;化合物m3与巯基乙胺的摩尔比为1∶1;化合物m3-nh2与ha的摩尔比为20∶1;化合物ha-m3与dsf的质量比为4∶1,利用聚合物ha-m3在水相中的自组装包裹化合物dsf,得到近红外二区成像剂。
根据本发明技术方案,其中:
步骤(5)中,萘二甲酰亚胺与3-溴丙酸甲酯的反应在n,n-二甲基甲酰胺溶剂中进行,萘二甲酰亚胺与3-溴丙酸甲酯的摩尔比为1∶3;优选的,反应在氮气保护下进行,反应为回流反应6h。
步骤(6)中,化合物m1与甲基氯化镁的反应在四氢呋喃中进行,化合物m1和甲基氯化镁的摩尔比为1∶8;优选的,反应在氮气保护下进行,所述反应为回流反应2h。
步骤(7)中,化合物m2与2-氯-3-(羟亚甲基)-1-环己烯-1-羧醛的反应在乙酸钠存在的乙酸酐溶剂中进行,化合物m2、2-氯-3-(羟亚甲基)-1-环己烯-1-羧醛和乙酸钠的摩尔比为2.2∶1∶2.2;优选的,反应在氮气保护下进行,反应为常温反应4h。
步骤(8)中,化合物m3与巯基乙胺的反应在n,n-二甲基甲酰胺溶剂中进行,化合物m3与巯基乙胺的摩尔质量比为1∶1;优选的,反应为常温反应48h。
步骤(9)中,化合物m3-nh2与ha的反应在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)、n-羟基琥珀酰亚胺(nhs)存在的水相溶剂中进行,化合物m3与ha的摩尔质量比为20∶1;优选的,反应为常温反应8h。
步骤(10)中,自组装在水相溶剂中进行,化合物ha-m3与dsf的摩尔质量比为20∶1;优选的,自组装为室温超声反应20min;将化合物ha-m3与dsf的混合溶液加入水中进行自组装。
本发明中,化合物q1、化合物q2、化合物q3、纳米颗粒q3-nps(新型高稳定性近红外二区纳米荧光探针)的化学结构式分别如下:
本发明中,化合物m1、化合物m2、化合物m3、化合物ha-m3、纳米颗粒ha-m3-dsf(新型高稳定性近红外二区纳米荧光探针)的化学结构式分别如下:
利用上述高稳定性近红外二区纳米荧光探针q3-nps进行近红外二区荧光活体成像的方法,包括以下步骤,将所述高稳定性近红外二区纳米荧光探针的水溶液尾静脉注射入荷瘤小鼠的体内,麻醉状态下观察不同时间点活体荧光成像效果;完成活体近红外二区荧光成像。
利用上述高稳定性近红外二区纳米荧光探针进行近红外二区活体光声成像的方法包括以下步骤,将所述高稳定性近红外二区纳米荧光探针的水溶液尾静脉注射入荷瘤小鼠的体内,麻醉状态下观察不同时间点活体光声成像效果;完成活体近红外二区光声成像。
利用上述高稳定性近红外二区纳米荧光探针进行肿瘤光热治疗的方法包括以下步骤,将所述高稳定性近红外二区纳米荧光探针的水溶液尾静脉注射入荷瘤小鼠的体内,16h后进行808nm激光照射肿瘤位置(1w/cm2,10min),记录肿瘤体积及小鼠体重变化情,观察肿瘤治疗效果。
由于上述技术方案的运用,本发明与现有技术相比具有如下优点:
(1)本发明中设计合成了两种新型高稳定性近红外二区纳米荧光探针,可以实现活体近红外二区荧光及光声成像;
(2)本发明中目标探针对肿瘤组织具有良好的被动靶向性,肿瘤的光热治疗效果显著,实现对肿瘤的诊疗一体化。
附图说明
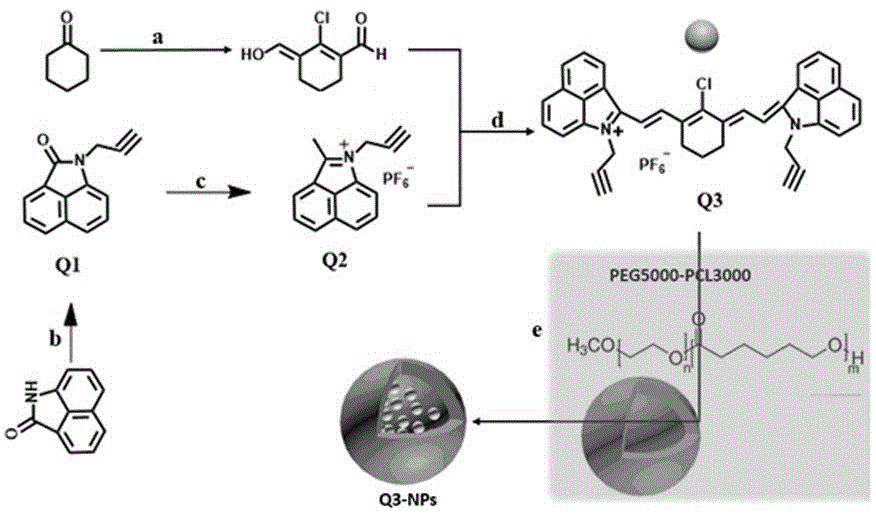
图1为新型高稳定性近红外二区纳米荧光探针的合成示意图;
图2为(a)实验组探针q3-nps在水溶液中的紫外可见近红外吸收及近红外二区荧光光谱,(b)实验组探针q3-nps和q3水溶液的水合粒径,(c)实验组探针q3-nps的透射电子显微镜图像的粒径统计图,(d)实验组探针q3-nps和q3的水溶液的透射电子显微镜图像和近红外二区荧光图像;
图3为(a)实验组探针q3-nps尾静脉注射入小鼠体内不同时间点的近红外二区活体荧光成像,(b)对应(a)中荧光强度随时间变化,(c)实验组探针q3-nps尾静脉注射入小鼠体内16h二区活体荧光成像导航的肿瘤切除手术前后对比图;
图4为(a)实验组探针q3-nps尾静脉注射入小鼠体内不同时间点的活体光声成像,(b)对应(a)中光声强度随时间变化,(c)q3-nps在水溶液中的光声强度与浓度的线性关系;
图5为实验组探针q3-nps以及q3分别尾静脉注射入小鼠体内6h后,808nm激光器(1w/cm2,10min)照射后的小鼠升温图像,(b)不同组小鼠经过光热治疗后的相对肿瘤体积,(c)不同组小鼠经过光热治疗后的肿瘤体积,(d)不同组小鼠经过光热治疗后的体重变化。
图6为新型高稳定性近红外二区纳米荧光探针的合成示意图;
图7为近红外染料m3的质谱;
图8为(a)实验组探针ha-m3-dsf水溶液的水合粒径,(b)实验组探针ha-m3-dsf水溶液的近红外二区荧光图像。
具体实施方式
下文将结合附图和具体实施例来进一步阐述本发明。应当理解的是,这些实施例仅用于解释和说明本发明中的技术方案,而并非旨在限制本发明的范围。此外,除非另有说明,下列实施例中所使用的材料、试剂、仪器等均可通过商业手段获得。
本发明构建、合成新型高稳定性近红外二区纳米荧光探针q3-nps的步骤如下:
萘二甲酰亚胺与3-溴丙炔发生亲核取代反应,得到化合物q1;化合物q1与甲基氯化镁反应,得到化合物q2;化合物q2与2-氯-3-(羟亚甲基)-1-环己烯-1-羧醛反应,得到化合物q3;化合物q3与聚合物(比如peg5000-pcl3000)在超声条件下自组装反应,得到高稳定性近红外二区纳米荧光探针q3-nps。
(1)新型高稳定性近红外二区纳米荧光探针的活体荧光成像:
将上述获得的实验组探针q3-nps和对照组探针q3分别溶于pbs溶液中(浓度:100μg/ml,体积:200μl),以尾静脉注射的方式将探针注入荷瘤(4t1小鼠乳腺癌)的balb/c雌性白鼠体内,随后置于小动物seriousii900-1700nm近红外二区活体成像系统中(激发波长:808nm),实时观察成像效果,最终通活体成像分析软件计算裸鼠的肿瘤部位在不同时间点的荧光强度。
(2)新型高稳定性近红外二区纳米荧光探针的活体光声成像:
将上述获得的实验组探针q3-nps溶于pbs溶液中(浓度:100μg/ml,体积:200μl),以尾静脉注射的方式将探针注入荷瘤(4t1小鼠乳腺癌)的balb/c雌性白鼠体内,同时打开小动物光声断层扫描成像系统,待光声成像仪水浴池中的水温达37°c时,放入麻醉好的小鼠,扫描小鼠的肿瘤部位图像。之后将获得的光声成像数据使用msotinsight/invision分析软件进行重建分析。
(3)新型高稳定性近红外二区小分子荧光探针的光热治疗:
将荷瘤(4t1小鼠乳腺癌)的balb/c雌性白鼠(肿瘤体积约20mm3)随机分成4组(n=5):仅尾静脉注射pbs(10mm,200μl)的小鼠(第1组,简写pbs);尾静脉注射pbs(10mm,200μl)后808nm激光照射处理的小鼠(第2组,简写pbs+laser);仅尾静脉注射q3-nps(100μg/ml,200μl)的小鼠(第3组,简写q3-nps);尾静脉注射q3-nps(100μg/ml,200μl)后808nm激光照射处理的小鼠(第4组,简写q3-nps+laser)。尾静脉注入材料后16h后进行808nm光热治疗(1w/cm2,10min),使用红外相机(ftir,a65)记录小鼠光热治疗图像,并分析肿瘤部位升温曲线。治疗后,每隔一天记录小鼠肿瘤体积变化并绘制小鼠存活率曲线。
实施例1:新型高稳定性近红外二区纳米荧光探针q3-nps的合成
(1)氮气保护下,150ml圆底烧瓶中加入萘二甲酰亚胺(1.69g,10mmol)、3-溴丙炔(2.38g,20mmol)以及10ml无水n,n-二甲基甲酰胺作为溶剂,混合液加热到100℃磁力搅拌并回流5h。反应完成,冷却至室温,混合物倒入500ml冰水混合液中,并用1mol/l盐酸水溶液调节ph至中性,减压抽滤,粗产物使用硅胶柱层析纯化(石油醚:乙酸乙酯=9:1,v/v),产物为黄色固体化合物q1(1.56g,产率:75%)。maldi-tof:m/z,cal:208.07,found:208.17[m+].
(2)氮气保护的冰浴条件下,100ml圆底烧瓶中加入化合物q1(1.03g,5.0mmol)以及20ml无水四氢呋喃作为溶剂,逐滴加入甲基氯化镁的四氢呋喃溶液(13.4ml,3mol/l),随后撤去冰浴,混合液回流搅拌反应2h。混合液倒入酸性冰水浴中,搅拌条件下加入六氟磷酸钾(0.92g,5.0mmol),继续室温搅拌6h。反应完成,析出浅绿色固体后,抽滤,得绿色固体化合物q2,产物室温保存,不需进一步处理直接作为下一步原料。
(3)氮气保护下,50ml圆底烧瓶中加入化合物q2(0.77g,2.19mmol)、2-氯-3-(羟亚甲基)-1-环己烯-1-羧醛(0.17g,0.98mmol)、无水醋酸钠(0.16g,2.0mmol)以及20ml无水乙酸酐作为溶剂,混合液室温搅拌反应4h。反应完成,混合液减压浓缩,硅胶柱层析纯化(二氯甲烷:甲醇=50:1,v/v),产物为深绿色固体化合物q3(0.44g,产率:63%),为对照组探针。maldi-tof:m/z,cal:547.19,found:547.26[m+].
(4)q3(1mg)和peg5000-pcl3000(4mg)分别溶于100µl二甲基亚砜中。将q3的二甲基亚砜溶液加入到peg5000-pcl3000的二甲基亚砜溶液中,超声10分钟得到混合溶液。在超声条件下将混合物滴加到4ml超纯水中,再超声处理20分钟。所得溶液用蒸馏水透析2天,在分子量截止(mwco)为14kda的透析袋中去除dmf,合成q3-nps,为高稳定性近红外二区小分子荧光探针。
上述反应示意图以及涉及各部产物的化学结构式如图1中的所示。
实施例2:新型高稳定性近红外二区纳米荧光探针的光物理性质
将实施例1中制得的实验组探针q3-nps用超纯水稀释至浓度为10μg/ml,并使用紫外可见近红外分光光度计及荧光分光光度计测其紫外可见近红外光谱及荧光光谱。如图2(a)所示,结果表明,探针q3-nps的最佳吸收在750nm;在水溶液中显示出强烈的近红外二区发射荧光信号。
实验组探针q3-nps和对照组探针q3的水溶液的水合粒径如图2(b)所示,透射电子显微镜图像如图2(d)所示,透射电子显微镜图的粒径统计如图2(c)所示,将实施例1中制得的实验组探针q3-nps和对照组探针q3用超纯水稀释至浓度为10μg/ml,测试其水合粒径大小。结果表明,实验组探针q3-nps在水中以平均粒径为75nm的纳米颗粒存在,而对照组探针由于较差的水溶性,在水溶液中基本未溶解,不成纳米颗粒。
实验组探针q3-nps和对照组探针q3的水溶液在808nm激光器激发下,1000lp波片下的近红外二区成像如图2(d)所示,将实施例1中制得的实验组探针q3-nps和对照组探针q3用超纯水稀释至浓度为10μg/ml,转移至500μl离心管中并置于近红外二区成像系统中。结果表明,与对照组探针q3相比,实验组探针q3-nps直观地显示出更强的近红外二区发射。
实施例3:新型高稳定性近红外二区纳米荧光探针的活体近红外二区荧光成像
将实施例1中制得的实验组探针q3-nps溶于pbs溶液中(100μg/ml,200μl),以尾静脉注射的方式将探针注入荷瘤(4t1小鼠乳腺癌)的balb/c/nu雌性白鼠体内,随后置于小动物seriousii900-1700nm近红外二区活体成像系统中(激发波长:808nm),实时观察成像效果,最终通活体成像分析软件计算裸鼠的肿瘤部位在不同时间点的荧光强度。实验组探针q3-nps不同时间点的近红外二区活体荧光成像如图3(a)所示,结果表明,实验组探针q3-nps随时间推移在24h时肿瘤部位荧光最强,随后荧光强度逐渐降低。图3(b)为对应3(a)中肿瘤部位荧光强度随时间变化,可以直观的看出,实验组中肿瘤部位的荧光信号呈现先增后减的趋势,且在24h时达到峰值。图3(c)为将实施例1中制得的实验组探针q3-nps溶于pbs溶液中(100μg/ml,200μl),尾静脉注射入小鼠体内16h后进行肿瘤切除手术前后二区荧光成像图像。
实施例4:新型高稳定性近红外二区纳米荧光探针的活体光声成像
将实施例1中制得的实验组探针q3-nps溶于pbs溶液中(100μg/ml,200μl),以尾静脉注射的方式将探针注入荷瘤(4t1小鼠乳腺癌)的balb/c/nu雌性白鼠体内,同时打开小动物光声断层扫描成像系统,待光声成像仪水浴池中的水温达34°c时,放入麻醉好的小鼠,扫描小鼠的肿瘤部位图像。之后将获得的光声成像数据使用msotinsight/invision分析软件进行重建分析。实验组探针q3-nps不同时间点的光声成像如图4(a)所示,结果表明,实验组随时间的增强肿瘤部位的光声强度呈现先增后减的变化趋势,且在8h时附近光声强度达到最大值。图4(b)为对应4(a)中肿瘤部位光声强度随时间变化,可以直观的看出,实验组中肿瘤部位的光声信在8h时附近达到峰值。
实施例5:新型高稳定性近红外二区纳米荧光探针的光热治疗
将荷瘤(4t1小鼠乳腺癌)的balb/c雌性小鼠(肿瘤体积约20mm3)随机分成6组(n=5),将实施例1中制得的实验组探针q3-nps溶于pbs溶液中(浓度:100μg/ml,体积:200μl),以尾静脉注射的方式将探针分别注入小鼠体内,16h后进行808nm光热治疗(1w/cm2,10min),使用红外相机(ftir,a65)记录小鼠光热治疗图像。如图5(a)所示,为实验组探针q3-nps以及pbs组分别尾静脉注射入小鼠体内16h后,808nm激光器(1w/cm2,10min)照射后的小鼠升温图像,明显地,pbs组在0-10min内光热信号无明显变化,而实验组光热信号随时间增加显著增强。图5(c)为不同组小鼠经过光热治疗后的相对肿瘤体积,可以看出除了实验组q3-nps+laser组肿瘤大小在经过光热治疗后逐渐减小至消失,其他组小鼠的肿瘤大小都不同程度的增大。图5(d)为不同组小鼠经过光热治疗后的体重变化,各组小鼠体重变化基本相同,无明显差异。
本发明构建、合成新型高稳定性近红外二区纳米荧光探针ha-m3-dsf的步骤如下:
萘二甲酰亚胺与3-溴丙酸甲酯发生亲核取代反应,得到化合物m1;化合物m1与甲基氯化镁反应,得到化合物m2;化合物m2与2-氯-3-(羟亚甲基)-1-环己烯-1-羧醛反应,得到化合物m3;化合物m3与巯基乙胺反应,得到化合物m3-nh2;化合物m3-nh2与ha反应,得到化合物ha-m3;化合物ha-m3与dsf在超声条件下自组装反应,得到高稳定性近红外二区纳米荧光探针ha-m3-dsf。
实施例6:新型高稳定性近红外二区纳米荧光探针ha-m3-dsf的合成。
(1)氮气保护下,150ml圆底烧瓶中加入萘二甲酰亚胺(1.69g,10mmol)、3-溴丙酸甲酯(3.34g,20mmol)以及10ml无水n,n-二甲基甲酰胺作为溶剂,混合液加热到100℃磁力搅拌并回流5h。反应完成,冷却至室温,混合物倒入500ml冰水混合液中,并用1mol/l盐酸水溶液调节ph至中性,减压抽滤,粗产物使用硅胶柱层析纯化(石油醚:乙酸乙酯=9:1,v/v),产物为黄色固体化合物m1;
(2)氮气保护的冰浴条件下,100ml圆底烧瓶中加入化合物m1(1.269g,5.0mmol)以及20ml无水四氢呋喃作为溶剂,逐滴加入甲基氯化镁的四氢呋喃溶液(13.4ml,3mol/l),随后撤去冰浴,混合液回流搅拌反应2h。混合液倒入酸性冰水浴中,搅拌条件下加入六氟磷酸钾(0.92g,5.0mmol),继续室温搅拌6h。反应完成,析出浅绿色固体后,抽滤,得绿色固体化合物m2,产物室温保存,不需进一步处理直接作为下一步原料;
(3)氮气保护下,50ml圆底烧瓶中加入化合物m2(0.88g,2.19mmol)、2-氯-3-(羟亚甲基)-1-环己烯-1-羧醛(0.17g,0.98mmol)、无水醋酸钠(0.16g,2.0mmol)以及20ml无水乙酸酐作为溶剂,混合液室温搅拌反应4h。反应完成,混合液减压浓缩,硅胶柱层析纯化(二氯甲烷:甲醇=50:1,v/v),产物为灰黑色色固体化合物m3;
(4)氮气保护下,50ml圆底烧瓶中加入化合物m3(0.2g,0.3mmol)、巯基乙胺(11.57mg,0.15mmol)以及10mldmf作为溶剂,混合液室温搅拌反应48h。反应完成,混合液减压浓缩,c18反向制备柱纯化,产物为灰黑色固体化合物m3-nh2;
(5)氮气保护下,50ml圆底烧瓶中加入化合物m3-nh2(10mg,0.015mmol)、透明质酸钠(30mg,相对分子质量4万)、edc(14.3mg,0.075mmol)、nhs(8.6mg,0.075mmol)以及5ml超纯水作为溶剂,混合液室温搅拌反应8h。反应完成,在分子量截止(mwco)为14kda的透析袋中处理48h,冷冻干燥处理,产物为浅黑色固体化合物ha-m3;
(6)dsf(1mg)和ha-m3(4mg)分别溶于100µl二甲基亚砜和超纯水中。将dsf的二甲基亚砜溶液加入到ha-m3的水溶液中,超声10分钟得到混合溶液。在超声条件下将混合物滴加到4ml超纯水中,再超声处理20分钟。所得溶液用蒸馏水透析2天,在分子量截止(mwco)为14kda的透析袋中去除dmf,合成ha-m3-dsf,为高稳定性近红外二区纳米荧光探针。
上述反应示意图以及涉及各部产物的化学结构式如图6中的所示。
实施例7:新型高稳定性近红外二区纳米荧光探针的光物理性质
如图7所示,将实施例6中制得的m3做质谱表征。结果表明其分子量与理论分子量完全吻合。如图8(a)所示,将实施例1中制得的实验组探针ha-m3-dsf用超纯水稀释至浓度为10μg/ml,测试其水合粒径大小。结果表明探针ha-m3-dsf在水中以平均粒径为150nm的纳米颗粒存在,一共测了三次。
将实施例6中制得的实验组探针ha-m3-dsf用超纯水稀释至浓度为10μg/ml,转移至500μl离心管中并置于近红外二区成像系统中。在808nm激光器激发下,1000lp波片下的近红外二区成像如图8(b)所示,结果表明,实验组探针ha-m3-dsf直观地显示出很强的近红外二区发射。
- 还没有人留言评论。精彩留言会获得点赞!