一种金纳米材料/碳量子点复合等离子体荧光纳米探针、其制备方法及应用
1.本发明涉及纳米生物材料合成技术领域,具体涉及一种金纳米棒/碳量子点复合等离子体荧光纳米探针、其制备方法及应用。
背景技术:
2.目前,光热治疗法用于抗肿瘤治疗已在世界范围内普遍开展,并且疗效显著。光热治疗法是基于等离子体纳米粒子在体内癌变部位的积累,利用红外光刺激下的局部表面质子共振的热效应来杀死癌细胞,从而达到杀死肿瘤的目的。与其他联合辅助方式相比,光热治疗法具有创伤小、副作用低和选择性高的优点。另外,有研究发现癌细胞对热刺激比正常细胞更加敏感。因此,这种治疗方式为肿瘤患者的治疗带来了希望。
3.其中,金纳米棒作为有效的光热纳米剂,具有独特的lspr光热效应、优良的生物相容性和纳米表面能量转移特性,且与荧光共振能量转移相比,具有更长的作用距离,已经被广泛应用于生物成像、光热治疗、药物输送和分子检测等领域。然而,癌症生物系统分子特征的复杂性使金纳米棒在临床诊疗应用中的特异性潜力并未完全发挥,因此有必要对金纳米棒进行改性以优化诊疗效果。
4.核仁作为真核细胞核内的无膜结构,是核糖体rna(rrna)和核糖体亚基装配的场所,并且核仁的大小和数量一直被作为恶性肿瘤预后的诊断参数。近些年来研究发现,核仁作为主要的“细胞压力感受器”,承担着沉重的代谢负担,对细胞的外部刺激极为敏感,是驱动癌症发展的应激反应的枢纽。因此,核仁更有希望成为光热治疗领域抗癌策略的目标靶点。
5.三磷酸腺苷(atp)作为人体内细胞储能和供能的重要物质,是生物体和生命现象的结构基础和功能基础。当人体遇到强烈刺激,如病菌侵犯或濒临死亡等严重情况时,atp会快速转化为二磷酸腺苷,同时释放出巨大的能量。因此快速且特异性地测定atp的含量是监测肿瘤细胞生长的重要手段。
6.在现有技术中,大多在金纳米材料表面修饰稳定性分子和靶向分子以提高金纳米材料的光热稳定性和靶向性。如cn109701017a公开了一种靶向金纳米锥复合材料,包括金纳米锥,所述金纳米锥表面包覆有预处理牛血清蛋白,且每个金纳米锥表面修饰有靶向分子,所述金纳米锥复合材料稳定性好,生物相容性高,可实现肿瘤的光热治疗。但金纳米锥复合材料并不能实现监测核仁形态及核仁成像,同时特异性测定细胞内atp含量以提高对肿瘤的诊疗效果,且目前关于监测核仁形态同时测定atp含量的金纳米复合材料的开发,还未有相关报道。
技术实现要素:
7.有鉴于此,本发明的目的在于提供一种金纳米材料/碳量子点复合等离子体荧光纳米探针、其制备方法及应用。所述金纳米材料/碳量子点复合等离子体荧光纳米探针在光
热治疗过程中既可以实现核仁成像,监测核仁形态,增加靶向核仁的特异性,提高对肿瘤细胞的热杀伤能力,减少对周围正常组织的损伤,同时还可以特异性检测atp含量,提高光热治疗对于肿瘤细胞的诊疗效果。
8.第一方面,本发明提供一种金纳米材料/碳量子点复合等离子体荧光纳米探针,包括金纳米材料和碳量子点;
9.所述金纳米材料表面修饰有atp核酸适配体和fa修饰的聚乙二醇;
10.所述碳量子点表面修饰有单链dna;
11.所述单链dna与atp核酸适配体中的部分或者全部序列的碱基互补。
12.优选地,所述金纳米材料、fa修饰的聚乙二醇和atp核酸适配体的摩尔比为1:(1-1.5):(1.8-2.2)。
13.优选地,所述fa修饰的聚乙二醇为fa修饰的巯基聚乙二醇。
14.优选地,所述金纳米材料包括金纳米棒。
15.优选地,所述金纳米棒的长径比为3.5-4。
16.优选地,所述atp核酸适配体的序列如seq id no:1所示:5sh-c6-tcgattc cctggggg agta ttg cggaggagg-cy5。
17.优选地,单链dna的序列如seq id no:2所示:nh
2-c6-act ccc cca ggt aat。
18.第二方面,本发明提供一种所述金纳米材料/碳量子点复合等离子体荧光纳米探针的制备方法,包括如下步骤:
19.将表面修饰有单链dna的碳量子点溶液与表面修饰有atp核酸适配体和fa修饰的聚乙二醇的金纳米材料溶液混合后,于30-40℃水浴中培养10-14h,得到金纳米材料/碳量子点复合等离子体荧光纳米探针。
20.优选地,所述表面修饰有单链dna的碳量子点溶液由包括以下步骤的制备方法制备得到:
21.将偶联剂、碳量子点溶液和单链dna混合,于2-6℃反应8-15h。
22.优选地,所述表面修饰有atp核酸适配体和fa修饰的聚乙二醇的金纳米材料溶液由包括以下步骤的制备方法制备得到:
23.(1)将还原剂与atp核酸适配体混合后进行避光反应,得到还原后的atp核酸适配体;
24.(2)将还原后的atp核酸适配体与金纳米材料溶液混合后反应,得到atp核酸适配体修饰的金纳米材料溶液;
25.(3)将fa修饰的聚乙二醇与atp核酸适配体修饰的金纳米材料溶液混合后反应,得到表面修饰有atp核酸适配体和fa修饰的聚乙二醇的金纳米材料溶液。
26.优选地,步骤(1)所述避光反应的温度为25-35℃,所述避光反应的时间为2-5h。
27.优选地,步骤(2)所述反应的温度为25-35℃,所述反应的时间为8-15h。
28.优选地,步骤(3)所述反应的温度为25-35℃,所述反应的时间为8-15h。
29.第三方面,本发明提供一种所述金纳米材料/碳量子点复合等离子体荧光纳米探针或由所述制备方法制备得到的金纳米材料/碳量子点复合等离子体荧光纳米探针在生物成像、制备光热治疗剂和/或atp检测中的应用。
30.与现有技术相比,本发明的有益效果为:
31.(1)本发明通过在金纳米材料表面修饰atp核酸适配体和fa修饰的聚乙二醇,在碳量子点表面修饰单链dna,借助atp核酸适配体和单链dna的碱基互补配对原则,将碳量子点复合在金纳米材料上,得到金纳米材料/碳量子点复合等离子体荧光纳米探针;
32.(2)所述金纳米材料/碳量子点复合等离子体荧光纳米探针,可用于生物成像、制备光热治疗剂和/或atp检测,其在光热治疗过程中既可以实现核仁成像,监测核仁形态,增加靶向核仁的特异性,提高对肿瘤细胞的热杀伤能力,减少对周围正常组织的损伤,同时还可以特异性检测atp含量,提高光热治疗对于肿瘤细胞的诊疗效果。
附图说明
33.图1为aunrs的长度分布图;
34.图2为aunrs的宽度分布图;
35.图3为aunrs的tem图像;
36.图4为cds的tem图像;
37.图5为aunrs-cds的tem图像;
38.图6为aunrs、aunrs-atp和fa-aunrs-atp的紫外可见光谱图;
39.图7为aunrs、cds和aunrs-cds的紫外可见光谱图;
40.图8为aunrs、aunrs-atp、fa-aunrs-atp、cds、cds-ss-dna和aunrs-cds的zeta电位结果图;
41.图9为cds在不同激发波长下的荧光光谱图;
42.图10为cds在不同浓度下的荧光光谱图;
43.图11为hepg2(人肝癌细胞)和hl-7702(人正常肝细胞)吸收的aunrs-cds含量图;
44.图12为不同激光照射强度下aunrs-cds探针溶液的温度随时间的变化情况图;
45.图13为aunrs-cds的温度反应与重复的开/关辐照周期变化情况图;
46.图14为激光照射前后的aunrs-cds探针溶液的吸光度变化情况图;
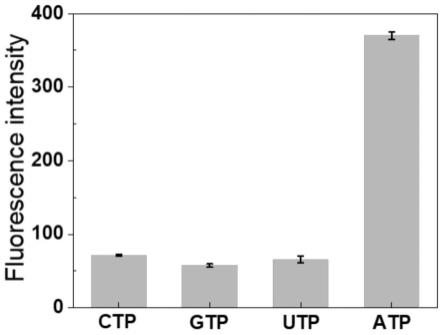
47.图15为aunrs-cds对hepg2细胞和hl-7702细胞的毒性结果图;
48.图16为hepg2细胞中aunrs-cds的细胞活力结果图;
49.图17为hl-7702细胞中aunrs-cds的细胞活力结果图;
50.图18为hepg2和hl-7702细胞中的体外光热性能结果图;
51.图19为aunrs-cds在不同atp浓度下的荧光光谱图;
52.图20为aunrs-cds在ctp、gtp、utp和atp存在下的荧光强度结果图;
53.图21为aunr-cds、aunr-cds+cacl2和aunrs-rancds的荧光图像结果图;
54.图22为aunrs-cds在不同照射时间下的荧光强度变化图;
55.图23为hoechst 33342和aunrs-cds共同染色dnase和rnase处理的hepg2活细胞用于荧光成像的结果图;
56.图24为随光热治疗时间延长,hepg2细胞和hl-7702细胞中核仁的大小变化图。
具体实施方式
57.本发明对所涉及的所有原料的来源没有特殊限制,从市场上购买或者按照本领域技术人员熟知的常规制备方法制备得到的即可。
58.本发明提供一种金纳米材料/碳量子点复合等离子体荧光纳米探针,包括金纳米材料和碳量子点;
59.所述金纳米材料表面修饰有atp核酸适配体和fa修饰的聚乙二醇;
60.所述碳量子点表面修饰有单链dna;
61.所述单链dna与atp核酸适配体中的部分或者全部序列的碱基互补。
62.在本发明中,所述金纳米材料优选包括金纳米棒(aunrs),所述金纳米棒的长径比优选为3.5-4。所述fa修饰的聚乙二醇(fa-peg)优选为fa修饰的巯基聚乙二醇。本发明对聚乙二醇的分子量没有特别的限制,优选为聚乙二醇5000。
63.本发明通过在金纳米棒表面借助金硫键修饰有atp核酸适配体和fa修饰的聚乙二醇,得到fa-aunrs-atp。其中,atp核酸适配体能够特异性识别atp,fa基团可以区分fr阳性(fr+)和fr阴性(fr-)细胞。因此,得到的fa-aunrs-atp可以有效地增强fr阳性癌细胞的内吞作用。另外,在碳量子点(cds)表面修饰单链dna(ss-dna),得到cds-ss-dna,通过单链dna与atp核酸适配体中的部分或者全部序列的碱基互补,将碳量子点复合在金纳米材料上,得到金纳米材料/碳量子点复合等离子体荧光纳米探针(aunrs-cds)。
64.所述金纳米材料/碳量子点复合等离子体荧光纳米探针,发出稳定绿色荧光的cds最初会被aunrs通过nset(纳米表面能量转移)淬灭。然而,在细胞中atp的存在下,cds和aunrs之间的nset消失。aunrs-cds上的atp核酸适配体特异性地识别atp后,cds会与aunrs分离,荧光信号得到一定程度的恢复,从而实现核仁的原位成像。所述金纳米材料/碳量子点复合等离子体荧光纳米探针能够于生物成像、制备光热治疗剂和/或atp检测,其在光热治疗过程中既可以实现核仁成像,监测核仁形态,增加靶向核仁的特异性,提高对肿瘤细胞的热杀伤能力,减少对周围正常组织的损伤,同时还可以特异性检测atp含量,提高光热治疗对于肿瘤细胞的诊疗效果。
65.在本发明中,所述金纳米材料、fa修饰的聚乙二醇和atp核酸适配体、的摩尔比为1:(1-1.5):(1.8-2.2)。
66.在本发明中,所述atp核酸适配体的序列如seq id no:1所示:5sh-c6-tcgattc cctggggg agta ttg cggaggagg-cy5。所述单链dna的序列如seq id no:2所示:nh
2-c6-act ccc cca ggt aat。
67.本发明还提供一种所述金纳米材料/碳量子点复合等离子体荧光纳米探针的制备方法,包括如下步骤:
68.将表面修饰有单链dna的碳量子点溶液与表面修饰有atp核酸适配体和fa修饰的聚乙二醇的金纳米材料溶液混合后,于30-40℃水浴中培养10-14h,得到金纳米材料/碳量子点复合等离子体荧光纳米探针。
69.本发明对表面修饰有单链dna的碳量子点溶液和表面修饰有atp核酸适配体和fa修饰的聚乙二醇的金纳米材料溶液的加入顺序没有特别的限制,将得到的混合溶液于30-40℃恒温水浴中培养10-14h后,即可得到金纳米材料/碳量子点复合等离子体荧光纳米探针。在本发明中,优选将混合溶液在37℃恒温水浴中共同培养12h。在本发明中,为了去除多余的配体,在恒温水浴中共同培养后优选还包括用hepes缓冲液洗涤金纳米材料/碳量子点复合等离子体荧光纳米探针,所述洗涤的次数没有特殊的限制,优选不低于3次。
70.在本发明中,所述碳量子点溶液可从市场上购买或者按照本领域技术人员熟知的
常规制备方法制备得到。示例性地,所述碳量子点溶液由包括以下步骤的制备方法制备得到:
71.将间苯二胺与单宁酸水溶液混合,进行水热反应后冷却至室温,离心,取上层清液进行透析,得到碳量子点溶液。
72.在本发明中,所述水热反应的温度优选为160-200℃,所述水热反应的时间优选为8-12h。所述离心优选在10000-15000rpm下离心10-20min。所述透析的时间优选为20-30h,优选每2h换一次水。在本发明中,所述透析的截留分子量优选为1000da。
73.在本发明中,所述表面修饰有单链dna的碳量子点溶液由包括以下步骤的制备方法制备得到:
74.将偶联剂、碳量子点溶液和单链dna混合,于2-6℃反应8-15h。
75.本发明对偶联剂、碳量子点溶液和单链dna的加入顺序没有特别的限制。在本发明中,所述偶联剂优选包括nhs和edc,优选将偶联剂加入碳量子点溶液中,混合15min后再向得到的混合溶液中加入单链dna,于2-6℃反应8-15h,更优选在加入单链dna后,于4℃混合12h,所述混合优选在搅拌条件下进行。在本发明中,所述反应后优选还包括透析,以去除未反应的序列。所述透析的分子量优选为3500da。
76.本发明在碳量子点表面修饰单链dna的方法简单易行,成本低。
77.在本发明中,所述表面修饰有atp核酸适配体和fa修饰的聚乙二醇的金纳米材料溶液由包括以下步骤的制备方法制备得到:
78.(1)将还原剂与atp核酸适配体混合后进行避光反应,得到还原后的atp核酸适配体;
79.(2)将还原后的atp核酸适配体与金纳米材料溶液混合后反应,得到atp核酸适配体修饰的金纳米材料溶液;
80.(3)将fa修饰的聚乙二醇与atp核酸适配体修饰的金纳米材料溶液混合后反应,得到表面修饰有atp核酸适配体和fa修饰的聚乙二醇的金纳米材料溶液。
81.本发明对还原剂与atp核酸适配体的加入顺序没有特别的限制,优选将还原剂加入至atp核酸适配体中进行还原反应。所述避光反应的温度优选为25-35℃,避光反应的时间优选为2-5h。所述还原后的atp核酸适配体与金纳米材料溶液混合后反应的温度优选为25-35℃,反应的时间优选为8-15h。所述得到atp核酸适配体修饰的金纳米材料溶液后,优选还包括离心和重悬处理,以去除多余的atp核酸适配体。在本发明中,具体为:将atp核酸适配体修饰的金纳米材料溶液在9500rpm下离心15min,取沉淀在10ml水中重悬。在本发明中,步骤(3)所述反应的温度优选为25-35℃,反应的时间优选为8-15h。
82.本发明在金纳米材料表面修饰atp核酸适配体和fa修饰的聚乙二醇的方法简单易行,容易操作,难度低。
83.本发明还提供一种所述金纳米材料/碳量子点复合等离子体荧光纳米探针或由所述制备方法制备得到的金纳米材料/碳量子点复合等离子体荧光纳米探针在生物成像、制备光热治疗剂和/或atp检测中的应用。
84.所述金纳米材料/碳量子点复合等离子体荧光纳米探针在受到外界的808nm激光刺激下,单链dna与atp核酸适配体会断开,从而导致游离的碳量子点,可以发出荧光,从而能够用于生物成像、制备光热治疗剂或进行atp含量检测。
85.下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
86.为了进一步说明本发明,下面通过以下实施例进行详细说明。本发明以下实施例中所用的实验原料均可从市场上购买或者按照本领域技术人员熟知的常规制备方法制备得到。
87.制备例1
88.本制备例提供一种金纳米棒(aunrs),其制备方法如下:
89.(1)将haucl4(0.25ml,0.01m)与ctab(5ml,0.2m)混合,得到混合溶液;
90.(2)将新鲜制备的冰nabh4(0.25ml,0.025m)加入上述混合溶液中,搅拌2min,溶液由黄色变为棕黄色,将得到的溶液放置在30℃水浴中3h,得到金纳米棒种子液;
91.(3)将hcl(0.4ml,2m)和ctab(40ml,0.1m)混匀后,加入haucl4(2ml,0.01m)和agno3(0.365ml,0.01m),将得到的溶液在30℃水浴中静置15min后加入抗坏血酸(0.32ml,0.1m),摇晃直至溶液变透明;
92.(4)向步骤(3)得到的溶液中加入0.096ml金纳米棒种子液,搅拌30s,并在30℃水浴中静置12h,将得到的溶液在9500r/min离心2次,离心15min。取沉淀分散于水中(10ml),得到金纳米棒溶液。
93.针对制备例1得到的金纳米棒进行长度和宽度的测量,测量结果如图1-2所示,图1为金纳米棒的长度分布图,图2为金纳米棒的宽度分布图,经过计算,金纳米棒的平均长度为51.20nm,平均宽度为14.15nm,长宽比为3.73。
94.制备例2
95.本制备例提供一种碳量子点(cds),其制备方法如下:
96.取间苯二胺(10ml,30mg/ml)水溶液与单宁酸水溶液(20ml,33.75mg/ml)混合后移入水热反应器,于180℃处理10h后降低到室温,取溶液在15000rpm下离心15min。取上层清液在室温下透析24h(mwco:1000da),每2h换一次水,得到的cds溶液在4℃保存备用。
97.制备例3
98.本制备例提供一种cds-ss-dna,其制备方法如下:
99.将nhs(500μl,25mm)和edc(500μl,25mm)混合后加入至1.5ml cds溶液中,室温混合15min后,加入ss-dna序列(10μl,100μm),4℃搅拌12h,然后透析24h(mwco:3500da),得到cds-ss-dna溶液。
100.实施例1
101.本实施例提供一种atp核酸适配体和fa修饰的巯基聚乙二醇修饰的金纳米棒探针,其制备方法如下:
102.(1)tcep与atp核酸适配体(hs-aba,终浓度为10μm)按摩尔比200:1混合,避光3h,得到还原后的atp核酸适配体;
103.(2)将还原后的atp核酸适配体dna(5sh-c6-tcgattc cctgggggagta ttg cggaggagg-cy5)(10μl,100μm)与10ml合成的金纳米棒溶液混合,于30℃搅拌12h;
104.(3)将混合溶液在9500rpm下离心15min,取沉淀在10ml水中重悬,得到atp修饰的
金纳米棒溶液,即aunrs-atp;
105.(4)将fa-peg5000-sh(100μl,1mm)与atp修饰的金纳米棒溶液(10ml)混合,搅拌后放置12h,得到atp核酸适配体和fa修饰的聚乙二醇修饰的金纳米棒探针,即fa-aunrs-atp。
106.实施例2
107.本实施例提供一种金纳米棒/碳量子点复合等离子体荧光纳米探针(aunrs-cds),其制备方法如下:
108.(1)将实施例1得到的金纳米棒探针溶液与制备例3得到的cds-ss-dna溶液按1:2的体积比混合,得到的混合溶液在恒温水浴(37℃)中共同培养12h,得到组装后的探针;
109.(2)取40mm hepes缓冲液与组装后的探针按体积比1:1混合,在9500rpm下离心15min,重复3次,弃上清,用20mm hepes缓冲液重悬,4℃保存待用。
110.性能测试
111.采用透射电子显微镜对aunrs、cds和aunrs-cds进行表面形貌的表征,结果如图3-5所示,图3为aunrs的tem图像,图4为cds的tem图像,图5为aunrs-cds的tem图像。由图可知,金纳米棒形貌规则,呈良好的棒状结构,合成的cds具有良好的分散性,均匀的颗粒大小经计算统计为~2.7
±
0.44nm。
112.针对aunrs、aunrs-atp和fa-aunrs-atp进行紫外可见光谱的测试,测试结果如图6所示,可以看出质谱峰的蓝移表明hs-atp核酸适配体和fa-peg-sh成功修饰在aunrs表面。
113.针对aunrs、cds和aunrs-cds进行紫外可见光谱的测试,测试结果如图7所示,可以看出cds的紫外吸收光谱显示在263nm和410nm有两个吸收峰,263nm处的峰归因于芳香环的π-π*转变,410nm处的峰则表明了cds表面状态的n-π*转变的存在。
114.采用nano zs zetasizer仪器对aunrs、aunrs-atp、fa-aunrs-atp、cds、cds-ss-dna和aunrs-cds进行zeta电位的测试。
115.测试结果如图8所示,可以看出aunrs与atp结合的核酸适配体耦合后,纳米探针的zeta电位从30.26mv变为14mv,表明atp结合的核酸适配体成功地与aunrs共价连接。然后用fa-peg-sh进一步修饰aunrs-atp以获得更好的生物相容性;相应的zeta电位从14.00mv下降到-2.09mv,这意味着aunrs表面的大量ctab被fa-peg-sh取代;在ss-dna与cds共轭后,cds的zeta电位从-20.73mv增加到-8.74mv,表明ss-dna通过共价键成功修饰在cds表面。最后,aunrs-cds由fa-aunrs-atp和cds-ss-dna通过互补的碱基配对组装而成。组装后,fa-aunrs-atp的zeta电位从-2.09mv变为-4.43mv。
116.针对cds进行荧光强度进行测试,测试方法如下:
117.采用不同激发波长从300nm~500nm对cds进行荧光光谱测试;选用不同浓度从0.9mg ml-1
~10.4mg ml-1
的cds进行荧光光谱测试。
118.测试结果如图9-10所示,图9为cds在不同激发波长下的荧光光谱图,图10为cds在不同浓度下的荧光光谱图。由图9可知,cds的荧光发射光谱在不同的激发波长下显示出不同的峰位和强度,表现出激发依赖性的行为,这是由于π-共轭芳香域和连接化学基团杂交形成的表面状态。由图10可知,荧光强度随着cds浓度的增加而增加,这表明cds的合成是成功的。
119.采用电感耦合等离子体发射光谱仪(icp)对人肝癌细胞和人正常肝细胞所吸收的aunrs-cds进行测量。具体方法如下:
120.将hepg2(高表达fa)细胞和hl-7702细胞(低表达fa)分别在6孔板中以2
×
105个细胞/孔的密度在37℃培养12h。然后用aunrs-cds(32μg ml-1
)培养这些细胞2h,用pbs仔细清洗和消化。所有收集的细胞进行icp测量,对纳米探针含量的做定量分析。
121.测试结果如图11所示,经aunrs-cds探针处理2h后,hepg2(人肝癌细胞)和hl-7702(人正常肝细胞)细胞的细胞内金含量分别为266.7
±
51.9ng/ml和121.0
±
2.4ng/ml,这表明fa修饰的aunrs-cds可以增强hepg2细胞的内吞作用,并将成为fr阳性癌细胞中atp追踪的一种出色方法。
122.针对aunrs-cds探针进行光热稳定性的测试,测试方法如下:
123.取32μg ml-1
上述aunrs-cds分散至1ml超纯水中,以30s为间隔记录此溶液在808nm激光器(2w cm-2
)照射下的温度变化,记录10min升温变化后关闭激光器,再持续记录10min降温变化,此为一个周期,共记录三个周期。
124.测试结果如图12-14所示,图12为不同激光照射强度下aunrs-cds探针溶液的温度随时间的变化温度升高曲线图,图13为aunrs-cds的温度反应与重复的开/关辐照周期变化情况图(808nm激光,2w cm-2
),图14为激光照射前后的aunrs-cds探针溶液的吸光度变化情况图。由图12可知,在2w cm-2
的激光照射下,aunrs-cds(32μg ml-1
)溶液的温度在5min内增加到55.2
±
0.2℃。由图13可知,在反复的开/关辐照循环中,aunrs-cds的光热性能的变化可以被忽略。由图14可知,连续辐照2h后,质子峰仅轻微衰减。以上结果表明aunrs-cds复合探针具有良好的光热稳定性。
125.针对aunrs-cds探针进行生物相容性的测试,测试方法如下:
126.aunrs-cds的生物相容性是通过mtt试验来检验的。将hepg2和hl-7702细胞(每孔1
×
104个细胞)接种在96孔孔板上,在37℃下培养24h。然后,在每孔中加入10μl不同浓度的aunrs-cds,辅以90μl完全培养基,在37℃下培养24h。然后用90μl新鲜的完全培养基替换平板,之后在每个孔中加入10μl的mtt,在37℃的co2培养箱中再培养4h。最后,将150μl的dmso加入平板中。在测量波长为490nm的酶标仪上测试吸光度。在没有纳米材料孵化的细胞被用作对照组。
127.测试结果如图15所示,可以看到hepg2和hl-7702细胞均保持90%以上的存活率,aunrs-cds表现出优异的生物相容性。
128.针对aunrs-cds探针进行在808nm激光照射下细胞活力的测试,测试方法如下:
129.用808nm激光在不同的时间间隔(1min、3min、5min)和不同密度(0w cm-2
、0.5w cm-2
、1w cm-2
、1.5w cm-2
、2w cm-2
)下培养aunrs-cds(32μg ml-1
)与hepg2和hl-7702细胞孵育2h测试了细胞活力。
130.测试结果如图16-17所示,图16为用808nm激光在不同的时间间隔和密度的hepg2细胞的细胞活力结果图,图17为用808nm激光在不同的时间间隔和密度的hl-7702细胞的细胞活力结果图,可以看出用aunrs-cds处理2h后,用808nm激光在不同的激光强度下照射hepg2细胞和hl-7702细胞,照射时间不同,细胞活力结果存在差异性。当激光强度大于1w cm-2
时,随着处理时间的延长,癌变的hepg2细胞的细胞活力明显下降,而用同样方法处理的正常hl-7702细胞的细胞活力持续到1.5w cm-2
。
131.针对aunrs-cds探针进行体外光热性能的测试,测试方法如下:
132.用calcein am/pi混合荧光染料来验证光热效果。所有的细胞在96孔板中以1
×
104个细胞/孔的密度培养24h。然后,除去细胞培养基,用磷酸盐缓冲液(pbs,10mm,ph=7.4)洗3次,在每个培养皿中加入核仁靶向的aunrs-cds(32μg ml-1
)与一定量的完全培养基。孵化2h后,用pbs洗涤3次,除去游离的纳米探针。通过不同条件下的光热消融(功率密度为12w cm-2
、1.52w cm-2
、2w cm-2
,时间为1min、3min、5min)记录aunrs-cds的光热效率,并将没有任何处理的孔设置为对照组。最后,用calcein am/pi混合染料染色15min,用pbs洗涤2次,在leica显微镜下收集荧光图像。
133.测试结果如图18所示,图18为不同时间间隔和密度的激光照射后,hepg2和hl-7702细胞的活/死染色图像(比例尺=100μm)。对于两种细胞,在1.5w cm-2
的808nm激光照射5min后,大部分细胞死亡,而在不同照射时间的1w cm-2
的808nm处理中,细胞仍有很好的生存能力,结果表明aunrs-cds在光热治疗应用中具有良好的光热特性。因此,为了更好地探索atp能量代谢和核仁形态转化与光热刺激之间的内在关系,我们采用1w cm-2
的激光强度进行了以下实验。
134.针对aunrs-cds探针进行atp含量检测特异性的测试,测试方法如下:
135.在细胞内atp传感之前,我们首先测量纳米探针对溶液中不同浓度(0nm~10mm)atp的反应,用808nm激光照射10min,功率为2w cm-2
,我们记录了上述溶液的荧光光谱。其次,将含有2mm mgcl2的hepes中稀释到浓度为32μg ml-1
的aunrs-cds溶液中,然后与不同浓度的atp或其类似物混合,将这些溶液在恒温水浴中培养1h(37℃),荧光光谱的变化由分光荧光仪(ex=460nm,em=480~650nm)进行atp及类似物测试。最后,为了进一步证明aunrs-cds在活细胞中监测atp含量波动的可行性,用5mmol/l的cacl2或dna随机序列(nh
2-c6-gcagcagcagca,aunrs-rancds)作为对照组与hepg2细胞预处理2h,然后再与aunrs-cds共孵育2h用于后续荧光成像(aunrs-cds与hepg2细胞共孵育为实验组)。
136.测试结果如图19-22所示,图19为aunrs-cds在atp浓度从0到10mm增加的溶液中的荧光光谱结果图,图20为aunrs-cds在ctp、gtp、utp和atp的荧光强度结果图,图21为aunr-cds、aunrs-cds+cacl2、aunrs-rancds培养的hepg2细胞的荧光图像,图22为aunrs-cds在不同照射时间下的荧光强度变化图。由图19可知,强度随着atp浓度从0到10mm的增加而增加,这是atp诱导cds从aunrs表面释放的结果。由图20可知,由于核酸适配体对atp的特异性,加入atp类似物,包括utp、gtp和ctp,与空白样品相比没有表现出明显的荧光强度增强,这些结果显示了aunrs-cds在溶液中对atp的良好反应。由图21可知,与单独用aunrs-cds处理的对照组相比,用5mm cacl2处理的细胞导致纳米探针的cds荧光发射明显增加。当纳米探针的atp分子被dna随机序列取代时,没有明显的荧光。在同样的实验条件下,没有观察到明显的荧光信号。这证实了只有atp可以导致cds的荧光恢复。由图22可知,aunrs-cds探针在808nm激光下照射15min,其荧光强度基本没有下降。
137.针对aunrs-cds探针在光热治疗过程中监测核仁形态的测试,测试方法如下:
138.首先,为了探索核子靶向机制研究(dnase和rnase消化试验),我们随后在cds染色前用核糖核酸酶(rnase)或脱氧核糖核酸酶(dnase)处理细胞。首先,用1%的triton x-100在室温下处理hepg2细胞1min,然后用pbs洗2次。然后,用pbs溶液(对照实验)、25μg ml-1
dnase和25μg ml-1
rnase分别在37℃、5%co2下处理细胞1h。用pbs洗两次后,用aunrs-cds(32μg ml-1
)和hoechst 33342(5μg ml-1
)对细胞进行联合染色。最后,用荧光显微镜拍摄激发波长为405nm的共染活细胞的荧光图像。最后,将hepg2和hl-7702细胞分别与aunr-cds
(32μg ml-1
)孵育2h。在相同条件下(功率密度为1w cm-2
,持续1min、3min、5min、7min、9min、11min),通过光热治疗观察细胞核仁形态和数量的变化过程,将没有任何处理的孔设置为对照组。
139.测试结果如图23-24所示,图23为hoechst 33342和aunrs-cds共同染色dnase和rnase处理的hepg2活细胞用于荧光成像图,图24为随光热治疗时间延长,hepg2细胞和hl-7702细胞中核仁的大小变化图。由图23可知,cds可以特异性地照亮核仁,这在活的hepg2细胞的明亮图像中可以清楚地看到,表明aunrs-cds可以实现活细胞核仁成像。由图24可知,随着光热疗法治疗时间的延长,两种细胞系与aunrs-cds孵育后的核仁变得更小。然而,与hl-7702正常细胞相比,hepg2癌细胞的核仁变化更为明显。结果表明,癌细胞比正常细胞具有更高的热敏感性,aunrs-cds可以有效监测光热治疗过程中癌细胞核仁形态的动态变化。
140.所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1