一种逆转录病毒的生产灌装工艺的制作方法
1.本发明涉及细胞免疫治疗技术领域,具体为一种逆转录病毒的生产灌装工艺。
背景技术:
2.目前基因改造的免疫细胞治疗产品,国内监管机构将其纳入药品进行管理,该产品属于无菌注射剂范畴,作为无菌注射剂,整个产品的生产工艺要求做到严格无菌,由于细胞治疗产品在产品的生产全流程以及制剂终端均无法进行过滤除菌或灭活除菌处理,所以要求产品生产的整个环节做到严格无菌。封闭式生产工艺是细胞治疗产品无菌的有效保障。而作为基因改造的细胞治疗产品的关键原材料之一病毒液产品本身的无菌保障至关重要。病毒液生产结束后进行封闭灌装,以及与细胞治疗产品生产工艺有效的无菌对接,是细胞制剂实现无菌的基本保障。另外,由于目前已经上市的基因改造免疫细胞如car-t产品价格昂贵,其中主要的成本之一即是病毒液的成本。
技术实现要素:
3.本发明所解决的技术问题在于提供一种逆转录病毒的生产灌装工艺,以解决技术背景中所提到的问题。为实现上述目的,本发明提供如下技术方案:一种逆转录病毒的生产灌装工艺,包括以下步骤:
4.步骤1、培养液制备:在dmem培养基加上一定比例的fbs,即可获得培养液;
5.步骤2、制备病毒液:将按照gmp法规构建的产毒株细胞库的细胞取出后,通过培养液进行复苏培养,在细胞培养瓶中进行逐级放大培养,待细胞达到一定的数量之后,转入含片状载体细胞培养袋的生物反应器进行扩大培养,每天换液处理,中间进行病毒液的取样滴度检测,待反应器体系扩大培养至第六、七、八、九天,连续4次分别收获病毒液上清作为病毒原液,病毒原液分别两两合并,第六和第七天的病毒原液在第七天过滤合并即得第一亚批病毒液,第八和第九天的病毒原液在第九天过滤合并即得第二亚批病毒液;
6.步骤3、罐装:采用赛多利斯的自动分配体系进行病毒液灌装至冻存袋中。
7.优选地,所述步骤1中fbs的比例为0%~10%之间。
8.优选地,所述步骤2中片状载体细胞培养袋为一种将贴壁细胞直接进行悬浮化培养的装置,片状载体采用适合于细胞贴壁生长的材质稳定的聚酯纤维和聚丙烯网,表面积为1200cm2/g,可实现细胞的高密度培养。
9.优选地,所述步骤8中灌装的体积大小可以依据car-t制备的需求进行调整,灌装体积为1-10ml的范围区间,灌装完毕后进行贴签、外包装,再于-80度条件下进行长期保存。
10.与现有技术相比,本发明具有以下有益效果:该工艺生产一批病毒液可以满足1000-1500例自体治疗患者的car-t生产制备;本工艺在病毒液收获后,采用赛多利斯的自动分配体系进行病毒液灌装至冻存袋中,如果病毒液在室温环境进行长时间的灌装,会影响病毒液的活性,从而影响病毒液的滴度和感染效率,而采用赛多利斯的自动分配体系进行病毒液灌装系统,可以快速高效的进行病毒液的封闭灌装,可以有效降低灌装时长对病
毒液活性的影响。
附图说明
11.为了更清楚地说明本发明的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
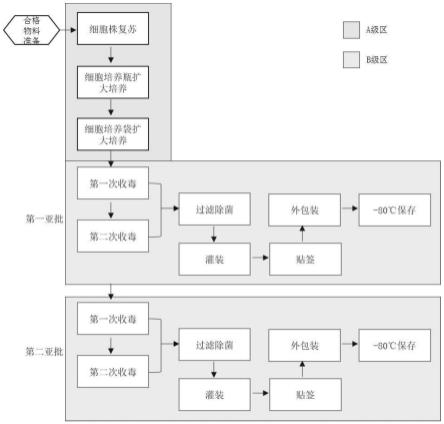
12.图1为实施例中本发明的工艺流程图;
13.图2为实施例中三批病毒液的取样病毒滴度结果图;
14.图3为实施例中三批病毒液的病毒总数结果图;
15.图4为实施例中一批病毒液每次收毒以及过滤前后的滴度对比结果图;
16.图5为实施例中病毒液采取moi为0.1、moi为0.15和moi为0.2感染t细胞的感染效率结果图;
17.图6为实施例中病毒液采取moi为0.1、moi为0.15和moi为0.2感染t细胞制备car-t周期中细胞扩增倍数图。
具体实施方式
18.为了使本发明的技术手段、创作特征、工作流程、使用方法达成目的与功效易于明白了解,下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,及进行非创造性的扩展而得出的其它结论,都属于本发明保护的范围。
19.实施例
20.如图1所示一种逆转录病毒的生产灌装工艺,包括以下步骤:
21.培养液制备:在dmem培养基加上比例为5%的fbs,即可获得培养液。
22.制备病毒液:将按照gmp法规构建的产毒株细胞库的细胞取出后,平均分三批通过培养液进行复苏培养,在细胞培养瓶中进行逐级放大培养,待细胞达到一定的数量之后,接种到含片状载体细胞培养袋的摆床生物反应器进行扩大培养(其中片状载体采用适合于细胞贴壁生长的材质稳定的聚酯纤维和聚丙烯网,表面积为1200cm2/g,可实现细胞的高密度培养),每天换液处理并使用取样带进行病毒液的取样滴度检测和病毒总量计算,待反应器体系扩大培养至第六、七、八、九天,连续4次分别收获病毒液上清作为病毒原液,病毒原液分别两两合并,第六和第七天的病毒原液在第七天过滤合并即得第一亚批病毒液,第八和第九天的病毒原液在第九天过滤合并即得第二亚批病毒液;其中每天的病毒液取样滴度检测结果如图2所示,最终三批病毒滴度分别为1.40e+06tu/ml、1.53e+06tu/ml、1.48e+06tu/ml;病毒总量计算结果如图3所示,病毒总量最高值分别为4.62e+09tu、5.04e+09tu、4.87e+09tu;一批病毒液每次收毒以及过滤前后的滴度对比结果如图4所示。
23.罐装:采用赛多利斯的自动分配体系进行病毒液灌装至冻存袋中,且灌装的体积大小可以依据car-t制备的需求进行调整,灌装体积为1-10ml的范围区间,灌装完毕后进行贴签、外包装,再于-80度条件下进行长期保存。
24.用第一批生产所得的病毒液感染活化的t细胞制备car-t,分别采取moi为0.1、moi为0.15和moi为0.2感染t细胞,感染率如图5所示(图中从左到右为moi为0.1、moi为0.15、moi为0.2的感染结果),其中采取moi为0.1感染t细胞仍然可以得到56.5%的感染效率,且整个car-t制备周期中,细胞扩增良好,其结果如图6所示,满足临床car-t制备的需求。制备一批自体治疗的car-t仅需病毒液2-6ml,而按照此病毒工艺批量理论可得6600ml的病毒液,理论可以满足1000-1500例患者的car-t患者治疗(起始感染的t细胞量为2
×
107~6
×
107个总细胞),大大的提升了病毒液的生产产能,降低了病毒液和car-t的生产成本。
25.以上显示和描述了本发明的基本原理、主要特征及本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明的要求保护范围由所附的权利要求书及其等效物界定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1