包括用水解酶处理污泥的用于处理废水的方法与流程
本发明涉及用于处理废水的方法,并且更具体地,涉及一种用于处理废水的生物方法。
背景技术:
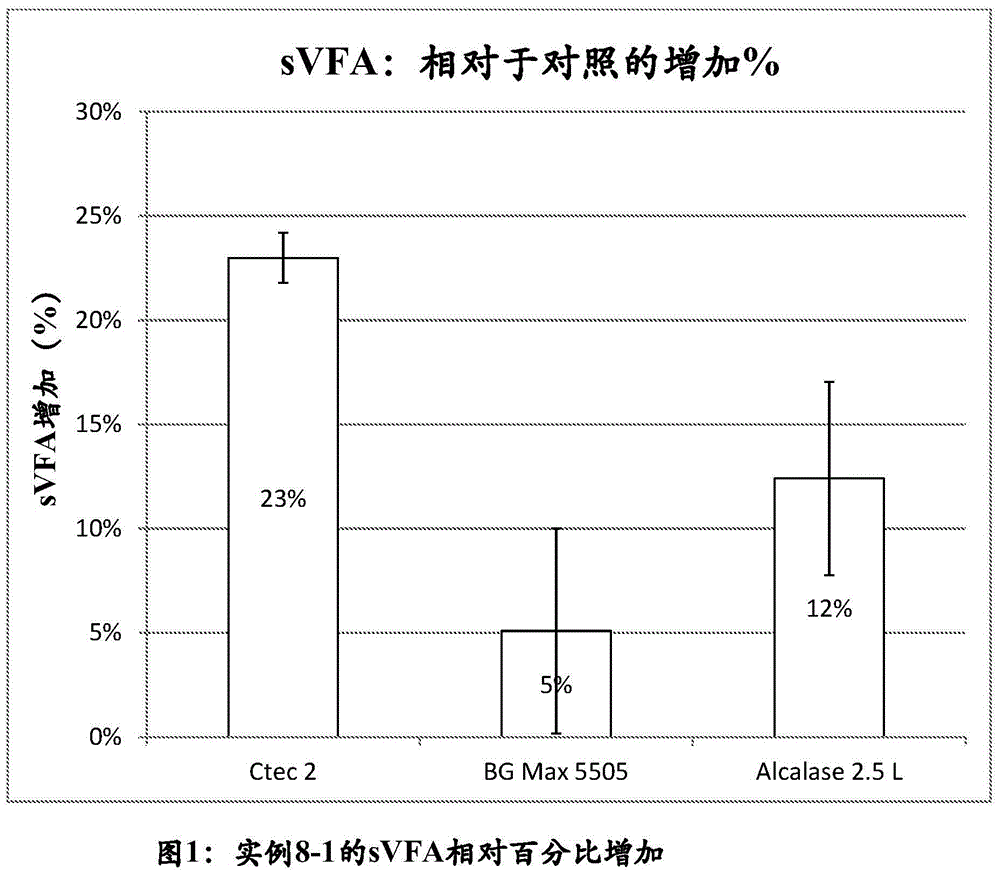
:废水处理方法通常包括多个处理区域或区,这些处理区域或区大致可分为:(1)前处理区域;(2)初级处理区域;以及(3)二级处理区域。在位点到位点的基础上可能存在另外的处理区域和或序列。废水处理过程开始于前处理区域。前处理涉及从未经处理的废水中除去砂砾和有破坏性的碎屑,诸如罐、浴巾等。这通常是两阶段的处理过程,由此通过筛除去碎屑(诸如碎布和罐),并且在未经处理的废水经过速度控制的区时砂砾和较重的无机固体从其中沉淀出来。因此,当流体流中携带的有机物通过时,通过筛选或沉降除去有害的无机碎屑。在前处理区域之后,废水被引导至初级处理区域。初级处理区域需要进行物理过程,其中通过浮选或沉淀除去一部分有机物。除去的有机物包括粪便、食物颗粒、油脂、纸等,并且在技术上被定义为悬浮固体。通常,在此初级阶段中,百分之40至百分之80的悬浮固体作为初级污泥被除去。第三个处理阶段被称为二级处理,并且通常是生物处理过程,其中在受控条件下利用细菌从废水中除去营养物或不沉降的悬浮且可溶的有机物。如果不进行处理,这些材料将导致不可接受的生物需氧量(bod)。典型地,此过程的一种模式由池组成,在该池中将废水(主要流出物)与微生物悬浮液(活性污泥)混合。然后将此混合物曝气,以提供氧气来支持微生物,然后这些微生物可以吸收、同化并且代谢废水中过量的生物需氧量。在足够的保留时间后,然后将混合物引入澄清池或沉降池,其中生物质作为沉降的污泥或二级污泥从液体中分离出来。然后,使部分净化的水(二级流出物)溢流到接收流中。有三种主要类型的用于进行废水处理的二级处理。第一种类型,被称为滴流过滤器或固定膜系统,允许废水滴落通过石料或塑料介质床,由此废水中存在的有机材料通过附着在石料或介质上的微生物的作用而被氧化。类似的概念是旋转生物接触器(rbc),其中生物附着在介质上,该介质在废水中旋转并且以滴流过滤器的方式将其净化。第二种方法是常规的活性污泥方法,其中通过压缩空气或机械手段与从澄清池或沉降池返回的生物质的一部分一起将废水充分曝气和搅拌。第三种方法是活性污泥方法的改变形式,并且可以被称为半好氧(厌氧/有氧)方法,其中第一阶段典型地是厌氧或缺氧的,并且然后是有氧或好氧阶段。这种厌氧-有氧-缺氧方法与phoredox方法和修改的bardenpho方法(两者在废水处理行业中均是众所周知的)的初始阶段非常相似。另外,在生物营养物去除(或bnr)的涵盖性术语下存在多种方法,其中废水流动和污泥返回流动通过厌氧-缺氧-有氧区或序列交替和/或重复。这些另外的方法已知为但不限于:a/o、a2/o、ludzack和ettinger(le)、修改的ludzack和ettinger(mle)、bio-denitro、开普敦大学模型(uct)、和弗吉尼亚首创工厂(virginiainitiativeplant,vip)。现在许多废水设施都面临着非常严格的氮和磷控制标准,并且这些控制标准有望在不久的将来变得更加严格并且得到更广泛的应用。这是因为越来越关注倾倒到接收流中的废水的硝酸盐水平。从废水中除去磷或氮可能是困难的,并且包括需要向废水处理过程中添加诸如金属盐和/或碳源的添加剂的高成本过程。例如,可以在厌氧处理区和/或缺氧处理区和/或好氧处理区中将碳源(诸如甘油、甲醇、或挥发性脂肪酸(vfa))添加到过程中,以辅助脱磷或脱氮。然而,由于处理的废水的体积非常大,必须添加大量的碳源以有效地增加其在废水中的浓度。因此,向废水中添加碳源是苛刻的,并且显著地促进了处理废水的费用。尝试通过混合微藻和细菌培养来从废水中除去氮和磷酸盐(delgadillo-mirquez等人,biotechnologyreports[生物技术报告],第11卷,2016年9月,第18-26页)。然而,已知微藻会打破营养物吸收与生长的关系。在营养物耗尽(包括磷耗尽)后,它们可以继续生长。另外,将细胞间磷酸盐含量释放到培养基中的细胞破裂可能增加磷酸盐浓度。在废水处理中需要添加外部碳源的方法中,需要更经济且实用的方法。附图说明图1展示了实例8-1的与对照相比可溶性脂肪酸的相对百分数增加。图2展示了实例8-2的与对照相比可溶性脂肪酸的相对百分数增加。图3展示了实例8-3的与对照相比可溶性脂肪酸的相对百分数增加。图4展示了实例8-4的与对照相比可溶性脂肪酸的相对百分数增加。技术实现要素:本发明至少部分涉及一种包括使用水解酶的处理废水的方法,其特征在于:当与初级或二级污泥接触时,该水解酶生成碳源。在一方面,本发明涉及一种用于处理废水的方法,该方法包括:(a)将该废水引导至并且通过初级澄清池以分离含有有机化合物的废水和初级污泥;(b)将该含有有机化合物的废水引导至厌氧处理区和/或缺氧处理区和/或好氧处理区;以及(c)将通过该厌氧处理区和/或该缺氧处理区和/或好氧处理区的废水引导至二级澄清池以分离纯化的上清液和二级污泥;其中该初级污泥和/或该二级污泥与水解酶接触以产生包含碳源的上清液。本发明的另一方面涉及一种用于在市政或工业废水处理过程中除去废水中的磷和氮的原位碳源生成,其包括向初级或二级污泥中添加水解酶以进行原位碳源生成。本发明的另一方面涉及一种在市政或工业废水处理中增加污泥水中的碳源的方法,其包括使用水解酶,其中该水解酶的特征在于该酶引起原位生成碳源。本发明的另一方面涉及一种通过向废水的初级或二级污泥中添加水解酶来减少或消除添加到废水或其污泥中的外源碳源的量的方法,其中所述水解酶增强该污泥的水解和后续发酵,从而原位生成更多碳源。在另一方面,本发明涉及一种用于通过废水生产包含碳源的上清液的方法,其包括a)将该废水引导至并且通过初级澄清池以分离含有有机化合物的废水和初级污泥;(b)将该含有有机化合物的废水引导至厌氧处理区和/或缺氧处理区和/或好氧处理区;(c)将通过该厌氧处理区和/或该缺氧处理区和/或好氧处理区的废水引导至二级澄清池以分离纯化的上清液和二级污泥;以及(d)发酵初级污泥和/或二级污泥以产生包含碳源的上清液;其中该初级污泥和/或该二级污泥与水解酶接触。在另一方面,本发明涉及一种用于从废水中除去诸如bod、磷、和氮的污染物和营养物的方法,其包括(a)将该废水引导至并且通过初级澄清池以分离含有有机化合物的废水和初级污泥;(b)将该含有有机化合物的废水引导至厌氧处理区和/或缺氧处理区和/或好氧处理区;(c)将通过该厌氧处理区和/或该缺氧处理区和/或好氧处理区的废水引导至二级澄清池以分离纯化的上清液和二级污泥;其中该初级污泥和/或该二级污泥与水解酶接触以产生包含碳源的上清液。具体实施方式在一方面,本发明涉及一种用于处理废水的方法,该方法包括:(a)将该废水引导至并且通过初级澄清池以分离含有有机化合物的废水和初级污泥;(b)将该含有有机化合物的废水引导至厌氧处理区和/或缺氧处理区和/或好氧处理区;以及(c)将通过该厌氧处理区和/或该缺氧处理区和/或好氧处理区的废水引导至二级澄清池以分离纯化的上清液和二级污泥;其中该初级污泥和/或该二级污泥与水解酶接触以产生包含碳源的上清液。在另一方面,本发明涉及一种用于通过废水生产包含碳源的上清液的方法,其包括a)将该废水引导至并且通过初级澄清池以分离含有有机化合物的废水和初级污泥;(b)将该含有有机化合物的废水引导至厌氧处理区和/或缺氧处理区和/或好氧处理区;(c)将通过该厌氧处理区和/或该缺氧处理区和/或好氧处理区的废水引导至二级澄清池以分离纯化的上清液和二级污泥;以及(d)发酵初级污泥和/或二级污泥以产生包含碳源的上清液;其中该初级污泥和/或该二级污泥与水解酶接触。在另一方面,本发明涉及一种用于从废水中除去诸如bod、磷、和氮的污染物和营养物的方法,其包括(a)将该废水引导至并且通过初级澄清池以分离含有有机化合物的废水和初级污泥;(b)将该含有有机化合物的废水引导至厌氧处理区和/或缺氧处理区和/或好氧处理区;(c)将通过该厌氧处理区和/或该缺氧处理区和/或好氧处理区的废水引导至二级澄清池以分离纯化的上清液和二级污泥;其中该初级污泥和/或该二级污泥与水解酶接触以产生包含碳源的上清液。对于具有生物营养物去除(bnr)过程、特别是增强的生物除磷(ebpr)的废水系统,需要可用的碳源,包括挥发性脂肪酸(vfa)。一些废水处理厂已经建造了槽或改变其用途,以用于发酵初级和/或二级污泥的目的。这种发酵允许产乙酸菌将污泥自然转化为vfa。然而,系统通常在处理的初级阶段不产生足够的vfa(如果有的话),并且因此需要添加补充碳源(对于ebpr,通常为乙酸)。在本发明中,水解酶增强初级污泥的水解和后续发酵,从而生成更多的碳源。在一个实施例中,通过添加水解酶在发酵中生成的碳源的量足够,使得可以减少或消除另外补充到废水中的碳源的量。在一个实施例中,不需要补充碳源。碳源的添加量严格取决于待除去的氮、磷的量。在一个实施例中,通过添加水解酶,与不使初级污泥和/或二级污泥与水解酶接触的情况相比,来自初级污泥和/或二级污泥发酵的上清液中的碳源的量增加按质量计至少5%,诸如至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、和至少100%、至少120%、至少150%、至少180%、至少200%。在实施例中,向废水处理过程中另外补充的碳源减少了10%-100%。在实施例中,向废水处理过程中另外补充的碳源减少了10%、20%、30%、40%、50%、60%、70%、80%、90%、或100%。在实施例中,从该过程中消除了另外补充的碳源,使得不向处理中另外地补充碳源。在一个实施例中,碳源可以进入厌氧处理区和/或缺氧处理区和/或好氧处理区。在一个实施例中,在进料到曝气池之前,将这些vfa直接进料到处理槽的厌氧/缺氧部分。初级和二级污泥含有多种易受水解酶影响的有机材料,包括纤维素、蛋白质、脂质、糖、淀粉等,这些有机物质来自部分消化的食物(膳食纤维等)和厕纸。根据本发明,可以在初级澄清池或尤其是用于发酵的处理区(例如,发酵罐)中使水解酶与初级污泥接触。在一个实施例中,可以将初级污泥保留在初级澄清池中并且在初级澄清池中发酵,以产生包含更多最佳碳源的上清液。因此,在初级澄清池中使水解酶与初级污泥接触。在另一个实施例中,可以将初级污泥引导至发酵罐;并且在该发酵罐中保留并且发酵,以产生包含碳源的上清液。因此,在发酵罐中使水解酶与初级污泥接触。在一个实施例中,本发明的废水处理包括将该初级污泥引导至发酵罐的步骤;将该二级污泥引导至发酵罐的步骤;以及保留并且发酵该初级污泥和该二级污泥以产生包含碳源的上清液的步骤。在一个实施例中,该污泥是新鲜的污泥。该污泥具有优选0-30天日龄、更优选0-15天日龄、更优选0-5天日龄、更优选0-2天日龄、更优选0-24小时时龄、最优选0-12小时时龄。在一个实施例中,生物废水处理过程还包括将该包含碳源的上清液转移到该厌氧处理区和/或缺氧处理区和/或好氧处理区以除去诸如bod、磷和氮的污染物和营养物的步骤。在一个实施例中,生物废水处理过程还包括将包含最佳碳源的上清液转移至缺氧和厌氧处理区的步骤。在另外的实施例中,将通过该厌氧处理区和/或缺氧处理区的废水引导至好氧处理区以除去诸如bod、磷、氮的污染物和营养物。通过发酵过程,产生包含最佳碳源的上清液。在一个实施例中,该废水处理中的发酵是通过在该废水处理过程的污泥中的自然发酵生物体或外部添加的外源发酵生物体进行的。在另外的实施例中,该废水处理中的发酵是通过在该废水处理过程的污泥中的自然发酵生物体(补充有外部添加的外源发酵生物体)进行的。在另外的实施例中,发酵是在不外部添加外源发酵生物体的情况下通过自然发酵生物体进行的。如本文所用,“自然发酵生物体”是指在废水处理过程中自然起源或生长的发酵生物体。自然发酵生物体包括多种生物组分,包括细菌、真菌、原生动物、轮虫等。尽管异养微生物和自养微生物均可存在于该污泥中,但异养微生物典型地占主导地位。异养微生物从工厂流入废水中的碳质有机物获得能量用于合成新细胞。然后,这些微生物通过将有机物质转化为化合物诸如二氧化碳和水而释放能量。活性污泥中的自养微生物通常减少氧化的碳化合物,诸如二氧化碳,用于细胞生长。这些微生物通过将氨氧化成硝酸盐而获得其能量,这称为硝化。如本文所用,“外源”是指在废水处理过程之外起源或生长的生物体。外源发酵生物体的非限制性实例包括除感兴趣的废水流中的发酵生物体以外的发酵生物体,以及从废水处理过程中分离并且与其分开生长的发酵生物体。归类为聚磷酸盐累积生物体(pao)的一组特定的异养细菌负责大部分磷吸收。当通过厌氧和有氧处理区或循环进行循环时,诸如四联球状菌属物种(tetrasphaeraspp.)和聚磷假丝酵母菌属物种(candidatusaccumulibacterspp.)的pao会执行过度磷吸收的功能。这些生物体典型地需要添加容易获得的碳源,优选vfa,以进行过度磷吸收。根据本披露,适合于从废水流中除去或消除的磷的非限制性实例包括在废水中溶解的磷,包括生物可利用磷和在废水处理过程中由微生物降解后的生物可利用磷。生物可利用磷的非限制性实例包括正膦,诸如po43-、hpo42-、h2po4-、h3po4。在废水处理过程中在由微生物降解后生物可利用磷的非限制性实例包括无机缩合磷、有机磷、化学结合磷和还原磷。无机缩合磷的非限制性实例包括焦磷酸盐、三聚磷酸盐、三偏磷酸盐和多磷酸盐颗粒。有机磷的非限制性实例包括流入细胞材料,诸如atp。化学结合磷的非限制性实例包括沉淀剂磷复合物,吸收的磷,金属磷酸盐诸如磷酸铁、磷酸铝或磷酸钙,或更高级的金属复合物。还原磷的非限制性实例包括氧化数大于5的磷、磷化物(氧化数-3)、二磷化物(氧化数-2)、四磷化物(-0.5)、元素p(氧化数0)、次磷酸盐(氧化数+1)和亚磷酸盐(氧化数+3)。在一个实施例中,将污泥保留并且发酵,其中发酵时间为0.5天至15天、优选1.0天至10天;更优选1.0天至5天;最优选1.5-3天。在本发明中,该废水处理过程提供了一种用于从废水中除去或消除诸如bod、磷、和氮的污染物和营养物的能量和成本有效的方法。向常规的废水处理过程中添加碳是有问题的,因为废水处理系统处理数百万加仑(或数万立方米)的废水,并且将碳浓度增加1mg/l以实现更好的除磷所需的碳源(或其他添加剂)的量是巨大的并且昂贵的。由于许多系统需要大量的碳源和/或其他添加剂,本披露的实施例与典型地在废水处理系统中使用的量相比,需要减少量的外部添加碳源。在本披露的实施例中,污染物和营养物(诸如bod、磷、和氮)的去除需要减少的量或不需要向过程流中添加外部碳源,因为在发酵之前,在使用水解酶降解污泥的过程中它产生更多碳源。如上所述,本发明的一方面涉及一种包括使用水解酶的处理废水的方法,其特征在于:当与初级或二级污泥接触时,该水解酶生成碳源。根据本发明,该水解酶可以选自由以下各项组成的组:糖酶,诸如阿拉伯聚糖酶、纤维素酶、β-葡聚糖酶、半纤维素酶和木聚糖酶,蛋白酶,淀粉酶,脂肪酶及其组合。在一个实施例中,该水解酶选自由以下各项组成的组:木聚糖酶、纤维素酶、半纤维素、淀粉酶、和β-葡糖苷酶、α半乳糖苷酶、β-半乳糖苷酶和半乳聚糖酶、蛋白酶、脂肪酶、以及其组合。在另外的实施例中,该水解酶选自由以下各项组成的组:木聚糖酶、纤维素酶、β-葡糖苷酶的组合;10r蛋白酶枯草杆菌蛋白酶;和脂肪酶。在一个实施例中,该水解酶是木聚糖酶、一种或多种纤维素酶、和β-葡糖苷酶的组合,所述组合包含gh10木聚糖酶、里氏木霉(trichodermareesei)纤维素酶制剂。在感兴趣的实施例中,该水解酶是包含里氏木霉纤维素酶制剂的组合,所述里氏木霉纤维素酶制剂含有烟曲霉(aspergillusfumigatus)β-葡糖苷酶(如wo2005/047499中所描述)和橙色嗜热子囊菌(thermoascusaurantiacus)gh61a多肽(如wo2005/074656中所描述)。在优选的实施例中,该水解酶选自由以下各项组成的组:一种或多种纤维素酶、一种或多种脂肪酶、一种或多种蛋白酶、和一种或多种淀粉酶及其组合。该水解酶可以是包含发酵产物混合物的酶混合物,诸如包含任选地与兼性细菌共混的纤维素酶、淀粉酶、蛋白酶、和脂肪酶的酶混合物。在另外的优选的实施例中,该水解酶选自由以下各项组成的组:一种或多种纤维素酶、一种或多种半纤维素酶、一种或多种脂肪酶、一种或多种内切蛋白酶、和一种或多种淀粉酶及其组合。在本发明的合适的实施例中,该水解酶包含棘孢曲霉(aspergillusaculeatus)发酵产物,诸如野生型棘孢曲霉发酵产物。典型地,在此实施例中,棘孢曲霉发酵产物是包含糖酶(诸如阿拉伯聚糖酶、纤维素酶、β-葡聚糖酶、半纤维素酶和木聚糖酶)的多酶复合物在一个实施例中,该水解酶包含烟曲霉gh10木聚糖酶(wo2006/078256)和烟曲霉β-木糖苷酶(wo2011/057140)的共混物。相关的实施例涉及里氏木霉纤维素酶制剂,该里氏木霉纤维素酶制剂含有烟曲霉纤维二糖水解酶i(wo2011/057140)、烟曲霉纤维二糖水解酶ii(wo2011/057140)、烟曲霉β-葡糖苷酶变体(wo2012/044915)、和青霉属物种(埃默森青霉(emersonii))gh61多肽(wo2011/041397)。在替代性实施例中,该水解酶包含来自里氏木霉的纤维素酶和来自土生梭孢壳霉(thielaviaterrestris)的cel45内切葡聚糖酶的粗发酵产物的混合物。另外的替代性实施例涉及一种酶混合物,该酶混合物含有纤维素酶和β-葡聚糖酶以及天然里氏木霉木聚糖酶在另外的实施例中,该水解酶是包含来自里氏木霉的纤维素酶的发酵产物。在一个实施例中,该水解酶包含糖酶,优选地该水解酶包含纤维素酶,尤其是里氏木霉纤维素酶,更优选纤维素酶和半纤维素酶的组合。在另外的实施例中,其中水解酶包含纤维素酶,尤其是里氏木霉纤维素酶,更优选纤维素酶和半纤维素酶的组合。并且进一步包含蛋白酶、淀粉酶、和/或脂肪酶在一个实施例中,该水解酶包含蛋白酶,其中该蛋白酶是丝氨酸蛋白酶、优选10r蛋白酶,典型地来自葱绿拟诺卡氏菌(nocardiopsisprasina)。在另外的实施例中,该蛋白酶是枯草杆菌蛋白酶,诸如来自地衣芽孢杆菌(bacillusllicheniformis)或来自克劳氏芽孢杆菌(bacillusclausii)的枯草杆菌蛋白酶。该水解酶可以包含选自由以下各项组成的组的酶:来自葱绿拟诺卡氏菌的丝氨酸蛋白酶cas#37259-58-8、来自地衣芽孢杆菌的枯草杆菌蛋白酶cas#9014-01-1、来自克劳氏芽孢杆菌的枯草杆菌蛋白酶cas#9014-01-1e.c.3.4.21.62、来自解淀粉芽孢杆菌(bacillusamyloliquefaciens)的α-淀粉酶cas#9000-90-2e.c.3.2.1.1、来自疏棉状嗜热丝孢菌(thermomyceslanuginosus)的脂肪酶cas#9001-62-1e.c.3.1.1.3、和来自微小根毛霉(rhizomucorpusillus)的α-淀粉酶,诸如葡糖淀粉酶(葡聚糖1,4-α-葡糖苷酶)。如从实例可以看出,该水解酶可以适当地选自由以下各项组成的组:纤维素酶和半纤维素酶制剂、阿拉伯聚糖酶、纤维素酶、β-葡聚糖酶、半纤维素酶、和木聚糖酶制剂、内切蛋白酶制剂、α-淀粉酶制剂、脂肪酶制剂和葡萄糖淀粉酶制剂。合适地,该水解酶是商业制剂,诸如选自由以下各项组成的组:ctec2、ctec3、cl、bg5505、480ls、和10.5c.,诸如ctec2、ctec3、和cl、bg5505、480ls、和在本发明的一个实施例中,该水解酶是纤维素酶制剂,诸如商业纤维素酶制剂,诸如选自由以下各项组成的组:ctec2、ctec3、和cl。本发明的一方面涉及一种包括使用水解酶的处理废水的方法,其特征在于:当与初级或二级污泥接触时,该水解酶生成碳源。碳源可以选自由以下各项组成的组:一种或多种挥发性脂肪酸、单糖和醇。典型地,醇选自由以下各项组成的组:甲醇、乙醇、丙醇、和丁醇。典型地,使该水解酶与初级或二级污泥接触6至240小时,诸如6至120小时,典型地8至96小时,诸如12至72小时,更典型地18至72小时。在本发明中,水解酶(hydrolyticenzyme或hydrolase)或是催化化学键水解的酶。例如,催化以下反应的酶是水解酶:a-b+h2o→a-oh+b-h在一个实施例中,该水解酶包含糖酶。如本文所用,糖酶是催化碳水化合物分解成简单糖的酶。糖酶包括但不限于阿拉伯聚糖酶、纤维素酶、β-葡聚糖酶、半纤维素酶、木聚糖酶和淀粉酶。在另一个实施例中,该水解酶包含纤维素酶,优选纤维素酶和半纤维素酶的组合。如本文所用,“纤维素酶”或“纤维素分解酶”意指一种或多种(例如,若干种)水解纤维素材料的酶。此类酶包括一种或多种内切葡聚糖酶、一种或多种纤维二糖水解酶、一种或多种β-葡糖苷酶、或其组合。用于测量纤维素分解酶活性的两种基本方法包括:(1)测量总纤维素分解酶活性,以及(2)测量个体纤维素分解酶活性(内切葡聚糖酶、纤维二糖水解酶和β-葡糖苷酶),如在zhang等人,2006,biotechnologyadvances[生物技术进展]24:452-481中所述的。可使用不溶性底物,包括沃特曼(whatman)№1滤纸、微晶纤维素、细菌纤维素、藻类纤维素、棉花、预处理的木质纤维素等,测量总纤维素分解酶活性。最常见的总纤维素分解活性测定是将沃特曼№1滤纸用作底物的滤纸测定。该测定是由国际纯粹与应用化学联合会(iupac)建立的(ghose,1987,pureappl.chem.[纯粹与应用化学]59:257-68)。纤维素酶可以是具有纤维素酶活性的细菌多肽。例如,每种纤维素酶可以是具有纤维素酶活性的革兰氏阳性细菌多肽,或具有纤维素酶活性的革兰氏阴性细菌多肽。每种纤维素酶还可以是具有纤维素酶活性的真菌多肽,例如酵母菌纤维素酶或丝状真菌纤维素酶。在一个实施例中,纤维素酶是里氏木霉纤维素酶。如本文所用,“半纤维素酶”或“半纤维素分解酶”意指一种或多种(例如,若干种)水解半纤维素材料的酶。参见,例如shallom和shoham,2003,currentopinioninmicrobiology[微生物学当前观点]6(3):219-228)。半纤维素酶是植物生物质降解中的关键组分。半纤维素酶的实例包括但不限于:乙酰甘露聚糖酯酶、乙酰木聚糖酯酶、阿拉伯聚糖酶、阿拉伯呋喃糖苷酶、香豆酸酯酶、阿魏酸酯酶、半乳糖苷酶、葡糖醛酸糖苷酶、葡糖醛酸酯酶、甘露聚糖酶、甘露糖苷酶、木聚糖酶、以及木糖苷酶。这些酶的底物(半纤维素)是支链和直链多糖的异质性组,这些多糖经由氢键与植物细胞壁中的纤维素微纤维相结合,从而将它们交联成稳健的网络。半纤维素还共价附接至木质素,从而与纤维素一起形成高度复杂的结构。半纤维素的可变结构和组织要求许多酶的协同作用以使其完全降解。半纤维素酶的催化模块是水解糖苷键的糖苷水解酶(gh),或是水解乙酸或阿魏酸侧基团的酯键的碳水化合物酯酶(ce)。这些催化模块基于其一级序列的同源性,可以分配到gh和ce家族。一些家族(具有总体上类似的折叠)可以进一步分组为宗族(clan),以字母标记(例如,gh-a)。在碳水化合物活性酶(cazy)数据库中可得到这些以及其他碳水化合物活性酶的最翔实和最新的分类。可以根据ghose和bisaria,1987,pure&appi.chem.[纯粹与应用化学]59:1739-1752,在合适的温度(诸如40℃-80℃,例如,50℃、55℃、60℃、65℃或70℃)以及合适的ph(诸如4-9,例如,5.0、5.5、6.0、6.5或7.0)下测量半纤维素分解酶活性。在另外的实施例中,该水解酶可以是包含另外的蛋白酶、淀粉酶、和/或脂肪酶的制剂。在一个实施例中,将该水解酶以按重量计占该污泥的总固体(ts)的从0.001%至10%、优选0.005%-10%、更优选0.01%-8%、最优选0.05%-5%的量添加至该初级污泥和/或二级污泥中。本发明可以通过降低使用外源碳源的成本和复杂性来实现bod去除、生物除磷或脱氮。它在经济上高效并且与现有设施兼容。在本发明中,可以使用单独的处理区从工厂流入废水中除去污染物和营养物,诸如bod、磷、和氮。如本文所用,工厂流入废水是尚未被处理并且因此尚未进入废水处理系统(诸如本文所描述的废水处理系统)的原废水。当在该废水处理系统中或被部分处理时,该流入物在流过处理过程时变成混合液。在本发明中,将废水引导至前处理区,该前处理筛选、研磨和/或分离该废水中的碎屑。在此,除去碎屑诸如砾石、塑料及其他物体以节省处理过程中的空间并且保护泵送和其他设备避免阻塞、堵塞或磨耗及损伤。合适的筛网的非限制性实例包括放置在通道中的棒筛或穿孔筛。前处理区还可以包括适用于除去碎屑诸如沙子、砾石、粘土及其他类似材料的沉砂池(gritchamber)。也可以使用曝气砂砾去除系统和旋风除砂器(cyclonedegritter)。前处理后,将废水引导至初级澄清池。在此,发生沉淀,其中将水的速度降低到低于悬浮速度,导致悬浮颗粒通过重力从水中沉降出来。典型的废水处理厂在其处理过程中包括沉淀。然而,在具有少量悬浮固体的水中,沉淀可能不是必需的。初级澄清池可以包括不同类型池。池的非限制性实例包括允许水水平流过长槽的矩形池,用于扩增体积同时使土地面积使用最小化的双层矩形池,具有水平流动的正方形或圆形沉淀池,和/或在单个池内组合凝结、絮凝和沉淀的固体接触澄清池。适用于本文的典型沉淀池具有四个区,包括控制流入水的分布和速度的入口区、其中发生大部分沉降的沉降区、控制流出水的出口区、以及其中收集污泥的污泥区。在一个实施例中,在初级澄清池中使初级污泥与水解酶接触。可以将初级污泥保留在初级澄清池中并且在初级澄清池中发酵,以产生包含碳源的上清液。在此类情况下,污泥保留时间大于常规废水处理过程的时间。在另一个实施例中,可以将初级污泥引导至尤其用于发酵的处理区,例如发酵罐。可以将初级污泥保留在发酵罐中并且在发酵罐中发酵,以产生包含碳源的上清液。因此,在发酵罐中使水解酶与初级污泥接触。通过简单的操作改变,本发明可以生产更多用于除去污染物和营养物(诸如bod、磷、和氮)所需的碳源。在废水经过初级澄清池并且该初级污泥已经被充分沉降或除去之后,该废水流入二级处理。在一个实施例中,废水任选地经过第一厌氧处理区,诸如厌氧池。在此,将废水与厌氧池的内容物混合,并且可以称为混合液。在另一个实施例中,厌氧池是具有足够体积的深池,以允许固体沉淀,消化保留的污泥,以及厌氧地还原一些可溶性有机底物。厌氧池可以由诸如土、混凝土、钢或任何其他合适材料的材料制成。在初级澄清池的下游以及在缺氧处理区(诸如缺氧池)和好氧处理区(诸如好氧池)的上游或之前添加厌氧池。在一个实施例中,厌氧池不曝气或加热。任选地,可以混合厌氧池。预定厌氧池的深度以减少氧气从表面扩散的影响,允许厌氧条件占优势。在实施例中,厌氧池用于处理废水,该废水包括高强度有机废水,诸如工业或市政废水和具有显著有机负荷的群落。在此,生物化学需氧量(bod)去除率大于50%是可能的。在一个实施例中,在厌氧池中的保留时间是在0.25至6小时之间,并且温度大于15℃。本发明的方法合适地在从0℃至40℃、典型地从5℃至35℃、优选从10℃至30℃的温度范围内进行。在一个实施例中,将通过在废水处理过程中发酵或消化污泥生成的碳源转移到厌氧池中,以帮助原生或外源pao进行其磷释放阶段。这种磷释放步骤对于pao在好氧池或区中进行以下过度摄入步骤至关重要。在厌氧步骤中,pao将典型地在过度摄入步骤过程中释放一分子正磷酸盐,对于三分子正磷酸盐,pao将在好氧步骤过程中摄入。废水离开厌氧池并且任选地流入缺氧处理区,诸如缺氧池。缺氧池在缺氧条件下操作。在一个实施例中,该废水过程流包括缺氧池以促进废水的脱氮,其中将硝酸盐转化为氮气。缺氧池中的异养细菌在缺氧条件下使用硝酸盐作为氧源分解有机物质。在缺氧条件下:硝酸盐+有机物+异养细菌=氮气、氧气和碱度在一个实施例中,缺氧池在任何合适的条件下操作以促进缺氧条件。非限制性实例包括在未曝气池中建立缺氧区,其中将溶解氧水平保持低于1mg/l或尽可能接近,而不达到0mg/l。在一个实施例中,氧水平为0.2mg/l至0.5mg/l的量。缺氧池的ph应接近中性(7.0),并且优选不下降低于6.5。在一个实施例中,将在废水处理过程中通过发酵或消化污泥生成的碳源转移到缺氧池,其量为每mg所除去的no3-n需要至少2.86mgcod。在实施例中,缺氧池在有利于异养细菌的条件下操作,这些条件包括但不限于保持在5℃至48℃范围内或至少高于5℃的温度。缺氧池的ph应当在从6.0至8.5的范围内,至少大于5.5。废水过程流离开缺氧池,并且典型地流入好氧处理区,诸如好氧池。在一个实施例中,好氧池在任何合适的条件下操作以促进好氧条件。好氧条件的非限制性实例包括将空气或氧气注入废水过程流或混合液中以促进其生物氧化。在一个实施例中,表面曝气器将废水暴露于空气。在实施例中,池的目的是在生物学上帮助将流入物(或通过处理的混合液)中的可溶性可生物降解的有机物转化为能够沉降为污泥的生物质。存在于好氧池中的细菌包括适用于在好氧池中降解有机杂质的那些细菌。因此,在一个实施例中,好氧处理过程在空气的存在下进行,并且利用那些微生物,诸如使用分子/游离氧同化有机杂质(即,将它们转化为二氧化碳、水和生物质)的好氧微生物。在实施例中,好氧池在有利于好氧微生物的条件下操作,这些条件包括但不限于保持在5℃至45℃范围内或至少高于5℃的温度。好氧池的ph值应该在从6至8.5的范围内,至少大于5.5。在实施例中,将在废水处理过程中消化污泥生成的碳源转移到好氧池中,以用于过度磷摄入。废水离开好氧池并且流入二级澄清池。任何合适的二级澄清池可以适用于固/液分离。根据本披露使用的合适的二级澄清池以适合过程目标(快速污泥去除、停留时间等)的方式分离和除去在生物过程中产生的固体/生物质。二级澄清池也可用于增稠固体以用于再循环和过程再利用和/或将生物质作为缓冲液储存以防止过程扰乱。所有返回的活性(ras)污泥均收集在二级澄清池的底部。可以将ras泵送回系统(例如上游),以及可以将污泥泵送至污泥处理。在实施例中,为了确保足够的细菌可用于消耗废水中的废物,将污泥将从二级澄清池返回到厌氧池中。活性污泥将在数量上增加,因为其在废水过程流中消耗更多有机材料。废水离开二级澄清池,并且任选地流入三级处理、消毒和排放。在实施例中,污泥离开三级处理并且流动或泵送回到污泥处理。根据本披露,可以在过程流或混合液中在各个点将碳源引导至废水系统中。例如,可以单独地或与厌氧槽、缺氧槽、好氧槽、原活性污泥流、或侧流组合地引导碳源。碳源包括乙酸、丙酸、甘油、葡萄糖、糖蜜、高果糖玉米糖浆、甲醇、高碳质工业废物及其组合。将碳源以足以维持或滋养其中的细菌条件的量转移到过程流中。例如,碳源可以1mg/l至1000mg/l废水过程流、底流或从污泥中分离的水的量添加。在实施例中,根据本披露添加至少3或更多mg/l碳源/mg/l待除去的磷。在实施例中,根据本披露添加至少1或更多mg/l碳源/mg/l待除去的磷。在实施例中,根据本披露,将至少有3或更多mg/l的碳源/mg/l待除去的磷引导到废水处理过程中。在一个实施例中,通过添加水解酶在发酵中生成的碳源的量足够,使得可以减少或消除另外补充到废水中的碳源的量。在一个实施例中,不需要补充碳源。本披露的实施例可以应用于各种已知的废水处理厂,并且许多已知的配置是可能的。在一个实施例中,二级处理可以包括依次使用厌氧池、缺氧池和好氧池的池组合。在另一个实施例中,二级处理可以包括除了依次使用厌氧池、缺氧池和好氧池的实施例以外的池组合。替代性废水处理过程的非限制性实例包括那些过程,其中二级处理仅包括一个或多个缺氧池和一个或多个好氧池,或仅一个或多个厌氧池和一个或多个好氧池。池可以本领域普通技术人员已知的各种方式来建立。在实施例中,在二级处理中仅使用一个或多个好氧池。在增强的生物除磷(ebpr)系统中除磷需要碳源,典型地是可溶性挥发性脂肪酸(svfa)。具体地,磷累积生物体(pao)在厌氧条件下吸收这些svfa以产生能量,使得它们可以在好氧条件下累积正磷酸盐。流入废水通常不含有足够的svfa,因此经常需要增加svfa。这通常是通过添加酸(诸如乙酸)来完成的。本发明涉及使用酶通过催化初级污泥的水解和发酵来增加svfa。本发明的一方面涉及一种用于在市政或工业废水处理过程中除去废水中的磷和氮的原位碳源生成,其包括向初级或二级污泥中添加水解酶以进行原位碳源生成。可替代地定义,本发明的另一方面涉及一种在市政或工业废水处理中增加污泥水中的碳源的方法,其包括使用水解酶,其中该水解酶的特征在于该酶引起原位生成碳源,诸如挥发性脂肪酸。进一步可替代地定义,本发明的另一方面涉及一种通过向废水的初级或二级污泥中添加水解酶来减少或消除添加到废水或其污泥中的外源碳源的量的方法,其中所述水解酶增强该污泥的水解和后续发酵,从而原位生成更多碳源。本发明的感兴趣的另一方面是用于在市政或工业废水处理过程中除去废水中的磷和/或氮的原位碳源生成,其包括向初级或二级污泥中添加水解酶以进行原位碳源生成。该废水中的氮典型地呈铵、亚硝酸根(no2-)和硝酸根(no3-)以及氮微粒的形式。该废水中的磷典型地呈po43-的形式。以下非限定性实例进一步展示了根据本披露的组合物、方法和处理。应该注意的是本披露不限于实例中示例的特定细节。实例方法学在建立试验之前,分析初级污泥的初始ph、总固体(ts)、挥发性固体(vs)、化学需氧量(cod)、可溶性cod(scod)(用0.22μm过滤)、和可溶性挥发性脂肪酸(svfa)(用0.22μm过滤)。另外,确定每种酶样品的cod。表1示出了每种酶的cod和密度;这些值分别用于计算样品的初始cod和所希望的剂量(以ml为单位)。表1:酶特征实例1:水解酶对初级污泥发酵产生vfa的影响设置多个600ml烧杯,其中含有按体积计25%的初级污泥和75%的di水。对于每个试验,运行对照(不含酶)和配制的酶产物剂量为按体积计大约1,500ppm或52-270ppm范围的活性酶蛋白(aep)的样品。将每个烧杯用磁力搅拌棒以缓慢速率混合30分钟。停止混合,并且分析样品的ph和svfa。将样品用箔覆盖并且允许沉降一段时间(24-96小时)。此时,将样品再次混合5-10分钟,刚好足以得到均质的样品,并且再次分析cod、scod、svfa和ph。实验设置进行两项试验,以确定水解酶对增加来自初级污泥的vfa的有效性。试验1测试了水解酶-2和水解酶-1的酶,其中每种重复两次。试验2测试了水解酶-2、水解酶-1和、水解酶-3的酶,其中每种重复四次。对于试验1,该初级污泥是从罗诺克(roanoke)地区水污染控制厂(美国弗吉尼亚州罗诺克)取得的离散样品。该样品代表该初级污泥,因为它在固体处理操作中经受消耗并且不是代表初级流出物的包含本体水的“核心”样品。表2示出了该初级污泥的特征。六个总体积为350ml的600ml烧杯由88ml污泥和262mldi水构成。向两个烧杯中以283ppmaep的浓度添加水解酶-1,并且向两个烧杯中以58ppm的aep浓度添加水解酶-2。此试验的设置见表3。表2:试验1的初级污泥的特征表3:试验1的实验设置对于试验2,该初级污泥是从罗诺克地区水污染控制厂取得的另一个离散样品。表4示出了该初级污泥的特征。十六个总体积为400ml的600ml烧杯由100ml污泥和300mldi水构成。向四个烧杯中以298ppm的aep浓度添加水解酶-1;向四个烧杯中以61ppm的aep浓度添加水解酶-2;并且向四个烧杯中以92ppm的aep浓度添加水解酶-3。此试验的设置见表5。表4:试验2的初级污泥的特征表5:试验2的实验设置结果:试验168小时后,在水解酶-1的情况下观察到最大的vfa增加,其中增加267%。水解酶-2显示增加190%。两者均应与对照的160%增加进行比较。表6比较了vfa增加。误差条(未包括)显示,每个样品之间的差都显著。最初的vfa是在添加酶并且经过三十分钟的混合后取得的,这可以通过酶提高样品的初始vfa。表6:试验1的初始和最终svfa(mg/l)初始最终对照237616水解酶-12921071水解酶-22778001像vfa结果一样,水解酶-1对ph的影响最大,其中最终平均ph为4.4。水解酶-2的最终平均ph为5.3,并且对照为5.9。表7示出了平均初始和最终ph。表7:试验1的初始和最终ph初始最终对照5.85.9水解酶-15.54.4水解酶-25.45.3根据所分析的初级污泥和酶的scod和总cod,计算每个烧杯的scod和总cod的初始值。表8列出了初始和最终的scod和总cod。如所预期的,烧杯的总cod不变,因为系统中没有碳损失。由于通过消化过程不溶性cod转化为vfa并且变为可溶,因此所有样品的可溶cod均增加。表8:试验1的总cod和scod结果:试验224小时后,在水解酶-1的情况下再次观察到最大的vfa增加,其中增加185%。水解酶3显示增加174%,并且水解酶2显示增加113%。这些都应与对照的84%增加进行比较。表9是vfa增加的比较图表。误差条包括在图表上,并且显示每个样品之间的差都显著。最初的vfa是在添加酶并且经过三十分钟的混合后取得的,这可以通过酶提高样品的初始vfa。表9:试验2的初始和最终svfa(mg/l)初始最终对照149274水解酶-1217619水解酶-2191406水解酶-3179491试验2的ph下降遵循与试验1相同的趋势,在试验1中,vfa增加最大的样品(水解酶-1)显示了最大的ph下降。具有水解酶-1的样品的平均最终ph为4.5;具有水解酶-3的样品的平均最终ph为5.2;具有水解酶-2的样品的平均最终ph为4.45;并且对照样品的平均最终ph值为5.8。表10列出了平均初始和最终ph。表10:试验1的初始和最终ph初始最终对照5.95.8水解酶-15.84.5水解酶-25.85.2水解酶-35.74.9表11中列出了试验2的初始和最终的scod和总cod。如所预期的,烧杯的总cod不变,因为系统中没有碳损失。由于通过消化过程不溶性cod转化为vfa并且变为可溶,因此所有样品的可溶cod均增加。然而,在试验2中,与试验1相比,所有具有酶的样品的scod的百分比增加均较小。表11:试验2的总cod和scod结论:这两个初步试验显示,添加酶可以增加通过消化初级污泥生成的svfa。与对照相比,水解酶-1和水解酶3显示出最大的增加。实例2:水解酶-1和水解酶-3对初级污泥发酵生成vfa的研究方法学设置多个600ml烧杯,其中含有按体积计25%的初级污泥和75%的di水。对于每个试验,运行对照以及酶剂量为按质量计大约1%ts和5%ts的样品。将每个烧杯用磁力搅拌棒以缓慢速率混合5分钟。停止混合,并且分析样品的ph和svfa。将样品用箔覆盖并且允许沉降24小时。此时,将样品再次混合5-10分钟,刚好足以得到均质的样品,并且再次分析cod、scod、svfa和ph。实验设置在试验3中,以两种剂量测试水解酶1和水解酶3的酶,其中每种重复两次。另外,测试失活的酶以确定来自酶产物的增加的scod对vfa的生成的影响。为了使酶失活,将酶在di水中的10%溶液在80℃热水浴中保持30分钟。具有活性酶的样品也从10%酶溶液来添加。该初级污泥是从罗诺克地区水污染控制厂获得的离散样品。该样品代表该初级污泥,因为它在固体处理操作中经受消耗并且不是代表初级流出物的包含本体水的“核心”样品。表12示出了该初级污泥的特征。十四个总体积为400ml的600ml烧杯由100ml污泥和300mldi水构成。向四个烧杯中分别添加浓度为大约5%克酶产物或0.9%和0.3%aep/克ts的高压灭菌的水解酶-1或水解酶-3(每种两个烧杯);向两个烧杯中各自分别以1%和5%克酶产物或0.2%和0.9%克aep/克ts添加水解酶-1;并且分别以1%和5%酶产物或0.05%和0.26%克aep/克ts添加水解酶-3。此试验的设置见表13。表12:试验3的初级污泥的特征表13:实验设置*热激酶以失活。结果:试验324小时后,在5%克酶产物/克ts的剂量的水解酶-1的情况下,观察到最大的vfa增加。表14是每种样品的平均初始和最终vfa的比较图表。误差条包括在图表上,并且显示每个样品之间的差都显著。因为在仅混合5分钟后取得初始vfa,所以每种样品的初始vfa大约相等。表14还示出了每种样品的百分比增加。相对于vfa增加的范围为从98%-178%的具有活性酶的样品,对照和具有失活酶的两个样品显示出83%-89%的增加。这使人相信,vfa的生成不仅是由于cod的增加,还在于酶的活性。表14:试验3的初始和最终svfa(mg/l)初始最终增加%对照22240783水解酶-1(失活的)22843289水解酶-3(失活的)21740989水解酶-1-1%225468108水解酶-1-5%228627176水解酶-3-1%22143798水解酶-3-5%223494121试验3的ph降低显示,vfa增加最大的样品(水解酶-1%-5%,水解酶-3%-5%)显示了最大的ph下降。表15示出了所有样品的平均初始和最终ph。在比较试验1-3的最终ph值和vfa的百分比增加时,两个值之间的相关性为负。线性关系被定义为具有-0.4947的斜率和5.8014的y-截距(r2=0.8146)。表15:试验3的初始和最终ph初始最终对照5.885.32水解酶-1(失活的)5.765.14水解酶-3(失活的)5.665.21水解酶-1-1%5.755.11水解酶-1-5%5.634.81水解酶-3-1%5.785.22水解酶-3-5%5.735.08表16中列出了试验3的初始和最终的scod和总cod。如所预期的,烧杯的总cod不变,因为系统中没有碳损失。轻微的下降可能是由于测试中的误差。很可能由于通过消化过程不溶性cod转化为vfa并且变为可溶,因此大多数样品的可溶cod均增加。表16:试验3的总cod和scod结论:此试验比较了对于水解酶-1和水解酶-3两者,1%和5%ts的酶产物剂量。水解酶-1对增加通过消化初级污泥生成的svfa具有更大的作用。另外,运行失活的酶产物样品,显示vfa生成的增加是由于酶活性引起的,而不是产物的cod升高。实例3:水解酶-1、水解酶-4、水解酶-5、和水解酶-6对初级污泥发酵生成vfa的研究方法学设置多个600ml烧杯,其中含有按体积计10%的初级污泥和90%的di水。以按质量计大约5%ts添加(分别约为0.9%、1.0%和0.8%aep)添加液体酶产物(水解酶-1、水解酶-4、水解酶-5),并且以大约225g水解酶-6/1000gcod添加干酶微生物共混物(水解酶-6)。将所有样品与其中不添加酶的对照进行比较。将每个烧杯用磁力搅拌棒以缓慢速率混合5分钟。停止混合,并且分析样品的ph和svfa。将样品用铝箔覆盖并且允许沉降24小时。此时,将样品再次混合5-10分钟,刚好足以得到均质的样品,并且再次分析svfa和ph。实验设置在实验中,对于这些液态酶产物,以按重量计大约5%ts测试水解酶-1、水解酶-4、和水解酶-5,并且以225g产物/1000gcod测试水解酶-6,其中每种重复两次。另外,测试失活的水解酶-6以确定来自产物的增加的scod对vfa的生成的影响。通过高压灭菌使水解酶-6失活。该初级污泥是从罗诺克地区水污染控制厂获得的离散样品。该样品代表该初级污泥,因为它在固体处理操作中经受消耗并且不是代表初级流出物的包含本体水的“核心”样品。注意,在实验前将初级污泥样品在冷室中储存3周,并且其结果是,与新鲜采集的样品相比,在3周后取得时样品的发酵已进行(如看到的)增加的svfa水平。表17示出了该初级污泥的特征。表17:初级污泥的特征十二个总体积为400ml的600ml烧杯由40ml污泥和360mldi水构成。向两个烧杯中各自分别添加113ppm(大约5%g酶产物/gts)的水解酶1、水解酶4、和水解酶5。以225g/1000gcod添加水解酶-6和高压灭菌的水解酶-6,得到810ppm剂量。此试验的设置见表18。表18:实验设置*高压灭菌产物结果:24小时后,在水解酶-6的情况下观察到最大的vfa增加,增加32%。记住,高压灭菌的水解酶-6(其中酶和细菌两者均是失活的)显示出16%的vfa增加,这表明水解酶-6增加32%的部分原因可能是由于配制品中的原料,而不是酶或细菌的作用。仅含酶的产物显示出相似的百分比增加,其范围为从21%-28%。表19是每种样品的平均初始和最终vfa的比较表。对于相同数据测量的误差条(未示出)显示,每个样品之间的差都显著。因为在仅混合5分钟后取得初始vfa,所以每种样品的初始vfa大约相等。表19还示出了每种样品的百分比增加。与以前的工作相比,样品的百分比增加较低。这很可能是由于污泥的储龄(age)导致在冷室中发生vfa生成/发酵。表19:试验3的初始和最终svfa(mg/l)初始最终增加%对照201183-9水解酶-119625028水解酶-419723721水解酶-519324326水解酶-619525732水解酶-6(高压灭菌的)19122116表20示出了所有样品的平均初始和最终ph。表20:试验3的初始和最终ph初始最终对照5.695.70水解酶-15.435.08水解酶-45.405.25水解酶-55.735.17水解酶-65.685.54水解酶-6(高压灭菌的)5.625.65其中两个样品均运行5%g水解酶-1/gts的样品以及其中使用在25%v/v污泥和10%v/v污泥的样品(3周龄)。表21示出了这两种样品的比较。最后一列示出了vfa增加%/酶/污泥体积的计算值,这两种样品的计算值是显著相似的。表21:水解酶-1的比较结论:此试验比较了使用添加了水解酶-1、水解酶4、水解酶5、和水解酶6的初级污泥生成的vfa的百分比增加。此试验中使用的初级污泥是大约3周龄的,这对初始vfa具有影响,并且由于该污泥生成vfa的能力显著降低,很可能会使结果产生偏差。然而,所有酶产物的vfa均显示增加21%-28%,并且水解酶-6的vfa显示增加32%。实例4:水解酶-1和水解酶-4对初级污泥发酵生成vfa的研究方法学设置多个600ml烧杯,其中含有按体积计10%的初级污泥和90%的di水。将酶产物添加到适当的烧杯中。将所有样品与其中不添加酶的对照进行比较。将每个烧杯用磁力搅拌棒以缓慢速率混合5分钟。停止混合,并且分析样品的ph和svfa。将样品用箔覆盖并且允许沉降24小时。此时,将样品再次混合5分钟,刚好足以得到均质的样品,并且再次分析svfa和ph。实验设置该初级污泥是从罗诺克地区水污染控制厂获得的离散样品。该样品代表该初级污泥,因为它在固体处理操作中经受消耗并且不是代表初级流出物的包含本体水的“核心”样品。表22示出了该初级污泥的特征。表22:初级污泥的特征svfa1876ts30,055ppm%ts/污泥3.0%%vs/ts83%%vs/污泥2.5%六个总体积为400ml的600ml烧杯由40ml污泥和360mldi水构成。向两个烧杯中各自添加63ppm(大约2%g酶产物/gts)的水解酶-1和水解酶-4。此试验的设置见表23。表23:实验设置*高压灭菌产物以失活。结果:24小时后,与vfa的百分比增加仅为2%的对照相比,这些酶产物显示出37%-38%增加的相似百分比增加。表24是每种样品的平均初始和最终vfa的比较表。因为在仅混合5分钟后取得初始vfa,所以每种样品的初始vfa大约相等。表24还示出了每种样品的百分比增加。表24:试验4的初始和最终svfa(mg/l)初始最终增加%对照2282322%水解酶-122430938%水解酶-422130337%表25示出了所有样品的平均初始和最终ph。表25:试验4的初始和最终ph初始最终对照5.325.47水解酶-15.124.93水解酶-45.064.92结论:此试验比较了使用添加了水解酶-1和水解酶-4的初级污泥生成的vfa的百分比增加。与显示出增加2%的对照相比,两种酶产物(水解酶-1和水解酶-4)显示出增加37%-38%。实例5:水解酶-4、水解酶-6、和水解酶-6的酶对初级污泥发酵生成vfa的研究方法学设置多个600ml烧杯,其中含有按体积计10%的初级污泥和90%的di水。将酶/产物添加到适当的烧杯中。将所有样品与其中不添加酶/产物的对照进行比较。将每个烧杯用磁力搅拌棒以缓慢速率混合5分钟。停止混合,并且分析样品的ph和svfa。将样品用箔覆盖并且允许沉降24小时。此时,将样品再次混合5分钟,刚好足以得到均质的样品,并且再次分析svfa和ph。实验设置该初级污泥是从罗诺克地区水污染控制厂获得的离散样品。该样品代表该初级污泥,因为它在固体处理操作中经受消耗并且不是代表初级流出物的包含本体水的“核心”样品。表26示出了在第二天被分析的初级污泥的特征。在运行试验之前,将该初级污泥在冷室中放置大约6天。如在使用样品初级污泥的实例4与实例5中的单独样品的初始vfa水平的比较中所见,此储存时间可能导致样品发酵。表26:初级污泥的特征svfa1876ts30,055ppm%ts/污泥3.0%%vs/ts83%%vs/污泥2.5%十个总体积为400ml的600ml烧杯由40ml污泥和360mldi水构成。向两个烧杯中各自添加63ppm(大约2%g酶产物/gts)的水解酶-4。以成本可比较的水平(其为按质量计大约0.386%ts)添加水解酶-6和高压灭菌的水解酶-6。以按质量计0.20%ts添加水解酶-6(仅酶)样品。实验设置见表27。表27:实验设置*高压灭菌产物以失活结果:24小时后,在水解酶-4的情况下观察到最大的vfa增加,增加23%。水解酶-6样品(完全配制的样品和高压灭菌的样品两者)表现得与对照相似,所述对照显示出不显著的vfa水平变化。水解酶-6的仅酶配制品显示增加了7%,这与对照相比是显著的,但仅略微增加。表28是每种样品的平均初始和最终vfa的比较表。因为在仅混合5分钟后取得初始vfa,所以每种样品的初始vfa大约相等。表28还示出了每种样品的百分比增加。表28:试验5的初始和最终svfa(mg/l)初始最终增加%对照268263-2水解酶-426933023水解酶-6265261-2水解酶-6(高压灭菌的)2632651水解酶-6(仅酶)2592787表29示出了所有样品的平均初始和最终ph。表29:试验5的初始和最终ph初始最终对照4.895.32水解酶-44.944.93水解酶-64.955.37水解酶-6(高压灭菌的)5.035.26水解酶-6(仅酶)5.075.25结论:此试验比较了使用添加了水解酶-4、水解酶-6、高压灭菌的水解酶-6、和水解酶6的仅酶形式的初级污泥生成的vfa的百分比增加。与水解酶-4相比,所有形式的水解酶-6都显示出显著更少的vfa生成。实例6:水解酶-4的剂量曲线和变化的ts水平对初级污泥发酵生成svfa的影响方法学设置了多干600ml烧杯,其中含有用di水稀释至400ml总体积的初级污泥。将酶产物添加到适当的烧杯中。将所有样品与其中不添加酶/产物的对照进行比较。将每个烧杯用磁力搅拌棒以缓慢速率混合5分钟。停止混合,并且分析样品的svfa。将样品用箔覆盖并且允许沉降24小时。此时,将样品再次混合5分钟,刚好足以得到均质的样品,并且再次分析svfa。实验设置该初级污泥是从罗诺克地区水污染控制厂获得的离散样品。该样品代表该初级污泥,因为它在固体处理操作中经受消耗并且不是代表初级流出物的包含本体水的“核心”样品。表29示出了被分析的初级污泥的特征。试验7在与将其收集的同一天开始,并且试验8在将其收集后的一个月时开始。表29:初级污泥的特征对于试验7,十二个总体积为400ml的600ml烧杯由40ml污泥和360mldi水构成。向两个烧杯中各自添加以基于ts的不同水平(酶产物剂量%=g酶/gts)的水解酶-4。在分析所有初级污泥的特征之前,0.5%-4.0%的近似值基于流入物的假定ts值以开始试验。一旦确定了该初级污泥的实际%ts,就计算实际的%酶剂量。表30示出了试验7的实验设置。表30:试验7的实验设置对于试验8,对于所有样品,八个总体积为400ml的600ml烧杯由各种污泥体积(20、40、60、80ml)构成,具有相对于克ts的恒定酶剂量的水解酶-4(2.0%=克酶产物/克ts或0.41%aep克/克ts)。表31示出了试验8的实验设置。表31:试验8的实验设置结果:试验724小时后,该酶剂量越高,svfa的增加越大。表31示出了产生svfa的趋势。表31是每种样品的平均初始和最终svfa的比较表。因为在仅混合5分钟后取得初始svfa,所以每种样品的初始svfa大约相等。表31还示出了每种样品的百分比增加。表31:试验7的初始和最终svfa(mg/l)初始最终增加%对照90164820.5%92168831.0%861841142.0%891921153.0%902101334.0%86214148从试验7中的结果计算出与剂量和%增加的线性关系,并且发现其中斜率是0.4627并且y-截距是0.0301(r2=0.9442)的关系。这显示出svfa(克)总增加/克添加的酶。结果:试验824小时后,在污泥量最大的样品中看到最大的svfa增加。表32是每种样品的平均初始和最终svfa的比较表。由于添加的污泥增加,每种样品的初始svfa不相等。污泥体积越大,初始svfa越高。因此,初始svfa与最终svfa之间的总差(而不是svfa的百分比增加)也示出在表32中。表32:试验8的初始和最终svfa(mg/l)初始最终净增加5%污泥77992210%污泥1111948315%污泥15229113920%污泥195388193从试验8中的结果计算出与克污泥和净增加(svfa的克数)的线性关系,并且发现其中当y-截距逼近于零(r2=0.9554)时斜率是0.0414的关系。这显示出svfa(克)总增加/克固体。随着可用ts的增加,svfa的生成也随之增加。结论:试验7比较了使用添加了各种量(从0.5%到4.0%(克酶产物/克ts))的水解酶-4的初级污泥生成的svfa的百分比增加。随着酶剂量的增加,生成的svfa也呈线性增加。试验8示出了在恒定酶剂量下,可用克数的ts(或污泥体积)对svfa生成的影响。随着可用污泥的增加,生成的svfa也增加。实例7:水解酶-1、水解酶-5、和水解酶-7对来自pepper’sferry废水处理厂的初级污泥发酵生成svfa的研究方法学设置了多干600ml烧杯,其中含有用di水稀释至400ml总体积的初级污泥。将酶/产物添加到适当的烧杯中。将所有样品与其中不添加酶/产物的对照进行比较。将每个烧杯用磁力搅拌棒以缓慢速率混合5分钟。停止混合,并且分析样品的svfa。将样品用箔覆盖并且允许沉降24小时。此时,将样品再次混合5分钟,刚好足以得到均质的样品,并且再次分析svfa。实验设置初级污泥是取自pepper'sferrywwtp(pepper'sferry废水处理厂,美国弗吉尼亚州瑞德福(radford))的离散样品。该样品代表该初级污泥,因为它在固体处理操作中经受消耗并且不是代表初级流出物的包含本体水的“核心”样品。表33示出了被分析的初级污泥的特征。实验在将其收集的同一天开始。表33:初级污泥的特征svfa212mg/lts43,596mg/l%ts/污泥4.4%%vs/ts70.2%%vs/污泥3.1%八个总体积为400ml的600ml烧杯由40ml污泥和360mldi水构成。向两个烧杯中各自添加水解酶-1、水解酶-7、和水解酶-5,样品为大约2.0%克酶产物(分别为0.2%、0.18%和0.09%克aep)/克ts。在分析所有初级污泥的特征之前,2.0%的近似值基于流入物的假定ts值,以便开始试验。一旦确定了该初级污泥的实际%ts,就计算实际的酶产物剂量。表34示出了实验设置。表34:实验设置结果:24小时后,在水解酶-5的情况下观察到最大的vfa增加,增加282%,其次是水解酶-1,增加244%。表35示出了产生svfa的趋势。表35是每种样品的平均初始和最终svfa的比较表。因为在仅混合5分钟后取得初始svfa,所以每种样品的初始svfa大约相等。表35还示出了每种样品的百分比增加。表35:试验7的初始和最终svfa(mg/l)初始最终增加%对照59120104水解酶-150173244水解酶-554205282水解酶-751157207结论:经酶处理的pepper’sferry初级污泥的vfa与对照相比有所增加,这因此得到了对此酶应用的验证。与对照相比,水解酶-5(之前仅在三周龄的污泥上进行过试验)的vfa增加最大,其次是水解酶-1和水解酶-7。应理解的是,可以对本文披露的实施例进行各种修改。因此,不应将上述描述理解为限制,他们仅作为对实施例的示例说明。本领域那些技术人员将预见到本文所附权利要求范围和精神内的其他修改。此外,除非并且除了当明确描述了各个步骤的顺序,否则不应将术语解释为暗示本文披露的各种步骤之间或其中的任何具体顺序。实例8:用于产生svfa的酶方法学为了测试以确定在初级污泥发酵过程中哪些酶促进更大的svfa生成,进行简单的烧杯试验。表36示出了可商购酶ctec2、bgmax5505、alcalase2.5l、ban480ls、lipex100l、lipolase100l、savinase16l、和bpx10.5c的密度(来自产品数据表)(该密度用于计算以ml计的剂量),活性酶蛋白(aep),阐述的活性、和酶的简要描述。在设置试验之前,分析初级污泥的初始ts和vs。设置八个600ml烧杯,其中含有用di水稀释至400ml总体积的初级污泥。将酶产物添加到适当的烧杯中。将所有样品与其中不添加酶产物的对照进行比较。将每个烧杯用磁力搅拌棒以缓慢速率混合5分钟。停止混合,并且分析样品的svfa、scod、cod、和ph。将样品用箔覆盖并且允许沉降24小时。此时,将样品再次混合5分钟,刚好足以得到均质的样品,并且再次分析svfa、scod、cod、和ph。在0.45μm过滤样品上进行所有可溶性分析。表36:酶特征实验设置实例8-1中使用的初级污泥是2018年5月22日取自温彻斯特wwtp的样品。表37示出了该初级污泥(48小时污泥)的特征。表37:温彻斯特初级污泥的特征%ts/污泥5.88%%vs/ts78.88%%vs/污泥4.64%实例8-2和实例8-3中使用的初级污泥是取自罗诺克wwtp的样品。表38示出了该初级污泥的特征。实例8-2为3小时污泥。实例8-3为48小时污泥。表38:罗诺克初级污泥的特征%ts/污泥4.25%%vs/ts64.91%%vs/污泥2.76%实例8-4中使用的初级污泥是取自罗诺克wwtp的样品。表39示出了该初级污泥的特征。实例8-4为24小时污泥。表39:罗诺克初级污泥的特征%ts/污泥4.25%%vs/ts64.91%%vs/污泥2.76%对于每个实验,八个总体积为400ml的600ml烧杯由100ml污泥和300mldi水构成。以大约2.0%克酶/克ts向两个烧杯中各自添加水解酶#1、和水解酶#8和#9(根据试验而有所不同),同时2个烧杯未添加并且充当对照。对于实例8-2和实例8-4,在分析一些初级污泥的特征之前,2.0%的近似值首先基于流入物的假定ts值,以便开始试验。一旦确定了该初级污泥的实际%ts,就计算实际的酶剂量。对于实例8-2,实际剂量结果为1.2%,并且对于实例8-4,实际剂量结果为3.01%。表40、41、42和43分别示出了实例8-1、实例8-2、实例8-3和实例8-4的实验设置。表40:实例8-1的实验设置表41:实例8-2的实验设置表42:实例8-3的实验设置表43:实例8-4的实验设置结果实例8-1:24小时后,在水解酶#1的情况下观察到最大的vfa增加,增加48%,其次是水解酶#9,增加38%。因为在仅混合5分钟后取得初始svfa,所以每种样品的初始svfa大约相等。图1示出了相对于对照的百分比增加。结果实例8-2:24小时后,在水解酶#1的情况下观察到最大的vfa增加,增加139%,其次是水解酶#10和水解酶#11,均增加123%。因为在仅混合5分钟后取得初始svfa,所以每种样品的初始svfa大约相等。图2示出了相对于对照的百分比增加。结果实例8-3:24小时后,在水解酶#1的情况下观察到最大的vfa增加,增加69%,紧接着是水解酶#13,增加68%。即使这与在8-2中测试的初级污泥相同,但svfa的增加较小,因为该初级污泥的储龄较久并且在此时间点时已开始发酵。因为在仅混合5分钟后取得初始svfa,所以每种样品的初始svfa大约相等。图3示出了相对于对照的百分比增加。结果实例8-4:24小时后,在水解酶#1的情况下观察到最大的vfa增加,增加36%,紧接着是水解酶#13,增加28%。因为在仅混合5分钟后取得初始svfa,所以每种样品的初始svfa大约相等。图4示出了相对于对照的百分比增加。实例8的结论:实例8显示,与对照相比,在初级污泥发酵过程中至少纤维素酶、脂肪酶、蛋白酶、和淀粉酶产生svfa增加。总体而言,纤维素酶和蛋白酶在所有测试类型的酶中表现最好。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1