基于淀粉基纳米材料固定化生物酶微反应器及其应用
1.本发明属于酶的固定化技术领域,具体涉及一种以氧化石墨烯修饰的淀粉水凝胶为载体固定化生物酶微反应器及其应用。
背景技术:
2.生物酶是由活细胞产生的具有催化作用的有机物,大部分为蛋白质,它是一种无毒、对环境友好的生物催化剂。生物酶催化效率非常高,具有高度特异性,一种酶只能催化一种或者一类化学反应,反应条温和。但是游离酶在高温、强酸强碱、有机溶剂等环境容易失活,采用固定化酶的方式可以有效提高酶对温度、酸碱性、有机溶剂的耐受性。而且固定化酶由于其绿色、可回收等特点,在污水处理方面具有广泛的应用前景。
3.辣根过氧化物酶(hrp)是一种含有铁卟啉辅基的糖蛋白复合酶,是当前研究最广泛的一种过氧化物酶。在过氧化氢存在的情况下,辣根过氧化物酶能够催化氧化多种化合物,特别是含有大π共轭体系的物质,如酚类、芳香类、苯胺类、吲哚等化合物。其比活性高,稳定,分子量小,纯酶容易制备,广泛分布于植物界,辣根中含量高。
4.淀粉水凝胶中含有大量的羟基,具有很强的交联能力,同时,生物相容性和生物动力学响应好,因此可作为固定化酶载体。然而,天然淀粉水凝胶普遍存在机械性能差、脆性大、拉伸性低等缺点,限制了淀粉水凝胶在生物酶催化方面的广泛应用。因此,改善淀粉水凝胶的相关性能使其在生物酶催化方面发挥更大的作用仍然是一项具有挑战性的任务。
技术实现要素:
5.本发明的目的是提供一种催化活性高,热稳定性、重复使用性及有机溶剂耐受性好,且制备简单、生产成本低廉、具有工业化应用前景的固定化生物酶微反应器,并为该生物酶微反应器提供新的应用。
6.针对上述目的,本发明所采用的生物酶微反应器是在淀粉水凝胶的制备过程中加入氧化石墨烯得到氧化石墨烯修饰的淀粉水凝胶,并以所述水凝胶作为载体,通过静电作用和氢键作用固定生物酶得到;其中,所述生物酶为辣根过氧化物酶、过氧化氢酶、血红蛋白酶、氯过氧化物酶、细胞色素c中任意一种。
7.上述氧化石墨烯修饰的淀粉水凝胶的制备方法为:将氧化石墨烯超声均匀分散于去离子水中,得到氧化石墨烯悬浮液;将淀粉搅拌均匀分散于去离子水中,得到淀粉悬浮液;向淀粉悬浮液中加入氧化石墨烯悬浮液充分混合,然后将所得混合溶液加热到80~90℃并持续搅拌3~5h,冷却到室温后冷冻干燥,得到氧化石墨烯修饰的淀粉水凝胶。
8.上述淀粉悬浮液的浓度为0.08~0.12g/ml,氧化石墨烯悬浮液的浓度为0.5~1mg/ml;所得混合溶液中氧化石墨烯的最终浓度为0.2~0.4mg/ml。
9.上述氧化石墨烯修饰的淀粉水凝胶优选在ph为3~5的pbs缓冲溶液中,通过静电作用和氢键作用固定生物酶。
10.本发明基于淀粉基纳米材料固定化生物酶微反应器可用于降解废水中双酚a或2,
4
‑
二氯苯酚,其中所述的生物酶为辣根过氧化物酶。
11.与现有技术相比,本发明具有以下有益效果:
12.1、本发明使用具有高度生物相容性的淀粉基纳米材料作为主要载体,首先,通过在水中加热淀粉使其糊化然后发生回生形成三维网络结构的淀粉水凝胶,并在淀粉水凝胶的形成过程中修饰氧化石墨烯,引入的氧化石墨烯不仅可以改善淀粉水凝胶的结构,克服淀粉水凝胶的原始结构孔径过大导致生物酶泄露的弊端,使水凝胶的网络结构更致密,而且通过淀粉的引入可防止氧化石墨烯的堆叠团聚,有效提高比表面积,增大生物酶负载的有效面积,提升生物酶的固载效果。其次,由于所得水凝胶具有丰富的亲水基团,能增强水凝胶与生物酶之间的相互作用,增强生物酶的固定化效率,同时提高生物酶的负载量和水凝胶固定化生物酶的重复使用性。
13.2、本发明生物酶微反应器既能保持生物酶的催化活性又能保证生物酶的高分散性,同时克服游离生物酶的稳定性低、寿命短、对各种环境因素敏感、难以重复利用等缺点,提高了生物酶分子结构的稳定性及操作稳定性,避免了重复使用过程中生物酶分子泄漏的弊端,提高了重复使用次数,且该生物酶反应器在dmf、甲醇、乙腈等有机溶剂中耐受性好,这为游离生物酶的储存和回收方面提供了良好的方法。
14.3、本发明生物酶微反应器由于采用淀粉基纳米材料作为载体,生产成本低廉,具有工业化应用前景,且淀粉基纳米材料的笼状结构中具有相互连接的大孔,有利于溶质的非交叉扩散和传质,故固定化辣根过氧化物酶反应器在降解废水中双酚a和2,4
‑
二氯苯酚的应用中,能够在较短时间内即可达到较好的降解效果。
附图说明
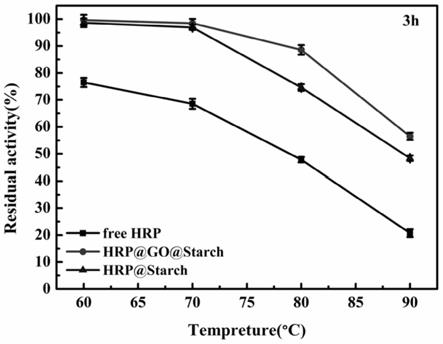
15.图1是温度对hrp@starch和hrp@go@starch催化活性的影响图。
16.图2是hrp@starch和hrp@go@starch在缓冲溶液中的重复使用性图。
17.图3是甲醇对hrp@starch和hrp@go@starch催化活性的影响图。
18.图4是乙腈对hrp@starch和hrp@go@starch催化活性的影响图。
19.图5是dmf对hrp@starch和hrp@go@starch催化活性的影响图。
20.图6是不同浓度双酚a被hrp@starch和hrp@go@starch降解的效果图。
21.图7是不同浓度2,4
‑
二氯苯酚被hrp@starch和hrp@go@starch降解的效果图。
具体实施方式
22.下面结合附图和实施例对本发明进一步详细说明,但本发明的保护范围不仅限于这些实施例。
23.实施例1
24.将10mg氧化石墨烯(go)超声均匀分散于10ml去离子水中,得到go悬浮液;将1g淀粉(starch)搅拌均匀分散于10ml去离子水中,获得淀粉悬浮液;向8ml淀粉悬浮液中加入2ml go悬浮液充分混合,使混合溶液中go的最终浓度为0.2mg/ml,然后将混合溶液加热到90℃并以300rpm的转速持续搅拌3h,再在60℃超声浴中超声处理2h,以获得均相的水凝胶,冷却到室温后冷冻干燥,得到得到氧化石墨烯修饰的淀粉水凝胶,记为go@starch。
25.称取5mg go@starch,加入1400μl ph=5的pbs缓冲溶液和100μl 0.25mmol
·
l
‑
1
hrp溶液,在29℃恒温震荡10h,静置6h后除掉上清液,并用pbs缓冲液清洗2~3次,除去未固定的hrp,得到基于淀粉基纳米材料固定化hrp微反应器,记为hrp@go@starch。
26.对上述制备的hrp@go@starch进行性能测试,同时以hrp@starch(上述方法中不添加go悬浮液制备成冷冻干燥的starch水凝胶,然后固定化hrp)做对比试验,具体试验如下:
27.1、催化活性实验
28.以hrp催化氧化abts生成稳定的蓝绿色abts
·
+
自由基作为模型反应来测定hrp催化活性。具体步骤为:取ph=5.0的pbs缓冲溶液、30μl 2mmol
·
l
‑1abts溶液、游离hrp或者相当于等量游离酶的starch@hrp或go@starch@hrp,最后加入20μl 0.1mol
·
l
‑1h2o2水溶液,保持溶液总体积为1.5ml。摇匀后在摇床中充分震荡15min后离心,吸出上清液,用紫外分光光度计测定415nm处的吸光度值。abts的转化率由以下公式计算:
[0029][0030]
式中a:紫外分光光度计实际测得的吸光度值;ε
415nm
:abts
·
+
在415nm处的摩尔吸光系数;b:测量时所用比色皿的宽度(cm);c
abts
:反应前abts底物浓度(mol
·
l
‑1)。结果显示,以游离hrp的催化活性为100%计,hrp@starch和hrp@go@starch保留有较高的催化活性,约为90.26%和93.58%。
[0031]
2、热稳定性实验
[0032]
将10mg hrp@starch和hrp@go@starch以及等量的游离hrp在不同温度(60~90℃)的水浴锅中温育3h,3h后取出游离hrp、hrp@starch和hrp@go@starch,待温度降至室温后,利用催化abts转化反应来测定其催化活性。将特定温度下温育前的酶催化活性看作100%,以温育3h后保留的催化活性相对于温育前的催化活性对温度作图,表征游离hrp、hrp@starch和hrp@go@starch的热稳定性情况,结果见图1。
[0033]
由图可见,两种酶反应器催化abts转化反应的残余活性随着温度升高而下降,在每一个温度下,酶反应器的保留活性均比游离hrp高。其中,go@starch@hrp和hrp@starch在80℃条件下放置1h后能分别保持88.58%和74.62%的催化活性;当90℃放置3h后,go@starch@hrp和hrp@starch仍可分别保留56.48%和48.36%的催化活性,与游离hrp相比,在高温下都具有良好的热稳定性。
[0034]
3、重复使用性实验
[0035]
分别称取5mg hrp@starch和hrp@go@starch于2ml离心管,加入1.2ml ph=5的pbs缓冲溶液和30μl 2mmol
·
l
‑1abts溶液,最后加入h2o2(0.1mmol
·
l
‑1)启动反应,保持溶液总体积为1.5ml。反应一段时间后,离心分离,测上清液在415nm处的吸光度值,清洗材料后重复上述操作。以第一次abts的转化率为100%,之后每一次的转化率与第一次比较,以残余活性表征hrp@starch和hrp@go@starch的重复使用性,结果见图2。
[0036]
由图可见,重复使用10次后,hrp@starch可保留62.08%的催化活性,hrp@go@starch可保留75.42%的活性,明显高于hrp@starch,说明hrp@go@starch的重复使用性好。
[0037]
4、有机溶剂耐受性实验
[0038]
(1)对甲醇耐受性
[0039]
在体积分数为5%~30%的甲醇水溶液中,加入10mg hrp@starch或hrp@go@starch或等量的游离hrp,室温下放置1h之后通过abts转化反应测试它们的保留活性。将未
加入甲醇的hrp@starch、hrp@go@starch以及游离hrp的催化活性看作100%,以各体积分数下hrp@starch、hrp@go@starch以及游离hrp保留的催化活性相对于未加入甲醇时的催化活性来表征对甲醇的耐受性,结果见图3。
[0040]
由图可见,经体积分数为30%的甲醇水溶液处理后,游离hrp保留的活性只有30.61%,hrp@starch保留的催化活性为75.88%,而同样条件下hrp@go@starch保留的催化活性可达到90.23%,明显高于游离酶,且高于hrp@starch。
[0041]
(2)对乙腈耐受性
[0042]
在体积分数为5%~30%的乙腈水溶液中,加入10mg hrp@starch或hrp@go@starch或等量的游离hrp,室温下放置1h之后通过abts转化反应测试它们的保留活性。将不加入乙腈时hrp@starch、hrp@go@starch以及游离hrp的催化活性看作100%,以各体积分数下hrp@starch、hrp@go@starch以及游离hrp保留的催化活性相对于未加入乙腈时的催化活性来表征对乙腈的耐受性,结果见图4。
[0043]
由图可见,经体积分数为30%的乙腈水溶液处理后,游离hrp的保留活性仅为32.09%,hrp@starch保留80.02%的催化活性,而hrp@go@starch可保留89.65%的催化活性,明显高于游离酶,且高于hrp@starch。
[0044]
(3)对n,n
‑
二甲基甲酰胺(dmf)耐受性
[0045]
在体积分数为5%~30%的dmf水溶液中,加入10mg hrp@starch或hrp@go@starch或等量的游离hrp,室温下放置1h之后通过abts转化反应测试它们的保留活性。将不加入dmf时hrp@starch、hrp@go@starch以及游离hrp的催化活性看作100%,以各体积分数下hrp@starch、hrp@go@starch以及游离hrp保留的催化活性相对于未加入dmf时的催化活性来表征对dmf的耐受性,结果见图5。
[0046]
由图可见,经体积浓度为15%的dmf水溶液处理后,游离hrp的剩余活性为20.75%,而hrp@go@starch及hrp@starch的剩余活性仍可以分别达到73.63%、65.44%。
[0047]
5、hrp与载体之间结合的静电驱动力
[0048]
将starch以及go@starch分别超声分散至ph=3和ph=5的pbs缓冲溶液中,用激光粒度仪测定其在不同ph下的zeta电位,如表1。
[0049]
表1
[0050][0051]
由表1可知,starch和go@starch在两种缓冲液中均呈负电性。已知hrp的等电点pi为7.2,初步认为可选择ph为3~5的pbs缓冲溶液来固定化hrp。hrp和载体starch以及go@starch间主要通过静电相互作用结合。
[0052]
实施例2
[0053]
实施例1制备的hrp@go@starch降解废水中降解双酚a的应用
[0054]
在10ml离心管中加入10mg hrp@go@starch(同时以hrp@starch做对比试验)、人工废水、不同浓度的双酚a,最后加入36μl 0.1mol
·
l
‑1h2o2水溶液启动反应,保持溶液总体积
为3ml。在磁力搅拌下室温反应25min,反应结束后用乙酸乙酯萃取3次。最后用旋转蒸发仪将萃取液全部蒸发去除,之后用色谱纯乙腈溶解样品,得到粗样。粗样经0.22μm的有机相过滤膜过滤后用于高效液相色谱(hplc
‑
15c)分析测定,高效液相色谱测定条件为:等梯度模式下采用乙腈
‑
水溶液(v
乙腈
:v
水
=90:10)为流动相,流速为0.5ml
·
min
‑1,检测波长为275nm,柱温25℃,进样量15μl。
[0055]
降解率(η)的计算根据公式为:η=(c0‑
c
t
)/c0×
100%,式中c
t
表示加酶后双酚a在t时刻的浓度,c0表示未加酶时反应体系的双酚a浓度。
[0056]
图6结果显示,当双酚a浓度为0.5mmol
·
l
‑1时,hrp@go@starch和hrp@starch在20min内降解率均可达到90%以上。当底物浓度继续增大时,两种固定化酶的降解率逐渐降低。当双酚a浓度为3.0mmol
·
l
‑1时,hrp@go@starch对人工废水中的双酚a降解率为57.58%,高于hrp@starch对人工废水中双酚a的降解率46.86%。
[0057]
实施例3
[0058]
实施例1制备的hrp@go@starch降解废水中2,4
‑
二氯苯酚的应用
[0059]
以甲醇作为溶剂准确配制一系列不同浓度的2,4
‑
二氯苯酚标准溶液,用0.22μm的有机相滤膜过滤,用高效液相色谱法测定不同底物浓度对应的峰面积,以底物浓度和其对应的峰面积作图,拟合得标准曲线方程。在10ml离心管中加入10mg hrp@go@starch(同时以hrp@starch做对比试验)、人工废水、不同浓度的2,4
‑
二氯苯酚,最后加入36μl 0.1mol
·
l
‑1h2o2水溶液启动反应,保持溶液总体积为3ml。在避光条件下反应20min后离心,用移液枪取出1000μl反应液于容器中,加入1000μl乙酸乙酯,避光搅拌进行萃取,重复操作3次。将萃取液旋转蒸发,溶剂完全蒸干后用1000μl甲醇溶解,过滤后的滤液做高效液相色谱分析。高效液相色谱测定条件为:等梯度模式下采用甲醇
‑
水溶液(v
甲醇
:v
水
=60:40)为流动相,流速为1.0ml
·
min
‑1,检测波长为284nm,柱温25℃,进样量20μl。
[0060]
由图7结果可见,当2,4
‑
二氯苯酚浓度为1.0mmol
·
l
‑1时,hrp@go@starch和hrp@starch在20min内基本能被完全降解。继续增大2,4
‑
二氯苯酚的浓度,当2,4
‑
二氯苯酚的浓度为3.0mmol
·
l
‑1时,hrp@go@starch对其降解率可达到94.5%,略高于hrp@starch的降解率。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1