一种氯碱出电解淡盐水中氯及氯氧化物处理方法及其装置与流程
本发明一种氯碱出电解淡盐水中氯及氯氧化物处理方法及其装置,属于氯碱工业盐水电解生产技术(含naoh、koh生产)领域,具体是将精盐水电解后出阳极室溶于淡盐水中、副产的氯及氯氧化物(clo3-、clo-、cl2)从出槽淡盐水中彻底清除技术,处理后的淡盐水残余氯质量合格率100%,且不损失淡盐水所携带电解释放的热能,高效、节能地循环再溶解食盐生产烧碱。
背景技术:
1、现通用出电解淡盐水脱氯工艺过程,参考附图2
2、出离子膜电解槽淡盐水~87℃加酸调节ph值2±0.5后入脱氯塔,在真空泵的抽吸下,脱氯塔内绝压保持33.3kpa左右,脱氯塔内淡盐水中大部分氯气携水蒸气自液相闪蒸逸出,入冷却器降温至40℃以下,湿氯气与氯水分离,一部分氯气冷凝成氯水回收至氯水槽中,同时湿氯气总管冷凝下的氯水也收集到氯水槽中,循环加热至~90℃再次进脱氯塔脱氯,出冷却器的氯气为不凝气被抽入水环式真空泵,经冷却分离后湿氯气进入湿氯气总管,氯水用于水环式真空泵工作液,多余氯水去氯水槽集中收集,出脱氯塔含有少量活性氯的淡盐水加烧碱调节ph值至9~11,再加入液体浓度5%~10%na2so3还原成cl-,消除剩余活性氯;化学方程式如下:
3、na2so3+cl2+2naoh=na2so4+2nacl+h2o
4、残余活性氯化学还原后,淡盐水去饱和nacl,na2so4由脱硝工序脱除。
5、外购固体na2so3由人工加入配制槽中,加水升温溶解为液体,浓度5%~10%na2so3,用离心泵在控制阀的控制下加入淡盐水中除去残余活性氯,淡盐水氧化还原电位控制-500mv~+500mv为合格。
6、现淡盐水中氯酸盐分解工艺运行状况
7、出电解的淡盐水自真空脱氯总管分流出一部分,按其中氯酸盐含量高低与高纯盐酸(31%hcl)相配比后入氯酸盐分解槽,加热蒸汽加入其中提升温度至90~95℃之间,淡盐水中氯酸盐分解,气相部分经工艺空气稀释后去除害吸收,不溶于碱性液体的成分放空。液相部分经充分反应后溢流去回收进入淡盐水总管,之后入脱氯塔脱除残余氯。在氯酸盐分解完成液中控制naclo32~3g/l、hcl20~25g/l,分解温度控制在t=90~95℃之间。此氯酸盐分解技术仅是局部的分解,不是全分解(含气相),其工艺原理中就明确地说明氯酸盐全分解(含气相)是不可能的,气相中存在大量未完全分解的clo2是合理的,其理论依据也仅支持不完全分解。液相分解不彻底,氯酸盐分解完成液中仍残存一定数量的氯酸盐。
技术实现思路
1、本发明的技术任务是将现出电解阳极室副产的淡盐水中氯及氯氧化物(clo3-、clo-、cl2)彻底清除,使其在近于中性环境中残余氯为零,分解后气相产物纯净,易于资源化回收。1本发明完成以上任务的基本思路
2、从氯及氯氧化物电化学反应机理上证明此创新技术工业装置设计所依据的的电化学理论基础的正确性。
3、1.1淡盐水中氯酸盐全分解(含气相)
4、在强酸性工况环境下(t=298k,[h+]=1mol/l,标准电极电位)电极电位图如附图1,图中,与氯酸盐分解有关的氧化还原标准电极电位:
5、eaθclo3-/clo2=1.75v, eaθclo2/hclo2=1.188v,
6、eaθclo3-/cl2=1.468v, eaθclo3-/hclo2=1.181v,
7、eaθhclo2/cl2=1.659v, eaθhclo2/hclo=1.701v,
8、eaθhclo/cl2=1.630v。 eaθcl2/cl-=1.35828v
9、根据图1中标准电极电位对得知:
10、(eaθclo2/hclo2=1.188v)-(eaθcl2/cl-=1.35828v)=-0.17028v→反应向左
11、(eaθclo3-/hclo2=1.181v)-(eaθcl2/cl-=1.35828v)=-0.17728v→反应向左
12、(eaθclo3-/clo2=1.75v)-(eaθcl2/cl-=1.35828v)=0.39172v→反应向右
13、(eaθclo3-/cl2=1.468v)-(eaθcl2/cl-=1.35828v)=0.1097v→反应向右即:
14、naclo3+2hcl=nacl+clo2+1/2cl2+h2o (1)
15、naclo3+6hcl=nacl+3cl2+3h2o (2)
16、而,
17、clo2+hcl≠hclo2+1/2cl2
18、这也是自离子膜电解工艺产生以来,氯碱界公认的氯酸盐分解工艺原理,是现所有的设备、工艺配置,工艺控制指标和操作法唯一的理论依据,但并没有达到淡盐水中氯酸盐分解的终极目标,至今氯酸盐分解单元也没有解决氯酸盐分解气相产物中始终存在大量clo2的问题,氯酸盐分解并不彻底,而且其它更优秀的淡盐水处理技术也不能在氯碱装置上采用。
19、从另外一个思维角度就完全可将此问题解决,在非标准状态下,上面的电极电位对差值可发生变化。将[h+]在0.5~1.5mol/l稀盐酸工况环境提升至[h+]~10mol/l,t=298k不变。其中,eaθclo2/hclo2=1.188v,eaθcl2/cl-=1.35828v;
20、氧化侧:cl--e=1/2cl2,
21、eacl2/cl-=1.35828+0.0592/2*lg(1/102)v=1.29908v;
22、还原侧:clo2+h++e=hclo2,
23、eaclo2/hclo2=1.188+0.0592/1*lg(10/0.01)v=1.3656v;
24、电极电位对差:
25、(eaclo2/hclo2=1.3656v)-(eacl2/cl-=1.29908v)=0.06652v;
26、此氧化还原反应往右进行。
27、clo2+hcl=hclo2+1/2cl2(3)。
28、事实上,hclo2在强酸性溶液中极不稳定,
29、亚氯酸还原电极电位对差:
30、(eaθhclo2/cl2=1.659v)-(eaθcl2/cl-=1.35828v)=0.30072v,
31、化学反应方程式:
32、hclo2+3hcl=2cl2+2h2o(4)。
33、新生态的hclo2在浓盐酸(31%hcl)中很容易被高浓度的cl-还原为cl2,cl-自身也被氧化成cl2。clo2还原成hclo2溶于浓盐酸中,气相hclo2占clo2的比例在浓盐酸环境中非常低,1%仅是个非常保守的数据。
34、淡盐水中氯酸盐全分解(含气相)整个分解过程如下:
35、在稀盐酸工况下,
36、naclo3+2hcl=nacl+clo2+1/2cl2+h2o和naclo3+6hcl=nacl+3cl2+3h2o
37、在浓盐酸工况下,
38、clo2+hcl=hclo2+1/2cl2和hclo2+3hcl=2cl2+2h2o
39、最终,淡盐水中氯酸盐全分解(含气、液相)
40、naclo3+6hcl=nacl+3cl2+3h2o
41、从理论上,氯酸盐分解后气相中的clo2在浓盐酸环境中进一步被还原、再分解为cl2得以证明,现作为其相应氯酸盐全分解(含气相)创新工艺的依据。
42、1.2淡盐水中活性氯(cl2、clo-)的歧化
43、在弱酸性工况下(t=333k,ph=3~7),淡盐水中活性氯歧化反应化学方程式:
44、2hclo≒hclo2+hcl(5)
45、hclo2+naclo=naclo3+hcl (6)
46、2hclo+naclo≒naclo3+2hcl(7)
47、活性氯歧化时,式(5)生成物hclo2为分子状态为双分子可逆反应,反应速度取决于分子之间的平衡常数,温度升高可提升歧化反应电位差和分子活跃度,加速歧化反应到达平衡浓度。而式(6)歧化产物为clo3-、cl-均为完全电离的阴离子,反应迅速完成。
48、从上面的化学反应方程式可以看出,在氯酸盐全分解的前提下,特别是clo2能够彻底分解后,歧化(化学)法正是消除活性氯(cl2、clo-)最简易的方法。在ph稳定的工况下,只有温度为影响反应速度的因素,它决定了(5)式可逆反应的平衡常数的大小,常温下反应速度较慢,电槽槽温(~87℃)下的反应速度是否适宜要由实验数据来确定。
49、2上述理论推导的实验证据
50、2.1氯酸盐全分解(含气相)小试方案
51、淡盐水中氯酸盐在稀盐酸(hcl0.5~1.5mol/l)环境下分解已工业化,此实验验证不再涉及,只需确认第二步浓盐酸吸收clo2时的反应条件,即在适宜的反应温度下的反应速度,就可补足整个氯酸盐分解全过程。当吸收气相中clo2盐酸浓度为商品级浓度[hcl]=10mol/l时,clo2可完全溶于浓盐酸中,其彻底吸收的反应时间和温度,即为最优选择。
52、小试方案,在正常运行的氯酸盐分解槽分解后的气相管道取样口连接气体导管,后接气体流量计(3000ml/h),再串联三只吸收瓶(1000ml),三只吸收瓶内均加入800ml温度45℃浓盐酸(31%hcl),出口接入引风机,风机出口连接盛有800ml15%naoh吸收液的吸收瓶(1000ml)玻璃管插入底部,瓶塞上有玻璃管排气。打开气相管道取样口处取样阀,启动风机以2l/h速度抽吸混合气体浓盐酸净化吸收clo2,之后15%naoh吸收氯气,分别在30min、60min后从盛有15%烧碱吸收瓶溶液中取样,分析其中naclo3和naclo。
53、分析结果都显示15%烧碱吸收瓶溶液中只含有naoh和naclo,而naclo3未检出。
54、按以上方案重复进行了20次实验,结果完全一致。
55、结论:此小试仅做定性分析,就已证明了clo2完全被45℃浓盐酸(31%hcl)吸收、还原为cl2
56、2.2活性氯歧化技术在氯碱工业化装置上的实验方案
57、活性氯消除常温下反应速度较慢,只确认在电槽正常运行槽温(87±3℃)下的反应速度,在允许反应时间内可逆反应后残余氯在允许范围即可,同时测试淡盐水浓缩后残余氯。
58、①在氯碱工业化装置上的实验方案
59、在送往脱氯单元的淡盐水总管上分流出10m3/h的淡盐水,测定其ph值4.1,稳温加热至90℃,取样分析活性氯(hclo、clo-)、naclo3,送往歧化反应器反应,控制反应器液位10m3(60min)、20m3(120min)、30m3(180min),歧化反应后~90℃淡盐水加~10%na2so3还原残余氯后回盐水工序。另外,在歧化120min时从歧化反应器淡盐水出口取样250ml,浓缩至190~200ml。
60、从歧化反应器淡盐水出口取样,样品冷却至常温,分析其中活性氯(hclo、clo-)、naclo3;每一时间段取分析样子三份,分析结果以平均值记录;
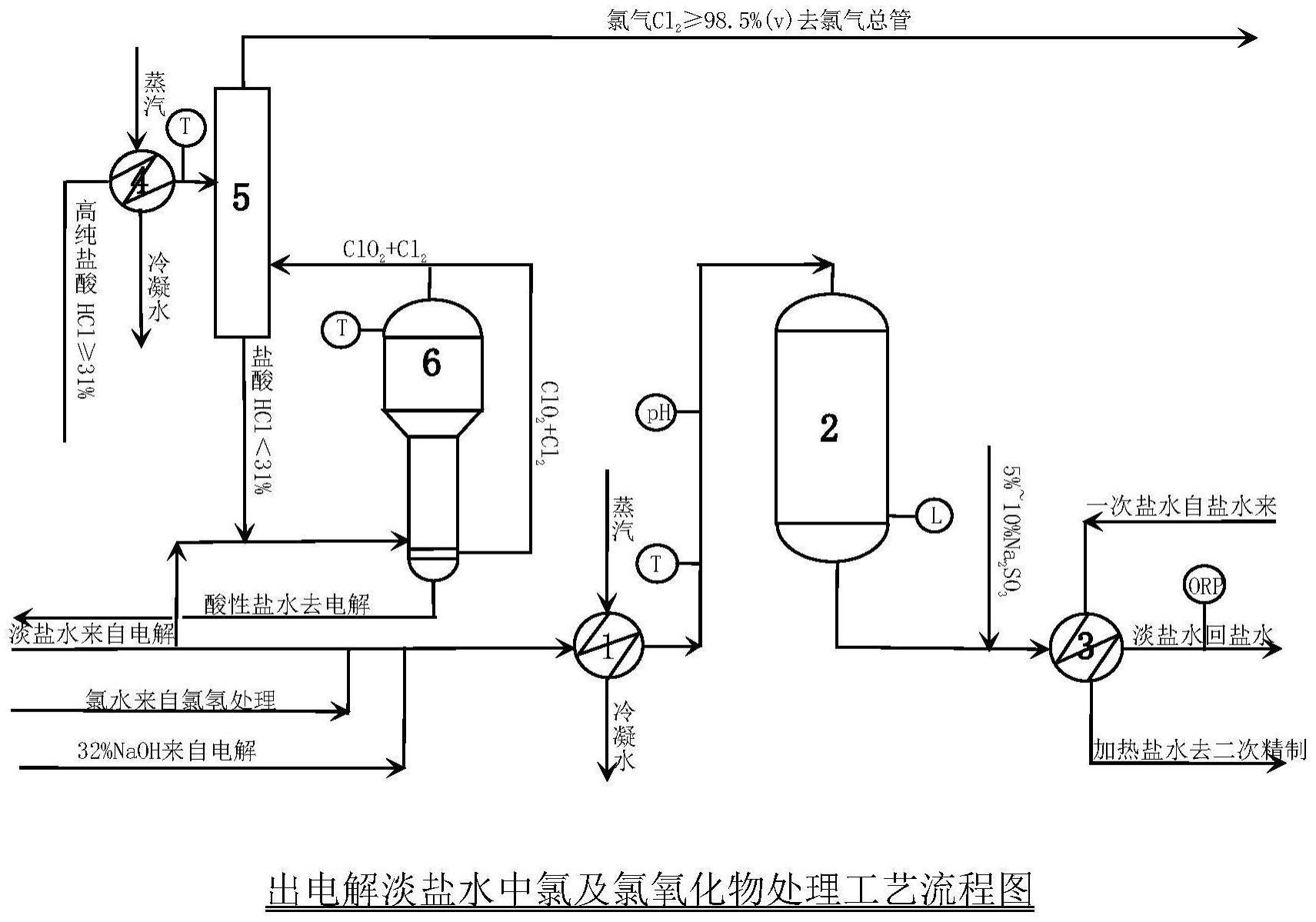
61、按上述操作法操作,将淡盐水ph值调节为ph5±0.2,分析其活性氯(hclo、clo-)、naclo3;
62、按上述操作法操作,将淡盐水ph值调节为ph6±0.2,分析其活性氯(hclo、clo-)、naclo3;
63、取250ml淡盐水浓缩至190~200ml,分析浓盐水ph值、nacl、活性氯(hclo、clo-)、naclo3。
64、活性氯分析方法:碘量法。
65、按以上方案实验重复进行了20次,结果完全一致。
66、②实验结果
67、
68、
69、③结论:在电解槽正常运行槽温下,经过180min恒温歧化,出电解后的淡盐水中所含活性氯(clo-、cl2)就足以降至体现此创新技术经济价值的工艺指标。采用淡盐水歧化浓缩装置,浓缩后盐水中残余氯工艺指标更佳。
70、3本发明清除淡盐水中氯及氯氧化物(clo3-、clo-、cl2)所采用的技术方案
71、淡盐水中氯酸盐(clo3-)全分解(含气相)装置(参考图3):包括盐酸加热器、clo2还原塔、氯酸盐分解器及其连接管道,工艺参数测量仪表包括测温仪、测压表、液位显示器、流量计及控制工艺参数的自动控制阀。
72、具体工艺过程:由界区外提供的高纯盐酸加热至25~60℃,按淡盐水中氯酸盐含量配比计量加入clo2还原塔,由盐酸调节阀控制流量,与从氯酸盐分解器分解出clo2和cl2混合气在塔内逆流接触,clo2被吸收还原成cl2,从还原塔气相出口排出并入氯气总管。还原clo2后的浓盐酸浓度有所下降,加入自电解来的淡盐水中,均匀混合后入氯酸盐分解器,经预热、加热、分解、冷却分离完成淡盐水中氯酸盐的分解,气相部分汇合后入还原塔处理,分解后的酸性淡盐水在自动调节阀的控制下去酸化进出电解槽盐水,中和电槽阴极室透过离子膜反迁移来的naoh。
73、淡盐水中活性氯(clo-、cl2)的歧化装置(参考图4):包括静态混合器、加热器、歧化反应罐、盐水换热器和氯酸盐分解装置一套,淡盐水总管上有支管去氯酸盐分解装置,和32%naoh加入管道和自动调节阀及来自氯水槽经酸化后的氯水管接入静态混合器前的淡盐水总管上,设备之间由管道连接,测量仪表包括测温仪、ph检测仪安装在连接管道上,5~15%na2so3加入管道和自动调节阀接入歧化后淡盐水总管上,淡盐水总管上的氧化还原电位仪测量提供工艺参数控制5~15%na2so3加入量。
74、具体工艺过程:来自电解后的出槽淡盐水入淡盐水总管,在自动调节阀的控制下加入32%naoh、酸化氯水,经静态混合器充分混合后进入蒸汽加热器控制淡盐水温度在84~90℃之间,ph值5~6之间,进入歧化反应器,活性氯(clo-、cl2)歧化为clo3-,残余氯溶于淡盐水中一起排出,再加入5~15%na2so3加入量还原至活性氯(clo-、cl2)为零,84~90℃之间的淡盐水在盐水换热器中与来自一次盐水的45~55℃精盐水换热,一次精盐水温度升至65℃以上去二次精制后电解,~55℃淡盐水去脱硝或化盐。出电解淡盐水从总管上的支管进氯酸盐分解装置,分解掉淡盐水中氯酸盐,回收氯气去总管,分解后酸性淡盐水去酸化进出电槽盐水和来自氯氢处理的湿氯气冷凝氯水。
75、含氯淡盐水(clo-、cl2)歧化浓缩装置(参考图5)包括:淡盐水中活性氯(clo-、cl2)的歧化装置一套和通用的淡盐水浓缩装置共同组成。
76、具体工艺过程:歧化后的淡盐水直接去淡盐水浓缩装置(淡盐水浓缩装置为公知技术),浓缩成浓盐水(nacl≥225g/l),浓盐水去脱硝或化盐,脱硝后的浓盐水与一次精盐水按配比混合后去二次精制、电解。
- 还没有人留言评论。精彩留言会获得点赞!