降低含纤维素的过滤材料中可浸出的β-葡聚糖的水平的制作方法
本申请要求2016年10月26日提交的美国临时专利申请号62/413,013的优先权,该临时专利申请通过引用整体并入本文。本公开一般涉及降低含纤维素的过滤材料中可浸出的(1→3)-β-d-葡聚糖的水平。
背景技术:
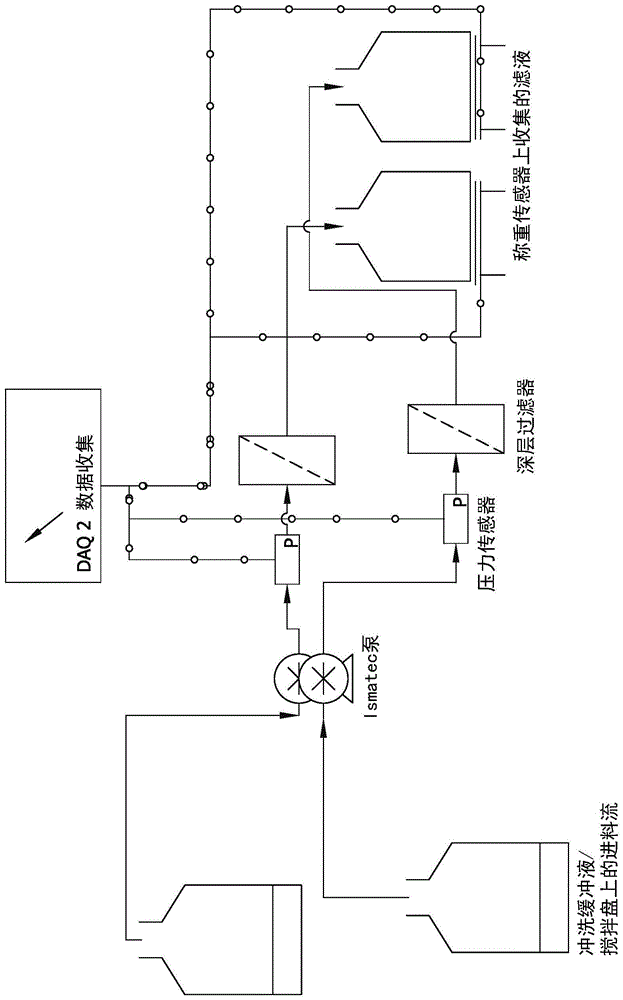
:含纤维素的介质和过滤器广泛用于生物制药和血浆纯化过程,以从靶分子中除去杂质。(1→3)-β-d-葡聚糖(“β-葡聚糖”)是纤维素基质中的固有杂质,并且在蛋白质和类似组分的过滤过程中可以浸出到产物流中。监管机构要求生物制药商密切监测β-葡聚糖杂质的含量,并将其维持在规定的阈值以下。由于患者安全和监管原因,来自过滤器的,特别是来自该过程下游进一步使用的过滤器的可浸出β-葡聚糖的水平升高引起关注。此外,基于血清的产品制造商需要将β-葡聚糖可浸出水平维持在阈值量以下。技术实现要素:在本公开的各个方面中,提供了一种用于降低含纤维素的过滤材料中可浸出的β-葡聚糖的量的方法。因此,简言之,本发明涉及一种用于降低含纤维素的过滤材料中可浸出的β-葡聚糖的量的方法,该方法包括用包含碳酸盐、有机碳酸酯(例如碳酸酯)或碳酸的溶液处理所述过滤材料。本公开的另一方面是提供根据本文所述方法处理的含纤维素的过滤材料,其中所述过滤材料与未处理的过滤材料相比,具有减少量的可浸出的β-葡聚糖。本公开的另一方面是提供制备具有减少量的浸出β-葡聚糖的生物药物或血浆衍生物的方法,该方法包括通过与根据本文所述方法处理的含纤维素的过滤材料接触来处理生物药物或血浆衍生物。。本公开的另一方面是提供通过与根据本文所述方法处理的含纤维素的过滤材料接触而制备的生物药物或血浆衍生物,其中所述生物药物或血浆衍生物与未处理的生物药物或血浆衍生物相比,包含减少量的浸出的β-葡聚糖。其他目的和特征部分是显而易见的,部分将在下文中指出。附图说明根据以下详细描述,所附权利要求和附图,本公开的这些和其他特征,方面和优点将变得更加显而易见,其中附图示出了根据本公开的示例性方面的特征,其中:图1是用于研究专门冲洗的工作台规模设置的示例性示意图。图2是用于研究再循环模式中的专门冲洗的工作台规模设置的示例性示意图。图3是说明专门冲洗对产品池中浸出的β-葡聚糖水平的影响的图。图4是说明碳酸盐(酯)冲洗的和标准冲洗的vpf(单克隆抗体a,vpf批号c4aa98988)的vpro比较性能的图。图5是说明碳酸盐(酯)冲洗的和标准冲洗的vpf(单克隆抗体b,vpf批号c3aa43491)的vpro比较性能的图。图6是说明用于从深层过滤器中除去β-葡聚糖的碳酸钠和碳酸钾的比较的图。图7是示出效果分析的大小的帕累托图表。图8是说明测量的与预测的β-葡聚糖可浸出水平的关系图。图9是示出低保持值的等高线图。图10是示出中间保持值的等高线图。图11是示出高保持值的等高线图。图12是说明在再循环模式中冲洗溶液的不同体积与面积比的影响的图。图13是说明使用氢氧化钠和氢氧化钾从未加工的纤维素纸浆中浸出的β-葡聚糖降低的图。缩略语和定义提供以下定义和方法以更好地定义本公开并指导本领域普通技术人员实施本公开。除非另有说明,否则术语应根据相关领域普通技术人员的常规用法来理解。本文引用的所有出版物,专利和专利申请,无论上文或下文,均通过引用整体并入本文,其程度如同每个单独的出版物,专利或专利申请被具体和单独地指出通过引用并入。与“包括”,“含有”或“特征在于”同义的术语“包含”是包含性的或开放式的,不排除另外的、未列举的元素或方法步骤。术语“基本上由......组成”将权利要求的范围限于指定的材料或步骤和“实质上不影响所要求保护的发明的基本和新颖特征的那些”。本文所用的术语“由...组成”不包括权利要求中未指定的任何要素,步骤或成分。必须注意,如在本说明书和所附权利要求中使用的,单数形式“一”,“一个”和“该”包括复数指示物,除非内容另有明确说明。因此,例如,对“一种组分”的引用包括一种,两种或更多种这样的组分。除非另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。尽管许多与本文所述相似或等同的方法和材料可用于本发明的实践,但本文描述了优选的材料和方法。具体实施方式本公开内容的一个方面涉及用于降低含纤维素的过滤材料中可浸出的β-葡聚糖的量的方法。已经有利地发现,本文所述的方法和由此产生的经处理的过滤材料可以显著降低通常浸入产品池(即,过滤通过后收集的组分)例如生物药物或血浆衍生物中的β-葡聚糖的量。通常,本文所述的方法和过滤器能够将含纤维素的过滤材料中可浸出的β-葡聚糖的水平降低大于10%,大于20%,大于30%,大于40%。大于50%,大于60%,大于70%,大于80%,大于90%,大于95%或大于99%。例如,可以在处理过程后的滤液中检测这种浸出的β-葡聚糖(即,作为治疗功效的指标)。当本文所述的经处理的含纤维素的过滤材料随后用于生物制药或血浆衍生物加工时,可浸出的β-葡聚糖水平的降低可转化为例如β-葡聚糖杂质水平小于1000pg/ml,小于900pg/ml,小于800pg/ml,小于700pg/ml,小于600pg/ml,小于500pg/ml,小于400pg/ml,小于300pg/ml,小于200pg/ml,或小于100pg/ml的生物药物或血浆衍生物产品。β-葡聚糖杂质的下限没有特别限制,可以优选小于50pg/ml或甚至更低。处理方案本文所述的方法涉及用含碳酸盐(酯)的溶液处理含纤维素的过滤材料。通常,过滤材料的处理是通过用溶液浸泡,循环,再循环,洗涤,冲洗,通过或者接触过滤材料以从中除去可浸出的β-葡聚糖来进行的,如下面进一步详细讨论的。含碳酸盐(酯)的溶液包括碳酸盐、有机碳酸酯或碳酸。也可以使用碳酸盐、有机碳酸酯和/或碳酸的组合。在一些实施方案中,例如,溶液包含碳酸盐。示例性的碳酸盐包括碳酸铵,碳酸氢铵,碳酸钡,碳酸钙,碳酸铁,碳酸锂,碳酸镁,碳酸锰,碳酸钾,碳酸氢钾,碳酸钠,碳酸氢钠,以及它们的混合物。在一个具体实施方案中,碳酸盐选自碳酸铵,碳酸钙,碳酸铁,碳酸镁,碳酸锰,碳酸钾,碳酸钠及其混合物。在另一个具体实施方案中,碳酸盐选自碳酸铵,碳酸钙,碳酸钾,碳酸钠及其混合物。在一个优选的实施方案中,碳酸盐是碳酸钠,碳酸钾或其混合物。在其他实施方案中,例如,溶液包括有机碳酸酯。有机碳酸酯通常具有下式:ro[(co)o]nr,其中每个r独立地是具有1至20个c原子的取代或未取代的、直链或支链的脂族、芳族/脂族(芳脂族)或芳族烃基。两个基团r也可以彼此连接形成环。两个基团r可以相同或不同;在一个具体实施方案中,它们是相同的。在该实施方案中,r优选为脂族烃基,更优选为具有1至5个c原子的直链或支链烷基,或者为取代或未取代的苯基。在这种情况下,r是直链或支链的,优选直链的(环)脂族、芳族/脂族或芳族,优选(环)脂族或芳族,更优选脂族烃基,其具有1至20个c原子,优选1至12个碳原子,更优选1至6,非常优选1至4个碳原子。这种基团的实例是甲基,乙基,异丙基,正丙基,正丁基,异丁基,仲丁基,叔丁基,正己基,正庚基,正辛基,正癸基,正十二烷基,正十四烷基,正十六烷基,正十八烷基,正二十烷基,2-乙基己基,环戊基,环己基,环辛基,环十二烷基,苯基,邻-或对-甲苯基或萘基。这些基团r可以相同或不同;它们优选是相同的。基团r也可以彼此连接形成环。这种二价基团r的实例是1,2-亚乙基,1,2-亚丙基和1,3-亚丙基。一般而言,n是1至5的整数,优选1至3的整数,更优选1至2的整数。碳酸酯可以优选为通式ro(co)or的简单碳酸酯,即在这种情况下n为1。合适的碳酸酯的实例包括脂族、芳族/脂族或芳族碳酸酯,例如碳酸亚乙酯,碳酸1,2-或1,3-亚丙酯,碳酸二苯酯,碳酸二甲苯酯,碳酸二甲苄酯,碳酸二萘酯,碳酸乙基苯酯,碳酸二苄酯,碳酸二甲酯,碳酸二乙酯,碳酸二正丙酯,碳酸二正丁酯,碳酸二异丁酯,碳酸二戊酯,碳酸二己酯,碳酸二环己酯,碳酸二庚酯,碳酸二辛酯,碳酸二癸酯或碳酸二月桂酯。一种示例性取代碳酸酯是碳酸甘油酯。其中n大于1的碳酸酯的实例包括二碳酸二烷基酯,例如二碳酸二叔丁酯,或三碳酸二烷基酯,例如三碳酸二叔丁酯。一种示例性芳族碳酸酯是碳酸二苯酯。在一个具体实施方案中,有机碳酸酯是选自以下组的碳酸酯:碳酸二甲酯,碳酸二苯酯,碳酸亚乙酯,碳酸三亚甲基酯,碳酸亚丙酯,碳酸甘油酯,以及它们的混合物。含碳酸盐(酯)溶液的ph通常为约7.5至约12(例如,约7.5,约8,约8.5,约9,约9.5,约10,约10.5,约11,约11.5,或约12)。在一个实施方案中,例如,溶液的ph范围为约8.5至约12(例如,约8.5,约8.75,约9,约9.25,约9.5,约9.75,约10,约10.25,约10.5,约10.75,约11,约11.25,约11.5,约11.75,或约12)。在一个优选的实施方案中,溶液的ph范围为约10至约12(例如,约10.1,约10.2,约10.3,约10.4,约10.5,约10.6,约10.7,约10.8,约10.9,约11,约11.1,约11.2,约11.3,约11.4,约11.5,约11.6,约11.7,约11.8,约11.9,或约12)。溶液的碳酸盐(酯)浓度可以根据例如所选择的碳酸盐(酯)(例如碳酸盐或碳酸),所需的ph和/或处理过程的保持时间而变化。在一个实施方案中,例如,碳酸盐(酯)浓度可具有约0.005mm的下限和所用特定碳酸盐(酯)的最大溶解度极限的上限。在另一个实施方案中,溶液的碳酸盐(酯)浓度为约0.005mm至约2m。因此,例如,碳酸盐(酯)浓度可以是约0.005mm,约0.01mm,约0.025mm,约0.05mm,约0.1mm,约0.5mm,约1mm,约5mm,约10mm,约25mm,约50mm,约0.1m,约0.15m,约0.2m,约0.25m,约0.5m,约0.75m,约1.0m,约1.25m,约1.5m,约1.75m或约2m。在一个具体实施方案中,溶液的碳酸盐(酯)浓度为约0.01m至约0.5m。在另一个具体实施方案中,溶液的碳酸盐(酯)浓度为约0.01m至约1m。在使用有机碳酸酯的实施方案中,例如,它们可以原样使用(即,不稀释或以含水形式使用)。除碳酸盐(酯)外,溶液还可含有缓冲剂以将ph保持在所需范围内(例如,约8.5至约12),否则调节溶液浓度。任何缓冲剂都可以用于本文提供的溶液中,只要它不会对碳酸盐(酯)组分产生不利影响并支持所需的ph范围。示例性缓冲剂包括氢氧化钠,氢氧化钾等。在一个具体实施方案中,缓冲剂是氢氧化钠。通常,缓冲剂浓度为0.005mm,约0.01mm,约0.025mm,约0.05mm,约0.1mm,约0.5mm,约1mm,约5mm,约10mm,约25mm,约50mm,约0.1m,约0.15m,约0.2m,约0.25m,约0.5m,约0.75m,约1.0m,约1.25m,约1.5m,约1.75m或约2m。在一些实施方案中,并且取决于所选择的缓冲剂,以及其ph和浓度,缓冲剂可以为过滤材料提供消毒益处。如上所述,过滤材料的处理包括用溶液浸泡,循环,再循环,洗涤,冲洗,通过或接触过滤材料。通常,可以使用任何用于制备使用的过滤材料的常规洗涤或冲洗方法。另外或可替代地,在制造包括过滤材料的装置之前,可以如本文所述处理过滤器组件,例如纤维素纸浆或膜。因此,例如,过滤材料可以用溶液处理或接触30秒至6小时的任意时间或更长的时间,条件是该时间长度不会不利地影响或损害过滤材料的性能。在一个实施方案中,将过滤材料浸泡或浸入溶液中一段时间(即静态浸泡)。通常,例如,将过滤材料浸泡或浸入溶液中约1分钟至约240分钟(例如,约15分钟,约30分钟,约45分钟,约60分钟,约75分钟,约90分钟,约105分钟,约120分钟,约135分钟,约150分钟,约165分钟,约180分钟,约195分钟,约210分钟,约225分钟,或约240分钟)。在一个具体实施方案中,将过滤材料浸泡或浸入溶液中约1分钟至约180分钟(例如,约15分钟,约30分钟,约45分钟,约60分钟,约75分钟,约90分钟,约105分钟,约120分钟,约135分钟,约150分钟,约165分钟,或约180分钟)。在另一个具体实施方案中,将过滤材料浸泡或浸入溶液中约60分钟至约120分钟(例如,约60分钟,约75分钟,约90分钟,约105分钟,或约120分钟)。在另一个实施方案中,该方法包括使溶液再循环通过过滤材料,例如通过泵系统使溶液两次或更多次通过过滤材料。示例性再循环装置在实施例1和图2中描述。常规过滤、切向流过滤和类似方法可以容易地应用于本文所述的再循环实施方案。例如,深层过滤器队列中的平均系统滞留量约为10l/m2至约100l/m2。在一个具体实施方案中,平均系统滞留量为约10l/m2至约60l/m2;例如,25l/m2至约60l/m2。应当理解的是,可以优化上述ph、碳酸盐(酯)浓度和接触/循环方案以提供可浸出的β-葡聚糖的最大降低(参见例如实施例2)。例如,在某些情况下,在较低浓度(例如,0.01m至0.5m)下较高的ph(例如10至12)和较高的接触时间(例如,80至120分钟)可以特别有效地降低浸出的β-葡聚糖水平。作为另一个实例,较低的ph(例如7.5至10)可能需要较高的摩尔浓度(例如,0.5m至溶解度极限),以最有效地降低可浸出的β-葡聚糖水平。作为又一个实例,延长的保持时间(>80分钟)对于用ph11-12的溶液在低于0.5m碳酸盐(酯)浓度下将浸出的β-葡聚糖降低至100pg/ml以下可能是特别有效的。作为又一个实例,较低的ph(例如,7.5至10),较高的碳酸盐(酯)浓度(>0.8m)和较低的静态保持时间(例如1至20分钟)可以特别有效地降低浸出的β-葡聚糖水平。在一个具体实施方案中,溶液具有0.01m至1m的碳酸盐(酯)浓度,10至12的ph,并且将过滤材料浸入静态浸泡100至120分钟。在另一个具体实施方案中,溶液具有0.01m至0.5m的碳酸盐(酯)浓度,11至12的ph,并且将过滤材料浸入静态浸泡中80至120分钟。处理方案的压力(例如,在通过或流通或(再)循环布置中)不是非常关键的,只要压力不会不利地影响或损害过滤材料的性能和/或可浸出的β-葡聚糖的去除。含纤维素的过滤材料一般而言,本文所述的用于去除本文所述的可浸出β-葡聚糖的方法可使用任何含纤维素的过滤或固体支持材料、介质或膜,所述材料、介质或膜可能导致β-葡聚糖浸出到所需产品中的风险。如本文进一步详细描述的,可以在形成过滤装置(例如,包括用于过滤材料的外壳)之前或之后,在形成过滤装置之前和之后,在过滤所需产品之前(即,作为预处理),及其组合情况下,进行处理。因此,本公开的另一方面是根据本文所述方法处理的含纤维素的过滤材料,其中该过滤材料与未处理的过滤材料相比,具有减少量的可浸出的β-葡聚糖。作为含纤维素的过滤材料,过滤材料可包括纤维素纤维(例如,木浆和/或棉衍生的),再生纤维素纤维,纤维素纤维与无机助滤剂(例如硅藻土,珍珠岩,热解二氧化硅)的组合,纤维素纤维与无机助滤剂和有机树脂的组合,纤维素/二氧化硅共混物,纤维素衍生物如乙酸纤维素或三乙酸纤维素,或其任意组合。这些材料及其通过湿法(类似于造纸)或干法制备它们的方法在本领域中是公知的。在一些实施方案中,例如,过滤材料是深层过滤器或将用于最终形成深层过滤装置。可根据本文的处理方法使用的代表性市售深层过滤器包括例如3m/cunoap系列深层过滤器(ap01);3m/cunocp系列深层过滤器(cp10,cp30,cp50,cp60,cp70,cp90);3m/cunohp系列深层过滤器(hp10,hp30,hp50,hp60,hp70,hp90);3m/cunoca系列深层过滤器(ca10,ca30,ca50,ca60,ca70,ca90);3m/cunosp系列深层过滤器(例如sp10,sp30,sp50,sp60,sp70,sp90);3m/cunodelipid和delipidplus过滤器;3m/cunopolynet过滤器(polynet-pb);3m/cunolifeassure过滤器;emdmilliporece系列深层过滤器(ce15,ce20,ce25,ce30,ce35,ce40,ce45,ce50,ce70,ce75);emdmilliporede系列深层过滤器(de25,de30,de35,de40,de45,de50,de55,de560,de65,de70,de75);emdmilliporehc过滤器(a1hc,b1hc,cohc,d0hc,x0hc,vpf,f0hc),clarisolve(40ms,20ms);emd和过滤器;mancelassociates深层过滤器(pr12up,pr12,pr5up)和pallcorporation过滤器(bio20,supraekip,ks-50p);sartoriusag过滤器等。在其他实施方案中,过滤材料是木浆。可根据本文所述方法处理的其他过滤材料和装置包括吸收剂,超滤膜,透析器和含有纤维素或其衍生物的类似材料。同样,这些材料可以在商业过滤装置形成之前或之后(或之前和之后)如本文所述进行处理。生物制药和血浆衍生物如上所述,含纤维素的介质和过滤器广泛用于生物制药和血浆纯化过程,以从靶分子中除去杂质。因此,本公开的另一方面是制备具有减少量的浸出的β-葡聚糖的生物药物或血浆衍生物的方法,该方法包括通过与根据任何前述处理方法处理的含纤维素的过滤材料接触来处理生物药物或血浆衍生物。本公开的又一方面是根据前述方法制备的生物药物或血浆衍生物。通常,可以使用用于制备(即过滤)生物药物或血浆衍生物的常规方法,除了用本文所述的经处理的含纤维素的过滤材料代替标准过滤器和过滤材料。可以使用本文描述的方法制备/纯化的生物药物或血浆衍生物不是非常关键的;可以使用如本文所述通常被过滤的任何合适的生物药物或血浆衍生物。举例来说,血液因子(例如,因子viii和因子ix),血栓溶解剂(例如,组织纤溶酶原激活物),激素(例如,胰岛素,胰高血糖素,生长激素,促性腺激素),造血生长因子(例如,促红细胞生成素,菌落刺激因子),干扰素(例如,干扰素-α,-β,-γ),基于白细胞介素的产物(例如白细胞介素-2),疫苗(例如,乙型肝炎表面抗原),单克隆抗体(许多已知的实例),和其他产品(例如,肿瘤坏死因子,治疗性酶)等。已经详细提供了本公开,显而易见的是,在不脱离所附权利要求限定的本发明的范围的情况下,可以进行修改和变化。此外,应了解,本发明中的所有实施例均作为非限制性实施例提供。实施例提供以下非限制性实施例以进一步说明本发明。本领域技术人员应该理解,以下实施例中公开的技术代表发明人已经发现在本文公开的主题的实践中很好地起作用的方法,因此可以认为构成其实施方案的实例。然而,根据本公开内容,本领域技术人员应当理解,在不脱离本发明的精神和范围的情况下,可以对所公开的具体实施方案进行许多改变并仍然获得相同或类似的结果。实施例1:从深层过滤介质中去除β-葡聚糖的不同冲洗化学品的研究在该实施例中,测试了五种专门的冲洗化学品用于从纤维素深层介质中去除β-葡聚糖。所研究的化学品包括2m氯化钠,4m尿素,1m碳酸钠缓冲液ph10,0.5n氢氧化钠和rodi水(milliq)。制备溶液并在使用前进行无菌过滤。在具有5cm2膜面积的viresolveprefilter(vpf)微型装置(optiscale40capsulecatnosspva40nb9)上进行实验。实验装置包括用于收集压力下降和流量数据的自动数据采集系统(daq2.0),铂固化硅管流路(catno#hv-96410-14,coleparmer,il,usa),一次性压力传感器(pdkt-104-03,pendotech,nj)。四个队列并行设置。实验装置的示意图如图1所示。用100l/m2的专用冲洗溶液冲洗过滤器,然后静态保持1小时。在保持时间结束时,用400l/m2净化水以600lmh冲洗过滤器。在rodi冲洗后,用30l/m2平衡缓冲液(25mmtrisph7)平衡过滤器。平衡后,加载30μl/m2的单克隆抗体溶液,将滤液收集到15ml聚苯乙烯离心管中。使用charlesriverptsrapidmicromethodglucan测定法分析这些样品的浸出的β-葡聚糖。用作对照的标准冲洗包括100l/m2rodi冲洗,然后30l/m2缓冲液平衡。表1总结了该过程。所有步骤的通量设定为360l/m2.hr。表1.冲洗策略总结再循环模式的实验设置如图2所示。在再循环模式中,在进料罐中分配规定量的冲洗缓冲液。将要冲洗的深层过滤器的出口放入进料罐中。以限定的流速和规定的时间进行冲洗。与流通模式相同的设备设置和过滤器用于上述再循环研究,主要区别在于在再循环模式中过滤器出口被引导回到进料罐。调查的三个水平包括25l/m2,50l/m2和60l/m2。所有三个体积与面积比将浸出的β-葡聚糖水平降低至100-200pg/ml范围并且是有效的。测试在蛋白质溶液体积与过滤面积比为30l/m2下收集的蛋白质池的β-葡聚糖水平。使用第二vpf批次进行确认运行。对于这两个批次,产品池中可浸出的β-葡聚糖的减少大于80%(比较浅绿色条(对照,标准冲洗)和深绿色(1m碳酸盐(酯)冲洗)。结果如图3所示。为了确保使用1m碳酸钠ph10溶液的专门冲洗策略不会对viresolveprefilter吸收容量产生负面影响,进行了对比性能测试。使用标准冲洗(对照)和专用冲洗冲洗的viresolveprefilter(vpf)装置用作viresolveprofilter的预过滤器。比较了viresolvepro通量曲线,以研究专用冲洗对预过滤器性能的任何影响。该测试在两个不同批次的vpf上进行,并且在两种不同的单克隆抗体进料上测试了容量。在两种情况中均未观察到对vpf吸收容量的不利影响。结果显示在图4和图5中。实施例2:专门冲洗参数对β-葡聚糖去除效率的研究1.碳酸盐(酯)抗衡离子的影响进行碳酸盐(酯)抗衡离子的分析以评估其用作β-葡聚糖去除的冲洗溶液的操作可行性。选择用于分析的主要标准是毒性,溶解度和其他操作问题。表2中提供了示例性研究的抗衡离子的概述。表2.抗衡离子的分析如上所示,基于毒性,溶解度和其他操作考虑,钠(na+)和钾(k+)是最优选的抗衡离子。可以使用钙与碳酸的组合,但是具有二氧化碳起泡的操作挑战。碳酸铵(nh4+)可用于泵处理,但在gmp环境中使用可能具有挑战性,因为它具有强烈的刺激性。也可以使用有机碳酸酯。其他抗衡离子如镁、锰、铁具有有限的溶解度,碳酸钡具有毒性并且溶解度低。进行实验以比较钠和钾抗衡离子从深层过滤介质中去除β-葡聚糖。研究了实验的碳酸钠和碳酸钾从深层过滤器中去除β-葡聚糖。在碳酸钠和碳酸钾冲洗的情况下,均使用ph为10的0.5m浓度溶液。在200lmh通量下进行100l/m2溶液冲洗。没有执行静态保持。在溶液冲洗后,在600lmh下进行400l/m2水冲洗。然后通过在600lmh下流过30l/m2的缓冲液,用50mm乙酸盐缓冲液80mm氯化钠ph5.5缓冲液调节过滤器。缓冲液冲洗后,30l/m2单克隆抗体进料以100lmh加载作为模型蛋白质。收集该蛋白质并分析浸出的β-葡聚糖。charlesriverptsrapidmicromethodglucan测定法用于β-葡聚糖分析。如图6所示,碳酸钠和碳酸钾在从深层介质中去除β-葡聚糖上显示出相当的性能。2.溶液浓度,ph值和静态保持时间的影响进行实验设计(doe)以确定ph、浓度和静态保持时间的有效范围。选择boxbehnken设计进行研究。参数列表和相关水平如表3所示。表3.参数列表和相关水平变量低中高ph7.51012浓度(m)0.01m0.5m1m接触时间(min)10min60min110min对于所有运行,遵循下面描述的标准冲洗程序。使用的所有过滤器是相同类型和相同批次(viresolveprefilteroptiscale40capsulecatnosspva40nb9,批号c6ba18393)。在给定浓度和ph下以200lmh通量进行100l/m2专门溶液冲洗。根据doe在给定时间内进行静态保持。静态冲洗后,在600lmh下进行400l/m2水冲洗。然后通过在600lmh下流过30l/m2的缓冲液,用50mm乙酸盐缓冲液80mm氯化钠ph5.5缓冲液调节过滤器。缓冲液冲洗后,将30l/m2单克隆抗体进料以100lmh加载作为模型蛋白质。收集该蛋白质并分析浸出的β-葡聚糖浓度。charlesriverptsrapidmicromethodglucan测定法用于β-葡聚糖分析。为了比较碳酸盐(酯)冲洗相对于水的有效性,进行阴性对照实验。对于水对照实验,将100l/m2的水以200lmh冲洗通过过滤器。静态保持60分钟。静态冲洗后,在600lmh下进行400l/m2水冲洗。然后通过在600lmh下流过30l/m2的缓冲液,用50mm乙酸盐缓冲液80mm氯化钠ph5.5缓冲液调节过滤器。缓冲液冲洗后,将30l/m2单克隆抗体进料以100lmh加载作为模型蛋白质。收集该蛋白质并分析浸出的β-葡聚糖浓度。charlesriverptsrapidmicromethodglucan测定法用于β-葡聚糖分析。除了水对照之外,还进行了标准冲洗实验。这样做是为了将专门冲洗结果与目前工业中使用的结果进行比较。对于标准冲洗,冲洗程序包括100l/m2的水冲洗,然后是30l/m2的缓冲液冲洗,均在600lmh下进行。缓冲液冲洗后,将30l/m2单克隆抗体进料以100lmh加载作为模型蛋白质。收集该蛋白质并测试浸出的β-葡聚糖含量。从该研究获得的葡聚糖浓度显示在表4中。表4.浓度、静态保持时间和碳酸钠溶液的ph对β-葡聚糖去除的影响分析doe以鉴定重要参数及其对从深层介质中去除β-葡聚糖的影响。进行方差分析以确定在模型中具有统计显著性的参数。溶液ph被确定为最重要的过程变量,溶液浓度本身没有显著影响,但ph和浓度相互作用项是显著的。静态保持时间的线性和平方项对浸出的β-葡聚糖没有统计学显著影响,但相互作用项ph*静态保持时间是显着的。不同项的效果大小在图7中的帕累托图中示出。蓝条代表的项具有统计学显著性。表示可能浸出到蛋白质中的β-葡聚糖水平与doe中分析的因子之间的关系的回归方程式由等式1给出。β-葡聚糖=3154-908浓度-536.7ph+7.54静态保持时间+107.8浓度*浓度+23.84ph*ph-0.00854静态保持时间*静态保持时间+72.9浓度*ph+0.782浓度*静态保持时间-0.631ph*静态保持时间(1)图8中显示了预测的与测量的浸出的β-葡聚糖浓度的关系图。产生等高线图以观察具有三种保持条件的参数的效果,如表5中所示。表5.等高线图的保持值保持水平ph浓度(m)静态保持时间(min)低7.50.00110中间(中心)100.560高121110低保持值的等高线图显示在图9中。ph*浓度曲线(上,左)显示出在10分钟的保持时间下,通过溶液ph大于10可将浸出的β-葡聚糖浓度降至100-200pg/ml。较低ph的碳酸盐(酯)溶液(<10)需要更高的浓度(>0.5m)以降低浸出的β-葡聚糖水平。静态保持时间*浓度图(上,右)显示出低ph碳酸盐(酯)溶液(ph7.5)需要浓度大于0.7m以除去β-葡聚糖。静态保持时间*ph图(下,左)显示出在溶液浓度为10mm时,在ph9或更高的ph下可以实现浸出的β-葡聚糖的显著降低。同样在这些条件下,静态保持时间不会显著影响浸出的β-葡聚糖的降低。在ph11或更高下,用80至110分钟的延长静态保持时间下实现最高的去除。对于中间保持值,等高线图在图10中示出。ph*浓度图(上,左)显示出ph值为9.5或更高的碳酸盐(酯)溶液在60分钟静态保持时间下在整个研究的溶液浓度范围(0.001m至1m)上对于降低浸出的β-葡聚糖都是有效的。ph10碳酸盐(酯)溶液在整个保持时间和浓度范围内降低浸出的β-葡聚糖都是有效的,如静态保持时间*浓度图(上,右)所示。静态保持时间*ph图(下,左)显示出ph9.5或更高对于在0.5m浓度下降低浸出的β-葡聚糖是有效的,不管静态保持时间如何。对于高保持值,等高线图在图11中示出。ph*浓度图(上,左)显示出ph9.5或更高的碳酸盐(酯)溶液在110分钟静态保持时间下在整个研究溶液浓度范围(0.001m至1m)内降低浸出的β-葡聚糖都是有效的。另外,ph11-12和浓度0.001m至0.5m范围可以将浸出的β-葡聚糖浓度降低至低于100pg/ml。ph12碳酸盐(酯)溶液在整个保持时间和浓度范围内去除β-葡聚糖都是有效的,如静态保持时间*浓度图(上,右)所示。在静态保持时间大于75分钟下,在ph12下浓度低于0.5m对于去除β-葡聚糖是最有效的。静态保持时间*ph图(下,左)显示出1m的溶液浓度,ph8.5或更高有效地将浸出的β-葡聚糖水平降低至低于200pg/ml。3.评估再循环模式下的冲洗在该研究中,我们研究了与实施例1和实施例2的第1和第2部分的流通模式相比,是否可以在再循环模式下进行冲洗。再循环模式可以帮助减少执行安装在gmp设置中的深层过滤器的冲洗所需的溶液体积。在再循环模式下测试三种不同的体积与面积比。25l/m2,50l/m2和100l/m2。溶液冲洗在200lmh通量下进行。没有进行静态保持。在溶液冲洗后,在600lmh下进行400l/m2水冲洗。然后通过在600lmh下流过30l/m2的缓冲液,用50mm乙酸盐缓冲液80mm氯化钠ph5.5缓冲液调节过滤器。缓冲液冲洗后,将30l/m2单克隆抗体进料以100lmh加载作为模型蛋白质。收集该蛋白质并分析浸出的β-葡聚糖。结果显示在图12中。所有三个体积与面积比都能够将浸出的β-葡聚糖水平降低至100-200pg/ml范围。图12中显示的水对照和标准冲洗数据是来自实施例2的第2部分。实施例3:降低用于过滤介质的纤维素纸浆中的β-葡聚糖在该实施例中,研究了碳酸钾和碳酸钠用于降低制备过滤介质所用的纤维素纸浆中的β-葡聚糖的有效性。纸浆以平板纸(flatsheet)的形式接收。使用47毫米的拱形冲孔器冲出47毫米的圆盘。圆盘安装在milliporecorporation不锈钢过滤器支架catnoxx4404700中。每个支架上安装一个圆盘。使用自动数据采集系统建立四个平行过滤系列,用于收集与实施例1和2类似的压力和流速数据。在该研究期间测试0.5m碳酸钠ph10和0.5m碳酸钾ph10,0.5n氢氧化钠。水用作阴性对照。冲洗顺序包括100l/m2溶液冲洗(在阴性对照的情况下为水)在200lmh通量下进行。进行60分钟静态保持。静态保持后,在600lmh下进行400l/m2水冲洗。通过在600lmh下流过30l/m2的缓冲液,用50mm乙酸盐缓冲液80mm氯化钠ph5.5缓冲液调节纸浆。缓冲液冲洗后,将30l/m2单克隆抗体进料以100lmh加载作为模型蛋白质。收集该蛋白质并分析浸出的β-葡聚糖。charlesriverptsrapidmicromethodglucan测定法用于β-葡聚糖分析。碳酸钠和碳酸钾冲洗能够将浸出的β-葡聚糖水平分别降低620pg/ml和2110pg/ml。0.5nnaoh导致浸出的β-葡聚糖水平增加。结果显示在图13中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1