用于表征药物产品杂质的系统和方法与流程
本发明总体上涉及蛋白质分离方法和细胞培养方法。
发明背景
在过去的二十年中,单克隆抗体(mab)已成功地用于靶向广泛范围的治疗领域(walshg.,naturebiotechnology,32:992-1000(2014);lawrences.naturebiotechnology,25:380-2(2007))。尽管mab具有由两个二硫键连接的重链组成的保守共价异四聚体结构,每个重链通过二硫键与轻链共价连接,但是即使在大量纯化步骤之后,这些蛋白质也通常含有低水平的产品相关的杂质。低分子量(lmw)种类(例如肽主链截短的片段)和高分子量(hmw)种类(例如抗体二聚体种类)两者均是产品相关的杂质的实例,所述杂质导致mab产物的大小异质性。由于蛋白质聚集而在治疗性mab药物产品中形成hmw种类可能潜在地损害药物功效和安全性(例如引发不想要的免疫原性应答)(rosenbergas.theaapsjournal,8:e501-7(2006);moussaem,等人journalofpharmaceuticalsciences,105:417-30(2006))。任何治疗性蛋白质的lmw种类都可能由产生过程中的宿主细胞蛋白酶活性引起。相对于抗体的单体形式,lmw种类通常具有低活性或实质上降低的活性,同时暴露可在体内导致免疫原性或潜在影响药代动力学性质的新表位(vlasakj,ionescur.mabs,3:253-63(2011))。因此,hmw种类和lmw种类两者均被视为关键质量属性,在药物开发过程中并在制造过程中作为纯化药物物质的释放测试的一部分定期监测所述关键质量属性。
传统上,mab产物的分子量异质性通过多种正交分析方法来表征(michelsda,parkerm,salas-solanoo.electrophoresis,33:815-26(2012))。用于评估mab产物纯度的最常用技术之一是在非还原条件下进行的sds-page。关于抗体,在分析过程中,可常规地观察并定量对应于lmw种类的次要条带,包括h2l(2条重链和1条轻链)、h2(2条重链)、hl(1条重链和1条轻链)hc(1条重链)抗体)以及lc(1条轻链)种类(liuh,gaza-bulsecog,chumsaec,newby-kewa.biotechnologyletters,29:1611-22(2007))。还可观察到蛋白水解片段。可通过经由埃德曼(edman)降解的n-末端测序、凝胶内胰蛋白酶消化、随后质谱分析以及使用抗fc和抗轻链抗体的蛋白质印迹分析来支持每个次要条带的所提出的身份。然而,从这些方法得到的任何提出的结构都不能在完整蛋白水平下得到明确证实。此外,在sds-page实验中使用的样品制备条件可通过二硫键混杂产生lmw伪影,这可导致对次要lmw种类的过高估计(zhuzc,等人journalofpharmaceuticalandbiomedicalanalysis,83:89-95(2013))。最近,毛细管电泳-十二烷基硫酸钠(ce-sds)已成为sds-page的现代等效物,提供优异的可再现性、灵敏度和通量(rustandirr,washabaughmw,wangy.electrophoresis,29:3612-20(2008);lacherna,等人journalofseparationscience,33:218-27(2010);huntg,moorhousekg,chenab.journalofchromatographya,744:295-301(1996))。在mab产物的ce-sds分析过程中,可常规地观察到具有比完整抗体更短的迁移时间的次要峰(lmw形式)。与sds-page分析不同,这些lmw杂质不能提取或进行进一步分析。结果,通常仅基于经验知识提出在ce-sds方法中观察到的lmw杂质的身份。因此,直接分离并明确鉴定mab产物中的lmw杂质的正交方法对于确保在抗体产品研发过程中控制制造过程至关重要。
作为最可靠的鉴定技术之一,通过现代质谱仪对完整mab蛋白进行精确的质量测量已在生物制药行业中日渐流行(kaltashovia,等人,journaloftheamericansocietyformassspectrometry,21:323-37(2010));zhangh,cuiw,grossml.febsletters,588:308-17(2014))。具体而言,各种“联用色谱-质谱”方法已证明了检测mab产物中的低丰度杂质并提供通过sds-page或ce-sds方法不能实现的高度详细的分析的能力(lejc,bondarenkopv.journaloftheamericansocietyformassspectrometry,16:307-11(2005);habergerm,等人mabs,8:331-9(2016))。例如,反相色谱法(rplc)与质谱法结合可用于检测mab药物产品中存在的游离轻链和相关的翻译后修饰(例如,半胱胺酰化和谷胱甘肽化)。但是,与sds-page和ce-sds方法相比,rplc通常缺乏足够的分辨率来分离lmw种类,并且因此无法阐明完整lmw谱。例如,基于rplc的完整质量分析从未报告过mab药物产品中的h2l种类的鉴定,这是由于h2l种类的低丰度和与主要完整抗体的较差分辨。另一种对于表征mab产物相关的杂质的基于ms的技术是天然电喷雾电离质谱(天然esi-ms),所述技术当与尺寸排阻色谱法(sec)结合时特别有用(habergerm,等人mabs,8:331-9(2016))。然而,由于方法之间使用的实验条件显著不同,所以在天然sec-ms分析中鉴定的lmw种类通常与通过sds-page或ce-sds鉴定的lmw种类不同。具体而言,sds-page和ce-sds所需的样品制备通常始于蛋白质变性,其中hc-lc对的n-末端区域与hc-hc对的c-末端区域之间的非共价相互作用被破坏。结果,如果链间二硫键断裂,则lmw杂质(如h2l、半抗体和游离轻链种类)能够从mab分子解离。相比之下,天然sec-ms在接近天然条件下分析mab样品,从而允许即使链间二硫键断裂,也可保留强烈的非共价链间相互作用并允许保持mab分子的四链结构。尽管sec柱化学的进展使得使用变性缓冲液(例如30%乙腈、0.1%fa和0.1%tfa)成为可能,所述变性缓冲液通常用于反相色谱法中以进行sec分离并直接耦合至在线质谱分析(liuh,gaza-bulsecog,chumsaec.journaloftheamericansocietyformassspectrometry,20:2258-64(2009)),但lc分辨率对于检测许多lmw种类仍然不是最佳。
因此,本发明的目的是提供用于表征lmw蛋白质药物杂质的系统和方法。
本发明的另一个目的是提供具有降低的杂质水平的蛋白质药物产品。
本发明的仍然另一个目的是提供生产具有减少的蛋白质药物产品杂质的蛋白质药物产品的方法。
技术实现要素:
提供了用于表征低分子量(lmw)蛋白质药物产品杂质的系统和方法。一个实施方案使用结合质谱分析的亲水相互作用色谱法(hilic)。在从所述蛋白质药物产品,例如抗体药物产品中除去n-连接的聚糖后,通过分子量种类的大小确定自hilic柱的lmw杂质洗脱。在一些实施方案中,在变性条件下进行所述hilic分离,使得使用这种方法进行的lmw形式检测与sds-page和ce-sds方法两者具有高度可比性。lmw药物产品杂质包括但不限于轻链、半抗体、h2l、h2、hl、hc、肽主链截短的种类以及它们的组合。
所公开的hilic-ms系统和方法提供详细的lmw鉴定信息。通过hilic-ms分析揭示的可靠鉴定和详细的结构信息对于深入表征蛋白质药物产品中的lmw杂质非常有价值,其通常是后期分子研发所必需的。此外,由于所公开的hilic-ms系统和方法比sds-page或ce-sds使用更温和的样品制备,因此不太可能产生lmw伪影。hilic-ms系统和方法可用作半定量分析以比较样品之间的lmw杂质谱,或简单地定性应用。
一个实施方案提供了一种蛋白质药物产品,所述蛋白质药物产品含有蛋白质药物和赋形剂,其中所述蛋白质药物产品包含介于约0.05%与约30.0%w/w之间的低分子量蛋白质药物杂质。所述蛋白质药物产品可以是抗体、融合蛋白、重组蛋白或它们的组合。在其他实施方案中,所述药物产品含有介于约0.05%至约25%、或约0.05%至约15%、或约0.05%至约10%、或约0.05%至约5%、或约1%至约25%、约1%至约15%、约1%至约10%或约1%至约5%w/w的低分子量蛋白质药物杂质。
另一个实施方案提供了一种用于表征低分子量蛋白质药物产物杂质的方法,所述方法包括以下步骤:
i)使蛋白质药物产品样品去糖基化,
ii)通过亲水相互作用色谱法分离所述蛋白质药物产品样品的蛋白质组分,以及
iii)通过质谱法分析所述分离的蛋白质组分以表征所述蛋白质药物产品样品中的低分子量蛋白质药物产品杂质。
所述方法进一步提供了任选的还原步骤。所述还原步骤可在步骤i)与步骤ii)之间进行。所述蛋白质药物产品样品可取自补料分批培养物。如上所述,所述蛋白质药物产品可以是抗体、融合蛋白、重组蛋白或它们的组合。
仍然另一个实施方案提供了一种产生抗体的方法,所述方法包括以下步骤:在细胞培养物中培养产生所述抗体的细胞;从所述细胞培养物获得样品;根据上文所述的方法表征并定量所述样品中的低分子量杂质,以及修改所述细胞培养物的一种或多种培养条件以减少在所述抗体的细胞培养过程中产生的表征的低分子蛋白质药物杂质的量。在一些实施方案中,在细胞培养期间在任何时间间隔取得所述样品。在其他实施方案中,在产生培养后、在蛋白质收获后或在纯化后取得所述样品。经改变以减少低分子量蛋白质药物杂质的量的所述细胞培养物的一种或多种条件可选自由以下组成的组:温度、ph、细胞密度、氨基酸浓度、重量克分子渗透压浓度、生长因子浓度、搅拌、气体分压、表面活性剂或它们的组合。所述细胞可以是真核细胞或原核细胞。所述细胞可以是中国仓鼠卵巢(cho)细胞(例如chok1、dxb-11cho、veggie-cho)、cos细胞(例如cos-7)、视网膜细胞、vero细胞、cv1细胞、肾细胞(例如hek293、293ebna、msr293、mdck、hak、bhk21)、hela细胞、hepg2细胞、wi38细胞、mrc5细胞、colo25细胞、hb8065细胞、hl-60细胞、淋巴细胞例如自体t细胞、jurkat(t淋巴细胞)或daudi(b淋巴细胞)、a431(表皮)细胞、u937细胞、3t3细胞、l细胞、c127细胞、sp2/0细胞、ns-0细胞、mmt细胞、干细胞、肿瘤细胞以及源自上述细胞中的任一种的细胞系。在一个实施方案中,所述细胞是杂交瘤或四源杂交瘤细胞。仍然另一个实施方案提供了一种通过本文所述的方法产生的抗体。
又一个实施方案提供了一种用于表征低分子量药物杂质的系统。所述系统包括亲水相互作用液相色谱系统,所述亲水相互作用液相色谱系统包括连接至如本文例示的流动相a和流动相b的亲水相互作用液相色谱(hilic)柱,并且所述hilic柱与质谱系统处于流体连通。
在又一个实施方案中,本发明涉及根据本发明的方法用于蛋白质药物产品的稳定性确定和强制降解研究的用途。
在另一个实施方案中,本发明涉及用于蛋白质药物产品的稳定性确定和强制降解研究的用途。
附图说明
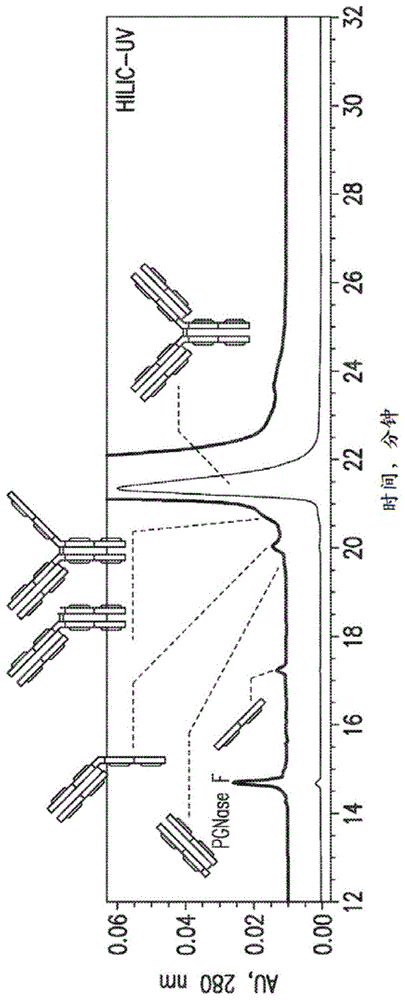
图1a和1b是mab-1药物物质样品的hilic分离的色谱图。图1a是紫外线谱,并且图1b是hilic谱。图1a中将uv信号放大10倍,以更好地可视化lmw杂质。
图2a示出使用最丰富的电荷态的m/z,不同轻链变体的提取的离子色谱图(xic)。图2b示出具有β消除的轻链的去卷积质谱。图2c示出由2-巯基乙酸修饰的轻链、未修饰的轻链和c-末端残基修剪的轻链的去卷积质谱。图2d示出具有半胱氨酰化的轻链的去卷积质谱。图2e示出具有谷胱甘肽化的轻链去卷积质谱。
图3a示出fab片段的去卷积质谱。图3b示出半抗体的去卷积质谱。图3c示出fab截短的片段的去卷积质谱。图3d示出h2的去卷积质谱。
图4示出通过dtt(箭头#1)和l-半胱氨酸(箭头#2)处理的去糖基化mab-1样品的hilic-uv分析。箭头#3指向未经处理的mab-1的迹线。分别将未经处理的样品和经l-半胱氨酸处理的样品的信号放大10倍和2倍,以更好地可视化lmw杂质。
图5a示出在用dtt处理后,在mab-1的hilic-ms分析中鉴定的轻链种类。图5b示出在用dtt处理后,在mab-1的hilic-ms分析中鉴定的重链种类。图5c示出在用dtt处理后,在mab-1的hilic-ms分析中鉴定的半抗体种类。图5d示出在用dtt处理后,在mab-1的hilic-ms分析中鉴定的重链二聚体种类。图5e示出在用dtt处理后,在mab-1的hilic-ms分析中鉴定的h2l种类。图5f示出在用dtt处理后,在mab-1的hilic-ms分析中鉴定的完整抗体种类。
图6a示出在非还原条件下来自lys-c消化的轻链c-末端肽的ms2光谱,其中所述c-末端cys通过碘乙酰胺修饰。图6b示出在非还原条件下来自lys-c消化的轻链c-末端肽的ms2光谱,其中所述c-末端cys通过+89.98da的未知修饰进行修饰。
图7a示出具有+89.98da非还原lys-c消化物的未知修饰的轻链c-末端肽的提取的离子色谱图(xic)。图7b示出具有来自非还原lys-c消化物的还原的+89.98da的未知修饰的轻链c-末端肽的提取的离子色谱图(xic)。
图8是未知修饰的提出的结构(2-巯基乙酸)。
图9是示例性hilic-ms系统。
具体实施方式
i.定义
除非另外在文中指出或明显与上下文矛盾,否则描述当前要求保护的本发明的上下文中(特别是权利要求的上下文中)的术语“一个/种(a/an)”和“所述”以及类似指示物视为涵盖单数和复数。
除非本文另外指示,否则本文中对值范围的列举仅仅意图用作单独地表示落入所述范围的各单独值的速记方法,并且犹如本文单独描述地那样将各单独值并入本说明书中。
术语“约”的使用意图描述高于或低于所陈述值大约+/-10%范围内的值;在其他实施方案中,所述值的值可在高于或低于所陈述值大约+/-5%范围的范围内;在其他实施方案中,所述值的值可在高于或低于所陈述值大约+/-2%范围的范围内;在其他实施方案中,所述值的值可在高于或低于所陈述值大约+/-1%范围的范围内。上述范围意图根据上下文确定,并且未隐含进一步限制。本文描述的所有方法可以任何适合的顺序进行,除非在本文中另外指示或明显地与上下文矛盾。除非另外声明,否则使用的任何和所有实例,或本文中提供的示例性语言(例如“如”)仅是为了更好地阐明本发明并且不对本发明的范围构成限制。本说明书中的语言不应解释为将任何非要求保护的要素指示为实践本发明所必需。
术语“低分子量(lmw)蛋白质药物杂质”包括但不限于前体、降解产物、截短的种类、蛋白水解片段(包括fab片段、fc或重链片段、配体或受体片段)、h2l(2条重链和1条轻链)、h2(2条重链)、hl(1条重链和1条轻链)、hc(1条重链)和lc(1条轻链)种类。lmw蛋白质药物杂质可以是蛋白质产物的不完整型式的任何变体,如多聚体蛋白质的一种或多种组分。蛋白药物杂质、药物杂质或产品杂质是在整个说明书中可互换使用的术语,并且包括lmw蛋白质药物杂质。lmw药物或产品杂质通常被认为是性质(如活性、功效和安全性)可能与所需药物产品的性质不同的分子变体。
在细胞培养系统中产生蛋白质药物产品的过程中,蛋白质产品的降解是有问题的。例如,由于在细胞培养基中释放蛋白酶,可能发生蛋白质产物的蛋白水解。在细胞培养中已采用中等添加剂(如添加以抑制金属蛋白酶的可溶性铁源或丝氨酸和半胱氨酸蛋白酶抑制剂)来防止降解(clincke,m.-f.,等人,bmcproc.2011,5,p115)。由于细胞培养物中的羧基肽酶,c-末端片段可能在产生过程中裂解(dick,lw等人,biotechnolbioeng2008;100:1132-43)。随后,需要对lmw杂质进行谱分析并监测。
“蛋白质”是指包含两个或更多个通过肽键彼此连接的氨基酸残基的分子。蛋白质包括多肽和肽,并且还可包括修饰,如糖基化、脂质附着、硫酸化、谷氨酸残基的γ-羧化、烷基化、羟基化和adp-核糖基化。蛋白质可具有科学或商业意义,包括基于蛋白质的药物,并且蛋白质尤其包括酶、配体、受体、抗体以及嵌合或融合蛋白。使用众所周知的细胞培养方法通过各种类型的重组细胞产生蛋白质,并且通常通过遗传工程改造技术(例如,如编码嵌合蛋白的序列或密码子优化的序列、无内含子的序列等)将蛋白质引入到细胞中,在细胞中所述蛋白质可作为附加体存在或整合到细胞的基因组中。
“抗体”是指由通过二硫键相互连接的四条多肽链(两条重(h)链和两条轻(l)链)组成的免疫球蛋白分子。每条重链具有重链可变区(hcvr或vh)和重链恒定区。重链恒定区含有三个结构域,ch1、ch2和ch3。每条轻链具有轻链可变区和轻链恒定区。轻链恒定区由一个结构域(cl)构成。vh区和vl区可进一步细分为高变区,称为互补决定区(cdr),其间散布着较保守的区域,称为框架区(fr)。每个vh和vl由按以下顺序从氨基末端至羧基末端排列的三个cdr和四个fr组成:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。术语“抗体”包括提及任何同种型或亚类的糖基化和非糖基化的免疫球蛋白。术语“抗体”包括通过重组方式制备、表达、产生或分离的抗体分子,如从转染以表达所述抗体的宿主细胞中分离的抗体。术语抗体还包括双特异性抗体,双特异性抗体包括可结合至多于一种不同表位的异四聚体免疫球蛋白。双特异性抗体通常在美国专利申请公布号2010/0331527中描述,所述专利以引用的方式并入本申请中。
“fc融合蛋白”包含否则在自然界中不会一起发现的两种或更多种蛋白质的部分或全部,所述两种或更多种蛋白质中的一种是免疫球蛋白分子的fc部分。例如,包含融合至抗体来源的多肽的各种部分(包括fc结构域)的某些异源多肽的融合蛋白的制备已由ashkenazi等人,proc.natl.acad.sclusa88:10535,1991;byrn等人,nature344:677,1990;以及hollenbaugh等人,"constructionofimmunoglobulinfusionproteins",incurrentprotocolsinimmunology,增刊4,第10.19.1-10.19.11页,1992描述。“受体fc融合蛋白”包含与fc部分偶联的受体的一个或多个细胞外结构域,在一些实施方案中所述fc部分包含铰链区,随后是免疫球蛋白的ch2和ch3结构域。在一些实施方案中,fc融合蛋白包含结合至一种或多种配体的两个或更多个不同的受体链。例如,fc融合蛋白是trap,如例如il-1trap或vegftrap。
“细胞培养物”是指细胞在诸如烧瓶或生物反应器的容器中的繁殖或增殖,并且包括但不限于补料分批培养、连续培养、灌注培养等。
术语“hilic或hilic色谱法”是指亲水相互作用液相色谱法或亲水相互作用色谱法,并且被认为是本领域熟知的术语。
目标蛋白
适合在原核或真核细胞中表达的任何目标蛋白质均可用于所提供的工程改造的宿主细胞系统中。例如,目标蛋白质包括但不限于抗体或其抗原结合片段、嵌合抗体或其抗原结合片段、scfv或其片段、fc融合蛋白或其片段、生长因子或其片段、细胞因子或其片段、或细胞表面受体的细胞外结构域或其片段。目标蛋白质可以是由单个亚基组成的简单多肽,或包含两个或更多个亚基的复杂多亚基蛋白质。目标蛋白质可以是生物制药产品、食品添加剂或防腐剂,或受制于纯化和质量标准的任何蛋白质产品。
在一些实施方案中,蛋白质产品(目标蛋白质)是抗体、人抗体、人源化抗体、嵌合抗体、单克隆抗体、多特异性抗体、双特异性抗体、抗原结合抗体片段、单链抗体、双功能抗体、三功能抗体或四功能抗体、fab片段或f(ab')2片段、igd抗体、ige抗体、igm抗体、igg抗体、igg1抗体、igg2抗体、igg3抗体或igg4抗体。在一个实施方案中,所述抗体是igg1抗体。在一个实施方案中,所述抗体是igg2抗体。在一个实施方案中,所述抗体是igg4抗体。在一个实施方案中,所述抗体是嵌合igg2/igg4抗体。在一个实施方案中,所述抗体是嵌合igg2/igg1抗体。在一个实施方案中,所述抗体是嵌合igg2/igg1/igg4抗体。
在一些实施方案中,所述抗体选自由以下组成的组:抗程序性细胞死亡1抗体(例如,如美国专利申请公布号us2015/0203579a1中所述的抗pd1抗体)、抗程序性细胞死亡配体1(例如,如美国专利申请公布号us2015/0203580a1中所述的抗pd-l1抗体)、抗dll4抗体、抗血管生成素-2抗体(例如,如美国专利号9,402,898中所述的抗ang2抗体)、抗血管生成素样3抗体(例如,如美国专利号9,018,356中所述的抗angptl3抗体)、抗血小板源性生长因子受体抗体(例如,如美国专利号9,265,827中所述的抗pdgfr抗体)、抗erb3抗体、抗催乳素受体抗体(例如,如美国专利号9,302,015中所述的抗prlr抗体)、抗补体5抗体(例如,如美国专利申请公布号us2015/0313194a1中所述的抗c5抗体)、抗tnf抗体、抗表皮生长因子受体抗体(例如,如美国专利号9,132,192中所述的抗egfr抗体或如美国专利申请公布号us2015/0259423a1中所述的抗egfrviii抗体)、抗-前蛋白转化酶枯草杆菌蛋白酶kexin-9抗体(例如,如美国专利号8,062,640或美国专利申请公布号us2014/0044730a1中所述的抗pcsk9抗体)、抗生长和分化因子-8抗体(例如抗gdf8抗体,也称为抗肌肉生长抑制素抗体,如美国专利号8,871,209或9,260,515中所述)、抗胰高血糖素受体(例如,如美国专利申请公布号us2015/0337045a1或us2016/0075778a1中所述的抗gcgr抗体)、抗vegf抗体、抗il1r抗体、白细胞介素4受体抗体(例如,如美国专利申请公布号us2014/0271681a1或美国专利号8,735,095或8,945,559中所述的抗il4r抗体)、抗白细胞介素6受体抗体(例如,如美国专利号7,582,298、8,043,617或9,173,880中所述的抗il6r抗体)、抗il1抗体、抗il2抗体、抗il3抗体、抗il4抗体、抗il5抗体、抗il6抗体、抗il7抗体、抗白细胞介素33(例如,如美国专利申请公布号us2014/0271658a1或us2014/0271642a1中所述的抗il33抗体)、抗呼吸道合胞病毒抗体(例如,如美国专利申请公布号us2014/0271653a1中所述的抗rsv抗体)、抗分化簇3(例如,如在美国专利申请公布号us2014/0088295a1和us20150266966a1以及美国申请号62/222,605中所述的抗cd3抗体)、抗分化簇20(例如,如美国专利申请公布号us2014/0088295a1和us20150266966a1以及美国专利号7,879,984中所述的抗cd20抗体)、抗cd19抗体、抗cd28抗体、抗分化簇-48(例如,如美国专利号9,228,014中所述的抗-cd48抗体)、抗feld1抗体(例如,如美国专利号9,079,948中所述)、抗中东呼吸系统综合征病毒(例如,如美国专利申请公布号us2015/0337029a1中所述的抗mers抗体)、抗埃博拉病毒抗体(例如,如美国专利申请公布号us2016/0215040中所述)、抗寨卡病毒抗体、抗淋巴细胞活化基因3抗体(例如抗lag3抗体或抗cd223抗体)、抗神经生长因子抗体(例如,如美国专利申请公布号us2016/0017029以及美国专利号8,309,088和9,353,176中所述的抗ngf抗体)以及抗活化素a抗体。在一些实施方案中,所述双特异性抗体选自由以下组成的组:抗cd3x抗cd20双特异性抗体(如美国专利申请公布号us2014/0088295a1和us20150266966a1中所述)、抗cd3x抗粘蛋白16双特异性抗体(例如,抗cd3x抗muc16双特异性抗体)以及抗cd3x抗前列腺特异性膜抗原双特异性抗体(例如,抗cd3x抗psma双特异性抗体)。在一些实施方案中,目标蛋白质选自由以下组成的组:阿昔单抗、阿达木单抗(adalimumab)、阿达木单抗(adalimumab-atto)、阿多-曲妥珠单抗、阿仑单抗、阿利库单抗、阿特珠单抗、阿维鲁单抗、巴利昔单抗、贝利木单抗、贝那利珠单抗、贝伐单抗、贝洛托单抗、博纳吐单抗、本妥西单抗维多汀、布罗达单抗、卡那单抗、卡罗单抗喷地肽、培化赛妥珠单抗、cemiplimab、西妥昔单抗、地诺单抗、达妥昔单抗、杜匹鲁单抗、德瓦鲁单抗、依库珠单抗、埃罗妥珠单抗、艾美赛珠单抗-kxwh、恩他新阿利库单抗、依凡纳单抗、依洛尤单抗、法希姆单抗、戈利木单抗、古塞库单抗、替伊莫单抗、依达赛珠单抗、英夫利昔单抗、英夫利昔单抗-abda、英夫利昔单抗-dyyb、伊匹单抗、希凯珠单抗、美泊利单抗、奈昔木单抗、奈西维单抗、纳武单抗、奥托昔单抗、奥比妥珠单抗、奥美珠单抗、奥法木单抗、奥拉单抗、奥马珠单抗、帕尼单抗、派姆单抗、帕妥珠单抗、雷莫芦单抗、兰尼单抗、瑞西巴库单抗、瑞利珠单抗、利诺库单抗、利妥昔单抗、萨瑞鲁单抗、瑟库吉努单抗、司妥昔单抗、托珠单抗、托珠单抗、曲妥珠单抗、曲戈卢单抗、优特克单抗以及维多珠单抗。
在一些实施方案中,目标蛋白质是含有fc部分和另一种结构域的重组蛋白(例如,fc融合蛋白)。在一些实施方案中,fc融合蛋白是受体fc融合蛋白,所述受体fc融合蛋白含有偶联至fc部分的受体的一个或多个细胞外结构域。在一些实施方案中,所述fc部分包含铰链区,随后是igg的ch2和ch3结构域。在一些实施方案中,所述受体fc融合蛋白含有结合至单个配体或多个配体的两个或更多个不同的受体链。例如,fc融合蛋白是trap蛋白,如例如il-1trap(例如,利纳西普,其含有与融合至higg1的fc的il-1r1细胞外区域融合的il-1racp配体结合区;参见美国专利号6,927,004,所述专利以引用的方式整体并入本文)或vegftrap(例如,阿柏西普(aflibercept或ziv-aflibercept),其包含与融合至higg1的fc的vegf受体flk1的ig结构域3融合的vegf受体flt1的ig结构域2;参见美国专利号7,087,411和7,279,159)。在其他实施方案中,fc融合蛋白是scfv-fc融合蛋白,其含有与fc部分偶联的抗体的一个或多个抗原结合结构域,如可变重链片段和可变轻链片段。
细胞培养
在蛋白质产生中,“补料分批细胞培养”是指这样一种分批培养:其中最初将细胞和培养基供应至培养容器,并且在培养期间以不连续增量方式将另外的培养营养素缓慢进料至培养物,在培养终止之前有或没有定期的细胞和/或产物收获。补料分批培养包括“半连续补料分批培养”,其中定期除去整个培养物(其可能包含细胞和培养基)并用新鲜培养基代替。补料分批培养不同于简单的“分批培养”,而是在分批培养的培养过程开始时,将用于细胞培养的所有组分(包括动物细胞和所有培养营养素)供应至培养容器。在标准补料分批过程中不从培养容器中除去上清液的程度上补料分批培养可与“灌注培养”不同,而在灌注培养中,通过例如过滤将细胞限制在培养物中,并且连续地或间歇地将培养基引入培养容器并从培养容器中移除。然而,考虑了在补料分批细胞培养过程中出于测试目的移除样品。分批补料过程继续进行,直到确定达到最大工作体积和/或蛋白质产生,并且随后收获蛋白质。
短语“连续细胞培养”涉及通常在特定生长阶段用于连续生长细胞的技术。例如,如果需要恒定细胞供应,或者需要产生特定目标蛋白质,则细胞培养可能需要维持在特定生长阶段。因此,必须连续地监测并调节条件,以将细胞维持在所述特定阶段。
术语“细胞培养基”和“培养基”是指用于生长哺乳动物细胞的营养液,所述营养液通常提供必要的营养物以增强细胞的生长,如碳水化合物能量源、必需氨基酸(例如苯丙氨酸、缬氨酸、苏氨酸、色氨酸、甲硫氨酸、亮氨酸、异亮氨酸、赖氨酸和组氨酸)和非必需氨基酸(例如丙氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、甘氨酸、脯氨酸、丝氨酸和酪氨酸)氨基酸、微量元素、能量源、脂质、维生素等。细胞培养基可含有提取物,例如血清或蛋白胨(水解物),所述提取物供应支持细胞生长的原料。培养基可含有酵母来源的提取物或大豆提取物,而不是动物来源的提取物。化学成分确定的培养基是指其中所有化学组分均已知(即具有已知化学结构)的细胞培养基。化学成分确定的培养基完全不含动物来源的组分,如血清或动物来源的蛋白胨。在一个实施方案中,培养基是化学成分确定的培养基。
所述溶液还可含有增强在最小速率以上的生长和/或存活的组分,包括激素和生长因子。可将溶液配制成对于所培养的特定细胞的存活和增殖而言最佳的ph和盐浓度。
“细胞系”是指通过细胞的连续传代或传代培养而源自特定谱系的一种或多种细胞。术语“细胞”可与“细胞群体”互换使用。
术语“细胞”包括适于表达重组核酸序列的任一种细胞。细胞包括原核生物和真核生物的细胞,如细菌细胞、哺乳动物细胞、人细胞、非人动物细胞、禽细胞、昆虫细胞、酵母细胞或细胞融合物,例如像杂交瘤或四源杂交瘤。在某些实施方案中,所述细胞是人、猴、猿、仓鼠、大鼠或小鼠细胞。在其他实施方案中,所述细胞选自以下细胞:中国仓鼠卵巢(cho)细胞(例如chok1、dxb-11cho、veggie-cho)、cos细胞(例如cos-7)、视网膜细胞、vero细胞、cv1细胞、肾细胞(例如hek293、293ebna、msr293、mdck、hak、bhk21)、hela细胞、hepg2细胞、wi38细胞、mrc5细胞、colo25细胞、hb8065细胞、hl-60细胞、淋巴细胞例如jurkat(t淋巴细胞)或daudi(b淋巴细胞)、a431(表皮)细胞、u937细胞、3t3细胞、l细胞、c127细胞、sp2/0细胞、ns-0细胞、mmt细胞、干细胞、肿瘤细胞以及源自上述细胞中的任一种的细胞系。在一些实施方案中,所述细胞包含一种或多种病毒基因,例如表达病毒基因的视网膜细胞(例如
ii.用于表征低分子量蛋白质药物杂质的系统
多亚基治疗性蛋白质、特别是基于单克隆抗体(mab)的治疗剂由于其复杂的多链结构以及适应多种酶促和化学翻译后修饰的倾向而关于大小是固有异质的。尽管可通过多种生物物理方法容易地量化mab药物产品内大小变体的水平,但是明确鉴定那些产品相关的杂质一直是特别具有挑战性的。
亲水相互作用色谱法(hilic)与质谱法分析结合用于鉴定纯化的药物物质批次内存在的低水平的较低分子量(lmw)杂质。在除去n-连接的聚糖后,hilic方法以基于大小的洗脱顺序分离mab相关的lmw杂质。来自高分辨率精确质谱仪的后续质量测量在单一lc-ms分析中直接且明确地鉴定各种低丰度lmw杂质。游离轻链、半抗体、h2l种类(具有单一轻链的抗体)和肽主链截短的种类都能够可靠地鉴定并详尽地阐明,包括截短位点和相关的翻译后修饰。传统纯度测定(例如sds-page和ce-sds)可能无法获得的此类详细信息对于阐明lmw杂质的形成方式非常重要,从而使得这种新方法成为分析表征组合的有价值的添加。这是首次已知的报告,其中通过完整质量分析直接在mab药物物质样品中检测h2l种类,而无需先前富集。
a.用于表征lmw杂质的系统
所述系统包括亲水相互作用液相色谱系统,所述亲水相互作用液相色谱系统包括连接至流动相a和流动相b的亲水相互作用液相色谱(hilic)柱,并且所述hilic柱与质谱系统处于流体连通。hilic柱适合与去糖基化蛋白质一起使用。在一个实施方案中,所公开的系统包括带有watersacquitytmuplc系统的watersacquitytmuplc糖蛋白酰胺柱(
uplc直接耦合至质谱仪,例如thermoscientificqexactive混合四极杆orbitrap质谱仪。毛细管电压通常设定在4.0kv,鞘流气体流速为40任意单位,并且辅助气体流速为15任意单位。毛细管温度通常设定在350℃,并且探针加热器温度通常设定在400℃。在m/z800-4000的质量范围内获取质谱。在一个实施方案中,使用由proteinmetrics开发的intactmasstm软件对原始数据进行去卷积。
b.表征lmw杂质的方法
所公开的系统和方法可用于表征lmw蛋白质药物杂质。一个实施方案提供了一种用于表征低分子量蛋白质药物产品杂质的方法,所述方法包括以下步骤:使蛋白质药物产品样品去糖基化,通过亲水相互作用色谱法分离所述蛋白质药物产品样品的蛋白质组分,以及通过质谱法分析所述分离的蛋白质组分以表征所述蛋白质药物产品样品中的低分子量蛋白质药物产品杂质。在一个实施方案中,所述蛋白质药物产品样品从补料分批细胞培养物、连续细胞培养物或灌注细胞培养物取得或纯化。示例性蛋白质药物产品包括但不限于抗体、融合蛋白、重组蛋白或它们的组合。示例性低分子量蛋白质药物产品杂质包括但不限于前体、降解产物、截短的种类、包括fab的蛋白水解片段、配体或受体片段或重链片段、游离轻链、半抗体、h2l、h2、hl、hc或它们的组合。
另一个实施方案包括使样品还原的步骤。示例性还原剂包括但不限于二硫苏糖醇(dtt,cas3483-12-3)、β-巯基乙醇(bme、2bme、2-me、b-mer,cas60-24-2)、2-氨基乙硫醇(2-mea-hcl,也称为半胱胺hcl,cas156-57-0)、三(2-羧乙基)膦盐酸盐(tcep,cas5961-85-3)、半胱氨酸盐酸盐(cys-hcl,cas52-89-1)或2-巯基乙磺酸钠盐(mesna)。用于还原蛋白质键的其他方法是本领域已知的,如固定化的还原剂柱,所述柱含有已固定有基于硫醇的还原剂以实现肽和蛋白质二硫键的固相还原的树脂。还设想了适合于减少多肽之间的化学相互作用的还原剂,包括氧化剂。
上文论述了示例性洗脱图谱。
c.产生高纯度蛋白质药物产品的方法
一个实施方案提供了一种产生抗体的方法,所述方法包括以下步骤:例如在补料分批培养物中培养产生所述抗体的细胞,从所述细胞培养物获得样品,使用本文公开的系统和方法表征并定量所述样品中的低分子量杂质,以及修改所述细胞培养物的一种或多种培养条件以减少在所述抗体的细胞培养过程中产生的表征的低分子蛋白质药物杂质的量。通常,改变所述条件以使蛋白质药物杂质在0.05%与30.0%、优选0.05%至15%、0.05%至10%、0.05%至5%或0.05%至2%(w/w)的范围内。
经改变以减少低分子量蛋白质药物杂质的量的所述细胞培养物的一种或多种条件选自由以下组成的组:温度、ph、细胞密度、氨基酸浓度、重量克分子渗透压浓度、生长因子浓度、搅拌、气体分压、表面活性剂或它们的组合。
在一个实施方案中,所述产生抗体的细胞是中国仓鼠卵巢细胞。在其他实施方案中,所述细胞是杂交瘤细胞。
另一个实施方案提供了一种根据本文提供的方法产生的抗体,所述抗体具有1%至5%、5%至10%、10%至15%、15%至20%的蛋白质药物杂质。
实施例
实施例1:mab-1药物物质样品的hilic分离
材料
对于这项研究,使用了由regeneron生产的重组igg1mab(mab-1)。肽-n-糖苷酶f(pngasef,#p0704l)购自newenglandbiolabs,1mtris-盐酸盐ph7.5溶液(#15567-027)购自invitrogen,二硫苏糖醇(dtt,#20291)购自thermofisherscientific,并且l-半胱氨酸(#168149-25g)购自sigma-aldrich。乙腈(lc-ms级,#a955-4)和三氟乙酸(tfa,#pi28904)购自fisherscientific。内部提供milli-q水。
方法
mab-1的去糖基化以及通过dtt和l-半胱氨酸进行的有限还原
使用100mmtri-hcl(ph7.5)将mab-1样品稀释至5μg/μl的最终浓度。以1单位/10μg蛋白质的酶与底物比例添加pngasef。去糖基化反应在37℃下进行3小时。为了起始通过dtt进行的有限还原,用5mmdtt还原去糖基化的mab-1样品的20μg等分试样,之后立即注入hilic柱进行在线uv和质谱分析。为了起始通过l-半胱氨酸进行的有限还原,用5mml-半胱氨酸还原去糖基化的mab-1样品的20μg等分试样,且然后在37℃下持续30分钟,然后注入hilic柱进行在线uv和质谱分析。
hilic-uv和hilic-ms分析
将watersacquityuplc糖蛋白酰胺柱(
结果
重组igg1mab(mab-1)药物样品用作模型分子。在用pngasef处理以除去每个重链上的n-连接的聚糖后,将去糖基化的mab-1样品在hilic柱上分离,并通过光电二极管阵列(pda)检测(在280nm和215nm处)和质谱分析两者进行分析(图1a和1b)。如uv谱所示(图a1,底部迹线),mab-1药物物质样品中lmw杂质的总体水平非常低,从而表明成功的纯化过程。通过将从质谱分析产生的总离子色谱图(tic)与uv色谱图进行比较,在tic迹线中观察到另一个峰(保留时间在约18.2分钟),所述峰对应于通过pngasef从mab-1释放的主要聚糖形式(g0f)。由于寡糖在280nm或215nm处均不显示uv吸收,因此它们在uv检测中不可见。除了pngasef试剂峰外,所有其他次要峰均被鉴定为mab-1相关的lmw杂质,具体地游离轻链(具有多种修饰)、fab片段、半抗体、fab截短的种类和h2l种类(图1a和1b)。这些lmw杂质在hilic柱上的洗脱顺序与它们的相对大小相关,较小的片段比较大的片段更早洗脱。重要的是注意,在此分析之前,必须从mab分子中除去n-连接的聚糖。否则,由于聚糖和不同糖型的存在或不存在,hilic柱上基于大小的洗脱顺序将变得复杂。
实施例2:游离轻链
结果
在mab-1样品的hilic-ms分析中检测到多种轻链相关的杂质(图2a-2e)。每一种类的提取离子色谱图(xic)表明,它们在hilic分离过程中也表现出不同的保留时间(图2a)。令人感兴趣的是,半胱氨酰化的轻链(+约119da)被鉴定为mab-1样品中存在的所有轻链种类的主要形式,并且它是通过uv可见的唯一种类(图2d)。半胱氨酰化可由于重链与轻链间二硫键与游离半胱氨酸分子之间的硫醇-二硫键交换反应而发生,所述游离半胱氨酸分子可在细胞质中发现。此外,还鉴定了谷胱甘肽化的轻链(+约306da),其保留时间比半胱氨酰化的轻链稍晚(图2e)。与半胱氨酰化过程相似,游离谷胱甘肽(gsh)分子(其也可在细胞质中发现)应负责这种修饰。还观察到另一种令人感兴趣的相比预期质量,δ质量为+约90da的lc变体(图2c)。使用重组lys-c蛋白酶进行的随后肽作图分析将这种修饰定位于轻链c-末端cys残基。基于精确的δ质量(+89.98da)和同位素分布,推测这种修饰是重链与轻链间二硫键与2-巯基乙酸分子之间的硫醇-二硫键交换反应的结果。然而,目前正在研究在mab产生过程中如何引入或产生这种化合物。尽管在uv迹线中不可见,但是未修饰的游离轻链与对应于c-末端氨基酸残基的顺序修剪的一组轻链变体一起也可通过更灵敏的质谱分析检测到(图2c)。如去卷积质谱(图2c)中所示的所得氨基酸梯与轻链的c-末端序列(gly-glu-cys)匹配。从轻链除去c-末端氨基酸残基可能归因于细胞培养物中的一些羧基肽酶的存在(dicklw,jr.,qiud,mahond,adamom,chengkc.biotechnologyandbioengineering,100:1132-43(2008);huz,等人biotechnologyandbioengineering,113:2100-6(2016)。最后,还鉴定了质量降低约34da的另一种轻链变体(图2b),从而表明经由轻链c-末端cys残基上的β-消除进行的可能的半胱氨酸至脱氢丙氨酸转化。这种反应先前已经进行了充分研究,并且被鉴定为在储存期间在抗体铰链区随后截短的主要途径(cohensl,pricec,vlasakj.journaloftheamericanchemicalsociety,129:6976-7(2007))。值得注意的是,所有这些轻链相关的杂质在天然条件下都不太可能通过sec方法检测到,因为尽管重链与轻链间二硫键断裂,但是所述轻链相关的杂质仍然能够经由强烈非共价相互作用结合至重链。
实施例3:fab片段
结果
众所周知,igg1分子中重链的上部铰链区易于水解,从而导致形成两种互补的lmw种类,fab片段和fab截短的种类(cordobaaj,shyongbj,breend,harrisrj.journalofchromatographyb:analyticaltechnologiesinthebiomedicalandlifesciences,818:115-21(2005)。hilic-ms方法检测到mab-1样品中的两种种类。鉴定了具有不同质量的四个主要fab片段(图3a-3d),并且基于cdna来源的氨基酸序列,通过将测量的质量与预测的质量进行比较来定位截短位点。去卷积质谱中指示的氨基酸模式与重链铰链区序列(cys-asp-lys-thr-his-thr-cys)匹配。值得注意的是,由于缺乏蛋白质a结合位点,在纯化过程中任何fab片段都应该容易地除去。因此,最终药物产品中fab片段的存在表明那些杂质在样品储存过程中作为降解产物引入。对那些种类的成功检测强调,hilic-ms方法将在mab药物开发过程中的稳定性和强制降解研究中有用。
实施例4:半抗体
结果
由于铰链区的重链与重链间二硫键混杂到重链内二硫键中而形成半抗体。在天然条件下,由于两个重链c-末端区域之间的强烈非共价相互作用,mab分子的四链结构仍然不被这种混杂破坏。然而,当使用具有变性条件的方法(如sds-page或ce-sds)时,两个半抗体分子将彼此解离并显示为lmw杂质。在mab-1产物的hilic-ms分析过程中,可靠地鉴定半抗体分子(图3b)。所测量的质量(73,099.5da)与预测的质量(73,100.1da)之间的良好一致性表明,与广泛修饰的游离轻链不同,没有实质性修饰与半抗体的形成相关,与二硫键混杂途径一致。
实施例5:fab截短的种类
结果
作为重链铰链区截短后fab片段的互补片段,还通过hilic-ms方法鉴定了mab-1样品中的fab截短的种类(图3c)。在hilic柱上,那些种类刚好就在主峰之前被洗脱为部分分辨的肩峰。随后的质量测量证实了fab截短的种类的身份,并且截短位点位于与在fab片段中观察到的那些一致的铰链区。尽管与电泳方法相比分离的分辨率较差,但hilic-ms方法因精确的质量测量在高保真度和特异性方面占优势,从而使明确的鉴定称为可能。与fab片段不同,由于保留的与蛋白质a结合的fc区,因此在纯化过程中很难从主要种类中除去fab截短的种类。缺失fab臂的单克隆抗体分子预期表现出受损的效力,因为两个靶结合位点中的一个不存在。对于双特异性mab分子,失去一个fab臂对于药物活性是有害的,因为两个fab臂对于实现设计的治疗功能是必不可少的。因此,直接检测并鉴定药物物质样品中的那些种类的能力非常重要,因为不仅节省时间和资源,而且避免在富集过程中引入可能的伪影。
实施例6:h2l种类
结果
通过sds-page和ce-sds方法,经常观察到由两条重链和一条轻链组成的h2l种类作为最丰富的lmw杂质,但通常仅通过间接和不足的证据支持它们的鉴定。例如,基于sds-page对含h2l的次要条带的n-末端测序分析可揭示重链与轻链两者的前几个氨基酸残基,并且重链与轻链之间的信号强度比可暗示2比1的比例。含h2l的次要条带的凝胶中消化、然后基于lc-ms的肽作图分析能够可靠地确认重链和轻链两者的存在。然而,难以确立重链与轻链之间的精确比例。两种方法均提供h2l种类的部分鉴定,但都不能揭示完整的结构。相比之下,hilic-ms方法提供完整蛋白质水平下h2l种类的直接鉴定。在mab-1产品中,观察到同质h2l种类与fab截短的种类稍微在完整抗体之前共洗脱。h2l种类的检测到的质量(122,851.0da)比h2l分子的预测的分子量(122,884.5da)小大约34da。重链半胱氨酸残基的β-消除(可能最初形成重链与轻链间二硫键的β-消除)是在mab-1样品中形成h2l种类的根本原因。这种置信水平和详细的信息不能通过其他公认的纯度测定获得,从而使得这种方法在为那些lmw杂质提供必要的鉴定方面非常有价值。据信,此研究是通过完整质量分析直接检测mab药物物质样品中的h2l种类而无需先前富集的首例(图3d)。
实施例7:在强制条件下通过有限还原产生的lmw杂质
结果
与mab-1样品的hilic-ms分析相比,sds-page和ce-sds方法经常鉴定更多的lmw杂质,包括重链二聚体和游离重链。为了证明新的hilic方法在检测那些杂质方面的能力,在自然条件下用还原剂(二硫苏糖醇(dtt)和l-半胱氨酸)进一步处理去糖基化的mab-1样品,以促进各种lmw杂质的形成。据报告,在天然条件下,dtt只能还原mab分子中的链间二硫键,因为它们是分子中仅有的溶剂可及的二硫键(liuh,等人analyticalchemistry,82:5219-26(2010))。在将mab-1分子短暂暴露于dtt或l-半胱氨酸后,可产生具有不同重链和轻链组合的lmw杂质,包括游离轻链、游离重链、半抗体、重链二聚体和h2l种类。如图4所示,在hilic分离中检测到这些预测的lmw种类,洗脱顺序与它们的相对大小一致。除了在未处理的mab-1样品中观察到的那些外,还观察到另外两种lmw种类(具体地说游离重链种类和重链二聚体种类)分别在游离轻链与半抗体之间和在半抗体稍后(部分分辨的峰)洗脱。
除了洗脱顺序指导的分配外,hilic分离后的后续质谱分析基于精确质量进一步证实了每种杂质的身份(图5a-5f)。令人感兴趣的是,经dtt处理的mab-1样品中的轻链种类表现出与未处理的样品中观察到的轻链种类非常不同的保留时间(图4)。基于精确质量测量,保留时间的差异归因于未处理的样品中存在轻链上的半胱氨酰化,但在经dtt处理的样品中不存在。一致地,当用l-半胱氨酸处理mab-1时,在与未处理的样品中的轻链种类相同的保留时间处观察到一小部分轻链种类,从而表明经l-半胱氨酸处理的样品中存在半胱氨酰化的轻链。最后,经dtt处理的样品中的h2l种类的测量的质量(122,884.5da)与未修饰的h2l种类的预测质量(122,884.5da)一致,因为它主要由经由二硫键还原产生的h2l种类(预测的质量:122,884.5da)和经由β消除产生的低水平的预先存在的h2l种类(预测的质量:122,850.4da)组成。
尽管在前述说明中已经关于本发明的某些实施方案描述了本发明,并且为了说明的目的已经列出了许多细节,然而对本领域的技术人员显而易见的是,本发明易受到另外实施方案的影响并且本文所述的某些细节可被显著地改变而不背离本发明的基本原理。
在整个本公开中提及的所有出版物都以引用的方式整体并入本文。
本文中引用的所有参考文献以引用的方式整体并入。本发明可以其他特定形式呈现而不背离其精神或本质属性,并且因此应参考所附权利要求书而不是前述说明书来指示本发明的范围。
序列表
<110>瑞泽恩制药公司(regeneronpharmaceuticals,inc.)
王顺海(wang,shunhai)
<120>用于表征药物产品杂质的系统和方法
<130>064752.011
<150>62/610,029
<151>2017-12-22
<150>62/743,632
<151>2018-10-10
<160>1
<170>patentinversion3.5
<210>1
<211>7
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>合成
<400>1
serpheasnargglyglucys
15
- 还没有人留言评论。精彩留言会获得点赞!