对细胞变形性进行多通道并行检测的微流控器件及系统的制作方法
本发明涉及一种微流控器件及系统,具体涉及一种对细胞变形性进行多通道并行检测的微流控器件及系统。
背景技术:
近年来,基于微流控技术的循环肿瘤细胞分选富集方法得到了广泛关注并取得了突破性进展。然而,对于分选后循环肿瘤细胞的鉴定与表征通常仍采用传统的分析手段,如免疫细胞学、流式细胞术和核酸检测技术等。这些方法均以生物分子标记物为分析对象,不仅影响细胞活性,而且无法实现不表达特定分子标记物的循环肿瘤细胞的检测,如部分肿瘤细胞在转移过程中可能发生上皮间充质转化而丢失上皮细胞标志物。此外,这些方法还存在操作复杂、检测效率低以及不易集成等共同缺点。
研究表明,细胞机械特性与细胞的病理状态密切相关,如癌变细胞比健康细胞更加柔软。得益于蓬勃发展的微加工技术,一些能够分析单细胞机械特性的微流控器件已研制成功,例如利用介电泳诱导变形技术测量细胞的变形能力,借助压缩、拉伸和流体剪切应力作用分析细胞的机械响应,以及通过图形化微柱基底表征细胞的收缩力等。上述这些微流控平台能够有效分析单细胞的机械特性,但在实验过程中需要对细胞进行捕捉和固定,使得整个测量过程耗时较长,极大地限制了该类器件的检测通量。
技术实现要素:
发明目的:本发明的目的是提供一种对细胞变形性进行多通道并行检测的微流控器件,解决现有检测需要对细胞进行捕捉固定,耗时长,限制检测通量的问题。
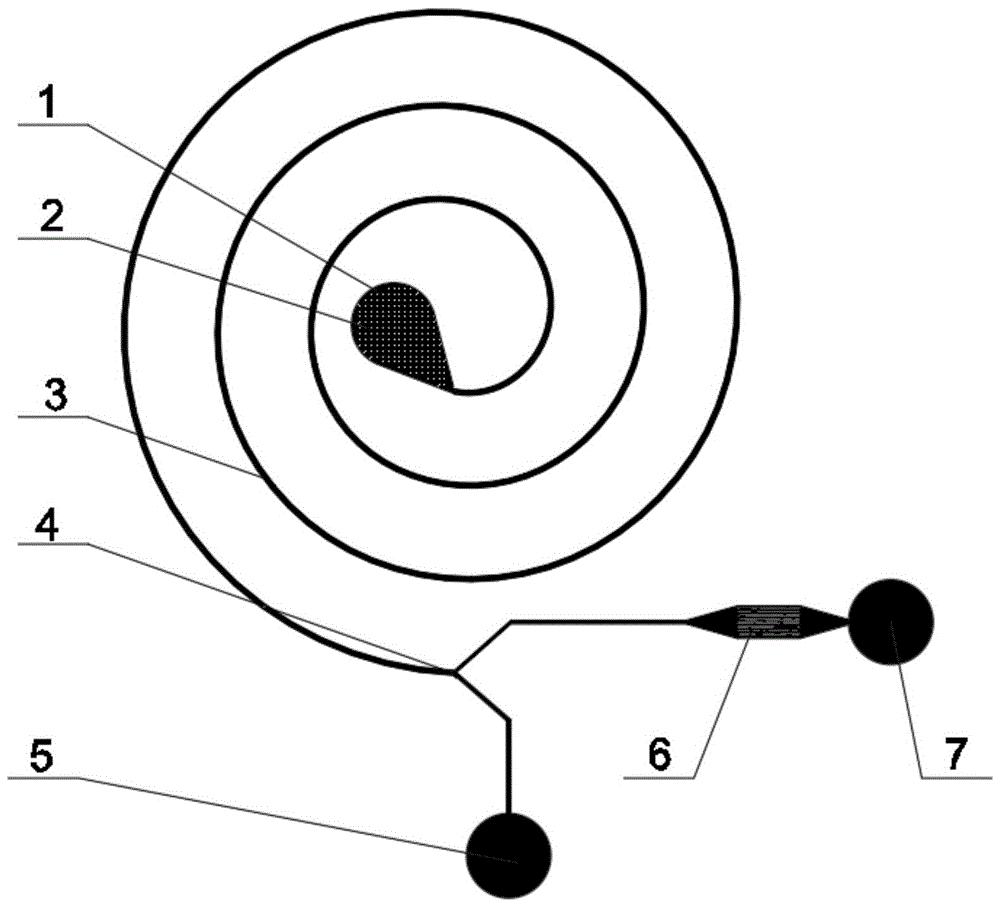
技术方案:本发明所述的对细胞变形性进行多通道并行检测的微流控器件,包括样品入口,所述样品入口下方连通螺旋流道一端,所述螺旋流道另一端连通y型出口通道,所述y型出口通道的第一支路连通第一出口,第二支路连通变形性检测流道,所述变形性检测流道内设置有多个平行的通道,所述变形性检测流道连通第二出口。
为使大于相应尺寸的杂质流经时将被捕获,减少流道堵塞的风险,所述样品入口设置有过滤筛,所述过滤筛由等距排列微柱列组成。
为使细胞粒子能够在螺旋流道内实现聚焦,所述螺旋流道的截面高度满足0.07<ap/h<0.3,其中ap为细胞直径,h为螺旋流道的截面高度。
为更好地利用微流体的作用力实现细胞的分选,所述螺旋流道的横截面呈高度与宽度的比值为1/2~1/4的矩形或者两侧高度不相同的梯形。
提高第二支路肿瘤细胞的纯度,所述y型出口通道的第一支路和第二支路的宽度比为1.5~3。
使细胞平缓地分散进入多个平行微通道,进而产生变形,所述变形性检测流道两侧为锥形结构,锥形结构的突扩区域先与流道壁互成10°~60°夹角,再经平直延伸扩张至所需宽度。
确保细胞能够在流体剪切力与压力作用下发生明显变形,所述变形性检测流道有多条平行等距的微柱列分割成多个通道,通道截面为正方形,其边长与所测细胞直径的关系为:细胞直径为边长的50%~90%。
本发明所述的一种包括对细胞变形性进行多通道并行检测的微流控器件的检测系统,还包括注射器、照明装置、图像拍摄装置和pc机,所述注射器与样品入口连接,所述照明装置设置在变形性检测通道上方,所述图像拍摄装置设置在变形性检测通道下方,所述图像拍摄装置和pc机信号连接,所述注射器将样品液注入样品入口,流体经过微流控器件处理,图像拍摄装置拍摄到变形的细胞后将图像传输到计算机中。
技术原理:样品液由进样入口注入螺旋流道,经过过滤筛筛选后进入螺旋流道以分离出绝大部分血细胞,而循环肿瘤细胞和少量尺寸相近的白细胞共同进入变形性检测流道,细胞在通过变形性检测流道内的狭窄通道时,受到流体剪切力与压力产生变形,图像拍摄装置在拍摄到变形后将图像传输到计算机中,同时,为了减少细胞在通过狭窄流道进行移位时的运动模糊,采用一个大功率led使用脉冲电流进行样品照明,相机快门触发脉冲,保证同步曝光;计算机接收到图像后由编制的程序进行处理得到细胞变形后的圆度值与横断面积,从而分析细胞的变形能力,进而鉴定细胞是循环肿瘤细胞还是白细胞。
有益效果:本发明采用集成惯性分选,有效实现全血中目标细胞的高通量分选;多通道并行检测,大大提高了检测通量,同时利用流体压力实现细胞形变,细胞变形更明显;通过细胞机械性能差异来鉴别,检测后细胞较利用生物分子标记物来鉴别具有更高的生物活性。
附图说明
图1是本发明整体结构的俯视图;
图2是本发明中微柱阵列的局部放大图;
图3是本发明中螺旋流道惯性分选原理示意图;
图4是本发明中细胞在狭窄通道内受力示意图;
图5是本发明中细胞在狭窄通道内形变过程示意图;
图6是本发明中计算机处理细胞图像流程图;
图7是本发明中实验平台示意图。
具体实施方式
下面结合附图对本发明进行进一步说明。
如图1所示,本发明公开了一种对细胞变形性进行多通道并行检测的微流控器件,包括样品入口1、过滤筛2、螺旋流道3、y型出口通道4、血细胞第一出口5、变形性检测流道6、循环肿瘤细胞与尺寸相近白细胞第二出口7。
集成器件上一端设有样品入口1,样品液通过注射泵推动注射器8将样品液由样品入口1注入器件,样品入口1处设置过滤筛2,样品液流经过滤筛2时,大颗粒杂质被截获,从而避免器件的流道堵塞。样品入口1下方连通于螺旋流道3,样品液进入螺旋流道3后在惯性力和迪恩拽力的共同作用下,样品液中的循环肿瘤细胞以及尺寸相近的白细胞靠近流道内壁面8,而大部分血细胞则靠近外壁面9,它们在到达y型出口通道4时,循环肿瘤细胞及尺寸相近的白细胞流入变形性检测流道6,而大部分血细胞则由第一出口5流出器件;细胞进入变形性检测流道6后通过多个平行的狭窄通道,在流体剪切力与压力的作用下产生变形,最后经第二出口7流出。各个流道的制备材质为聚二甲基硅氧烷(pdms),也可选用玻璃、环氧树脂、聚甲基丙烯酸甲酯(pmma)、聚碳酸酯(pc)等光学性能良好的材料制作,原型器件通过软光刻加工工艺制备,具体包括光刻su-8阳模、pdms浇注以及pdms-玻璃键合封装等步骤。此外,阳模的制备也可借助硅的湿法/深反应离子刻蚀、超精密机加工、金属电镀及感光电路板刻蚀加工实现。
在采用以上微流控器件进行检测时,在变形性检测通道6下方设置图像拍摄装置10,如高速摄像机,高速摄像机拍摄到变形的细胞后将图像传输到pc机11中;同时,为了减少细胞在通过收缩进行移位时的运动模糊,采用照明装置9如大功率led使用脉冲电流进行样品照明,相机快门触发脉冲,保证同步曝光;计算机在接收到图像后由图像处理程序进行处理得到细胞变形后的圆度值与横断面积,从而分析细胞的变形能力,进而鉴定细胞是循环肿瘤细胞还是白细胞。
如图2所示,在样品入口处设置过滤筛2,样品液流经过滤筛2时,大颗粒杂质被截获,从而避免器件的流道堵塞。
如图3所示,为一级螺旋流道3分选原理,螺旋流道3的内壁面8、外壁面9如图所示。以特定流速经样品入口1向螺旋流道3内注入粒子悬浮液后,因弯流道内中心线附近流体较壁面附近流体具有更高的流速,在离心力和径向压力梯度不平衡的作用下向外流动;同时基于封闭流道内的质量守恒,靠近外壁面9处的流体将沿着螺旋流道3的上下壁面回流,于是在垂直主流动方向上产生两个旋转方向相反的涡,称为迪恩流或二次流。此外,由于流道内流体流速从流体中心指向流道壁面呈抛物线分布,由此形成的速度梯度诱导产生一个指向流道壁面的剪切诱导升力,使得处于其中的粒子向流道壁面移动,与此同时又受到壁面和流体的共同作用,产生一个驱使粒子离开壁面的壁面诱导升力,这两种升力的合力称为惯性升力fl。在惯性升力fl及由迪恩流诱导产生的迪恩拽力fd的共同作用下,粒子将达到稳定的平衡位置a、b处,且不同尺寸的粒子具有不同的平衡位置。
如图4所示,粒子在狭窄通道内受到如图所示的流体剪切力与压力,柔性细胞在受力后将随之产生变形,形变程度的大小由细胞的变形能力即细胞的柔软程度决定。
如图5所示,细胞进入变形性检测流道6后通过多个平行的狭窄通道,在流体剪切力与压力的作用下产生变形,图中所示为细胞自左向右运动时细胞变形的各个阶段的形状,高速摄像机在拍摄到多个细胞变形后将图像传输到计算机中,由编制的程序进行处理得到多个细胞变形后的横断面积与圆度值,从而分析细胞的变形能力,进而鉴定细胞是循环肿瘤细胞还是白细胞。
如图6所示,计算机首先从摄像机获得单帧图像,图像被分配一个唯一的句柄,并传输到负责图像预处理的系统进行背景减法和阈值化,以创建二值图像。接下来,检测图像中是否存在细胞,如果存在,则使用边界跟踪算法得到细胞的轮廓。该算法从细胞的轮廓得到细胞的横截面积、周长和位置,并计算细胞的圆度c。如图7所示,实验平台主要设备包括注射器、微流控器件、高功率led、高速摄影机、倒置显微镜和计算机。
本发明集成惯性分选,有效实现全血中目标细胞的高通量分选。多通道并行检测,大大提高了检测通量;同时利用流体压力实现细胞形变,变形更明显,较介电泳诱导变形、原子力显微形变、微管吮吸等变性方式具有更大的检测通量及更明显的细胞变形。此外,循环肿瘤细胞与白细胞通过细胞机械性能差异来鉴别,检测后细胞较利用生物分子标记物来鉴别具有更高的生物活性。
- 还没有人留言评论。精彩留言会获得点赞!