线性对照组合物和使用方法与流程
线性对照组合物和使用方法
1.相关申请的交叉引用
2.本技术要求2019年12月20日提交的美国临时申请号62/951,581的权益,该临时申请通过援引以其全文并入本文。
技术领域
3.本发明涉及线性对照组合物和使用方法,能够确认基于图像的血液分析仪对白细胞计数(wbc)、血小板计数(plt)、红细胞计数(rbc)、有核红细胞计数(nrbc)、血红蛋白(hgb)和血细胞比容(hct)的计算参数以及网织红细胞(ret)枚举中任何一个或多个测量的可测量范围和线性。
背景技术:
4.血液分析仪等系统可用于分析血液样品的不同成分,如rbc、wbc、hgb、hct、plt、ret和nrbc。为了提供血液样品中不同血液成分浓度的准确读数,在系统上处理一个或多个线性对照标准,该系统通过比较恢复值与已知值来计算线性系数。线性标准用于验证系统在一定范围内的血液成分浓度。目前,没有商业上可用的血液学线性试剂盒或任何其他商业上可用的血液学产品适合支持验证基于图像的血液分析仪的线性要求,诸如m 511集成血液分析仪(roche diagnostics),例如,在例如美国专利号9,217,695;10,094,764;和10,764,538中公开的那些。因此,强烈需要产生解决该问题的线性对照组合物。
技术实现要素:
5.本公开至少部分基于以下发现:可以制备高浓度和低浓度的血液样品并将其用于产生新的线性材料/基质,这些线性材料/基质称为“线性对照载玻片”,其稳定至少六个月,并且可以在不同的基于图像的血液学系统上多次使用,以验证系统的可报告范围。本公开提供了产生高浓度和低浓度血液样品的方法和组合物,以在血液分析仪和细胞类型特定的浓度范围内制备等距稀释液,构成线性对照载玻片。
6.在一个方面,本公开的特征在于一组线性对照载玻片,用于验证基于图像的血液分析仪的分析测量区间(ami)或可报告范围。该组线性对照载玻片包括以下项中的至少一者,例如至少两者、三者、四者或全部五者:第一组载玻片,其用于组合的红细胞(rbc)血红蛋白(hgb)和血细胞比容(hct)成分;第二组载玻片,其用于白细胞(wbc)成分的载玻片;第三组用于血小板(plt)成分;第四组载玻片,其用于网织红细胞(ret)成分的载玻片;以及第五组用于有核红细胞(nrbc)成分的;其中每组载玻片包括三个或更多个载玻片,其中组中的每个载玻片包含在该组的血液成分的浓度范围内的一系列等距稀释液之一,并且其中例如,通过血液分析仪,例如基于图像的血液分析仪对每组载玻片进行固定和染色。
7.在一些实施例中,在固定和染色之后,该组在没有冷藏的情况下稳定至少六个月。在一些实施例中,染色包括曙红溶液。在一些实施例中,染色包括亚甲蓝溶液。
8.在一些实施例中,至少rbc、wbc和plt载玻片组,其中载玻片组包含以下高浓度和
低浓度的相应类型的细胞:
[0009][0010]
在另一方面,本公开的特征在于一种通过基于图像的血液分析仪在扩展的浓度范围内验证血液成分的枚举的线性的方法,该方法包括:获取用于一种或多种血液成分的本文公开的一组线性对照载玻片;使用用于每种血液成分的标准方案通过基于图像的血液分析仪分析该组线性对照载玻片;从基于图像的血液分析仪获取该血液成分的枚举值;使用该枚举值和基于图像的血液分析仪的该血液成分的已知靶范围来确定该血液成分枚举的线性。
[0011]
在一些实施例中,该方法进一步包括获取用于两种或更多种血液成分例如,rbc、wbc、plt、ret和nrbc中的两种或更多种的一组线性对照载玻片。
[0012]
在另一方面,本公开的特征在于生产一组线性对照载玻片的方法,用于在血液分析仪上验证关于一种或多种血液成分的线性。例如,该方法包括:从健康人类受试者获取全血样品或血液成分;从全血或血液制品样品制备用于第一血液成分的高浓度样品;从全血或血液制品样品制备用于第一血液成分的低浓度样品;为第一血液成分制备多种等距稀释液,其中该多种等距稀释液包括高浓度血液或血液制品样品、低浓度血液或血液制品样品、包含一份高浓度样品和一份低浓度样品的第一稀释液、包含一份第一稀释液和一份低浓度样品的第二稀释液、以及包含一份第一稀释液和一份高浓度样品的第三稀释液;以及通过在基于图像的血液分析仪中处理第一血液或血液制品成分的每种等距稀释液以将等距稀释液打印、固定和染色到载玻片上来为多种等距稀释液中的每一种制备载玻片。
[0013]
在一些实施例中,高浓度血液样品和低浓度血液样品源自相同的血液样品。在某些实施例中,高浓度血液样品和低浓度血液样品各自包含预定浓度的第一成分。
[0014]
在一些实施例中,第一血液成分选自由以下各项组成的组:红细胞(rbc)、白细胞(wbc)、血小板(plt)、网织红细胞(ret)和有核红细胞(nrbc)。
[0015]
在某些实施例中,该方法进一步包括对第二血液成分进行所叙述步骤的每一者以产生用于第二血液成分的第二组线性对照载玻片。
[0016]
在一些实施例中,第二血液成分选自由rbc、wbc、plt、ret和nrbc组成的组。在某些实施例中,第一血液成分是rbc。在一些实施例中,高浓度血液样品是≥8.0x106/μl的rbc,低浓度血液样品是≤0.4x106/μl的rbc。
[0017]
在一些实施例中,第一血液成分是wbc。在一些实施例中,高浓度血液样品是≥400x103/μl的wbc,低浓度血液样品是≤0.1x103/μl的wbc。在一些实施例中,wbc的低浓度血液样品进一步包含大于1.5x106/μl rbc。
[0018]
在某些实施例中,第一血液成分是plt。在一些实施例中,高浓度血液样品是≥5000x103/μl的plt,低浓度血液样品小于或等于≤10x103/μl的plt。在一些实施例中,plt的低浓度血液样品进一步包含大于1.5x106/μl rbc。
[0019]
在一些实施例中,多种等距稀释液各自在两个、三个、四个、五个或六个载玻片上进行处理。
[0020]
在一些实施例中,多种等距稀释液进一步包括第四稀释液,该第四稀释液包含一份低浓度血液样品和一份第二稀释液;第五稀释液,该第五稀释液包含一份第二稀释液和一份第一稀释液;第六稀释液,该第六稀释液包含一份第一稀释液和一份第三稀释液;以及第七稀释液,该第七稀释液包含一份高浓度血液样品和一份第三稀释液。
[0021]
如本文所用,所述术语具有以下含义。说明书中使用的所有其他术语和短语具有本领域技术人员将理解的它们的普通含义。
[0022]
本文提及的“线性”表示在给定浓度范围内提供与单个样品中特定细胞或血液成分例如rbc、wbc、plt和ret的浓度成正比的结果的能力。系统(例如,基于图像的血液学系统)的线性是通过测试样品中每种细胞成分的浓度范围来测量的,这些浓度范围是已知量,当血液学系统结果针对这些已知值作图时,结果符合直线的程度是系统的线性的量度。
[0023]
本文提及的“线性对照载玻片”是指这样的一系列载玻片:这些载玻片由含有不同已知量的细胞或血液成分的样品组成,这些样品在载玻片上被打印、固定和染色,随后可用于确定或验证基于图像的血液分析仪的线性范围。
[0024]
本文提及的“分析测量区间”(“ami”)或“可报告范围”是指一种方法可以无需任何稀释、浓缩或其他不属于正常样品处理的预处理而直接在给定样本上测量的分析物值的范围。
[0025]
本文提及的“等距稀释液”或“等距浓度”是指特定血液成分的高浓度样品和低浓度样品之间等间隔的中间浓度水平。
[0026]
本文提及的“零偏差”或“与线性的零百分比偏差”是指特定血液成分的预定(已知)浓度值与被测系统返回的线性测定结果之间没有差异。
[0027]
全血(实施)方案也可用于制备样品以验证基于图像的血液分析仪的线性。然而,这种全血方案耗时、昂贵,并且高度依赖样品,导致可报告范围有限(截断)。
[0028]
本文公开的线性对照载玻片可以为最终用户预先制造,从而消除了对客户现场技术专业知识的需求,并能够节省时间和成本以及比使用全血线性样品或方案产生更大的可报告范围。
[0029]
新的线性对照组合物和方法提供了各种好处和优点。例如,对于ami要求或水平,没有适合在基于成像的血液分析仪(如rochem 511系统)上证明线性要求或水平的市售线性试剂盒。全血实施方案不符合制造商sapc(系统分析性能特征)文件中公布的规范。使用全血实施方案wbc和plt无法达到表2中列出的ami范围,因为达到ami范围所需的样品不容易获得,难以从第三方供应商处获得资源,价格昂贵,并且需要大量的技术专长来操作以成功产生线性系列。然而,基于载玻片的解决方案能够有机会确保高度专业化的样品,这些样品随后可以由最少数量的训练有素的专家进行操作,他们将生产满足ami要求并适用于在额外的m 511系统上成像的载玻片(线性对照载玻片)。这种基于载玻片的线性解决方案将使得整个ami能够如制造商声称的那样在客户现场进行验证。
[0030]
在可靠性方面,新的组合物和方法在使用基于载玻片的解决方案的基础上有所改进,因为将识别出系统之间的光学差异的早期检测。生成ami载玻片消除了残留颗粒的“携带污染”,这是使用基于液体的血液分析仪时经常发生的情况。使用由维护和监控良好的
m 511系统生成的合格的ami载玻片,对ami载玻片重新成像的过程可以检测现场光学系统的故障。如果新测试的m 511系统在分析上不能与“黄金”m 511系统进行很好的比较,则故障将成为启动服务调查的理由。因此,可以使用基于载玻片的解决方案来早期检测出光学问题。
[0031]
新的组合物和方法还降低了成本,因为执行目前的线性验证方案(在实例1-3中描述)所产生的初始成本可以除以制造的载玻片在其他m 511测试系统上重新成像的次数。此外,可以从相同的验证实验或原材料中生成多组线性系列载玻片(例如,10组载玻片)。然后可以分发这些载玻片中的每一个并用于基于载玻片的线性验证,直到到期。例如,成本为5,000美元/10组/50次仪器验证=每组10美元。因此,通过使用基于载玻片的解决方案可以显著降低成本。
[0032]
在单个客户现场执行全血线性方案的时间可能需要大约五天。另一方面,使用本文所述的基于载玻片的解决方案的线性验证可以在一天内完成,从而节省大量时间。
[0033]
线性对照载玻片可用于包括但不限于线性验证、质量控制、能力测试和基于图像的血液分析仪的光学分析的应用。线性对照载玻片是有利的,因为它们可靠、坚固、稳定至少六个月,并且可以在一个或多个基于图像的血液学系统上重复使用。
[0034]
除非另外定义,否则本文中使用的所有技术和科学术语所具有的含义与本发明所属领域普通技术人员通常理解的含义相同。尽管在本发明的实践或测试中,可使用与本文所述的那些方法和材料类似或等同的方法和材料,但下文描述了合适的方法和材料。本文提及的所有出版物、专利申请、专利和其他参考文献通过引用以其全文合并于本文。如有歧义,以本专利说明书(包括定义)为准。此外,材料、方法和实例仅是说明性的,而不旨在限制。
[0035]
本发明的其他特征和优点将从以下详细描述以及权利要求中显而易见。
附图说明
[0036]
图1是制备初始高浓度血液样品和随后稀释高浓度样品以获得低浓度样品的一般方法的高级流程图。
[0037]
图2是制备在低浓度血液样品和高浓度血液样品之间的等距稀释液的详细方法的流程图。
[0038]
图3是一系列线性样品的示意图,这些样品已被打印、固定和染色到由基于图像的血液分析仪rochem 511系统处理的载玻片上。
[0039]
图4a是使用如本文所述的标准验证方案制备的高、低和中间浓度血液样品或产品由m 511系统测量的wbc分析测量区间(线性)的代表性图。
[0040]
图4b是由图4a的分析测量区间计算的可接受的线性限值和wbc线性偏差的代表性图。
[0041]
图5a是使用如本文所述的全血wbc方案制备的高浓度和低浓度血液样品由m 511系统测量的wbc分析测量区间(线性)的代表性图。
[0042]
图5b是由图5a的分析测量区间计算的可接受限值和wbc线性偏差的代表性图。请注意有限的可报告范围。
[0043]
图6a是rbc分析测量区间(线性)的代表性图,该rbc分析测量区间最初由标识为c4的第一m 511系统使用如本文所述制备并随后在同一m 511系统(c4)上使用新制备的rbc线性对照载玻片重新处理的高、低和中间浓度血液样品处理的。
[0044]
图6b是由图6a的分析测量区间计算的可接受限值和rbc线性偏差的代表性图。
[0045]
图6c是rbc分析测量区(线性)的代表性图,该rbc分析测量区是在第二个m 511系统p37上使用由如图6a所述的标识为c4的m 511系统创建的线性对照载玻片测量的。
[0046]
图6d是由图6c的分析测量区间计算的线性的rbc偏差的代表性图。
具体实施方式
[0047]
对于基于图像的血液分析仪上的一个或多个测量参数,通常需要通过线性测试验证可报告范围,例如美国专利号9,217,695;10,094,764;和10,764,538中公开的那些。为了完成验证,本文描述的方法可用于从专用的血液成分和/或全血制备线性对照组合物和载玻片。线性对照组合物包括诸如wbc、rbc、网织红细胞、plt和ret的血液成分的等距稀释液,它们被打印、固定和染色在稳定的表面上,例如玻璃或塑料载玻片,例如显微镜载玻片,然后通过基于数字图像的扫描来确定wbc、rbc(包括hgb和hct)、plt和ret的计数和浓度。
[0048]
当一系列测试样品的测量结果与每个测试样品中细胞或血液成分的已知浓度成正比时,就称定量分析方法是“线性的”。因此,对于导致ami或可报告范围的预定浓度范围,可以使用一条直线来表征测量的测试样品结果与测试样品的已知浓度之间的关系。
[0049]
在开发本文所述的新方法和组合物之前,每次要执行线性验证方案时都从供体收集专用的血液制品的验证方案。没有专门用于基于图像的血液分析仪的商用线性材料。验证方案的标准方法是制备九个浓度的样品的载玻片。从载玻片确定线性偏差,但这很大程度上取决于样品材料和用户体验。一旦验证方案被验证,载玻片就被丢弃。
[0050]
与由本文公开的专用血液产品和成分制备的线性对照组合物和载玻片相比,仅使用全血制备线性对照组合物和载玻片不提供跨越制造商的线性要求的结果或测量值。此外,全血程序的执行需要训练有素的抽血医生在安装基于图像的血液分析仪的地点抽取患者或供体血液。全血线性范围也受到特定于安装地点的可用样品(患者群体或供体)的限制。此外,执行全血方案还需要专用的现场实验室设备和经过培训且技术能力得到证实的技术人员。成功的线性测试结果高度依赖于技术专长(参见图5b,基于技术专长的线性故障,而不是仪器故障)。因此,与制造商声称的基于图像的血液分析仪的线性相比,由于患者样本数量有限、缺乏专用的实验室设备以及缺乏技术专长和创建线性系列的能力,可能实现的全血线性范围大大减少或截断。
[0051]
相比之下,制造商使用专用的血液制品制备的线性对照载玻片以产生本文所述的高、低和中间浓度样品,具有成本效益、高效,并满足制造商的线性要求。线性对照载玻片可提供可重复的结果,稳定性长达6个月,并可在一个或多个基于图像的血液学系统上重复使用。
[0052]
一般方法论
[0053]
本文所述的方法提供线性对照组合物,即线性对照载玻片,其可用于验证基于图
像的血液分析仪的可报告范围。将高浓度和低浓度样品制备成用于被测试的特定血液成分的特定浓度。然后从代表血液成分ami的高浓度和低浓度样品制备等距的中间稀释液。所有样品均在载玻片上打印、固定和染色以生成线性对照载玻片,通常具有多个重复,例如6、7、8或更多个重复。线性载玻片可以在不同的基于图像的血液分析仪上重复使用,从而产生可重复的线性范围结果以验证线性。
[0054]
线性对照载玻片的样品制备方法
[0055]
准备好血液样品和专用的血液制品,以确定和/或验证基于图像的血液系统对每种血液成分(例如wbc、rbc、plt和ret)以及计算参数(例如hgb和hct)的线性。
[0056]
高浓度血液样品和低浓度血液样品的制备一般如图1所示。血液样品或血液制品取自健康供体并离心。例如,获取白细胞分离样品用于wbc分析,获取全血样品用于rbc、hgb和hct分析,以及获取血小板单采样品用于plt分析。取出产生的上清液并在必要时保存以备以后稀释。“高浓度”线性样品的结果是通过在任何其他血液分析仪上分析等分试样来确定的。进行最终稀释以满足高浓度和低浓度样品的靶值。当基于图像的血液分析仪需要最少数量的红细胞进行成像时,可以将rbc添加到低浓度线性样品中。
[0057]
在一些实施例中,如果高浓度线性样品的结果小于靶值,则可以使用上述步骤进一步处理样品。表1示出了低浓度线性样品和高浓度线性样品的rbc、wbc和plt参数的靶值。
[0058]
表1:低浓度对照线性载玻片和高浓度对照线性载玻片的参数的靶值:wbc、plt和rbc(*成像所需)
[0059][0060]
高浓度和低浓度样品用于制备等距稀释液,其中高浓度样品和低浓度样品之间有三到七种中间稀释液,从而产生五到九种总等距浓度。图2是显示用于制备高浓度样品(管9)和低浓度样品(管1)之间的等距稀释系列的每个管的比率的流程图。
[0061]
首先,等量的高浓度血液样品和低浓度血液样品产生中等的中间浓度(管5)。其次,在低浓度和中等浓度或高浓度和中等浓度之间进一步稀释会产生中间浓度(管3和7)。第三,中间浓度可以进一步用中等浓度(管4和6)稀释,或用高浓度(产生管8)或用低浓度(产生管2)进一步稀释。所有稀释液都是等量的初始浓度。
[0062]
为了以自动化方式制备新的线性对照载玻片(如图3所示),在基于图像的血液分析仪上,例如rochem 511集成血液分析仪,使用标准步骤和方法处理等距浓度:
[0063]
1)在一张或多张独特的载玻片上打印每种等距的样品(重复);
[0064]
2)使用digimac3
tm
固定溶液固定每个独特的载玻片;
[0065]
3)使用digimac3
tm
溶液染色每个独特的载玻片;和
[0066]
4)使用digimac3
tm
冲洗液冲洗每个载玻片。
[0067]
更详细地说,每个样品以单层形式打印在载玻片上,例如玻璃或塑料载玻片(例如显微镜载玻片),然后将其固定并染色。染色后,对样品载玻片进行数字成像,并对血液成分
进行计数并与已知值进行比较。
[0068]
在一些实施例中,等距浓度以开管模式或闭管模式(即,机架模式)处理。开管模式是指使用开管探针从管中吸出血液来处理等距稀释液。闭管模式是指等距稀释液由基于图像的血液分析仪在闭管中自动处理。例如,每种等距稀释液都可以从管架中自动取回,并由系统使用设计或配置为刺穿每个闭管上的橡胶塞的样品探针进行抽吸。
[0069]
在一些实施例中,将等距浓度处理到多个不同载玻片上以制备重复,例如每种浓度两个、三个、四个、五个、六个或更多个重复。在一个实例中,将9个制备的等距浓度中的每一个在玻璃载玻片上打印、固定和染色6次(6个重复),生成针对特定血液成分(例如rbc)的总共54个线性对照载玻片。在基于图像的血液分析仪上分析线性对照载玻片,并与已知的上下靶值(ami范围)以及最大允许的线性偏差进行比较,如表2所示。根据临床实验室标准协会中描述的标准分析结果:h26-a2 validation,verification,and quality assurance of automated hematology analyzers;approved standard
–
第二版,2010年6月和ep06-a evaluation of the linearity of quantitative measurement procedures;a statistical approach approved guideline
–
2003年6月。
[0070]
表2:wbc、plt、rbc、hgb和hct的可接受下限和上限以及使用验证方案中描述的专用血液制品的最大允许线性偏差(制造商要求)
[0071][0072]
在一些实施例中,线性对照载玻片在室温下储存而无需冷藏。此外,线性载玻片可以在不冷藏的情况下在黑暗中储存长达六个月。
[0073]
使用线性对照载玻片的方法
[0074]
如本文所述,线性对照载玻片用于验证基于图像的血液分析仪的可报告范围。保存每个线性系列中保存的载玻片,并可在一台或多台额外的m 511集成血液分析仪
上重复使用(重新成像),这些分析仪已临时重新配置为绕过打印和染色,从而允许m 511系统对保存的载玻片上的细胞进行数字识别和计数。将例如在m 511系统上获取的每个线性对照载玻片上的血液成分的回收计数和浓度与每个相应线性对照载玻片上的已知值进行比较。系统的线性通过回收的计数和浓度与已知值的关系确定。
[0075]
在一些实施例中,可以在同一台基于图像的血液分析仪或不同的基于图像的血液分析仪上重复分析线性对照载玻片。
[0076]
当系统新安装、重新安装、接受维护、大修、故障排除或最终用户确定的任何时间间隔时,线性对照载玻片可用于验证基于图像的血液分析仪的可报告范围。
[0077]
m 511系统中使用的软件
[0078]
m 511系统包括三个主要软件组件:观察站软件、分析仪软件和图像分析应用程序。
[0079]
观察站软件:观察站软件为m 511分析仪提供用户界面,包括:管理系统配置和耗材;报告分析仪和样品处理状态;故障排除和错误恢复;质量控制处理和结果;审查样品结果;分类/重新分类细胞;以及评估细胞形态。
[0080]
分析仪软件:分析仪软件运行分析仪计算机并管理所有硬件元件、样品处理、数据管理和观察站通信。
[0081]
图像分析应用程序图像分析应用程序在分析仪计算机上运行,并与相机和运动控制硬件通信,以在低倍成像站和高倍成像站采集图像。该程序识别和测量图像中的细胞,并将细胞计数和测量结果报告给分析仪软件。它还保存图像以在观察站上显示。
[0082]
实例
[0083]
本发明的实例将进一步在以下实例中描述,这些实例不限制权利要求中描述的本发明的范围。
[0084]
下面公开的实例描述了制备高浓度和低浓度样品的方法,这些样品用于产生中间等距稀释液。每种血细胞类型都有不同的方案来满足血液分析仪的线性要求。等距稀释液用于制备线性对照载玻片。线性对照载玻片可以多次使用并提供可重复的准确读数。
[0085]
由专用的血液制品制备的线性方案
[0086]
实例1:白细胞分析测量区间
[0087]
实例1的目的是确定参数wbc的基于图像的血液分析仪的ami满足线性要求。
[0088]
为研究wbc ami,从单个志愿者供体获取新鲜的白细胞单采样品和三个相应的全血样品。在抗凝剂柠檬酸葡萄糖溶液a(acd-a)中收集大约120-130ml的白细胞单采样品。三个10ml全血样品中的每一个都收集在k2-edta样品收集管中。将样品浓缩和稀释(根据需要)以产生高浓度样品、低浓度样品和七个中间等距浓度样品,从而产生独特的线性系列(如图2所示)。总共产生了三个不同的线性系列以在三个m 511系统上运行。在闭管模式和开管模式下,对线性系列的每个浓度样品进行六次重复处理。
[0089]
高浓度wbc样品
[0090]
制备高浓度wbc样品以满足≥400x103/μl的wbc靶浓度。将白细胞单采袋混合约5分钟,并将内容物转移到锥形管中,每管约10ml。保留基线样品,并在另一台血液分析仪上进行处理以获取wbc浓度。
[0091]
如果wbc基线结果小于≥400x103/μl的靶值,则将剩余的白细胞单采样品以1,000rpms离心12分钟,形成wbc沉淀。去除上清液,在每管中留下大约2ml。将wbc沉淀和上清液重新悬浮并合并。如果存在血小板聚集体,则丢弃样品并用新的白细胞单采样品重复该方案。在另一台血液分析仪上处理浓缩样品在ste缓冲液(氯化钠-三-edta,1x溶液,ph 8.0)中的1:10稀释液,并获取wbc浓度。
[0092]
如果浓缩样品低于≥400x103/μl的靶值,则重新离心样品并去除额外的上清液。再次将样品重新悬浮在ste缓冲液中,并在另一台血液分析仪上分析1:10稀释液的wbc浓度。当达到靶值时,样品被标记为“高浓度”样品。
[0093]
低浓度wbc样品
[0094]
制备低浓度wbc样品以满足两个靶值,wbc≤0.1x103/μl和rbc》1.5x106/μl。添加rbc以满足罗氏基于图像的血液分析仪(m 511系统)启动样品处理和促进成像所需的最少细胞数量。将三个全血供体样品以4,000rpms离心12分钟。除去血沉棕黄层并将剩余的内容物转移到一个管中。样品在另一台血液分析仪上混合和处理以获取wbc和rbc结果。
[0095]
如果未达到样品的低浓度wbc靶值,则添加等体积的ste缓冲液,并将样品以4,000rpm离心12分钟。去除额外的血沉棕黄层,将样品重新悬浮并在另一台血液分析仪上进行分析。当达到wbc和rbc靶值时,将样品标记为“低浓度”样品。
[0096]
线性系列准备
[0097]
制备高浓度样品和低浓度样品之间的等距稀释系列以产生线性系列(见图2)。管1到9被标记,其中管1包含低浓度样品,管9包含高浓度样品。
[0098]
管5由管1的一部份和管9的一部份组合而成。管3由管1的一部份和管5的一部份组合而成。管7由管5的一部份和管9的一部份组合而成。管2由管1的一部份和管3的一部份组合而成。管8由管7的一部份和管9的一部份组合而成。管4由管3的一部份和管5的一部份组合而成。管6由管5的一部份和管7的一部份组合而成。
[0099]
样品处理
[0100]
将每种稀释液(浓度)充分混合,以准备通过m 511系统使用标准步骤进行处理。每个样品都以单层打印在玻璃显微镜载玻片上,然后由分析仪自动固定和染色。然后分析仪自动执行wbc的数字识别和计数。将每种稀释液的自动结果与每种稀释液的靶值进行比较,以确定样品的线性。
[0101]
wbc线性样品的结果
[0102]
54个wbc线性载玻片(9个浓度,每个浓度6个重复)在独立的m 511系统上进行处理,并显示出可重复的结果。跨越整个wbc线性范围(≤0.1
–
400.0x103/μl)的九个等距数据点以圆圈显示(图4a)。如线性偏差图(图4b)所示,九个等距样品中每一个的六个重复的平均值均落入可接受的限值内。
[0103]
表3:图4a中wbc线性载玻片的线性偏差
[0104][0105]
表4:wbc线性的线性偏差在独立的m 511系统上分析的载玻片
[0106][0107]
表3和表4展示了在独立的m 511系统上处理和分析的wbc线性载玻片的线性偏差。如上所述制备血液样品和载玻片。对于所使用的两组载玻片和系统,线性偏差均在可接受的限值内。
[0108]
实例2:红细胞、血红蛋白和血细胞比容分析测量区间
[0109]
实例2的目的是确定用于组合参数rbc-hgb-hct的基于图像的血液分析仪的ami满足线性要求。
[0110]
为了研究rbc-hgb-hct ami,从单个志愿者供体获取收集在k
2-edta管中的十个10ml全血样品。十个管中的一个管在另一台血液分析仪上进行处理以获取完全血细胞计数(cbc)。将样品浓缩和稀释(根据需要)以产生高浓度样品、低浓度样品和七个中间等距浓度样品,从而产生独特的线性系列(如图2所示)。线性系列在三个独立的m 511系统上进行处理。在闭管模式和开管模式下,对线性系列的每个浓度样品进行六次重复处理。
[0111]
高浓度和低浓度rbc样品
[0112]
制备高浓度血液样品以满足rbc≥8.00x106/μl的靶浓度。其中一个10ml k2-edta供体样品管被标记为“基线”,并在另一台血液分析仪上进行处理以获取基线cbc结果。然后将该管放在一边以备后用。其余九个供体样品管以4,000rpm离心10分钟。在此离心步骤中,获得了两个50ml锥形管,分别标记为“血浆”和“填充rbc”。
[0113]
离心完成后,将来自九(9)个供体样品管中的每一个的血浆转移到标有“血浆”的50ml锥形管中。然后将填充rbc转移到一个新的标有“填充rbc”的50ml锥形管中,并充分混合。将500μl的“填充rbc”等分试样转移到红/灰顶端的试管中。将来自“血浆”管的500μl等分试样添加到该同一红色/灰色顶端试管中,从而产生1:1稀释液。在另一台血液分析仪上处理1:1稀释管以获取rbc、hgb和hct结果。如果rbc结果达到≥8.00x106/μl的靶值,则将该管标记为“高浓度”样品。
[0114]
低浓度血液样品是通过稀释先前留出的供体样品制备的,以满足≤0.40x106/μl的靶浓度。当达到靶值时,将样品标记为“低浓度”样品。
[0115]
线性系列准备
[0116]
使用如实例1中所述和如图2所示的高浓度样品和低浓度样品制备等距稀释液。在m 511系统上处理了9种稀释液,进行了6个重复。
[0117]
样品处理
[0118]
将每种稀释液(浓度)充分混合,以准备通过m 511系统进行处理。每个样品都以单层打印在玻璃显微镜载玻片上,然后由分析仪自动固定和染色。然后,分析仪自动执行rbc的数字识别和计数,并评估rbc的细胞形态和内容物(例如,hgb和hct)。将每种稀释液的自动结果与每种稀释液的靶值进行比较,以确定样品的线性。
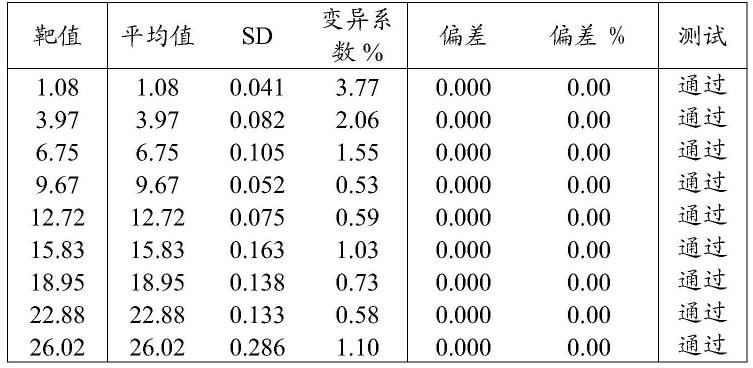
[0119]
rbc线性样品的结果
[0120]
54个rbc线性载玻片(9个浓度,每个浓度6个重复)在三个独立的m 511系统上进行处理,并显示出可重复的结果。九个等距数据点跨越的线性范围:
[0121]
对于rbc≤0.4
–
≥8.00x106/μl,
[0122]
对于hgb≤1.2
–
≥24.0g/dl,并且
[0123]
对于hct≤3.6
–
≥72.0%。
[0124]
表5:rbc线性载玻片的线性偏差
[0125][0126]
表6:hgb线性载玻片的线性偏差
[0127][0128]
表7:hct线性载玻片的线性偏差
[0129][0130]
如上所述制备载玻片。载玻片在m 511系统上使用标准步骤测量rbc、hgb和hct。对于rbc(表5)、hgb(表6)和hct(表7)的线性偏差,九个等距样品中每一个的六个重复的平均值均在可接受的限值内。
[0131]
实例3:血小板分析测量区间
[0132]
实例3的目的是确定参数plt的基于图像的血液分析仪的ami满足线性要求。
[0133]
为了研究plt ami,从单个供体获取了一个单一单位的plt单采样品。该成分供体的每个单一单位含有最少150ml到最多400ml收集在acd-a抗凝剂中的产品。还需要80-100ml混合的abo/rh兼容全血,经过检查以确保不存在凝块和聚集物。将样品浓缩和稀释(根据需要)以产生高浓度样品、低浓度样品和七个中间等距浓度样品,从而产生独特的线性系列(如图2所示)。线性系列在三个独立的m 511系统上进行处理。在闭管模式和开管模式下,对线性系列的每个浓度样品进行六次重复处理。
[0134]
高浓度和低浓度plt样品
[0135]
制备高浓度样品以满足plt≥5,000x103/μl的靶值。用100mg/ml k
2-edta制备具有4ml ste缓冲液的锥形管。将plt单采样品转移到锥形管中并与rbc和缓冲溶液混合。锥形管
以4,000rpm离心12分钟。去除上清液,重新悬浮plt沉淀,并在血液分析仪上分析剩余溶液的plt和rbc稀释液以获取样品中plt的结果。
[0136]
制备低浓度血液样品以满足plt≤10x103/μl和rbc 1.5x106/μl的靶值。所有与abo/rh兼容的全血样品均以4,000rpm的转速离心12分钟。去除血沉棕黄层。然后使用ste缓冲液洗涤剩余的rbc。然后在血液分析仪上对样品进行测试,以确定plt和rbc的靶值。
[0137]
线性系列准备
[0138]
使用如实例1中所述和如图2所示的高浓度样品和低浓度样品制备等距稀释液。在基于图像的血液分析仪上处理9种稀释液,重复6次。获取每个线性系列的plt结果。
[0139]
样品处理
[0140]
将每种稀释液(浓度)充分混合,以准备通过m 511系统进行处理。每个样品都以单层打印在玻璃显微镜载玻片上,然后由分析仪自动固定和染色。然后分析仪自动执行plt的数字识别和计数。将每种稀释液的自动结果与每种稀释液的靶值进行比较,以确定样品的线性。
[0141]
plt线性样品的结果
[0142]
54个plt线性载玻片(9个浓度,每个浓度6个重复)在独立的m 511系统上使用标准步骤进行处理,并显示出可重复的结果。使用了跨越完整plt线性范围≤10x103/μl且≥5,000x103/μl)的九个等距数据点。
[0143]
表8:plt线性载玻片的线性偏差
[0144][0145]
如线性偏差图(表8)所示,九个等距样品中每一个的六个重复的平均值均在可接受的限值内。
[0146]
从全血制备的线性方案
[0147]
表9示出了低浓度线性样品和高浓度线性样品使用全血方案的参数wbc、plt和rbc/hgb的靶值。
[0148]
表9:低浓度线性样品和高浓度线性样品的参数的靶标值:wbc、plt、rbc和hgb使用全血样品和方案(*成像所需)
[0149][0150]
高浓度样品和低浓度样品用于制备类似于前面描述的等距稀释液,但是高浓度样品和浓度样品之间只有三种中间稀释液,从而产生总共有五种等距稀释液。类似于图2流程图,识别了高浓度血液样品(管5)和低浓度血液样品(管1)。等量的高浓度血液样品和低浓度血液样品产生中等的中间浓度(管3)。其次,在低浓度和中等浓度或高浓度和中等浓度之间进一步稀释会产生中间浓度(管2和4)。
[0151]
每个样品以单层打印在载玻片上,例如玻璃或塑料载玻片(例如显微镜载玻片),并进行固定和染色。染色后,对样品载玻片进行自动成像,并对血液成分进行计数并与已知值进行比较。
[0152]
在一些实施例中,等距浓度以开管模式或闭管模式(即,机架模式)处理。在以下实例中,将5种制备的等距浓度中的每一者在载玻片上打印、固定和染色6次(6个重复),生成针对每个血液参数总共30次线性测量。根据临床实验室标准协会h26-a2 validation,verification,and quality assurance of automated hematology analyzers;approved standard
–
第二版,2010年6月,在基于图像的血液分析仪上分析线性测量值,并与已知的下限和上限靶标值(ami的截断范围)以及表10(中国食品药品监督管理局(cfda))和表11(美国食品和药物管理局(usfda))中所示的最大允许线性偏差进行比较。
[0153]
表10:wbc、plt、rbc和hgb ami的代表性(cfda/截断)可接受的下限和上限以及使用全血方案的最大允许线性偏差
[0154][0155]
表11:wbc、plt、rbc和hgb ami的代表性(usfda/截断)可接受的下限和上限以及使用全血方案的最大允许线性偏差
[0156][0157]
实例4:使用全血方案比较wbc线性
[0158]
如实例1所述,如果没有专用的样品和样品制备,就无法实现wbc的整个ami。实例4的目的是证明当使用通过wbc的全血实施方案制备的样品时,基于图像的血液分析仪的ami范围减小(截断)。
[0159]
为了研究全血wbc ami,通过标准静脉穿刺术从单个供体获取最少十五(15)个10ml k2/k3-edta管并充分混合。使用木制敷药棒,检查所有管是否有凝块。如果任何样品凝结,则将其丢弃并重新收集。将供体样品浓缩和稀释(根据需要)以产生高浓度和低浓度线性样品。
[0160]
基线wbc样品
[0161]
15支供血管中的一支标有“基线”。基线管在m 511系统上使用标准步骤进行处理,并留作将来使用。建议收集基线wbc结果≥8.0x103/μl的供体样品。
[0162]
高浓度wbc样品
[0163]
制备高浓度wbc样品以满足≥99x103/μl wbc靶值。为了制备高浓度样品,将剩余的供体管以5000rpm离心十(10)分钟。离心完成后,取出约2/3的血浆并从每个供体管转移到单个15ml锥形管中。该锥形管被标记为“血浆”并保留以备后用。如果出现血沉棕黄层或rbc层的破坏,则重复离心步骤。
[0164]
去除血浆后,去除每个供体管的血沉棕黄层并转移到单个15ml锥形管中。如果一些rbc从血沉棕黄层中移出是可以接受的。该锥形管被标记为“高浓度”样品。保留供体管(主要包含rbc)用于制备低浓度wbc样品。
[0165]
将高浓度样品涡旋五(5)秒,然后在m 511系统上使用标准步骤进行处理。审查结果以验证wbc》99.0x103/μl。如果无法达到高浓度wbc靶值,则收集基线wbc结果》8.0x103/μl的新供体样品。
[0166]
低浓度wbc样品
[0167]
制备低浓度wbc样品以满足两个靶值,wbc≤1.0x103/μl和rbc》0.30x106/μl。添加rbc以满足m 511系统启动样品处理和促进成像所需的最少细胞数量。
[0168]
为了制备低浓度样品,从如上所述保留的三个供体管中取出额外的一层rbc(约500μl),并转移到新的15ml锥形管中。
[0169]
血浆从血浆管转移到含有rbc的15ml锥形管中。该管被标记为“低浓度”。使用标准步骤在m 511系统上充分混合和处理低浓度样品。审查结果以验证达到wbc《1.0x103/μl和rbc》0.30x106/μl靶值。
[0170]
线性系列准备
[0171]
在高浓度样品和低浓度样品之间制备等距线性系列。管1到5被标记,其中管1包含低浓度样品,管5包含高浓度样品。
[0172]
管3由管1的一部份和管5的一部份组合而成。
[0173]
管2由管1的一部份和管3的一部份组合而成。
[0174]
管4由管3的一部份和管5的一部份组合而成。
[0175]
样品处理
[0176]
线性系列的每支试管都准备好通过m 511系统进行处理。每个样品都以单层打印在玻璃显微镜载玻片上,然后由分析仪自动固定和染色。分析仪还自动执行wbc的数字识别和计数。将每种稀释液的自动wbc计数与每种稀释液的靶值进行比较,以确定样品的线性。
[0177]
wbc线性样品的结果
[0178]
在m 511系统上获取了三十个wbc线性结果(五个浓度,每个浓度六个重复)。跨越截断wbc线性范围(≤1.0
–
99.0x103/μl)的五个等距数据点以圆圈显示(图5a)。由于操作人员技术差,如线性偏差图(图5b)所示,五个等距样品中的每一个的六个重复的平均值没有落在可接受的限值内。
[0179]
表12:使用wbc的线性偏差
[0180]
图5a中的全血wbc方案
[0181][0182]
图4a和图4b至图5a和图5b的比较强调了使用专用的线性样品与从全血样品制备的线性系列相比,结果的线性范围、准确度和精密度得到了提高。使用全血wbc方案的wbc线性偏差高于使用专用的血液制品方案(比较表3和表12)。
[0183]
实例5:使用全血方案比较rbc线性
[0184]
如实例2所述,如果没有专用的样品和样品制备,就无法实现rbc-hgb-hct的整个ami。实例5的目的是证明当使用通过rbc的全血实施方案制备的样品时,基于图像的血液分析仪的ami范围减小(截断)。可以开发独立的全血方案来分析hgb和hct线性。
[0185]
为了研究全血rbc ami,通过标准静脉穿刺术从单个供体获取三(3)个10ml k2/k3-edta管并充分混合。使用木制敷药棒,检查所有管是否有凝块。如果任何样品凝结,则将其丢弃并重新收集。将供体样品浓缩和稀释(根据需要)以产生高浓度和低浓度线性样品。
[0186]
基线rbc样品
[0187]
3支供血管中的一支标有“基线”。基线管在m 511系统上使用标准步骤进行处理,并留作将来使用。建议收集基线rbc结果≥4.5x106/μl的供体样品。
[0188]
高浓度rbc样品
[0189]
制备高浓度rbc样品以满足≥7.0x106/μl rbc靶值。为了制备高浓度样品,将剩余的供体管以5000rpm离心十(10)分钟。离心完成后,取出约2/3的血浆并从每个供体管转移到单个15ml锥形管中。该锥形管被标记为“血浆”并保留以备后用。如果出现血沉棕黄层或rbc层的破坏,则重复离心步骤。
[0190]
低浓度rbc样品
[0191]
制备低浓度rbc样品以满足≤0.30x106/μl的靶值。将先前留置的基线和血浆管的等分试样合并并标记为“低浓度”。使用标准步骤在m 511系统上充分混合和处理低浓度样品。审查结果以验证达到≤0.30x106/μl的rbc靶值。
[0192]
线性系列准备
[0193]
如实例4所述,通过高浓度样品和低浓度样品之间的等距稀释系列制备线性系列。
[0194]
样品处理
[0195]
将每种稀释液(浓度)充分混合,以准备通过m 511系统进行处理。每个样品都以单层打印在玻璃显微镜载玻片上,然后由分析仪自动固定和染色。然后分析仪自动执行rbc的数字识别和计数,并评估rbc的细胞形态和内容物(例如hgb和hct)。将每种稀释液的自动结果与每种稀释液的靶值进行比较,以确定样品的线性。
[0196]
rbc线性样品的结果
[0197]
在m 511系统上获取了三十个rbc线性结果(五个浓度,每个浓度六个重
复)。跨越截断rbc线性范围(≤0.3
–
7.0x106/μl)的五个等距数据点。如表13所示,五个等距样品中的每一个的六个重复的平均值均在可接受的限值内。
[0198]
表13:使用rbc的线性偏差
[0199]
图10a中的全血rbc方案
[0200][0201]
表5和13的比较强调了使用从高、低和七个中间浓度样品制备的样品与从高、低和三个中间浓度样品制备的线性系列相比,结果的线性范围、准确度和精密度得到了提高。使用全血rbc方案的偏差高于使用本文所述的专用血液制品方案时的偏差。
[0202]
实例6:使用全血方案比较plt线性
[0203]
如实例3中所述,如果没有的专用样品和样品制备,就无法实现plt的整个ami。实例6的目的是证明当使用通过plt的全血实施方案制备的样品时,基于图像的血液分析仪的ami范围减小(截断)。
[0204]
为了研究全血plt ami,通过标准静脉穿刺术从单个供体获取最少五(5)个10ml k2/k3-edta管并充分混合。使用木制敷药棒,检查所有管是否有凝块。如果任何样品凝结,则将其丢弃并重新收集。将供体样品浓缩和稀释(根据需要)以产生高浓度和低浓度线性样品。
[0205]
基线plt样品
[0206]
5支供血管中的一支被标记为“基线”。基线管在m 511系统上使用标准步骤进行处理,并留作将来使用。建议收集基线plt计数≥300x103/μl的供体样品。
[0207]
富血小板血浆样品制备
[0208]
为了产生高浓度的plt样品以满足≥999x103/μl的plt靶浓度,首先通过以2000rpm将剩余的4个供体管离心十(10)分钟来制备富含血小板的血浆(prp)级分。在进行离心时,称取0.3g edta并转移到两个edta 15ml锥形管中的每一个中。离心完成后,从每个供体管中取出富含血小板的血浆,并均匀地分布在两个含有edta的15ml锥形管之间。由于rbc和血浆层的分离不明确,因此如果在血浆转移过程中将一些rbc移液到edta管中是可以接受的。如果基于视觉评估未实现rbc和血浆的分离,则可以将供体管以2000rpm再离心五(5)分钟。充分混合“prp”管以确保edta溶解在溶液中。
[0209]
以下试管以5000rpm离心(10)分钟:
[0210]
a.两(2)个15ml锥形prp管
[0211]
b.移除含有prp的两(2)个10ml edta供体管
[0212]
高浓度plt样品
[0213]
离心完成后,在不干扰plt沉淀的情况下,将贫血小板血浆(ppp)从prp管中取出并转移到标有“ppp”的新15ml锥形管中并保留以备后用。
[0214]
将两(2)个“prp”管中的内容物充分混合,直到没有可见的plt沉淀残留。将两个“prp”管的内容物合并并加入500μl“基线”样品。这个锥形管被标记为“高浓度”。
[0215]
将高浓度管充分混合并在m 511系统上使用标准步骤进行处理。审查结果以验证plt》999x103/μl。如果无法达到高浓度plt要求,则收集具有更高基线plt结果》300x103/μl的新供体样品。
[0216]
低浓度plt样品
[0217]
制备低浓度plt样品以满足两个靶浓度,plt≤20.0x103/μl且rbc》0.30x106/μl。添加rbc以满足罗氏基于图像的血液分析仪(m 511系统)启动样品处理和促进成像所需的最少细胞数量。为了制备低浓度样品,取回了两(2)个含有prp的10ml edta供体管。去除并丢弃任何剩余的血浆和血沉棕黄层。将填充rbc转移并合并到一个新的15ml锥形管中,该管标有“低浓度”,其中转移了3.0-4.0ml的ppp。
[0218]
将低浓度管的内容物充分混合,并在m 511系统上使用标准步骤进行处理。审查结果以验证plt《20.0x103/μl且rbc》0.30x106/μl。
[0219]
线性系列准备
[0220]
如实例4所述,通过高浓度样品和低浓度样品之间的等距稀释系列制备线性系列。
[0221]
样品处理
[0222]
将每种稀释液(浓度)充分混合,以准备通过m 511系统进行处理。每个样品都以单层打印在玻璃显微镜载玻片上,然后由分析仪自动固定和染色。然后分析仪自动执行plt的数字识别和计数。将每种稀释液的自动结果与每种稀释液的靶值进行比较,以确定样品的线性。
[0223]
plt线性样品的结果
[0224]
使用标准步骤在m 511系统上获取30个plt线性结果(五个浓度,每个浓度六个重复)。使用了跨越截断plt线性范围(8
–
1379x103/μl)的五个等距数据点。如表14所示,五个等距样品中的每一个的六个重复的平均值均在可接受的限值内。
[0225]
表14:使用plt的线性偏差
[0226]
图11a中的全血plt方案
[0227][0228]
表8和14的比较强调了使用从高、低和七个中间浓度样品制备的专用线性样品与从全血和高、低和三个中间浓度样品制备的线性系列相比,结果的线性范围、准确度和精密度得到了提高。使用全血方案比使用本文所述的特殊血液产品方案时产生更高的偏差。
[0229]
线性对照载玻片
[0230]
数据是通过使用专用的血液产品与金标准验证方案(实例1-3)相结合的方法生成的,以及通过使用全血样品与全血实施方案相结合的方法(实例4-6)生成的。无论选择何种
方法和ami结果如何,所有6个实例都需要投入大量时间、金钱和技术专长。消除这些障碍对客户来说非常有利。
[0231]
实例7:rbc-hgb-hct线性对照载玻片的比较
[0232]
实例7的目的是比较使用线性对照载玻片的两个m 511系统的ami。选择一个或多个参数rbc-hgb-hct以证明原理论证的可行性。
[0233]
使用先前在实例2中描述的(金标准)方法在m 511系统c4上制备和处理线性稀释液。获取了rbc-hgb-hct的计数。保留了由金标准rbc方法产生的线性对照载玻片。然后临时重新配置同一个m511系统c4的打印和染色功能。
[0234]
然后在两个m 511系统上处理线性对照载玻片:首先在同一个m 511系统(c4)上,然后在第二个m 511系统(p37)上进行:
[0235]
1)分别如图6a和图6c所示,在第一个m 511系统上处理的rbc的线性范围(来自线性对照载玻片)为0.35-8.66x106/μl,在第二个m 511系统上处理的线性范围为0.34-8.30x106/μl,满足≤0.4-≥8.0x106/μl的靶值。
[0236]
表15:rbc的线性范围(0%偏差)
[0237][0238]
2)分别如图6b(表15)和图6d(表16)所示,在第一个
[0239]
m 511系统上所有浓度的可接受限值和rbc的线性偏差(使用线性对照载玻片)计算为0%偏差,在第二个m 511系统上的范围为-0.68%至0.07%偏差。
[0240]
表16:rbc的线性范围(《1%偏差)
[0241][0242]
3)如表17所示,在第一个m 511系统上处理的hgb的线性范围(来自线性对照载玻片)为1.08-26.02g/dl,在第二个m 511系统上处理的hgb的线性范围为1.00-25.57
[0243]
g/dl,满足≤1.2-≥24.0xg/dl的靶值。
[0244]
表17:hgb的线性范围(0%偏差)
[0245][0246]
4)如表18所示,在第一个m 511系统上所有浓度的可接受限值和hgb的线性偏差(使用线性对照载玻片)计算为0%偏差,在第二个m 511系统上的范围为-0.35%至2.71%偏差。
[0247]
表18:hgb的线性范围(《3%偏差)
[0248][0249]
5)如表19所示,分别在第一个m 511系统上处理的hct的线性范围(来自线性对照载玻片)为3%
–
79%,在第二个m 511系统上处理的hct的线性范围为3%
–
78%,满足
[0250]
≤3.6-≥72.0%的靶值。
[0251]
表19:hct的线性范围(0%偏差)
[0252][0253]
6)如表20所示,在第一个m 511系统上所有浓度的可接受限值和hct的线性偏差(使用线性对照载玻片)计算为0%偏差,在第二个m 511系统上的范围为-0.10%至0.95%偏差。
[0254]
表20:hct的线性范围(《1%偏差)
[0255][0256]
由如本文所述的专用的高、低和中间浓度样品制备的线性对照载玻片提供与由专用的高、低和中间浓度样品新鲜制备的线性样品相当的相关性。
[0257]
此外,与从全血样品制备的线性样品相比,如前所述制备的线性对照载玻片降低了变异性、提高了再现性并实现整个ami。表13和表16的比较强调了基于从高浓度和低浓度血液样品制备的线性样品的线性对照载玻片的准确度、精密度和仪器间标准化得到了提高。在两个m 511系统上测量时,使用专用血液制品时的偏差是一致的。
[0258]
最后,由于线性对照载玻片是由制造商产生/生成的,因此可以为客户节省大量时间和成本。
[0259]
实例8:线性对照载玻片的稳定性
[0260]
进行这项研究是为了证明储存30天的m 511系统载玻片与原始(基线)结果相比,在wbc差异和形态的手动显微镜检查方面产生了相似的结果。在本研究期间进行的所有评估的结果都是成功的,并且符合预定的验收标准。这表明由m 511系统生成的载玻片对于手动显微镜检查而言至少30天到高达180天是稳定的。
[0261]
为了验证m 511载玻片的稳定性性能,使用在k2 edta收集管中收集的至少二十(20)个样品执行该方案,并在自动血液分析仪上进行处理。样品由以下各项组成:
[0262]
·
六(6)份随机残留全血样品
[0263]
·
五(5)名正常健康的供体
[0264]
·
九(9)个靶向残留全血样品;每个来自以下各类别三(3)项:
[0265]
贫血
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
hgb 6-10g/dl
[0266]
白细胞减少症
ꢀꢀ
wbc ≤2x103/μl
[0267]
血小板减少症
ꢀꢀ
plt ≤50x103/μl
[0268]
在样品收集的八(8)小时内,在一(1)个m 511系统上以机架模式对每个样品一式三份进行处理。由m 511系统产生的m511系统载玻片由合格的医疗技术专家(mt)在基线处、至少三十(30)天后和至少一百八十(180)天后再次进行评估。
[0269]
评估由五(5)个单独的分析组成。不需要任何单独的评估来满足特定的psd要求;相反,组合的结果集将用于确定载玻片稳定性。
[0270]
1-红细胞内含物:存在/不存在:报告一致百分比
[0271]
2-wbc、rbc和plt形态:分级1-4+:报告一致百分比
[0272]
3-wbc差异参数偏差评估:报告偏差百分比
[0273]
4-wbc差异参数回归分析:报告斜率和截距
[0274]
5-宏观载玻片特点:剥离、剥落、打印、褪色:分级1-3+:报告一致百分比
[0275]
在样品处理的八(8)小时内评估在m 511系统上处理的每个样品的第一个重复(基线)的载玻片。每个样品的剩余载玻片在室温(15℃-25℃)下储存在fisher scientific载玻片储存盒中,用于剩余的研究。一百八十(180)天后,合格的医疗技术专家(mt)评估了剩余两(2)片载玻片中的一(1)片。评估后,将m 511系统载玻片放回载玻片储存盒中。
[0276]
细胞特征(rbc内含物和wbc、rbc和plt形态)在零(0)天和三十(30)天之间没有差异,在零(0)天和一百八十(180)天之间也没有差异。将基线结果与储存至少三十(30)天和储存一百八十(180)天后获取的结果进行比较时,5部分wbc差异的百分比偏差和相关系数是可以接受的,最后,m 511载玻片的宏观评估表明没有观察到样品剥离、样品剥落或打印均匀性的变化,只有轻微的颜色变化(褪色)。
[0277]
该方案表明,由m 511系统生成的载玻片至少可以稳定最少一百八十(180)天。
[0278]
其他实施例
[0279]
应当理解,虽然已经结合其详细描述描述了本发明,但前述描述旨在说明而不是限制由所附权利要求的范围限定的本发明的范围。其他方面、优点和修改在以下权利要求的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1